近年来大气中CO2浓度呈现出加速增长的趋势{Bui, 2018 #301},2013年CO2浓度约为400 cm3⋅m−3,2019年已达415 cm3⋅m−3[1-4]。因此,急需发展廉价高效的CO2捕获技术以减少CO2排放对全球气候的影响。“分子篮”固体胺吸附剂与胺溶液吸收剂相比,具有腐蚀性小、再生能耗低的优点,被认为是有效的CO2捕获技术。近年来多种介孔氧化硅(SBA-15[5-8]、KIT-6[9]、MCF[10-15]、MCM-41[9, 16]、二氧化硅纳米管[17-18]和HMS[19-20]等)已被用作“分子篮”吸附剂的载体,利用其高表面积和大的孔体积提高有机胺的CO2吸附性能。前期研究结果表明,具有较大孔体积和较大孔径的载体有利于提高固体吸附剂的CO2吸附能力[11-12, 18]。
然而介孔氧化硅的成本较高[21-23],且由于目前未进行大规模生产而产量较低,这些因素极大地限制了“分子篮”基CO2吸附剂的应用和推广。因此急需寻找廉价且具有特殊结构的载体[24-25],以降低固体吸附剂的成本,并提高CO2吸附性能。
工业上大规模生产的二氧化硅(SiO2)纳米粒子俗称白炭黑,被广泛用作橡胶、塑料、涂料、黏合剂和密封材料的添加剂,其成本远低于有序介孔二氧化硅。根据市售价格,SiO2纳米粒子的单价仅为SBA-15的1/3000。因此,以白炭黑作为载体,可以极大地降低“分子篮”固体吸附剂的成本。在本研究中,选择2种具有不同粒径的SiO2纳米粒子作为有机胺载体,通过浸渍法制备固体吸附剂,其表现出优异的CO2吸附能力,甚至远高于SBA-15基固体吸附剂。这可能是由于SiO2纳米粒子基吸附剂具有的开放结构有利于减少CO2与有机胺反应的传质阻力,从而提高了固体吸附剂的CO2吸附性能。
2 实验部分 2.1 主要试剂五乙烯六胺(PEHA)和SBA-15分别由成都科龙化工公司和先丰科技公司提供,2种不同粒径(6和30 nm)的二氧化硅纳米粒子(SiO2)由杭州万晶公司提供,分别命名为6SiO2和30SiO2。
2.2 吸附剂的制备及表征固体吸附剂通过浸渍法制备。将一定量的PEHA溶解在甲醇中,其后加入载体,搅拌后超声30 min,然后在蒸发皿中炒干。得到固体吸附剂命名为xPEHA/ySiO2,x代表PEHA的理论负载量,y代表二氧化硅粒子的平均尺寸。例如,50PEHA/6SiO2表示PEHA负载在粒径为6 nm的SiO2纳米粒子上且理论负载质量为50%。为了比较吸附性能,也通过浸渍法制备了50PEHA/SBA-15吸附剂。
通过扫描电子显微镜(S4800)、透射电子显微镜(JEOL-2100F)、物理吸附仪(Autosorb-1)、红外光谱(iS-50)以及热重分析仪(STA 449C)对吸附剂进行表征。
2.3 吸附性能测试使用固定床反应器通过穿透曲线法测试吸附剂的CO2吸附性能[11-12, 18]。使用在线质谱仪(Oic-20)检测反应器出口处的CO2含量。选取50PEHA/6SiO2考察循环使用性能,样品首先在N2 (20 mL⋅min−1)中100 ℃预处理1 h,降温至75 ℃,通入CO2体积分数为10%的CO2/N2混合气体(10 mL⋅min−1)直至吸附饱和,然后在100 ℃下N2 (20 mL⋅min−1)脱附1 h使得吸附剂再生,重复以上吸附-脱附过程10次。
3 结果与讨论 3.1 固体吸附剂的表征图 1(a)和1(b)分别为6SiO2和50PEHA/6SiO2的扫描电镜(SEM)图,可以看到SiO2粒子非常小,粒子之间有大量的缝隙(即堆积孔),且50PEHA/6SiO2仍然呈现出“干”的状态。图 1(c)和1(d)分别为6SiO2和SBA-15的透射电镜(TEM)图。6SiO2载体的粒径较小(6 nm),粒子间有大量空隙,而SBA-15载体为有序的孔道结构,孔径约7 nm。

|
图 1 6SiO2、50PEHA/6SiO2、SBA-15 SEM与TEM图 Fig.1 SEM and TEM images of 6SiO2, 50PEHA/6SiO2, SBA-15 |
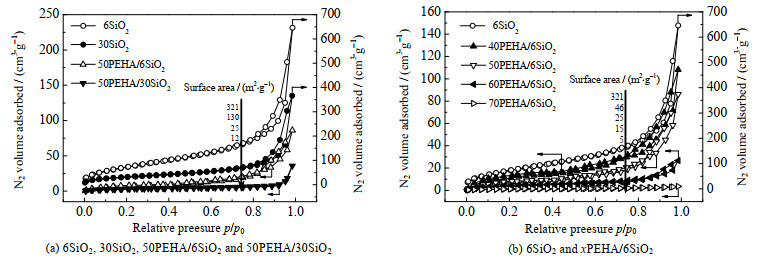
图 2(a)为6SiO2的N2吸脱附等温线,在相对压力p/p0为0.78~0.99时均具有H3型回滞环[26],表明6SiO2可能具有大量大孔或堆积孔结构[27-28]。图 1(c)的TEM图表明6SiO2的粒径非常小,不能存在大孔结构,因此回滞环归因于SiO2纳米粒子之间的堆积孔。如表 1所示,6SiO2和30SiO2的孔体积为1.00和0.57 cm3⋅g−1,这与介孔氧化硅SBA-15明显不同,SBA-15的孔体积主要归因于内部孔。图 2(a)还给出了50PEHA/6SiO2和50PEHA/30SiO2的N2吸脱附等温线。50PEHA/6SiO2的N2吸附量远低于6SiO2,表明堆积孔的孔体积显著减小,这是由于PEHA分子在SiO2纳米粒子之间的填充使得堆积孔的孔体积减小。因此,50PEHA/6SiO2的孔体积远小于6SiO2。而50PEHA/30SiO2的N2吸附量也低于50PEHA/6SiO2,表明50PEHA/30SiO2的堆积孔体积低于50PEHA/6SiO2,这是由于30SiO2的堆积孔体积小于6SiO2所引起的。可以看出随着PEHA负载量的增加,复合吸附剂的N2吸附量呈现明显的下降趋势,这表明堆积孔体积随着PEHA负载量的增加而减小。图 2(b)是6SiO2、40PEHA/6SiO2、50PEHA/6SiO2、60PEHA/6SiO2和70PEHA/6SiO2的N2吸脱附等温线。可以看出随着PEHA负载量的增加,复合吸附剂的N2吸附量呈现明显的下降趋势,这表明堆积孔体积随着PEHA负载量的增加而减小。
|
图 2 SiO2载体和PEHA/SiO2吸附剂的氮气吸脱附等温线 Fig.2 Nitrogen adsorption-desorption isotherms of SiO2 supports and PEHA/SiO2 sorbents |
|
|
表 1 SiO2和SBA-15负载PEHA前后的结构性质及CO2吸附能力 Table 1 Morphological properties and CO2 uptakes of SiO2 and SBA-15 before and after PEHA modification |
如表 1所示,6SiO2、40PEHA/6SiO2、50PEHA/6SiO2、60PEHA/6SiO2和70PEHA/6SiO2的堆积孔体积Vpore分别为1.00、0.14、0.11、0.04和0.01 cm3⋅g−1。PEHA改性前后的6SiO2和30SiO2的比表面积SBET分别为321和130 m2⋅g−1,6SiO2的比表面积远大于30SiO2的比表面积。而负载PEHA后,复合吸附剂的比表面积均明显下降。这是由于液体PEHA的比表面积可以忽略不计,因此负载PEHA后,吸附剂的比表面积急剧减小。6SiO2、40PEHA/6SiO2、50PEHA/6SiO2、60PEHA/6SiO2和70PEHA/6SiO2的比表面积分别为321、46、25、15和4 m2⋅g−1。这表明随着PEHA负载量的增加,在6SiO2上形成的PEHA膜会更厚,比表面积会更小。50PEHA/6SiO2和50PEHA/30SiO2的比表面积分别为25和7 m2⋅g−1,表明大比表面积载体负载PEHA后,仍然有较大的比表面积。
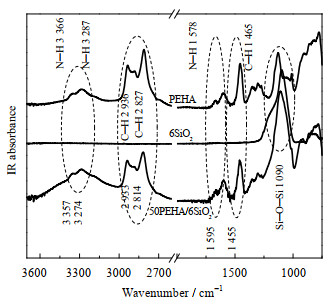
图 3为6SiO2、PEHA和50PEHA/6SiO2的红外光谱。在PEHA的红外光谱中,可以观察到与N─H,C─H和C─N相关的伸缩振动和变形振动模式。3 357和3 274 cm−1处的峰归因于N─H伸缩振动,1 595 cm−1处的峰归因于N─H弯曲振动,2 933和2 814 cm−1处的峰与C─H伸缩振动相关,1 455 cm−1处的峰值归属为C─H弯曲振动。而载体6SiO2仅在1 090 cm−1处观察到一个归属为Si─O─Si伸缩振动的强峰。复合吸附剂50PEHA/6SiO2的红外峰明显多于6SiO2的红外峰,表明PEHA已负载在6SiO2表面。此外,负载于6SiO2表面PEHA的红外峰相对纯PEHA的红外峰有一定的蓝移或红移。如N─H对称伸缩振动蓝移了11 cm−1,而N─H变形振动红移了17 cm−1。这表明PEHA分子与6SiO2表面发生了相互作用,PEHA分子的延展性发生了一定程度的变化。
|
图 3 6SiO2,PEHA和50PEHA/6SiO2的红外光谱 Fig.3 FTIR spectra of 6SiO2, PEHA and 50PEHA/6SiO2 |
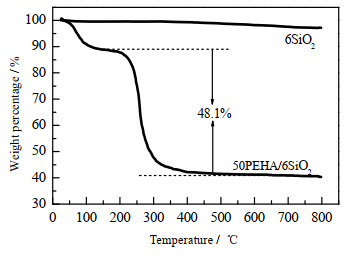
在本研究中,通过浸渍法将PEHA分子负载在SiO2载体表面,由于在制备过程中的损失,PEHA的实际负载量可能与理论负载量有所差别。本研究通过热分析法测量实际负载量。图 4为6SiO2和50PEHA/6SiO2的热重(TG)曲线。6SiO2纳米粒子从室温到600 ℃没有明显的重量损失,表明其较为稳定。50PEHA/6SiO2有2个明显的失重过程。第1个失重过程在室温到125 ℃,失重量约为总重量的11.0%,这归因于吸附剂在空气中吸附的水。第2个失重过程在220到500 ℃,这是由于PEHA在较高温度下的挥发引起的,失重量约为总重量的48.1%,表明PEHA的实际负载量约为48.1%,非常接近50% 的理论负载量。
|
图 4 6SiO2和50PEHA/6SiO2热重曲线 Fig.4 TG curves of 6SiO2 and 50PEHA/6SiO2 |
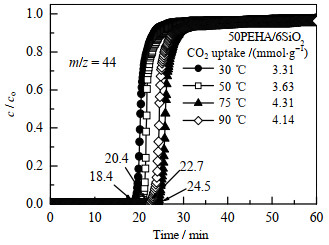
图 5为30、50、75和90 ℃时50PEHA/6SiO2的CO2穿透曲线。图中m/z为质荷比,c为固定床反应器出口CO2浓度,co为固定床反应器入口CO2浓度。随着吸附温度的升高,CO2穿透点(即质谱仪在固定床反应器的出口处检测到CO2信号)时间先增加后减少。30、50、75和90 ℃时的CO2穿透点时间分别为18.4、20.4、24.5和22.7 min。从图 5中可以推断,吸附剂在穿透点之前的CO2吸附量对总的CO2吸附量的贡献最大。因此从穿透点时间即可判断出50PEHA/6SiO2在75 ℃时表现出最佳的CO2吸附性能,故在后续实验中吸附温度均设置为75 ℃。
|
图 5 吸附温度对CO2吸附性能的影响 Fig.5 Effects of adsorption temperature on CO2 adsorption |
图 6(a)为6SiO2、PEHA以及不同PEHA负载量的PEHA/6SiO2吸附剂的CO2穿透曲线。6SiO2的穿透点仅有1.4 min,这表明SiO2纳米粒子只能吸附极少量的CO2。如表 1所示,6SiO2的CO2吸附量仅为0.25 mmol⋅g−1,这是由于6SiO2的中性表面缺少捕获CO2分子的碱性基团。而纯有机胺PEHA的CO2穿透点也仅为3.1 min,这表明液态PEHA对CO2的吸附也非常有限。根据PEHA分子结构,PEHA的CO2理论最大吸附量为12.93 mmol⋅g−1,但是其实际CO2吸附量仅为0.89 mmol⋅g−1。尽管6SiO2和PEHA都表现出较低的CO2吸附性能,但PEHA/6SiO2复合吸附剂却表现出优异的CO2吸附性能。如表 1所示,SiO2和PEHA的CO2吸附量分别仅为0.25和0.89 mmol⋅g−1,而40PEHA/6SiO2、50PEHA/6SiO2、60PEHA/6SiO2和70PEHA/6SiO2的CO2吸附量分别为3.57、4.31、4.56和3.54 mmol⋅g−1,因此通过将PEHA负载在SiO2载体上可以显著提高PEHA的CO2吸附性能。如图 6(b)所示,30SiO2基复合吸附剂的CO2吸附性能也随着PEHA负载量的增加先增加后减少,40PEHA/30SiO2、50PEHA/30SiO2、60PEHA/30SiO2和70PEHA/30SiO2,穿透点分别为6.6、12.5、9.1和5.9 min,总的CO2吸附量分别为2.53、3.08、2.94和2.78 mmol⋅g−1,明显低于6SiO2基固体吸附剂的吸附量。SBA-15是最早用于固体胺吸附剂的载体之一,SBA-15具有有序孔道以及比6SiO2更大的表面积(578 m2⋅g−1)。
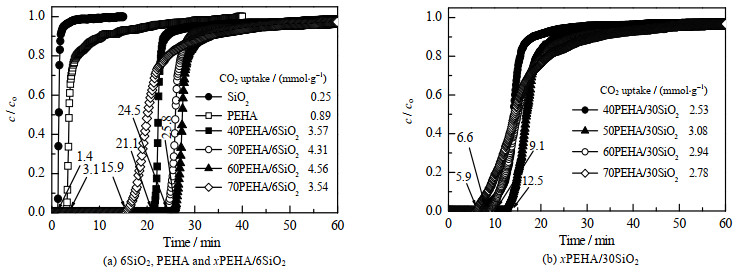
|
图 6 6SiO2穿透曲线和30SiO2穿透曲线 Fig.6 CO2 breakthrough curves of 6SiO2 and 30SiO2 based solid amine sorbents |
图 7对比了50PEHA/6SiO2、50PEHA/30SiO2和50PEHA/SBA-15的CO2穿透曲线,穿透点分别是24.5、12.5和16.8 min。这表明50PEHA/6SiO2和捕获性能优于50PEHA/SBA-15,而50PEHA/30SiO2的性能却低于50PEHA/SBA-15。众周所知,穿透期间的穿透曲线斜率可以反映传质阻力的大小,较大的斜率表示较低的传质阻力,而较小的斜率表示较大的传质阻力。PEHA膜越厚,传质阻力将越大。因为6SiO2的比表面积远大于30SiO2,6SiO2载体上的PEHA膜较薄,因此50PEHA/6SiO2的CO2吸附性能明显优于50PEHA/30SiO2。
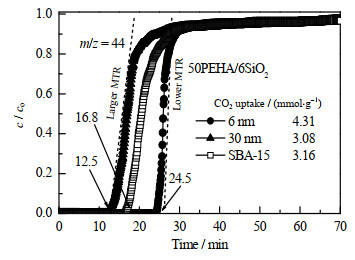
|
图 7 50PEHA/6SiO2、50PEHA/30SiO2和50PEHA/SBA-15吸附剂穿透曲线 Fig.7 Breakthrough curves of 50PEHA/6SiO2, 50PEHA/30SiO2 and 50PEHA/SBA-15 sorbents |
6SiO2的表面积(321 m2⋅g−1)虽然低于SBA-15的表面积(578 m2⋅g−1),但50PEHA/6SiO2仍然表现出比50PEHA/SBA-15低的传质阻力和较优的CO2吸附性能,这是由于50PEHA/6SiO2具有开放结构(图 1(a)~(c)),CO2可以从各个方向与载体表面的PEHA进行充分反应。如图 1(d)所示,50PEHA/SBA-15具有有序介孔结构,CO2只能从孔道的两端进入已填充PEHA的孔道,因而具有较大的传质阻力和较低的CO2吸附性能。
图 8为水汽(体积分数约为4.0%)对固体吸附剂CO2吸附性能的影响。在干燥气氛中,50PEHA/6SiO2的CO2穿透点为24.5 min,其CO2吸附量为4.31 mmol⋅g−1,─NH2与CO2以2:1的量比进行反应。在潮湿气氛中,CO2穿透点延长至31.0 min,CO2吸附提高至5.11 mmol⋅g−1,吸附性能提高了18.6%。这是由于在水汽存在的情况下,H2O分子也参与反应过程,─NH2可与CO2以1:1的量比进行反应。因此,由于H2O分子也参与了反应过程,大大提高了吸附剂的吸附性能。
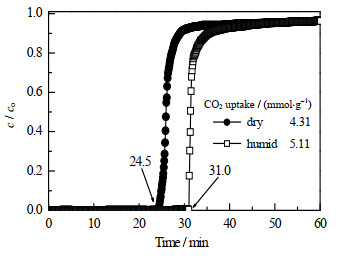
|
图 8 水汽对50PEHA/6SiO2吸附CO2性能的影响 Fig.8 Effects of moisture on CO2 sorption of 50PEHA/6SiO2 |
图 9为50PEHA/6SiO2吸附剂循环使用10次的CO2吸附性能。在第1次使用时50PEHA/6SiO2的CO2吸附量为4.31 mmol⋅g−1。经过10次吸附-脱附循环后,CO2吸附量为4.12 mmol⋅g−1,保持率为95.6%,这表明50PEHA/6SiO2吸附剂具有优异的稳定性。图 4中的TG曲线表明50PEHA/6SiO2在220 ℃以下比较稳定,而吸附剂的再生温度仅为100 ℃,因此50PEHA/6SiO2具有优异的循环稳定性。

|
图 9 50PEHA/6SiO2吸附剂循环实验 Fig.9 CO2 uptakes of 50PEHA/6SiO2 in 10 adsorption-desorption cycles |
以廉价的SiO2纳米粒子作为有机胺的载体,通过浸渍法制备了廉价高效的氧化硅基固体吸附剂。通过穿透曲线法对吸附剂的CO2吸附性能进行了测试。研究结果表明,SiO2纳米粒子载体的粒径和表面积大小对吸附剂的CO2吸附性能有重要影响,小的粒径和大的比表面积有利于提高吸附剂CO2吸附性能。其中50PEHA/6SiO2和60PEHA/6SiO2的CO2吸附量分别达到4.31和4.56 mmol⋅g−1,远高于高成本的50PEHA/SBA-15吸附剂的3.16 mmol⋅g−1。与50PEHA/SBA-15吸附剂相比,50PEHA/6SiO2具有开放结构,CO2分子可以充分与PEHA发生反应,从而提高吸附剂的CO2吸附性能。此外,50PEHA/6SiO2吸附剂也表现出良好的循环稳定性。
| [1] |
WANG L, YAO M, HU X, et al. Amine-modified ordered mesoporous silica: The effect of pore size on CO2 capture performance[J]. Applied Surface Science, 2015, 324(1): 286-292. |
| [2] |
XU X, SONG C, ANDRESEN J M, et al. Novel polyethylenimine-modified mesoporous molecular sieve of MCM-41 type as high-capacity adsorbent for CO2 capture[J]. Energy & Fuels, 2002, 16(6): 1463-1469. |
| [3] |
MA X, WANG X, SONG C. "Molecular Basket" sorbents for separation of CO2 and H2S from various gas streams[J]. Journal of the American Chemical Society, 2009, 131(16): 5777-5783. DOI:10.1021/ja8074105 |
| [4] |
ZHANG R, WANG X, LIU S, et al. Discovering inherent characteristics of polyethylenimine-functionalized porous materials for CO2 capture[J]. ACS Applied Materials & Interfaces, 2019, 11(40): 36515-36524. |
| [5] |
SANZ R, CALLEJA G, ARENCIBIA A, et al. CO2 adsorption on branched polyethyleneimine-impregnated mesoporous silica SBA-15[J]. Applied Surface Science, 2010, 256(17): 5323-5328. DOI:10.1016/j.apsusc.2009.12.070 |
| [6] |
YAN X L, ZHANG L, ZHANG Y, et al. Amine-modified SBA-15: Effect of pore structure on the performance for CO2 capture[J]. Industrial & Engineering Chemistry Research, 2011, 50(6): 3220-3226. |
| [7] |
YUE M B, SUN L B, CAO Y, et al. Promoting the CO2 adsorption in the amine-containing SBA-15 by hydroxyl group[J]. Microporous and Mesoporous Materials, 2008, 114(1/2/3): 74-81. |
| [8] |
ZHENG F, TRAN D N, BUSCHE B J, et al. Ethylenediamine-modified SBA-15 as regenerable CO2 sorbent[J]. Industrial & Engineering Chemistry Research, 2005, 44(9): 3099-3105. |
| [9] |
SON W J, CHOI J S, AHN W S. Adsorptive removal of carbon dioxide using polyethyleneimine-loaded mesoporous silica materials[J]. Microporous and Mesoporous Materials, 2008, 113(1/2/3): 31-40. |
| [10] |
SUBAGYONO D J N, LIANG Z, KNOWLES G P, et al. Amine modified mesocellular siliceous foam (MCF) as a sorbent for CO2[J]. Chemical Engineering Research and Design, 2011, 89(9): 1647-1657. DOI:10.1016/j.cherd.2011.02.019 |
| [11] |
YAO M, DONG Y, FENG X, et al. The effect of post-processing conditions on aminosilane functionalizaiton of mesocellular silica foam for post-combustion CO2 capture[J]. Fuel, 2014, 123(1): 66-72. |
| [12] |
FENG X, HU G, HU X, et al. Tetraethylenepentamine-modified siliceous mesocellular foam (MCF) for CO2 capture[J]. Industrial & Engineering Chemistry Research, 2013, 52(11): 4221-4228. |
| [13] |
ZHAO J Q, SIMEON F, WANG Y J, et al. Polyethylenimine-impregnated siliceous mesocellular foam particles as high capacity CO2 adsorbents[J]. RSC Advances, 2012, 2(16): 6509-6519. DOI:10.1039/c2ra20149f |
| [14] |
QI G, FU L, CHOI B H, et al. Efficient CO2 sorbents based on silica foam with ultra-large mesopores[J]. Energy & Environmental Science, 2012, 5(6): 7368-7375. |
| [15] |
YAN X, ZHANG L, ZHANG Y, et al. Amine-modified mesocellular silica foams for CO2 capture[J]. Chemical Engineering Journal, 2011, 168(2): 918-924. DOI:10.1016/j.cej.2011.01.066 |
| [16] |
BELMABKHOUT Y, SERNA-GUERRERO R, SAYARI A. Adsorption of CO2-containing gas mixtures over amine-bearing pore-expanded MCM-41 silica: Application for gas purification[J]. Industrial & Engineering Chemistry Research, 2010, 49(1): 359-365. |
| [17] |
LIU L, CHEN J, TAO L, et al. Aminopolymer confined in ethane-silica nanotubes for CO2 capture from ambient air[J]. ChemNanoMat, 2020, 6(7): 1096-1103. DOI:10.1002/cnma.201900742 |
| [18] |
YAO M, DONG Y, HU X, et al. Tetraethylenepentamine-modified silica nanotubes for low-temperature CO2 capture[J]. Energy & Fuels, 2013, 27(12): 7673-7680. |
| [19] |
KNOWLES G P, DELANEY S W, CHAFFEE A L. Diethylenetriamine[propyl(silyl)]-functionalized (DT) mesoporous silicas as CO2 adsorbents[J]. Industrial & Engineering Chemistry Research, 2006, 45(8): 2626-2633. |
| [20] |
KNOWLES G P, GRAHAM J V, DELANEY S W, et al. Aminopropyl-functionalized mesoporous silicas as CO2 adsorbents[J]. Fuel Processing Technology, 2005, 86(14/15): 1435-1448. |
| [21] |
JIANG K, FERON P, COUSINS A, et al. Achieving zero/negative-emissions coal-fired power plants using amine-based postcombustion CO2 capture technology and biomass cocombustion[J]. Environmental Science & Technology, 2020, 54(4): 2429-2438. |
| [22] |
BAKER R W, FREEMAN B, KNIEP J, et al. CO2 capture from cement plants and steel mills using membranes[J]. Industrial & Engineering Chemistry Research, 2018, 57(47): 15963-15970. |
| [23] |
KIM Y H, KIM J J, LEE C H. Adsorptive cyclic purification process for CO2 mixtures captured from coal power plants[J]. AIChE Journal, 2017, 63(3): 1051-1063. DOI:10.1002/aic.15440 |
| [24] |
CHANG J, HOU C, WAN D, et al. Enhanced CO2 adsorption capacity of bi-amine co-tethered flue gas desulfurization gypsum with water of hydration[J]. Journal of CO2 Utilization, 2020, 35: 115-125. DOI:10.1016/j.jcou.2019.09.009 |
| [25] |
HOSSAIN M M, I. DE LASA H. Chemical-looping combustion (CLC) for inherent CO2 separations−A review[J]. Chemical Engineering Science, 2008, 63(18): 4433-4451. DOI:10.1016/j.ces.2008.05.028 |
| [26] |
YANG S, LIN X, LEWIS W, et al. A partially interpenetrated metal-organic framework for selective hysteretic sorption of carbon dioxide[J]. Nature Materials, 2012, 11(8): 710-716. DOI:10.1038/nmat3343 |
| [27] |
YANG Z Z, HE L N, GAO J, et al. Carbon dioxide utilization with C-N bond formation: carbon dioxide capture and subsequent conversion[J]. Energy & Environmental Science, 2012, 5(5): 6602-6639. |
| [28] |
WANG Q, LUO J, ZHONG Z, et al. CO2 capture by solid adsorbents and their applications: Current status and new trends[J]. Energy & Environmental Science, 2011, 4(1): 42-55. |




