2-甲基烯丙基醇是一种重要的有机化工中间体,广泛用于农药、医药、香料、树脂和聚羧酸减水剂等有机合成领域[1]。2-甲基烯丙基醇含有羟基和不饱和双键两种官能团,可溶于水和有机溶剂,能发生自聚、共聚和酯化等多种反应[2],它和环氧乙烷反应生成2-甲基烯丙基聚氧乙烯醚,可用于合成第四代聚羧酸基混凝土减水剂[3];它和有机酸酯化生成2-甲基烯丙基酯,可用于表面活性剂、混凝土外加剂、聚醚大单体起始剂等领域[4]。
2-甲基烯丙基醇的合成方法主要有2-甲基烯丙基氯(methallyl chloride,简称MAC)水解法[5]和2-甲基丙烯醛还原法[6]。水解法又分为一步水解法和酯化-水解两步法[7-8],其中一步水解法是工业生产中最为常用的方法[9],但该法会生成副产物二-(2-甲基烯丙基)-醚[10],影响反应选择性和收率。
目前,国内外对2-甲基烯丙基醇合成的研究多见于专利文献报道[11-15],主要是改进生产工艺、优化操作条件以提高产物收率,未见相关反应动力学和反应机理研究的报道。为此,本文将对2-甲基烯丙基氯与碱作用水解反应动力学进行研究。
2 实验部分 2.1 实验原料2-甲基烯丙基醇(安耐吉化学,99%),2-甲基烯丙基氯(安耐吉化学,99%),氢氧化钠(Aladdin公司,≥98%),异丁醇(MACKLIN公司,分析纯),去离子水(杭州娃哈哈集团有限公司)。
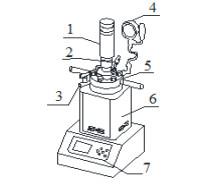
2.2 实验装置及方法2-甲基烯丙基氯(MAC)与碱作用水解反应需要较高反应温度,由于反应温度高于MAC的沸点,因此,反应在高压反应釜中进行。产物2-甲基烯丙基醇不仅易溶于有机相,而且部分溶于水相,为了保证对各组分取样分析的准确性,本文采用间歇动力学实验方法。具体方法如下:在如图 1所示的250 mL磁力耦合机械搅拌高压反应釜中,依次投入MAC、氢氧化钠、去离子水,密封后检查气密性,合格后开启加热和搅拌。以设定升温速率加热,当反应温度达到设定值并稳定后开始计时,达到设计的反应时间后停止加热和搅拌。将反应釜快速放入冰水浴中冷却至25℃左右,取出反应物,测量体积,并转移至分液漏斗中静置分层。分别称量油相和水相的质量与体积,并取样进行气相色谱分析,确定二相中各组分的含量。
|
图 1 实验装置示意图 Fig.1 Schematic diagram of the experimental apparatus 1. stirring motor 2. temperature detector 3. sample outlets 4. pressure gage 5. reactor 6. heating jacket 7. controlling unit |
使用GC-5190气相色谱仪进行定量分析,以异丁醇为内标。气相色谱分析条件如下:色谱柱为PEG20M强极性石英毛细管柱(30m×0.25mm×0.25μm),氢火焰离子化检测器,柱温初始值为70 ℃,保持6 min,之后以10 ℃·min-1升温至120 ℃并保持3min,汽化温度为250 ℃,检测器温度为280 ℃。
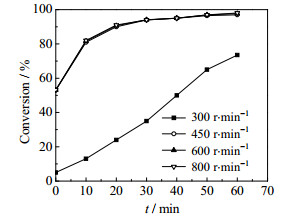
3 实验结果与讨论 3.1 传质影响的排除卤代烃水解反应是典型的液-液非均相反应,二相间的传质速率对宏观反应速率有显著影响。对于间歇搅拌釜式反应,搅拌速度增加,相界面积增加,二相间的传质速度加快,传质对反应的影响减小。图 2是当反应温度为383.15K(实验的最高反应温度)、MAC和氢氧化钠的摩尔比为1.0、氢氧化钠水溶液质量分数ω=10%时,搅拌转速对MAC转化率的影响。由图 2可见,当搅拌转速大于450r·min-1时,MAC的转化率不再受搅拌转速的影响,因此,可以认为搅拌转速大于450 r·min-1时传质影响已排除。为确保排除传质的影响,本文动力学实验均在600 r·min-1条件下进行。
|
图 2 搅拌转速对MAC转化率的影响 Fig.2 Effects of stirring speed on MAC conversion |
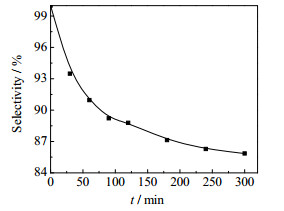
图 3是反应温度为353.15K、MAC和氢氧化钠的摩尔比为1.0、氢氧化钠水溶液质量分数ω =10%时,2-甲基烯丙基醇的选择性随时间的变化。由图 3可见,2-甲基烯丙基醇的选择性随着反应的进行而逐渐降低,这是连串反应中间产物选择性的典型变化规律。
|
图 3 反应时间对2-甲基烯丙基醇选择性的影响 Fig.3 Effects of reaction time on the selectivity of methallyl alcohol |
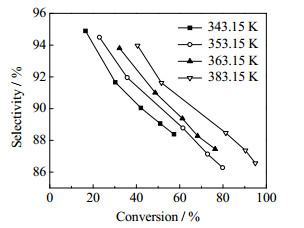
图 4是MAC和氢氧化钠的摩尔比为1.0、氢氧化钠水溶液质量分数ω=10%时,2-甲基烯丙基醇的选择性随转化率的变化情况。由图 4可见,2-甲基烯丙基醇的选择性随反应温度升高而升高,由此可以判断该体系主反应的活化能高于副反应,升高温度对反应有利。
|
图 4 反应温度对2-甲基烯丙基醇选择性的影响 Fig.4 Effects of reaction temperatures on the selectivity of methallyl alcohol |
图 5是反应温度为353.15K、水用量为144g时,氢氧化钠和MAC摩尔比对反应选择性的影响。由图 5可见,随着氢氧化钠和MAC摩尔比的增加,2-甲基烯丙基醇的选择性增加。其原因是MAC的水解需要碱性环境,适当增加碱量有利于维持良好碱性环境,加快主反应速率,提高反应选择性。但是碱量增加对反应选择性提高幅度不大,摩尔比增加0.1,选择性只增加1%左右,考虑到过量的碱会造成原料浪费,加快对设备的腐蚀,因此选择氢氧化钠和MAC摩尔比为1.0。
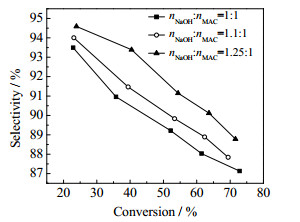
|
图 5 原料配比对反应的影响 Fig.5 Effects of molar ratios on the reaction |
图 6是反应温度353.15K、氢氧化钠与MAC摩尔比为1.0时,氢氧化钠浓度对反应的影响。由图 6可见,氢氧化钠质量分数增加,即水用量减少,2-甲基烯丙基醇的选择性有所下降,但幅度不大。其原因是水用量减少有利于氢氧化钠和2-甲基烯丙基醇正向反应,生成更多的2-甲基烯丙基醇钠,从而促进成醚副反应。但是降低氢氧化钠浓度会导致含盐废水量增加,增加后处理成本,因此,合适的氢氧化钠质量分数ω=10%左右。
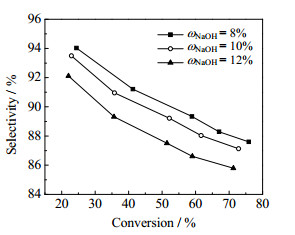
|
图 6 氢氧化钠浓度对反应的影响 Fig.6 Effects of sodium hydroxide concentration on the reaction selectivity |
MAC水解反应是SN2取代反应,生成产物2-甲基烯丙基醇;同时,2-甲基烯丙基醇又和MAC反应生成副产物二-(2-甲基烯丙基)-醚。反应方程式如下: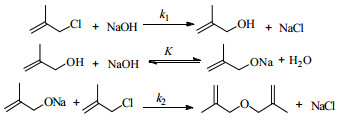
为验证反应机理的可靠性,本文安排了以下二个实验:一是将MAC与2-甲基烯丙基醇及水一起加热到383.15K并保温1 h,反应产物中没有发现副产物二-(2-甲基烯丙基)-醚;二是将2-甲基烯丙基醇与氢氧化钠水溶液一起加热到383.15 K并保温1 h,也未发现副产物二-(2-甲基烯丙基)-醚。由此可以确定二-(2-甲基烯丙基)-醚的生成途径为:2-甲基烯丙基醇先和氢氧化钠反应生成2-甲基烯丙基醇钠,再与MAC反应生成二-(2-甲基烯丙基)-醚。其中2-甲基烯丙基醇与氢氧化钠反应生成2-甲基烯丙基醇钠属于离子交换快反应,可以认为在任何时刻都达到平衡。
根据上述反应机理,并假设反应在水相中进行,反应速率方程可表示为:
| $ - {r_{{\rm{RCl}}}} = - \frac{1}{{{V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}\frac{{{\rm{d}}{n_{{\rm{RCl}}}}}}{{{\rm{d}}t}} = {k_1}\overline {{c_{{\rm{RCl}}}}} \cdot {c_{{\rm{NaOH}}}} + {k_2}\overline {{c_{{\rm{RCl}}}}} \cdot {c_{{\rm{RONa}}}} $ | (1) |
| $ {{r}_{\text{ROR}}}=\frac{1}{{{V}_{{{\text{H}}_{\text{2}}}\text{O}}}}\frac{\text{d}{{n}_{\text{ROR}}}}{\text{d}t}={{k}_{\mathrm{2}}}\overline{{{c}_{\text{RCl}}}}\cdot {{c}_{\text{RONa}}} $ | (2) |
| $ {r_{{\rm{ROH}}}} = \frac{1}{{{V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}\frac{{{\rm{d}}{n_{{\rm{ROH}}}}}}{{{\rm{d}}t}} = \frac{1}{{{V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}\frac{{{\rm{d}}\left( {{n_{{\rm{total}}}} - {n_{{\rm{RCl}}}} - 2{n_{{\rm{ROR}}}}} \right)}}{{{\rm{d}}t}} = {k_1}\overline {{c_{{\rm{RCl}}}}} \cdot {c_{{\rm{NaOH}}}} - {k_2}\overline {{c_{{\rm{RCl}}}}} \cdot {c_{{\rm{RONa}}}} $ | (3) |
| $ K = \frac{{{c_{{\rm{RONa}}}} \cdot {c_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}{{{c_{{\rm{NaOH}}}} \cdot \overline {{c_{{\rm{ROH}}}}} }} $ | (4) |
式中,下标RCl代表MAC,下标ROH代表 2-甲基烯丙基醇,下标ROR代表二-(2-甲基烯丙基)-醚,下标RONa代表甲基烯丙基醇钠,上标 ̄代表该化合物在水相的浓度。
由式(4)可得甲基烯丙基醇钠浓度表达式为:
| $ {c_{{\rm{RONa}}}} = \frac{{K{c_{{\rm{NaOH}}}} \cdot \overline {{c_{{\rm{ROH}}}}} }}{{{c_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}} $ | (5) |
MAC的质量守恒式为:
| $ {n_{{\rm{RCl}}}} = {V_{{\rm{Oil}}}}{c_{{\rm{RCl}}}} + {V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}\overline {{c_{{\rm{RCl}}}}} $ | (6) |
油水二相中的分配系数KRCl为:
| $ {K_{{\rm{RCl}}}} = \frac{{{c_{{\rm{RCl}}}}}}{{\overline {{c_{{\rm{RCl}}}}} }} $ | (7) |
由式(6)和(7)可得MAC的浓度表达式如下:
| $ \overline {{c_{{\rm{RCl}}}}} = \frac{{{n_{{\rm{RCl}}}}}}{{{K_{{\rm{RCl}}}}{V_{{\rm{Oil}}}}{\rm{ + }}{V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}} \approx \frac{{{n_{{\rm{RCl}}}}}}{{{K_{{\rm{RCl}}}}{V_{{\rm{Oil}}}}}} $ | (8) |
由于MAC在水中的溶解度很小,可认为KRCl>>1。同理可以得到2-甲基烯丙基醇的浓度表达式。
| $ \overline {{c_{{\rm{ROH}}}}} = \frac{{{n_{{\rm{ROH}}}}}}{{{K_{{\rm{ROH}}}}{V_{{\rm{Oil}}}} + {V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}} $ | (9) |
将式(1)和(2)相减,并将式(8)代入,可得:
| $ - \frac{1}{{{V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}\frac{{{\rm{d}}\left( {{n_{{\rm{RCl}}}} + {n_{{\rm{ROR}}}}} \right)}}{{{\rm{d}}t}} = {k_1}\overline {{c_{{\rm{RCl}}}}} \cdot {c_{{\rm{NaOH}}}} \approx {k_1}\frac{{{n_{{\rm{RCl}}}}}}{{{K_{{\rm{RCl}}}}{V_{{\rm{Oil}}}}}}{c_{{\rm{NaOH}}}} = \frac{{{k_1}}}{{{K_{{\rm{RCl}}}}}}\frac{{{n_{{\rm{RCl}}}} \cdot {c_{{\rm{NaOH}}}}}}{{{V_{{\rm{Oil}}}}}} $ | (10) |
| $ - \int_{n_{{\rm{RCl}}}^{\rm{0}} + _{{\rm{ROR}}}^{\rm{0}}}^{n_{{\rm{RCl}}}^t + _{{\rm{ROR}}}^t} {{\rm{d}}({n_{{\rm{RCl}}}} + {n_{{\rm{ROR}}}}) = {{k'}_1}\int_{\rm{0}}^t {\frac{{{n_{{\rm{RCl}}}}{n_{{\rm{NaOH}}}}}}{{{V_{{\rm{Oil}}}}}}} } {\rm{d}}t $ | (11) |
| $ n_{{\rm{RCl}}}^0 + n_{{\rm{ROR}}}^0 - n_{{\rm{RCl}}}^t - n_{{\rm{ROR}}}^t = {k_1}^\prime \int_{\rm{0}}^t {\frac{{{n_{{\rm{RCl}}}} \cdot {n_{{\rm{NaOH}}}}}}{{{V_{{\rm{Oil}}}}}}} {\rm{d}}t $ | (12) |
式(12)等号左边记作y1(n)、等号右边积分项记作x1(t),于是
| $ {y_1}(n) = {k_1}^\prime {x_1}(t) $ | (13) |
由式(2)、式(5)、式(8)和式(9)可得:
| $ - \frac{1}{{{V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}}\frac{{{\rm{d}}{n_{{\rm{ROR}}}}}}{{{\rm{d}}t}} = {k_2}\overline {{c_{{\rm{RCl}}}}} \cdot {c_{{\rm{RONa}}}} = {k_2}\frac{{{n_{{\rm{RCl}}}}}}{{{K_{{\rm{RCl}}}}{V_{{\rm{Oil}}}}}}\frac{{K{c_{{\rm{NaOH}}}} \cdot \overline {{c_{{\rm{ROH}}}}} }}{{{c_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}} = \frac{{{k_2}K}}{{{K_{{\rm{RCl}}}}}}\frac{{{n_{{\rm{RCl}}}} \cdot {c_{{\rm{NaOH}}}}}}{{{V_{{\rm{Oil}}}}{c_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}} \cdot \frac{{{n_{{\rm{ROH}}}}}}{{{K_{{\rm{ROH}}}}{V_{{\rm{Oil}}}} + {V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}} $ | (14) |
| $ n_{{\rm{ROR}}}^t - n_{{\rm{ROR}}}^{\rm{0}} = {k_{\rm{2}}}^\prime \int_{\rm{0}}^t {\frac{{{n_{{\rm{RCl}}}} \cdot {n_{{\rm{NaOH}}}} \cdot {n_{{\rm{ROH}}}}}}{{{V_{{\rm{Oil}}}}{n_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}({K_{{\rm{ROH}}}}\frac{{{V_{{\rm{Oil}}}}}}{{{V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}} + 1)}}{\rm{d}}t} $ | (15) |
式(15)等号左边记作y2(n)、等号右边积分项记作x2(t),于是
| $ {y_2}(n) = {k_2}^\prime {x_2}(t) $ | (16) |
对动力学方程通过积分法进行线性化处理,得到式(12)和式(15)。其中,实际反应温度下的油相和水相反应体积VOil和VH2O用常温下实际测得体积近似代替。KROH由实验测量得到,其方法是:取一定质量的2-甲基烯丙基醇,分别与质量分数ω=10%的氢氧化钠溶液、氢氧化钠和氯化钠混合溶液(假设实际反应过程中50%氢氧化钠转化成氯化钠)、氯化钠溶液(假设氢氧化钠全部转化成氯化钠)充分搅拌下混合,升温到所需温度后保持恒温,待混合充分后静置6 h以上,分别取样测出油相和水相中2-甲基烯丙基醇的浓度,计算对应转化率下的KROH。
由于温度过高时反应太快,并且2-甲基烯丙基醇会和水共沸,无法测得2-甲基烯丙基醇的分配系数,所以动力学实验时反应温度选择在343.15~363.15K。将实验得到的反应物及产物的量代入式(12)和式(15)进行拟合,求出x(t)和y(n),结果见图 7,由此得到不同温度下的反应速率常数k1'和k2'(见表 1)。
|
|
表 1 不同反应温度下的反应速率常数 Table 1 Reaction rate constants at different temperatures |
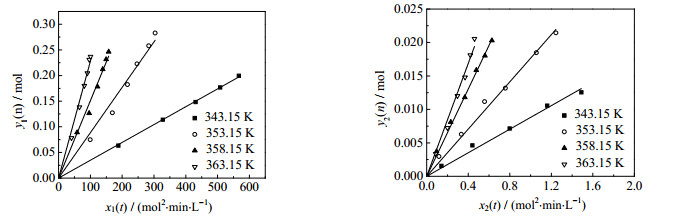
|
图 7 不同温度下y(n)随x(t)的变化 Fig.7 Profiles of x(t)~y(n) at different temperatures |
结合Arrhenius方程
结果如图 8所示。由图 8可求得MAC和氢氧化钠反应的活化能E为98.25kJ·mol-1、指前因子k0为3.101×1011 L·mol-1·min-1,MAC和2-甲基烯丙基醇钠反应的活化能E为83.89kJ·min-1、指前因子k0为5.024×1010 L·mol-1·min-1。
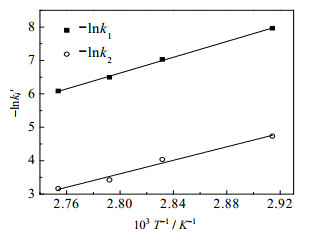
|
图 8 -lnk'与T-1关系 Fig.8 Relationship between-lnk'and T-1 |
为了验证上述动力学模型的可靠性,本文在反应温度353.15和363.15K、氢氧化钠与MAC摩尔比变为1.1,氢氧化钠水溶液质量分数仍为ω=10%条件下进行动力学实验,将实验数据代入式(12)和式(15),求出x(t)和y(n),绘制在图 9上;而图中的直线则为相同温度下氢氧化钠与MAC摩尔比为1.0时的x(t) ~ y(n)拟合线。由图 9可见,氢氧化钠与MAC摩尔配比改变前后,二者符合良好,也就是说,动力学模型依然适用。
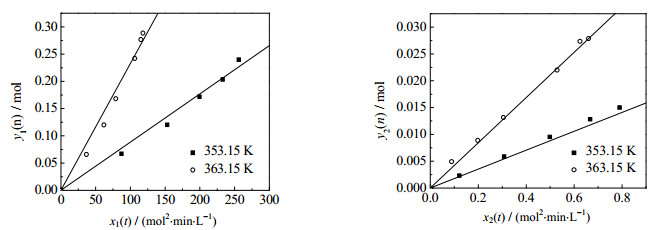
|
图 9 不同原料配比的实验值与拟合值对比 Fig.9 Comparison of experimental and fitting data at different mole ratios |
本文研究了2-甲基烯丙烯基氯的水解反应动力学,提出了反应机理和动力学模型,在排除传质影响条件下,反应温度为343.15~363.15 K、氢氧化钠和2-甲基烯丙基氯摩尔比为1.0~1.1、氢氧化钠水溶液质量分数为10%条件下,反应动力学方程可表述为:
| $ $\begin{array}{c} - {r_{{\rm{RCl}}}} = 3.101 \times {10^{11}}{\rm{exp}}\left( { - \frac{{98.25 \times {{10}^3}}}{{RT}}} \right)\frac{{{n_{{\rm{RCl}}}} \cdot {n_{{\rm{NaOH}}}}}}{{{V_{{\rm{Oil}}}} \cdot {V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}} + 5.024 \times {10^{{\rm{10}}}}{\rm{exp}}\left( { - \frac{{83.89 \times {{10}^3}}}{{RT}}} \right)\frac{{{n_{{\rm{RCl}}}} \cdot {n_{{\rm{ROH}}}} \cdot {n_{{\rm{NaOH}}}}}}{{{V_{{\rm{Oil}}}}{n_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}({K_{{\rm{ROH}}}}{V_{{\rm{Oil}}}} + {V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}})}}\\ {r_{{\rm{ROR}}}} = 5.024 \times {10^{10}}{\rm{exp}}\left( { - \frac{{83.89 \times {{10}^3}}}{{RT}}} \right)\frac{{{n_{{\rm{RCl}}}} \cdot {n_{{\rm{ROH}}}} \cdot {n_{{\rm{NaOH}}}}}}{{{V_{{\rm{Oil}}}}{n_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}({K_{{\rm{ROH}}}}{V_{{\rm{Oil}}}} + {V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}})}}\\ {r_{{\rm{ROH}}}} = 3.101 \times {10^{11}}{\rm{exp}}\left( { - \frac{{98.25 \times {{10}^3}}}{{RT}}} \right)\frac{{{n_{{\rm{RCl}}}} \cdot {n_{{\rm{NaOH}}}}}}{{{V_{{\rm{Oil}}}} \cdot {V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}}} - 5.024 \times {10^{10}}{\rm{exp}}\left( { - \frac{{83.89 \times {{10}^3}}}{{RT}}} \right)\frac{{{n_{{\rm{RCl}}}} \cdot {n_{{\rm{ROH}}}} \cdot {n_{{\rm{NaOH}}}}}}{{{V_{{\rm{Oil}}}}{n_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}}({K_{{\rm{ROH}}}}{V_{{\rm{Oil}}}} + {V_{{{\rm{H}}_{\rm{2}}}{\rm{O}}}})}} \end{array}$ $ |
|
|
| [1] |
韩微微. 2-甲基烯丙醇生产技术研究进展及应用[J]. 辽宁化工, 2014, 43(12): 1513-1514. HAN W W. Research progress and application of beta-methallyl alcohol production technology[J]. Liaoning Chemical Industry, 2014, 43(12): 1513-1514. |
| [2] |
张建锋, 宋永良, 王家丰, 杨慧芬. TPEG聚醚对聚羧酸减水剂性能的影响[J]. 浙江化工, 2012, 43(11): 7-10. ZHANG J F, SONG Y L, WANG J F, YANG H F, et al. The influence of TPEG-polyether on the performance of polycarboxylate superplasticizer[J]. Zhejiang Chemical Industry, 2012, 43(11): 7-10. DOI:10.3969/j.issn.1006-4184.2012.11.003 |
| [3] |
许永东.聚羧酸减水剂的合成研究[D].太原: 太原理工大学, 2014. XU Y D. Study on synthesis of polycarboxylate superplasticizer[D]. Taiyuan: Taiyuan University of Technology, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10112-1014418560.htm |
| [4] |
邹邵华.聚酯与聚醚型减水剂的合成和性能研究[D].北京: 北京交通大学, 2010. ZOU S H. The synthesize and study on performance of polyester-type and polyether type superplasticizer water reducing agent[D]. Beijing: Beijing Jiaotong University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10004-2010120016.htm |
| [5] |
MIROSLAV W T, Herbert P A. Process for the production of allyl alcohol: US, 2072016[P]. 1937-02-23.
|
| [6] |
RUI G, LING Y G, NING C L, et al. Selective hydrogenation of methacrolein to methylallyl alcohol: CN, 106631691[P]. 2017-05-10.
|
| [7] |
FRANZ K D. Preparation of allyl alcohol and its homologues: US, 2323781[P]. 1943-07-06.
|
| [8] |
CUI M F, TANG J M, XU Y C, et al. Preparation of 2-methylallyl alcohol by esterification and hydrolysis in two steps: CN, 103242139[P]. 2015-07-01.
|
| [9] |
张明.甲基丙烯醛选择性加氢制备甲基烯丙醇的催化剂研究[D].上海: 上海师范大学, 2017. ZHANG M. Study on catalyst for selective hydrogenation of methacrolein to methylallyl alcohol[D]. Shanghai: Shanghai Normal University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10270-1017154152.htm |
| [10] |
YANG Z J, YU W F, XU Y P, et al. Synthesis of 2-methyl alcohol: CN, 101759528[P]. 2013-01-16.
|
| [11] |
CHEN J H, ZHU X W, LIN Z Y, et al. Synthesis of 2-methylallyl alcohol by continuous hydrolysis: CN, 103588622[P]. 2015-09-02.
|
| [12] |
WANG S L, CHEN Z R, WANG X R, et al. A synthetic method of 2-methylallyl alcohol: CN, 105037097[P]. 2015-11-11.
|
| [13] |
XU Z H. A preparation method of 2-methyl-2-propylene-1-alcohol: CN, 104447206[P]. 2015-03-25.
|
| [14] |
TAO X Y, GU X C, WANG Q H, et al. A methyl allyl alcohol production system and method: CN, 107365245[P]. 2017-11-21. YIN H, CHEN Z R, WANG W S, et al. A method for continuous preparation of 2-methylallyl alcohol: CN, 108191604[P]. 2018-06-22.
|




