2. 南京林业大学 化学工程学院, 江苏 南京 210037;
3. 江苏晨光涂料有限公司, 江苏 常州 213154
2. College of Chemical Engineering, Nanjing Forestry University, Nanjing 210037, China;
3. Jiangsu Chenguang Paint Co., Ltd., Changzhou 213154, China
硅橡胶因其具有良好的耐温性,耐候性以及生理惰性等特点[1~3],而被广泛的应用于国防、医疗卫生、工农业生产及日常生活中[4]。硅橡胶在现代医学领域发挥着越来越重要的作用,但因硅橡胶表面高度疏水性使其极易导致表面细菌黏附,从而大大限制了其在医疗领域的应用,目前硅橡胶表面改性降低其表面细菌黏附成为研究热点之一[5~7]。硅橡胶表面改性[8, 9]方法主要有辐射、电晕放电、等离子体处理[10]等,但通过物理方法改性的硅橡胶表面功能性不够稳定,具有时效性。而化学接枝改性尤其活性接枝聚合[11, 12]具有可设计性强、有效等优点。本文通过改变复配交联剂比例制备系列室温硫化硅橡胶。采用等离子体处理硅橡胶,在硅橡胶表面产生活性基团,再利用表面引发原子转移自由基聚合技术,在硅橡胶表面接枝极性聚丙烯酰胺。考察硅橡胶表面组成、结构及性能对细菌黏附[13~15]的影响。
2 实验(材料和方法) 2.1 主要试剂端羟基聚二甲基硅氧烷(PDMS):Mn=8000,山东大易化工有限公司,C.P.,提纯后使用;甲基三丁酮肟基硅烷(D-30)、γ-甲基丙烯酰氧丙基三甲氧基硅烷(KH570):湖北新蓝天新材料股份有限公司;丙烯酰胺(AM)、乙酸乙酯:国药集团化学试剂有限公司,A.R.;CuCl:国药集团化学试剂有限公司,A.R.,提纯后使用;其它试剂均为分析纯,直接使用。
2.2 室温硫化硅橡胶的制备将提纯后的聚二甲基硅氧烷在110℃下抽真空搅拌2.5 h,加入脱肟型和脱醇型混合交联剂,其中羟基封端聚二甲基硅氧烷:混合交联剂(质量比)=100:8,其中混合交联剂中脱肟型交联剂与脱醇型交联剂D-30与KH570质量比为7:1;继续抽真空搅拌1 h后加入催化剂二月桂酸二丁基锡,抽真空搅拌30 min后倒入模具中,在室温下硫化2周,即制得室温硫化硅橡胶。
2.3 硅橡胶表面固定引发剂(1) 将制备的室温硫化硅橡胶剪成1 cm×1 cm的硅橡胶片,利用等离子体处理硅橡胶,采用氧气为处理氛围,功率:500 W,氧气流:0.2 NL·min-1,处理时间:4 min。
(2) 上述(1)中活化后的硅橡胶置于250 mL烧瓶,加入80 mL乙酸乙酯和6.5 mL三乙胺,冰盐浴下搅拌,用恒压滴液漏斗滴加含有5 mL α-溴代异丁酰溴和20 mL乙酸乙酯的混合液,升到室温继续搅拌反应5 h。取出硅橡胶片,用去离子水、无水乙醇和丙酮各超声洗涤三次,50 ℃真空下干燥过夜,得到表面含溴基团的硅橡胶。
2.4 硅橡胶表面接枝PAM对50 mL克氏瓶进行烤瓶-抽真空-充氮气循环操作3次。将表面固定引发剂的硅橡胶片、0.047 g 2,2′-联二吡啶(bpy)、0.01 g CuCl和2.50 g AM加入克氏瓶中。然后加入3 mL水与丙酮(V水:V丙酮=1:1)的混合溶剂、3 μL的游离引发剂(2-溴代乙丁酸乙酯)后密封,将克氏瓶置于50℃油浴中反应一定时间。取出硅橡胶,分别用去离子水、无水乙醇和丙酮超声波洗涤三次,置于50℃真空干燥箱中干燥24 h,即得到表面接枝聚丙烯酰胺的硅橡胶。
2.5 硅橡胶表面细菌粘附实验 2.5.1 菌液的制备按照液体培养基配比,配制出200 mL的牛肉膏胰蛋白胨液体培养基,利用湿热法高温杀菌。利用接种环刮取一环细菌接种于液体培养基中,置于37℃、120 r·min-1的气浴恒温振荡器中振荡培养12 h。液体及固体培养基配方如表 1所示。
| 表 1 牛肉膏蛋白胨培养基 Table 1 Composition of the beef extract peptone medium |
将接枝改性前后的硅橡胶膜片经高压灭菌后,放入处于对数期的新鲜菌液中,在37℃气浴恒温振荡器中振荡培养8 h,培养完成后取出膜片。将黏附有细菌的膜片用无菌水冲洗,除去其表面游离的细菌,再将薄片放入无菌水中,置于超声清洗机中超声处理5 min,分离黏附于硅橡胶薄膜样品表面的细菌。
2.5.3 平板菌落计数法将上述2.5.2节中菌液,采用10倍系列稀释法(1 mL菌液+9 mL稀释液)进行等比稀释,取0.1 mL菌液均匀涂在固体培养基中,在37℃培养箱中培养24 h后进行菌落计数(每个梯度做五个平行)。根据菌落计数结果,计算硅橡胶改性前后表面黏附的细菌个数。细菌计算公式:
细菌数=菌落数目×稀释倍数
2.6 硅橡胶表面结构表征及性能测试 2.6.1 硅橡胶表面XPS分析利用ESCALABMKLL型X射线光电子能谱(英国VG CO)测试硅橡胶表面元素组成。
2.6.2 红外光谱测试采用Nicolet 460型傅里叶变换红外光谱仪(美国Nicolet公司)分析接枝改性前后硅橡胶表面结构变化。
2.6.3 接枝量,接触角及表面自由能测试(A) 硅橡胶单位面积上的接枝量:利用称重法测定硅橡胶表面单位面积接枝量,G=(m2-m1)/A。
(B) 接触角:利用HARKE-CA接触角测试仪测试改性前后硅橡胶接触角。
(C) 表面自由能:根据水与甲酰胺接触角数据,通过如下Fowkes公式计算求出硅橡胶表面自由能。
| $ {\gamma _{\rm{L}}}\left( {1 + \cos \theta } \right) = 2{\left( {{\gamma _{\rm{S}}}^{\rm{d}} \times {\gamma _{\rm{L}}}^{\rm{d}}} \right)^{1/2}} + 2{\left( {{\gamma _{\rm{S}}}^{\rm{P}} \times {\gamma _{\rm{L}}}^{\rm{P}}} \right)^{1/2}} $ | (1) |
| $ {\gamma _{\rm{L}}} = {\gamma _{\rm{L}}}^{\rm{d}} + {\gamma _{\rm{L}}}^{\rm{P}} $ | (2) |
| $ {\gamma _{\rm{S}}} = {\gamma _{\rm{S}}}^{\rm{d}} + {\gamma _{\rm{S}}}^{\rm{P}} $ | (3) |
硅橡胶表面经喷金处理,利用日本电子公司JSM-6360LA型扫描电子显微镜观察改性前后硅橡胶表面形貌变化。
2.6.5 细菌黏附测试利用上海工微所科技有限公司提供的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌对硅橡胶进行细菌黏附性测试。
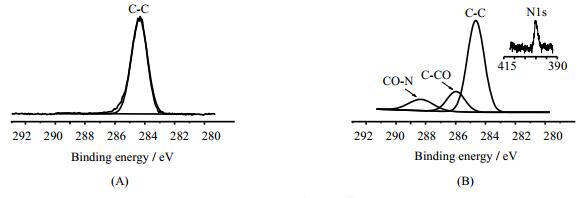
3 结果与讨论 3.1 硅橡胶表面XPS分析图 1分别为未改性硅橡胶和接枝PAM硅橡胶表面C 1s的XPS能谱图,纯硅橡胶表面C 1s的特征电子结合能峰只出现在284.8 eV处,而改性后硅橡胶表面的C 1s经拟合出现三个特征峰:(1)284.8 eV为脂肪烃中C特征峰;(2)285.8 eV为与酰胺基相连的C的特征能峰(C-CONH2);(3)288.4 eV为酰胺基中C的特征能峰(-CONH2)。其中-CONH2中C的特征能峰和图 1(B)右上角的N 1s特征能峰的出现表明PAM成功地接枝在硅橡胶表面。
|
图 1 C 1s的XPS谱图 Fig.1 XPS C1s core level spectra of (A): silicon rubber; (B): silicone rubber grafted with PAM |
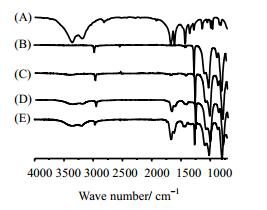
图 2(A)、(B)分别为AM和未改性硅橡胶的红外光谱图,对比图 2(C)、(D)表面接枝PAM改性4 h及24 h后硅橡胶表面的红外光谱图,改性后硅橡胶在1665 cm-1处出现了新的吸收峰,为酰胺基的特征吸收峰,3100~3300 cm-1是-NH2的伸缩振动吸收峰,1614 cm-1是-NH2的弯曲振动吸收峰,与丙烯酰胺特征吸收峰相符,表明在硅橡胶表面成功接枝上了亲水性PAM;随着接枝聚合时间的增长,硅橡胶表面-C=O和-NH2的吸收峰都在逐渐增强,主要是由于随着接枝聚合时间延长,硅橡胶表面接枝PAM的量在不断增大,从而其特征吸收峰在不断增强。(E)中脱肟型与脱醇型交联剂比例为7:10,对比图 2(D)、(E),随着复配交联剂中KH570用量的增加,硅橡胶表面接枝PAM的量也在不断增加,这是因为交联剂KH570中含有不饱和双键可以参与到接枝聚合中从而使接枝量增大。
|
图 2 硅橡胶改性前后的红外谱图 Fig.2 ATR-FTIR spectra of(A) : AM (B): native silicone rubber (C): silicone rubber grafted with PAM (5 h, KH570 accounts for 1% PDMS) (D): silicone rubber grafted with PAM (24 h, KH570 accounts for 1% PDMS (E): silicone rubber grafted with PAM (24 h, KH570 accounts for 10% PDMS) |
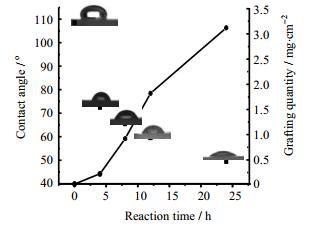
如图 3所示,未经处理的硅橡胶接触角为108.5°,基本为疏水性材料,随着接枝聚合时间的延长改性硅橡胶表面亲水性不断增强,接枝24 h后接触角下降到49.5°,亲水性得到明显改善;硅橡胶表面接枝量也在不断增大,接枝24 h后接枝量增加到3.1 mg·cm-2,体现了原子转移自由基聚合“活性”/可控的特点。表 2中硅橡胶表面自由能随着硅橡胶亲水性的不断增强也在逐渐增加,这主要是由于硅橡胶表面接枝PAM后,在硅橡胶表面引入了亲水性基团-NH2,且随着聚合时间的增加,接枝到硅橡胶表面的聚合物不断增加,-NH2的量也在不断增大,导致其接触角逐渐降低;同时随着极性聚合物PAM量的不断增加,极性基团酰胺基(-CO-NH2)的量也在不断增加,导致表面自由能的极性分量增加,从而提高了表面自由能;同时由于在硅橡胶表面形成氢键,因而接枝PAM的硅橡胶表面能进一步增大。
|
图 3 不同反应时间下表面接枝PAM硅橡胶的接触角及接枝量 Fig.3 Water contact angle and grafting capacity of the PAM grafted silicone rubber under different reaction times |
| 表 2 接枝PAM改性前后硅橡胶的接触角及表面自由能 Table 2 Contact angle and surface free energy of pure silicone rubber and silicone rubber grafted with PAM |
图 4为硅橡胶改性前后硅橡胶表面扫描电镜照片。(A)和(B)分别为未改性硅橡胶和接枝改性24 h后硅橡胶的扫描电镜图。对比两图可以发现,图 4(B)较图 4(A)出现了许多凸起和不平整的结构,这主要是接枝的PAM中极性基团-NH2在硅橡胶表面能形成氢键,分子间作用力增大,使得PAM在硅橡胶表面出现了团聚;并且PAM与硅橡胶基体之间存在相分离作用,导致硅橡胶表面形成粗糙结构。此外,整体上看,接枝的聚丙烯酰胺较均匀地覆盖于基体硅橡胶表面。

|
图 4 SEM扫描电镜照片 Fig.4 SEM micrographs of (A): native silicone rubber and (B): silicone rubber grafted with PAM for 24 h |
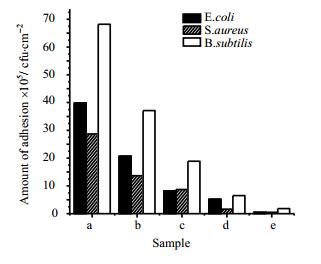
图 5给出了接枝PAM改性前后硅橡胶表面细菌的黏附状况示意图。样品由a到e中接枝时间依次增长,分别为0,4,8,12,24 h。从图中可以看出,未改性的硅橡胶膜片由于表面惰性疏水,大肠杆菌(E.coli)的黏附量较多。经表面接枝改性后,硅橡胶表面大肠杆菌(E.coli)的黏附量从39.9×105 cfu·cm-2最低降至0.5×105 cfu·cm-2,大肠杆菌黏附量降低了98.7%,与此同时,金黄色葡萄球菌(S.aureus),枯草芽孢杆菌(B.subtilis)较改性之前,硅橡胶表面细菌黏附量最低也可分别降低98.2%和97.3%。这是由于接枝PAM聚合物后向硅橡胶表面引入了大量的亲水性酰胺基团,提高了硅橡胶表面的极性及表面能,从而降低了硅橡胶表面与细菌之间的黏附引力,导致细菌的非特异性黏附被极性亲水的聚丙烯酰胺所抑制,而且随着接枝聚丙烯酰胺量的增大,细菌非特异性黏附能力越弱,从而起到了抑菌的效果。
|
图 5 不同反应时间硅橡胶表面细菌粘附状况 Fig.5 Bacterial adhesion of PAM grafted silicone rubber under different reaction times: (a) native silicone rubber (b) silicone rubber grafted with PAM for 4h (c) silicone rubber grafted with PAM for 8 h (d) silicone rubber grafted with PAM for 12 h (e) silicone rubber grafted with PAM for 24 h |
结合等离子体辐射和表面引发接枝在硅橡胶表面成功的接枝了PAM,而且随着混合交联剂中脱醇型交联剂量的增加,硅橡胶表面接枝的PAM的量也在不断增加;改性后亲水性聚合物PAM均匀地覆盖于硅橡胶表面,使得硅橡胶表面亲水性增强,但与基体硅橡胶存在相分离。此外接枝改性后硅橡胶表面细菌黏附量降低,在一定程度上大大改善了硅橡胶的生物亲和性。
符号说明:| [1] | XIE Zun-hu(谢尊虎), ZENG Fan-wei(曾凡伟), XIAO Jian-bin(肖建斌) . Performance and progress of silicone rubber(硅橡胶性能及其研究进展)[J]. Special Rubber Products(特种橡胶制品) , 2011, 32 (2) : 69-72 |
| [2] | Whitesides G M . The origins and the future of microfluidics[J]. Nature , 2006, 442 (7101) : 368-373 DOI:10.1038/nature05058 |
| [3] | ZHU Chun-feng(朱春凤), LI Bo-geng(李伯耿), YAO Ming(姚明) . Characterization of coloring structure unit of polysiloxane modified polyurethane latex(聚硅氧烷改性聚氨酯显色基团的结构、机理与表征)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2007, 21 (1) : 127-129 |
| [4] | KANG Jin(康瑾) . Application and modification technology of Silicone rubber(硅橡胶的应用及改性技术)[J]. Rubber Technology Market(橡胶科技市场) , 2008 (13) : 12-14 |
| [5] | ZHANG Cheng-yan(张承焱) . Silicone rubber applications in the biomedical field(硅橡胶在生物医学领域的应用)[J]. Silicone Materials(有机硅材料) , 2002, 16 (6) : 14-17 |
| [6] | XU Mai(许脉), ZHAO Ya-qun(赵亚群), LI Hong-min(李洪敏) . The study about the anti-bacterial adhesion ability of medical silicone rubber grafted by ultraviolet hydrophilic modification(医用硅橡胶紫外光亲水改性后的抗菌粘附能力研究)[J]. Science Technology and Engineering(科学技术与工程) , 2014, 28 (14) : 265-268 |
| [7] | Irina Fundeanua, Doris Kleeb, Arend J. Schouten. . Solvent-free functionalization of silicone rubber and efficacy of PAAm brushes grafted from an amino-PPX layer against bacterial adhesion[J]. Acta Biomaterialia , 2010, 11 (6) : 4271-4276 |
| [8] | WANG Liang(王亮), CHEN Hong(陈红), SONG Wei(宋巍) . Research progress of silicone elastomer surface biocompatibility(有机硅弹性体表面生物相容性的研究进展)[J]. Polymer Bulletin(高分子通报) , 2007 (10) : 21-25 |
| [9] | CHEN Xiao-dong(陈晓东), PU Dong-xu(朴东旭) . Plasma surface hydrophilic modification of silicone rubber(硅橡胶的等离子体表面亲水改性)[J]. Polymer Materials Science & Engineering(高分子材料科学与工程) , 2000, 16 (1) : 153-155 |
| [10] | LI Wei(李伟), YAO Shu-yong(姚树勇), MA Ke-ming(马克明) . Study on the application of plasma modification to carbon fiber/PEK-C composites(等离子体改性技术在碳纤维/PEK-C复合材料中的应用研究)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2014, 28 (3) : 690-694 |
| [11] | Matyjaszewski K, Xia J H . Atom transfer radical polymerization[J]. Chemical Reviews , 2001, 101 (9) : 2921-2990 DOI:10.1021/cr940534g |
| [12] | Matyjaszewski K, Paik H J, Zhou P . Determination of activation and deactivation rate const ants of model compounds in atomt ransfer radical polymerization[J]. Macromolecules , 2001, 34 (15) : 5125-5131 DOI:10.1021/ma010185+ |
| [13] | Vassiliki A T, Stuart L C . Staphylococcusaureus adhesion to self-assembled monolayers:effect of surface chemistry and fibrinogen presence[J]. Biointerfaces , 2002, 24 (3-4) : 217-228 DOI:10.1016/S0927-7765(01)00240-5 |
| [14] | Liu Y, Zhao Q . Influence of surface energy of modified surfaces on bacterial adhesion[J]. Biophysical Chemistry , 2005, 117 (1) : 39-45 DOI:10.1016/j.bpc.2005.04.015 |
| [15] | WU Gang(吴刚), WAN Chang-xiu(万昌秀), DUAN You-rong(段友荣) . Researches on surface modification for prevention of bacterial adhesion to implanting biomaterials(植入用高分子材料表面改性抗细菌粘附的研究进展)[J]. J Biomed Eng(生物医学工程学杂志) , 2000, 17 (1) : 84-86 |




