2. 大连工业大学 分析中心,辽宁 大连 116034
2. Instrumental Analysis Center, Dalian Polytechnic University, Dalian 116034, China
柚苷酶 (Naringinase) 是由α-L-鼠李糖苷酶和β-D-葡萄糖苷酶组成的混合酶,在柚皮苷的酶解过程中,首先α-L-鼠李糖苷酶将柚皮苷水解为L-鼠李糖和普鲁宁,然后β-D-葡萄糖苷酶进一步将普鲁宁水解为葡萄糖和柚皮素,因此柚苷酶具有α-L-鼠李糖酶和β-D-葡萄糖苷酶的双重活性[1]。柚苷酶作为一种生物酶制剂,能够将柚类果汁的苦味物质分解为无苦味物质,从而达到脱苦效果,具有非常重要的工业化应用价值[2]。同时柚皮苷及其分解产物作为重要医药化工的中间体,具有抗炎、抗癌、抗菌、抗氧化、降低胆固醇等功能,普鲁宁具有抗病毒活性,柚皮素还具有抗诱变和保护神经的作用[3]。
目前,微生物是柚苷酶的主要来源,能产生柚苷酶的微生物有细菌[4]、真菌和酵母[5]等。真菌是生产柚苷酶的最常用来源,主要生产菌种是黑曲霉、根霉和棘孢曲霉等。国内外关于柚苷酶的研究多集中在菌种筛选、单一菌种发酵、酶的分离纯化等方面。Vinothkunar等[6]利用土壤中分离得到的黑曲霉VB07发酵生产柚苷酶,探究了碳源、有机氮源、无机氮源、温度、初始pH等因素对产酶的影响,结果发现培养基优化后产酶量提高了1.8倍。Ni等[7]从Aspergillus niger发酵液中分离纯化出α-L-鼠李糖苷酶,该酶可将柚皮苷转化成普鲁宁,转化率为97%,可应用于食品和医药工业。Shanmugam等[8]研究发现根霉可以发酵生产α-鼠李糖苷酶。鲁浪波等[9]通过稀释平板法和透明圈法,筛选出一株柚苷酶生产菌,经摇瓶发酵后测得柚苷酶活力可达264.07 U·mL-1,最终鉴定该菌株为棘孢曲霉。但是,国内外研究中多使用单一菌种进行发酵生产柚苷酶,容易受到菌种生产能力低、底物谱窄、产物抑制等因素的限制。
近年来发展起来的共培养发酵策略能够有效解决上述问题,在共培养体系中,微生物之间的协同代谢和互惠共生作用会促进目标产物的积累或引起新产物的生成[10]。此外共培养还能够提高底物的利用率,增强对逆境的耐受性[11]。Li等[12]研究发现透明分支杆菌和枝孢菌之间存在协同作用,当两种菌同时使用时能够有效地对柴油污染物进行生物降解,清除率可达99%,显著高于单菌的降解效果。El-Deen等[13]发现在混合培养黑曲霉NRC7A和米曲霉NRRL447的过程中,β-葡萄糖苷酶的产量几乎是分别单独培养两种菌株的1.2和9.8倍。Hu等[14]通过平板生长实验发现,黑曲霉、米曲霉和稻瘟病菌混合接种时,会存在明显边界,不会相互侵染,且在共培养过程中能够提高β-葡萄糖苷酶、β-半乳糖苷酶和漆酶的活力。
本研究利用实验室自主保藏的真菌进行共培养发酵生产柚苷酶,采用柚皮苷作为诱导物,筛选出高产柚苷酶的菌株体系,同时对共培养生产柚苷酶的新型发酵工艺过程进行研究,为进一步降低生产成本,推动柚苷酶的工业化进程,探索并建立柚苷酶的高产发酵技术具有重要的研究意义和应用价值。
2 材料与方法 2.1 实验材料菌株:黑曲霉FFCC 848,黑曲霉FFCC 48,黑曲霉FFCC 3111,黑曲霉FFCC 3112,黑曲霉FFCC uv-11,黑曲霉FFCC Rapid,米曲霉FFCC 39,米曲霉FFCC 3102,根霉FFCC 3201,均由大连工业大学菌种保藏中心提供。
材料:柚皮苷 (≥98%),购自宝鸡市方晟生物开发有限公司;脱脂豆粉,购自大连调味食品厂。其他化学试剂皆为分析纯。
仪器设备:LRH-150生化培养箱,购自上海一恒科学仪器有限公司;ZHJH-1112垂直流超净工作台,购自上海智城分析科学仪器制造有限公司;H2P-250全温培养振荡器,购自上海精宏实验设备有限公司;TGL-16G高速离心机,购自上海安亭科学仪器厂;HH-8数显恒温水浴锅,购自江苏省金坛市荣华仪器制造有限公司;SpectraMax Plus384酶标仪,购自美国Molecular Devices (MD) 公司。
2.2 培养基斜面/平板筛选培养基 (g·L-1):NaNO3 3.0,FeSO4·7H2O 0.01,K2HPO4·12H2O 1.0,KH2PO4·2H2O 1.0,MgSO4·7H2O 0.5,KCl 0.5,蔗糖30.0,琼脂30.0,柚皮苷2.0,pH 6.0,121℃灭菌20 min。
种子培养基 (g·L-1):KH2PO4·2H2O 1.5,K2HPO4·12H2O 1.5,MgSO4·7H2O 0.5,(NH4)2SO4 4.0,ZnSO4·7H2O 0.09,CaCl2 0.1,豆粉2.0,蛋白胨2.0,酵母浸粉1.0,柚皮苷6.0,pH 6.0,121℃灭菌20 min。
发酵培养基 (g·L-1):KH2PO4·2H2O 1.5,K2HPO4·12H2O 1.5,MgSO4·7H2O 0.5,(NH4)2SO4 4.0,ZnSO4·7H2O 0.09,CaCl2 0.1,豆粉2.0,蛋白胨2.0,酵母浸粉1.0,柚皮苷6.0,初始pH 6.0,121 ℃灭菌20 min。
2.3 实验方法 2.3.1 单孢子悬液的制备将4℃贮藏的斜面菌种转接到斜面培养基上,于30℃恒温培养4~5 d得到成熟的孢子。然后用0.9%(w/v) 无菌生理盐水将孢子洗下,倒入到装有玻璃珠的锥形瓶中,30℃振荡培养l h,待孢子充分打散后,测孢子悬液OD600值,并用无菌生理盐水将其调整至OD600为0.200,即得单孢子悬液,备用。
2.3.2 种子液的制备将单孢子悬液以10%的接种量接种至装液量为30 mL的种子培养基 (250 mL三角瓶) 中,在30℃,180 r·min-1的条件下培养2~3 d。
2.4 测定方法 2.4.1 平板透明圈的测定将柚皮苷显色液滴加到平板培养基中至覆盖整个平板,40℃恒温反应20 min,然后移除反应残液,在柚苷酶生产菌落周围能够用肉眼观察到清晰可见的透明圈,进一步根据HC值的大小初步判断柚苷酶活力的高低[15]。
| $ {\rm{HC值 = }}\frac{{透明圈直径}}{{菌落直径}} $ |
采用改进的Davis法[16]:将0.8 mL的0.8 mg·mL-1柚皮苷溶液和0.2 mL粗酶液混合均匀,置于50℃恒温水浴中反应30 min。取0.1 mL反应酶解液,加入5 mL一缩二乙二醇 (90%,v/v) 和0.1 mL的氢氧化钠溶液 (4 mol·L-1),在室温下静置10 min,于波长420 nm处测定溶液的吸光值。
柚苷酶活力单位定义:在pH 4.5、50℃的条件下,1 min水解1 μg的柚皮苷所需的酶量为1个酶活性单位 (U·mL-1)。
2.4.3 pH值的测定采用酸度计法。
3 结果与讨论 3.1 共培养菌株的筛选 3.1.1 柚苷酶生产菌的平板筛选将米曲霉FFCC 39,根霉FFCC 3201,黑曲霉FFCC Rapid,米曲霉FFCC 3102,黑曲霉FFCC 3111,黑曲霉FFCC 3112,黑曲霉FFCC uv-11,黑曲霉FFCC 48,黑曲霉FFCC 848的单孢子悬液以三点接种法分别接至平板筛选培养基中,30℃恒温培养3~4 d,观察菌落形态并进行显色反应,发现在各菌落周围均出现一定程度的透明圈,分别对各透明圈直径和菌落直径进行测量,结果如表 1所示。
| 表 1 菌落的HC值 Table 1 HC values of different colonies |
由表 1中计算得出各菌落的HC值可知,9株实验菌之间的HC值相差不大,最大值为1.30,最小值为1.06,因此需要进行发酵实验来判断菌株产酶的能力。
3.1.2 共培养菌种组合的确定菌种组合分为uv-11+3201,uv-11+39,uv-11+3102,3111+3201,3111+39,3111+3102,3112+3201,3112+39,3112+3102,848+3201,848+39,848+3102,48+3201,48+39,48+3102,将两种菌的种子液以10%的接种量 (接种比例1:1) 同时接种到发酵培养基中进行摇瓶发酵,30℃,180 r·min-1培养120 h。结果如表 2所示。
| 表 2 共培养菌种组合的确定 Table 2 Determination of co-culture strains |
由表 2可知,uv-11+3201为最佳共培养产柚苷酶的菌种组合,在发酵时间为120 h时,柚苷酶酶活可达到330.00 U·mL-1,是黑曲霉FFCC uv-11纯培养 ((270.80±2.02) U·mL-1) 的1.22倍,根霉FFCC 3201纯培养 ((78.63±0.35) U·mL-1) 的4.20倍。黑曲霉FFCC uv-11属于产柚苷酶能力较强的菌种,并且在与根霉FFCC 3201进行共培养发酵时,柚苷酶酶活有所提高。此外,由于不同菌种代谢产物的酸碱度不同[17~20],导致各菌种组合之间发酵终点pH存在较大的差异。
3.2 真菌共培养发酵产柚苷酶的工艺研究 3.2.1 发酵时间对柚苷酶活性的影将黑曲霉FFCC uv-11与根霉FFCC 3201进行共培养发酵生产柚苷酶,初始培养条件为:两菌同时接入,接种量10%,接种比例1:1,培养基的初始pH为6.0。在此基础上,测定发酵过程中柚苷酶酶活随培养时间的变化情况,结果如图 1所示。黑曲霉FFCC uv-11与根霉FFCC 3201共培养在发酵时间为72 h时,发酵液的pH值趋于稳定,柚苷酶活力达到最大值。在生物量方面,发酵时间为48 h时生物量达到最大,同时也是产酶的对数期。随着发酵时间的延长,柚苷酶活力和生物量都有一定程度的降低,可能由于液体发酵培养基中的营养物质被菌体利用所剩不多、菌体分泌的产物不利于菌体生长等因素造成[22]。因此,确定72 h为发酵终止时间。
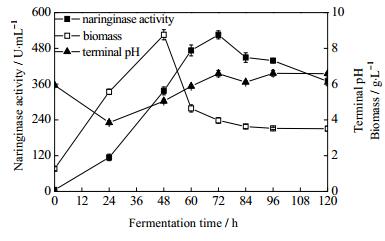
|
图 1 发酵时间对柚苷酶活性的影响 Fig.1 Effects of fermentation time on naringinase activity |
经实验分析发现,在共培养条件下黑曲霉FFCC uv-11是主要产柚苷酶的菌种,根霉FFCC 3201是作为辅助产生柚苷酶的菌种,因此在共培养过程中先接入黑曲霉FFCC uv-11,再接入根霉FFCC 3201,并进一步研究接种时间间隔对发酵产酶的影响。将黑曲霉FFCC uv-11与根霉FFCC 3201的接种时间间隔分别设为0、12、24、36、48和60 h进行共培养发酵实验,结果如图 2所示。
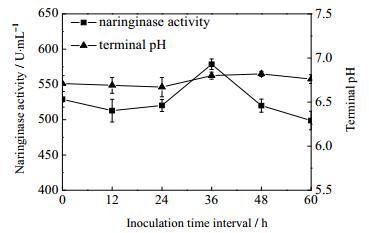
|
图 2 接种时间间隔对柚苷酶活性的影响 Fig.2 Effects of inoculation time interval on naringinase activity |
当黑曲霉FFCC uv-11和根霉FFCC 3201共培养发酵生产柚苷酶时,柚苷酶的酶活力随着接种时间间隔的增加呈现先增加后降低的趋势,并且在此过程中,发酵终点pH值变化不明显。当接种时间间隔为36 h时,柚苷酶活力达到最大值578.64 U·mL-1,此时两种菌之间的协同产酶效果最佳。Fang等[21]研究发现当里氏木霉和黑曲霉混合培养,接种时间间隔为48 h时,β-葡萄糖苷酶和滤纸酶酶活较高。表明在不同的接种时间间隔情况下,共培养体系中各菌株之间的协同代谢作用不同,进而影响目标产物的积累[10]。因此,接种时间间隔为36 h是共培养发酵生产柚苷酶的较适宜条件。
3.2.3 接种量及接种比例对柚苷酶酶活的影响发酵培养基的装液量为30 mL,菌种组合为uv-11+3201,共培养发酵总时间72 h,将黑曲霉FFCC uv-11与根霉FFCC 3201共培养发酵产酶过程的接种量及接种比例分别设定为5%、10%、15%和5:1、2:1、1:1、1:2,每组实验三个平行。结果如表 3所示。
| 表 3 接种量及接种比例对柚苷酶活性的影响 Table 3 Effects of inoculation volume and inoculation ratio on naringinase activity |
由表 3可知,在黑曲霉FFCC uv-11与根霉FFCC 3201共培养发酵过程中,接种量10%、接种比例为2:1时,柚苷酶酶活力达到最高。出现这一结果可能因为此条件较为适合菌体的生长和产酶,不会出现营养物质过少而抑制菌体生长[22]或营养物质太多不利于菌体生长[23]的情况。这与Niladevi和Prema的研究结果相类似,他们发现在较高接种量时会降低酶的产量,这可能是因为在发酵的过程中生成的某些有害产物会干扰酶的生成[24]。
3.2.4 发酵初始pH值对柚苷酶酶活的影响在上述实验条件的基础上,改变初始pH,以初始pH 4.5、5.0、5.5、6.0、6.5、7.0、7.5进行共培养发酵实验,每组实验三个平行,结果如图 3所示。
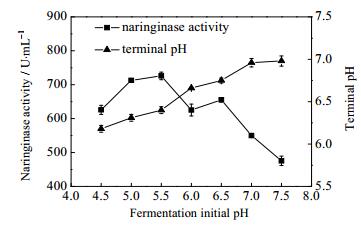
|
图 3 发酵初始pH值对柚苷酶活性的影响 Fig.3 Effects of initial pH of fermentation medium on naringinase activity |
随发酵初始pH值的不断增大,柚苷酶的活力先升高后下降,在pH为5.5时柚苷酶活力达到最高。发酵终点的pH随着培养基初始pH的增加而不断增大,当初始pH为7.0之后发酵终点的pH趋于稳定。Raza等[25]将黑曲霉和米曲霉共培养发酵生产β-葡萄糖苷酶,研究发现初始pH为5.5时酶活性最佳。Mendozacal等[26]研究结果显示发酵温度和pH能够显著影响柚苷酶的生产,得到曲霉菌产酶的最适pH为5.4~6.4。刘晓晶等[27]对雪腐镰刀菌6238产橙皮苷酶的特性及条件进行研究,结果表明培养基初始pH值为6.5时,发酵生产橙皮苷酶的酶活最高。产生这一现象的原因可能是在发酵过程中,微生物生长会消耗一定的碳源和氮源,同时也会生成一些酸性或碱性的产物,这都会造成pH值的改变,影响代谢途径、代谢速率和细胞结构,进而影响产酶[28]。
3.3 验证实验经过前述实验,得到真菌共培养发酵生产柚苷酶的最佳培养条件为:黑曲霉uv-11和根霉3201共培养发酵时间为72 h,接种时间间隔为36 h,接种量及接种比例分别为10%和2:1,发酵培养基的初始pH为5.5。在此基础上进行验证实验,结果如图 4所示。最佳培养条件下发酵终点的pH处于中性范围,同未优化条件相比差别不大。此时,柚苷酶发酵酶活为733.19 U·mL-1,是未优化条件下柚苷酶酶活330.00 U·mL-1的2.22倍。
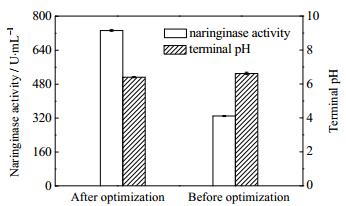
|
图 4 工艺优化前后柚苷酶酶活力及发酵终点pH的比较 Fig.4 Comparison on naringinase activity and terminal pH before and after optimization |
进一步将本工作得到的数据与文献报道相比较,发现优化后的共培养发酵产柚苷酶酶活接近或高于已有研究结果,如表 4所示。这为进一步获得高产柚苷酶发酵工艺,推动柚苷酶产业化发展提供了数据和实验技术支持。
| 表 4 不同研究中柚苷酶酶活力的比较 Table 4 Comparison on enzyme activity of naringinase from different research |
通过对真菌共培养发酵生产柚苷酶的工艺过程进行研究,得到以下结论:黑曲霉FFCC uv-11和根霉FFCC 3201组合共培养生产柚苷酶的能力较强,且发酵时间、接种时间间隔、接种量、接种比例及发酵初始pH都对共培养发酵产酶过程具有一定的影响。当发酵时间为72 h,接种时间间隔为36 h,接种量为10%,黑曲霉FFCC uv-11和根霉FFCC 3201的接种比例为2:1,发酵培养基的初始pH为5.5时,柚苷酶活力为733.19 U·mL-1,是未优化条件下柚苷酶酶活的2.22倍。与国内外同类研究相比,本研究采用共培养发酵策略生产柚苷酶,利用柚皮苷作为诱导物,获得了较适宜的发酵工艺条件,为降低生产成本、提高柚苷酶酶活提供了基础数据,对推动柚苷酶的开发与工业化进程具有重要意义。
| [1] | Puri M. Updates on naringinase:structural and biotechnological aspects[J]. Applied Microbiology and Biotechnology , 2012, 93(1): 49-60. DOI:10.1007/s00253-011-3679-3. |
| [2] | Puri M, Banerjee U C. Production, purification and characterization of the debittering enzyme naringinase[J]. Biotechnology Advances , 2000, 18(3): 207-217. DOI:10.1016/S0734-9750(00)00034-3. |
| [3] | Ribeiro M H. Naringinases:occurrence, characteristics, and applications[J]. Applied Microbiology and Biotechnology , 2011, 90(6): 1883-1895. DOI:10.1007/s00253-011-3176-8. |
| [4] | Puri M, Kaur A. Molecular identification of Staphylococcus xylosus MAK2, a new α-L-rhamnosidase producer[J]. World Journal of Microbiology & Biotechnology , 2010, 26(6): 963-968. |
| [5] | LI Li-jun(李利君), NI Hui(倪辉), XIAO An-feng(肖安风), et al. Characterization of Cryptococcus sp. Jmudeb008 and regulation of naringinase activity by glucose(一株产柚苷酶的罗伦隐球酵母的鉴定及柚苷酶表达)[J]. Acta Microbiologica Sinica(微生物学报) , 2010, 50(9): 1202-1207. |
| [6] | Vinothkunar V, Kayambu P, Revathibabu S. Optimization of fermentation parameters for enhanced production of naringinase by soil isolata Aspergillus niger VB07[J]. Food Science and Biotechnology , 2010, 19(3): 827-829. DOI:10.1007/s10068-010-0116-9. |
| [7] | Ni H, Xiao A F, Cai H N, et al. Purification and characterization of Aspergillus niger α-L-rhamnosidase for the biotransformation of naringin to pruning[J]. African Journal of Microbiology Research , 2012, 6(24): 5276-5284. |
| [8] | Shanmugam V, Yadav K D S. Extracellular production of alpha-rhamnosidase by Rhizopus nigricans[J]. Indian Journal of Experimental Biology , 1995, 33(9): 705-707. |
| [9] | LU Lang-bo(鲁浪波), SHAN Yang(单杨), XIA Jin-lan(夏金兰). Screening and identification of the strain for high-yield naringinase(高产柚苷酶菌株的筛选及鉴定)[J]. Journal of Chinese Institute of Food Science and Technology(中国食品学报) , 2015, 15(5): 206-212. |
| [10] | XU Deng-yang(徐德阳), WANG Li-li(王莉莉), DU Chun-mei(杜春梅). Progress in microbial co-culture-A review(微生物共培养技术的研究进展)[J]. Acta Microbiologica Sinica(微生物学报) , 2015, 55(9): 1089-1096. |
| [11] | Alam M Z, Fakhru'L-Razi A, Abd-Aziz S, et al. Optimization of compatible mixed cultures for liquid state bioconversion of municipal wastewater sludge[J]. Water Air and Soil Pollution , 2003, 149(1): 113-126. |
| [12] | Li Y Q, Liu H F, Tian Z L, et al. Diesel pollution biodegradation:synergetic effect of Mycobacterium and filamentous fungi[J]. Biomedical and Environmental Sciences , 2008, 21(3): 181-187. DOI:10.1016/S0895-3988(08)60026-4. |
| [13] | El-Deen A M N, Shata H M A H, Farid M A F. Improvement of β-glucosidase production by co-culture of Aspergillus niger and A. oryzae under solid state fermentation through feeding process[J]. Annals of Microbiology , 2014, 64(2): 627-637. DOI:10.1007/s13213-013-0696-8. |
| [14] | Hu H L, Brink J D, Gruben B S, et al. Improved enzyme production by co-cultivation of Aspergillus niger and Aspergillus oryzae and with other fungi[J]. International Biodeterioration & Biodegradation , 2011, 65(1): 248-252. |
| [15] | LIU Yi-wen(刘艺文), LIU Su-chun(刘素纯). Screening and preliminary identification of naringinase producing strain(产柚苷酶高产菌株的筛选)[J]. Food & Machinery(食品与机械) , 2013, 29(3): 55-57. |
| [16] | Davis D W. Determination of flavonones in citrus juice[J]. Analytical Chemistry , 1947, 19(7): 46-48. |
| [17] | Yuan Q P, Wang J D, Zhang H, et al. Effect of temperature shift on production of xylanase by Aspergillus niger[J]. Process Biochemistry , 2005, 40(10): 3255-3257. DOI:10.1016/j.procbio.2005.03.020. |
| [18] | ZHU Xiao-feng(朱晓峰), DUAN Yu-xi(段玉玺), LI Song(李颂). Determination of organic acids in fermentation broth of Aspergillus niger and effect on nematade(黑曲霉发酵液中有机酸的分析及对植物线虫的影响)[J]. Agrochemicals(农药) , 2009, 48(2): 137-139. |
| [19] | FU Wen(付雯), LI Dong-sheng(李冬生), HUANG Hong-xia(黄红霞), et al. Study on koji-making process of sweet flour paste with double strains(甜面酱双菌种制曲工艺条件的研究)[J]. China Condiment(中国调味品) , 2010, 35(10): 85-90. DOI:10.3969/j.issn.1000-9973.2010.10.017. |
| [20] | Biebl H, Marten S. Fermentation of glycerol to 1, 3-propanediol:use of cosubstrates[J]. Applied Microbiology and Biotechnology , 1995, 44(1-2): 15-19. DOI:10.1007/BF00164474. |
| [21] | Fang H, Zhao C, Song X Y, et al. Enhanced cellulolytic enzyme production by the synergism between Trichoderma reesei RUT-C30 and Aspergillus niger NL02 and by the addition of surfactants[J]. Biotechnology and Bioprocess Engineering , 2013, 18(2): 390-398. DOI:10.1007/s12257-012-0562-8. |
| [22] | LI Zhi-jian(李志坚), TAN Xing-he(谭兴和), LI Gao-yang(李高阳). Study on the optimum fermentation conditions of Aspergillus niger C-15 for the production of naringinase(Aspergillus niger C15产柚苷酶发酵条件的优化研究)[J]. Science and Technology of Food Industry(食品工业科技) , 2012, 33(22): 229-233. |
| [23] | ZHANG Jia-lin(张嘉林), TAN Xiao-fang(谈小芳), SUN Jun-she(孙君社), et al. Optimization of naringinase production by Aspergillus niger S-05 in liquid state fermentation(黑曲霉S-05产柚苷酶液态发酵培养条件的优化)[J]. China Brewing(中国酿造) , 2008, 27(15): 19-22. |
| [24] | Niladevi K N, Prema P. Effect of inducers and process parameters on laccase production by Streptomyces psammoticus and its applications in dye decolourization[J]. Bioresource Technology , 2008, 99(11): 4583-4589. DOI:10.1016/j.biortech.2007.06.056. |
| [25] | Raza F, Raza N A, Hameed U, et al. Solid state fermentation for the production of β-glucosidase by co-culture of Aspergillus niger and A.Oryzae[J]. Pakistan Journal of Botany , 2011, 43(1): 75-83. |
| [26] | Mendozacal A, Cuevasglory L, Lizamauc G, et al. Naringinase production from filamentous fungi using grapefruit rind in solid state fermentation[J]. African Journal of Microbiology Research , 2010, 4(19): 1964-1969. |
| [27] | LIU Xiao-jing(刘晓晶), SHEN Yu-bin(沈煜斌), YAO Shan-jing(姚善泾). Characterization of hesperidinase production using Snow rot Fusarium with process optimization(雪腐镰刀菌产橙皮苷酶的特性研究和条件优化)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(6): 1399-1406. |
| [28] | JIANG Shu-hai(蒋树海), SUN Jun-she(孙君社), LU Hua(卢华), et al. Optimum ferrmentation conditions of Aspergillus niger S-05 for the production of naringinase(Aspergillus niger S-05产柚苷酶液态发酵条件的优化)[J]. Food Research and Development(食品研究与开发) , 2009, 30(3): 13-17. |
| [29] | Bram B, Solomons G L. Production of the enzyme naringinase by Aspergillus niger[J]. Applied Microbiology , 1965, 13(6): 842-845. |
| [30] | LU Jian-ming(卢建明), ZHANG Chen(张晨), LIU Zhi-wei(刘志伟). Fringe screening of naringinase-producing fungus(产柚苷酶菌株的初步筛选)[J]. Guangdong Chemical Industry(广东化工) , 2005, 32(3): 15-16. |
| [31] | CHEN Ling(陈玲), TU Xiao-rong(涂晓嵘), TU Guo-quan(涂国全). Screening of chemical resistant mutant strains with high naringinase-producing capacity by means of NTC induction(NTC诱变筛选高产柚苷酶抗药性突变株)[J]. Acta Agriculturase Universitatis Jiangxiensis(江西农业大学学报) , 2007, 29(4): 670-674. |
| [32] | GUO Qian (郭倩). Studies on the screening and identification of strains with high naringinase and its enzyme producing characteristics (产柚苷酶高产菌株的筛选、鉴定及产酶特性研究) [D]. Yaan (雅安): Sichuan Agricultural University (四川农业大学), 2008. |
| [33] | WU Sheng-shan(吴升山), CAI Hui-nong(蔡慧农), SU Wen-jin(苏文金), et al. Optimization of culture medium for producing α-rhamnosidase and naringinase by Aspergillus Niger DB056(黑曲霉DB056发酵α-鼠李糖苷酶和柚苷酶培养基的优化研究)[J]. Journal of Chinese Institute of Food Science and Technology(中国食品学报) , 2010, 10(4): 193-201. |




