2. 河南省生物质能源重点实验室,河南 郑州 450008
2. Henan Key Lab of Biomass Energy, Zhengzhou 450008, China
生物质作为可再生的绿色资源和能源,具有巨大的开发潜能。木质纤维素资源含量丰富,可通过多途径转化为一系列能源、化学品、高附加值材料和食品等产品[1-3]。
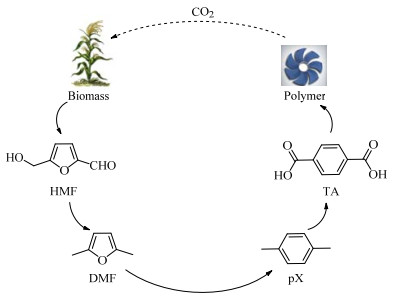
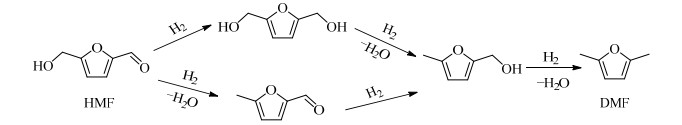
pX是重要的芳烃产品,主要用于生产对苯二甲酸及其聚酯[4]。我国已经成为世界上pX生产和消费第一大国。目前pX主要通过石油芳烃转化制得[5]。随着能源革命转型的深入,以生物质为原料制备pX的新路径已被关注[6-7]。图 1为生物质路线制备pX的过程示意图。5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)可由葡萄糖或果糖等生物质碳水化合物脱水制备得到,其呋喃环上的醛基和羟甲基在催化剂和氢源存在的情况下可经加氢和氢解反应制得具有广阔应用前景的生物质基液体燃料DMF(如图 2)[8-9]。近年来,由生物质基DMF合成pX的路径被提出[10]。含有共轭二烯结构的DMF可与一系列亲双烯体经Diels-Alder和脱水反应制备pX。
|
图 1 pX的生物质合成路线 Fig.1 Synthesis of pX via biomass route |
|
图 2 HMF加氢制备DMF Fig.2 Synthesis of DMF via hydrogenation of HMF |
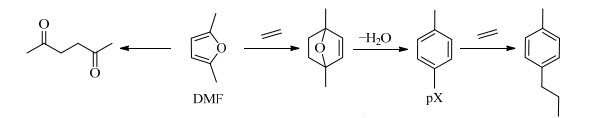
图 2为DMF与乙烯反应示意图,DMF作为双烯体,乙烯作为亲双烯体,两者首先发生Diels-Alder[4+2]成环反应生成氧杂降冰片烯,再通过脱水反应生成pX和水。主要的副反应包括DMF水解为2, 5-己二酮、pX与乙烯的烷基化反应以及DMF与2, 5-己二酮的聚合等。WILLIAMS等[11]的研究表明,DMF和乙烯在高温、低浓度的DMF、较高的乙烯压力以及适中的Brønsted酸浓度(约为2.0 mmol·L-1)等条件下的反应速率较快且产物选择性较好。NIKBIN等[12]认为,在DMF和乙烯合成pX的反应过程中,若是分子筛先吸附DMF,目的产物选择性将提高;反之,若是分子筛先吸附乙烯,则促使乙烯发生聚合反应,导致产物选择性明显降低。这些与XIONG等[13]所报道的相一致。如果底物DMF浓度不高,分子筛将优先吸附DMF,pX的选择性也较高。
近年来,国内外实验室陆续报道了生物质基DMF制备pX的研究,反应的溶剂体系不断丰富,各种用于催化该反应的催化剂也不断开发出来。本文对近年来DMF制备pX的研究进行综述,介绍研究过程中溶剂体系和催化体系的研究现状,并对今后pX的生物质合成的研究前景进行展望。
|
图 3 DMF和乙烯合成pX Fig.3 Production of pX from DMF and ethylene |
反应体系中的溶剂组成能够影响反应的催化活性、产物得率、影响产物稳定性以及产物分离的难易程度等。研究发现,混合溶剂中的有机助溶剂可能会在亲水性反应物的附近形成富含水的局部溶剂域,并增加反应物和域内水分子之间的氢键强度[14]。因此溶剂体系的选择对于催化反应非常重要。不少研究表明,Diels-Alder反应存在溶剂效应[15],这为利用溶剂效应提高pX选择性的研究提供了新的思路。例如,SALAVATI等[16]利用密度泛函理论(density functional theory,DFT)研究了酸催化DMF和顺丁烯二酸酐的Diels-Alder环加成以及脱水反应的溶剂效应。研究发现,若采用Lewis酸催化,溶剂可以大幅降低脱水反应的活化能,但仍需较高的温度;而采用Brønsted酸催化,脱水反应能够在室温下进行,且溶剂可以更大幅度地降低脱水反应活化能。总的来说,生物质基DMF制备pX的反应所采用的的溶剂大致可分为非极性溶剂、极性溶剂和离子液体溶剂三大类。
脂肪族非极性溶剂如庚烷可提供疏水环境以减少分子筛对水的吸附,从而抑制DMF的水解[13]。WILLIAMS等[17]研究了反应体系中加入庚烷对pX选择性的影响。在300℃下DMF和乙烯的反应体系中加入庚烷作为溶剂,pX的选择性可由51%提高至75.7%,且副产物2, 5-己二酮和低聚物的产量也大大降低。Wijaya等[18]认为极性溶剂比非极性溶剂更有助于DMF合成pX反应的进行,他们详细研究了不同溶剂对反应的影响,选取了庚烷、1, 4-二氧六环(极性非质子溶剂)、四氢呋喃(极性非质子溶剂)和异丙醇(极性质子溶剂)等为溶剂进行实验。结果表明,四氢呋喃和1, 4-二氧六环比庚烷和异丙醇更有利于提高DMF转化率和pX得率。这说明极性非质子溶剂有助于提升Diels-Alder反应效果和脱水的反应速率,其原因可能是极性溶剂能使Diels-Alder反应生成的环加成中间体更稳定,从而促进脱水反应的进行。
此外,离子液体具很强的极性、较高的热稳定性和化学稳定性,是性能优良的氢键供体,也可在Diels-Alder反应中用作溶剂[19]。离子液体一般由有机阳离子和无机或有机阴离子构成,常见的阳离子有季铵盐离子、季鏻盐离子、咪唑盐离子和吡咯盐离子等,阴离子有卤素离子、四氟硼酸根离子、六氟磷酸根离子等。AGGARWAL等[20]提出离子液体和亲双烯体之间的氢键作用有助于亲双烯体的活化,从而提高反应速率和产物选择性。同时,离子液体和活性组分之间的空间位阻对反应也有影响[21]。NI等[22]在DMF和丙烯酸合成pX的反应体系中加入离子液体作为溶剂,结果发现,pX的得率有了很大的提高,脱水反应速率也有所提升,脱水反应所产生的水可有效从反应体系中隔离,这表明离子液体也可以提供良好的疏水环境。另外,由于其特殊性能,离子液体加入反应体系中可使得反应在较为温和的条件下发生。酸性离子液体兼具酸催化活性位点与优良溶剂的特点,可同时作为催化剂和溶剂,在室温下便可更加简便、高效地从DMF制备pX[23]。不过,离子液体价格昂贵、分离回收困难也是制约着其大规模利用的重要原因。
3 非均相催化以乙烯气体作为亲双烯体和含有共轭二烯结构的DMF为原料合成pX,可认为是非均相催化体系。其中,非均相催化剂多不溶于反应体系,易于分离,催化活性高,是DMF制备pX反应中最常用的催化剂。其种类也较为丰富,主要有分子筛催化剂、负载型氧化物催化剂、杂多酸催化剂、三氟甲磺酸金属盐催化剂和卤代乙酸催化剂等等。
3.1 分子筛催化剂DMF制备pX的研究所采用的催化剂较为多样,最常见的便是H型分子筛催化剂。H型分子筛具有良好性能,已广泛应用于催化DMF合成pX (如表 1)。WILLIAMS等[17]报道了以H-Y分子筛为催化剂、庚烷为溶剂,DMF和乙烯在300℃下反应pX的选择性可达~75%。CHANG等[24]采用H-BEA为催化剂,DMF和乙烯在250℃下反应24 h,DMF转化率为99%,pX得率为90%。H-BEA优良的催化活性可能是由于该催化剂不易失活,能够催化脱水反应但不易催化副反应。鉴于分子筛可催化脱水反应的特点,TEIXEIRA等[25]提出利用H-USY催化乙醇原位脱水提供乙烯,与DMF反应合成pX的新思路,避免了高压乙烯的使用。在300℃下反应12 h后pX得率可达~60%。DFT理论研究表明,利用乙醇代替乙烯可提高反应速率和产物选择性,当乙醇与DMF的摩尔比为1:1时DMF转化率最高,过量的乙醇会导致大量副反应的产生,主要副反应为DMF的水解。此反应的关键步骤为乙醇吸附到催化剂的活性位点进行脱水反应。此法较采用乙烯而言会产生更多的水,需要克服的是DMF的水解。
|
|
表 1 催化DMF制备pX的H型分子筛 Table 1 H-type molecular sieves used in pX synthesis from DMF |
分子筛不同的结构骨架上还可引入杂原子进行改性以改变酸性强度[26]。YU等[27]以Zr-Beta、Sn-Beta和H-Beta催化DMF和乙烯合成pX,通过对比三种催化剂的吸附和反应性能发现,尽管H-BEA分子筛活性高,但其容易结焦失活且可促进DMF与其水解产物2, 5-己二酮的聚合反应,稳定性不如Sn-Beta和Zr-Beta。Sn-Beta和Zr-Beta具有相似的催化活性[28]。PACHECO等[29-30]报道了Sn-Beta和Zr-Beta作为Lewis酸可高效催化5-(甲氧基甲基)糠酸甲酯和乙烯生成4-甲氧基甲基苯甲酸甲酯的反应。PATET等[31]通过电子结构计算进行活性位点预测,从理论上研究了改性Zn-Beta分子筛对于串联Diels-Alder和脱水反应的催化性能,并用Zn-Beta催化5-(甲氧基甲基)糠酸甲酯、呋喃二甲酸二甲酯分别与乙烯反应。结果表明,与呋喃二甲酸二甲酯相比,5-(甲氧基甲基)糠酸甲酯的转化率更高,其原因是呋喃二甲酸二甲酯结构中的两个强吸电子基团使得Diels-Alder反应后的加成中间产物更稳定而不易进一步脱水生成目标产物。此外,Brønsted酸可促进DMF的水解反应[32]为改变Beta分子筛Brønsted酸强度和抑制副反应,PATET等[33]还研究了Al-Beta、Fe-Beta、Ga-Beta和B-Beta分子筛的催化效果。通过电子结构计算和动力学建模发现,虽然B-Beta的Brønsted酸强度最低而Al-Beta的Brønsted酸强度最高,但两者对于2-甲基呋喃、DMF和乙烯的催化效果却很相似,这说明Brønsted酸强度的变化并不影响催化剂的活性。CHO等[34]报道了磷改性的Beta、硅藻土、多孔级MFI等分子筛对DMF和乙烯制备pX良好的催化效果,以P-Beta催化DMF和乙烯在250℃反应24 h,DMF转化率可高达99%,pX得率可高达97%,P-Beta催化剂可以选择性地催化脱水反应而不催化聚合反应和pX的烷基化反应,是DMF高效转化为pX的重要原因。ROHLING等[35]通过离子交换制备了一系列碱金属原子(Li,K,Rb,Cs)改性的低硅铝比Y型分子筛,通过DFT计算和实验研究发现,KY分子筛催化效果最好,以其为催化剂,DMF和乙烯的反应速率比PATET等[36]报道的HY催化剂更大。KY分子筛可有效抑制DMF的水解反应,可能是由于碱离子交换后分子筛的Brønsted酸强度有所减小。
总的来说,分子筛催化活性好,选择性高,以分子筛为催化剂催化DMF制备pX已经取得了许多成果。但由于许多分子筛具有微孔道结构,也存在分子扩散缓慢、传质效果较差、整体反应速率偏低的缺点,且反应过程中催化剂活性位点容易被副产物占据,导致积碳失活[37-39]。目前分子筛主要是作为Lewis酸和Brønsted酸实现DMF合成pX的催化,这两种酸可分别催化Diels-Alder反应和脱水反应[40],因此需要加大力度研究分子筛掺杂金属改性以调变孔道内的活性位点以及酸性强度从而提高反应速率和产物得率。同时,开发出一类同时具有Lewis酸和Brønsted酸的双功能催化剂也值得深入研究。
3.2 负载型氧化物催化剂FENG等[41]首先报道了负载型催化剂SiO2-SO3H可以高选择性地催化DMF和乙烯合成pX,在250℃下反应6 h,pX的选择性可达89%,碳平衡率为95%。SO3H基作为Brønsted酸,其酸性位点分布于SiO2外表面,使得反应物可直接吸附在活性位点上,从而能够加快传质速率。同时,SiO2-SO3H具有介孔结构,可减轻积炭影响,有助于提高碳平衡率。这些与KIM等[42]报道的介孔MFI型分子筛高效催化DMF合成pX的实验结果相一致。此外,SiO2-SO3H催化剂比KIM等[43]采用的H-Beta分子筛更能有效抑制DMF水解产物2, 5-己二酮以及2, 5-己二酮的进一步聚合,因此可以高选择性地合成pX。SiO2-SO3H催化剂还具有良好的再生性能,经过两次再生后使用,DMF转化率由67.9%下降至50.5%,而pX的选择性由88.3%仅下降至83.5%,催化活性的降低可能是由于孔道积炭和SO3H基团的浸出。
FENG等[44]采用水热合成法制得负载型WO3/SBA-15催化剂,WO3可高度分散于SBA-15介孔通道内。WO3/SBA-15催化剂的酸性位点主要为Lewis酸,且Lewis酸和Brønsted酸的比率可通过调节焙烧温度在7.4到13.4之间改变。研究者制备了不同含量的WO3的催化剂,比较后选取催化效果最佳的wB = 20%的WO3/SBA-15用于DMF和乙烯的反应。在250℃下反应6 h后,DMF转化率为64.4%,碳平衡率为90.1%,pX选择性可达88.0%。这比WANG等[45]报道的WOx-ZrO2催化剂的催化选择性更高,是因为WO3/SBA-15的Lewis酸性位点多且酸强度适中,而WOx-ZrO2的强酸位点可能使DMF的水解反应更易发生。同时,使用过的WO3/SBA-15在550℃下焙烧6 h再生后催化效果仍然很好,4次再生后,SBA-15的结构依然存在,用于催化DMF和乙烯反应,pX的选择性几乎没有变化,DMF转化率仅下降了3%。
随后,采用氢氟酸制备的多孔级NbOx催化剂也被报道[46]。这种催化剂兼有Lewis酸和Brønsted酸,孔道主要为介孔和大孔,介孔孔径为3~48 nm,其活性组分主要为Nb2O5和NbOPO4,催化活性高、稳定性好,可高效催化DMF制备pX。DMF和乙烯在250℃下反应6 h,DMF转化率可达87.2%,pX选择性可达92.7%,碳平衡率为94.6%。由于Lewis酸可催化Diels-Alder反应,而Lewis酸和Brønsted酸均可催化后续的脱水反应且Brønsted酸的催化效果比Lewis酸更好,因此研究者还分析了Brønsted酸与Lewis酸的摩尔比(B/L)对反应的影响。实验结果表明,随着B/L的增大,DMF转化率和pX选择性逐渐增大,碳平衡率逐渐减少,副产物2, 5-己二酮等的量有所增加。NbOx催化剂还有良好的抗积炭能力,使用过的催化剂经550℃焙烧再生后催化活性依然很高,4次再生后,用于催化DMF和乙烯反应,pX的选择性没有变化,DMF转化率也仅下降了3.7%。
总的来说,这些负载型氧化物催化剂制备较为简单,催化效果较好,可为新型催化剂的开发提供新的思路。
3.3 杂多酸催化剂杂多酸稳定性好,可催化多种反应,包括均相及非均相反应,对环境无污染,是一类大有前途的新型催化剂[47]。有的杂多酸(如磷钨酸,硅钨酸等)具有特殊的Keggin结构,阴、阳离子的离散分布使得结构更加稳定,质子和金属原子的存在使其可同时作为Brønsted酸和Lewis酸,且在结构内部和外表面均有活性位点的分布[48]。杂多酸用于催化Diels-Alder反应的报道[49],为DMF制备pX的新型催化剂的开发提供了新思路。
WIJAYA等[50]提出采用磷钨酸(HPW)和硅钨酸(HSiW)为催化剂催化DMF和乙烯生产pX。通过初湿含浸法分别将磷钨酸和硅钨酸负载于SiO2、Al2O3、TiO2和ZrO2。利用XRD、BET、Raman和31P MAS-NMR表征后发现,除HPW/ZrO2以外的所有催化剂都保留了Keggin结构,TPD表征表明所有催化剂都具有Brønsted酸位点,且HPA/SiO2的酸度最强。DMF和乙烯在250℃下反应的实验结果表明,由于具有较多的强Brønsted酸位点,HPW/SiO2与HSiW/SiO2的催化活性最佳,250℃下反应6 h后,以HPW/SiO2和HSiW/SiO2为催化剂,DMF转化率可分别达94%和91%,pX得率可分别达85%和82%。研究者还测试了HSiW/SiO2催化剂的再生性能,结果表明,尽管在300℃下焙烧再生催化剂不能完全消除催化剂结焦,但焙烧温度应低于此温度以维持较高的催化活性,因为当温度超过300℃时,HSiW/SiO2的一部分Keggin结构会被破坏而导致催化活性的降低。此外,杂多酸催化乙醇脱水生产乙烯的研究报道[51-52]也进一步证明了利用乙醇代替乙烯作为原料与DMF制备pX的可行性。因此,利用杂多酸直接催化乙醇和DMF合成pX有待研究。由于大部分杂多酸可溶于极性溶剂,这给后续的产物分离带来困难,或许可以考虑将杂多酸负载于高比表面积材料以解决该问题[53]。同时有研究表明,杂多酸可通过引入过渡金属进行改性以增强其Lewis酸强度,进而提高Diels-Alder反应速率[54]。但目前杂多酸的改性研究还不多,需要进一步加大力度进行深入研究。
3.4 三氟甲磺酸金属盐催化剂三氟甲磺酸金属盐作为一类多功能的Lewis酸催化剂,具有极强的化学稳定性,因其在反应条件温和的情况下活性高、选择性好、可循环使用等特点而备受关注,可用于催化多种化学反应,包括DMF和亲双烯体的Diels-Alder和脱水反应[55-56]。
SONG等[57]采用三氟甲磺酸金属盐为催化剂、1, 4-二氧六环为溶剂,研究了不同金属盐对DMF和乙烯反应生成pX的影响。由于三氟甲磺酸金属盐溶于二氧六环,因此反应体系可认为准均相体系。通过实验比较了三氟甲磺酸钪、三氟甲磺酸镱、三氟甲磺酸钐、三氟甲磺酸铈和三氟甲磺酸镧所对应的金属元素钪、镱、钐、铈、镧的离子半径与pX生成速率关系,发现金属元素的离子半径越小,其对应的三氟甲磺酸金属盐的Lewis酸强度越大,对于DMF和乙烯反应效果越好。进一步选取三氟甲磺酸钪、三氟甲磺酸镱、三氟甲磺酸镧为催化剂,考察其对于pX的得率与选择性的影响。结果表明Sc(OTf)3的催化活性最佳,200℃下反应24 h,pX得率与DMF转化率可分别达到53.7%和76.6%。
3.5 卤代乙酸催化剂卤代乙酸作为一种Brønsted酸,也可用于生物质化学转化[58]。具有强吸电子能力的卤原子在乙酸的α碳上取代氢原子,使得卤代乙酸的酸性较乙酸有所增强。卤原子的吸电子能力越强,其对应的卤代乙酸酸性越大。脱水反应是典型的酸催化反应,酸性越大的催化剂越有利于脱水反应的进行。但酸性过大会导致DMF的大量水解从而减少产物得率。SONG等[57]通过实验比较了CF3COOH (pKa = 0.23)、CF2ClCOOH (pKa = 0.40)、CCl3COOH (pKa = 0.66)、CHCl2COOH (pKa = 1.30)和CH3COOH (pKa = 4.76)对DMF和乙烯反应的催化效果。结果发现,CF3COOH酸性最大而反应活性却最低,而酸性适中的CF2ClCOOH为最优催化剂,这说明卤代乙酸的酸性过大或过小对于反应的催化活性都较差。以1, 4-二氧六环为溶剂,利用CF2ClCOOH催化DMF和乙烯反应,200℃下反应24 h,DMF转化率可达72.1%,pX得率可达49.9%。反应过程中,pX的得率随反应时间线性增加,而pX的选择性却几乎不随反应时间变化,这与以三氟甲磺酸金属盐为催化剂的反应历程有所不同,说明以卤代乙酸为催化剂时,大部分的副反应与Diels-Alder反应同时进行。采用卤代乙酸催化DMF制备pX,产物与催化剂需要分离,且得率不高,有待进一步研究改进。
4 均相催化均相催化反应是催化剂与反应物同处于一均匀物相中的催化作用。目前在均相体系内由DMF制备pX的研究中,主要是利用丙烯醛和丙烯酸代替乙烯作为亲双烯体与DMF反应,所采用的均相催化剂仅报道了三氟甲磺酸金属盐催化剂和离子液体催化剂。采用均相催化需要考虑催化剂在反应体系中的稳定性,且后续的催化剂分离也比非均相催化困难,因此目前均相催化方面还需进一步研究。
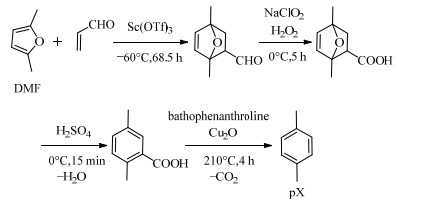
4.1 三氟甲磺酸金属盐催化剂SHIRAMIZU等[59]以DMF和丙烯醛为反应物,经过Diels-Alder、氧化、脱水和脱羧四步反应可得到得率为34%的pX (如图 4)。反应第一步在-60℃下采用三氟甲磺酸钪(Sc(OTf)3)催化DMF和丙烯醛反应68.5 h后,产物得率为84%。而第二步则在0℃下反应5 h,氧化产物得率为77%,第三步脱水反应产物得率仅为48%,最后的脱羧反应条件也相对苛刻。此法第一步需要在较低的温度下进行,最后的脱羧反应却需要高温,这不利于工业化生产;pX的得率较低,采用丙烯醛代替乙烯的反应路径值得深入研究催化剂、反应条件和反应体系等。
|
图 4 DMF和丙烯醛合成pX Fig.4 Synthesis of pX from DMF and acrolein |
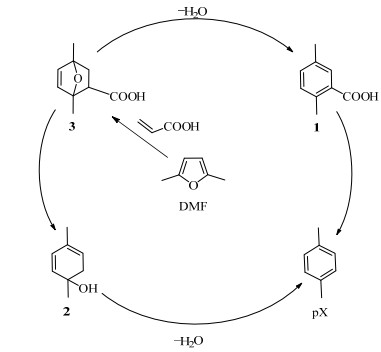
NI等[22]报道了通过一锅两步法在1-乙基-3-甲基咪唑双三氟甲基磺酰亚胺盐([Emim]NTf2)中利用Sc(OTf)3和H3PO4催化DMF和丙烯酸合成pX,DMF转化率和pX得率可分别达到90%和63%。图 5为反应流程:第一步为DMF和丙烯酸在15℃下发生Diels-Alder反应生成中间产物3,3可脱水产生2, 5-二甲基苯甲酸(1)。实验结果表明,3可转化为2,进一步脱水产生pX。第二步则为产物1的脱羧反应,在210℃下采用Cu2O等催化脱羧4 h,进一步提高pX的得率。Diels-Alder反应为热力学控制且反应物浓度对反应有较大影响[59-60],因此研究了丙烯酸与DMF的摩尔比(AA/DMF)对反应的影响。结果表明,在AA/DMF < 6.9时,pX得率随AA/DMF增大而提高,说明较大的AA/DMF有利于反应的进行,而1和3的得率却几乎不随AA/DMF的变化而变化,说明3同时为pX和1的中间产物(如图 5)。研究者还对比了CuCl2、CuBr2和三氟甲磺酸金属盐对于反应的催化效果。相同条件下,CuCl2和CuBr2催化活性较低,可能是由于酸性较弱,难以活化亲二烯体。因此,Lewis酸强度最大的Sc(OTf)3为最佳催化剂。离子液体的阴离子对反应的影响较大,通过实验比较发现,[Emim]NTf2为最佳溶剂。含[NTf2]-阴离子的离子液体具有疏水性且不溶于反应物,极少的量便可极大地提升反应速率,在室温下可提高反应选择性。因此这类离子液体作为溶剂用于Diels-Alder反应,可使脱水反应产生的水与反应体系隔离。实验结果表明,反应体系中加入[Emim]NTf2后,pX的得率有所提高,而产物1的得率却几乎不变,这说明离子液体的加入使得中间产物3更倾向于转化为pX。为进一步提高产物得率和反应选择性,研究者还采用H3PO4为共催化剂以提高脱水效率和产物得率,pX和1的总得率可由59%提高至65%,而反应选择性可由68%提高至92%。总的来说,此法条件温和,操作简单,避免了采用高压乙烯。但是第二步的脱羧反应依然采用高温条件,还需进一步的优化。
|
图 5 DMF和丙烯酸合成pX Fig.5 Synthesis of pX from DMF and acrylic acid |
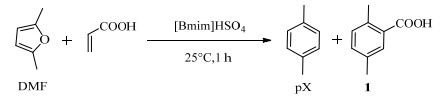
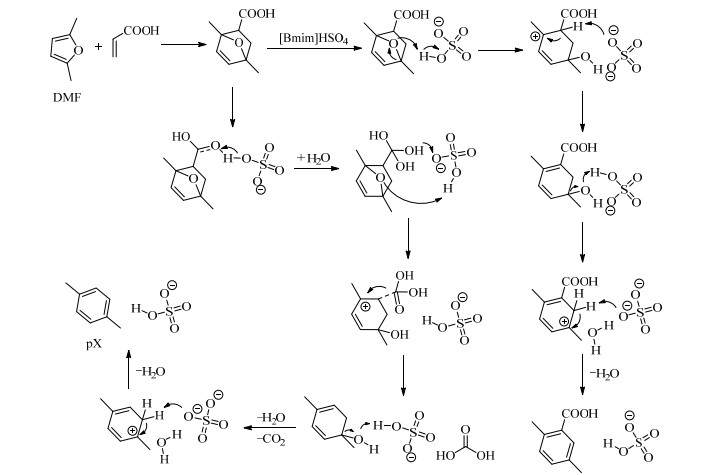
离子液体在Diels-Alder反应中除可用作溶剂外,其本身也可催化该反应[61]。在DMF和丙烯酸合成pX的反应中,由于Sc(OTf)3催化体系存在着副反应较多、产物选择性不够高等缺点,因此Ni等通过研究对此反应进行了进一步的改进[23]。第一步中(如图 6),利用酸性离子液体1-丁基-3-甲基咪唑硫酸氢盐([Bmim]HSO4)一步法催化DMF和丙烯酸发生Diels-Alder反应,25℃下反应1 h,DMF转化率为87%,pX和产物1的总得率可达78%。此外,通过动力学模拟和理论计算,研究者还提出了[Bmim]HSO4可能的催化机理(如图 7)。可以发现,[Bmim]HSO4作为Brønsted酸在脱水反应中起到主要的催化作用,在反应过程中发挥了催化剂和溶剂的双重作用。此法条件温和,操作简单,优势明显,反应在室温下进行,一步制得pX和产物1,芳香族产物选择性高达89%。
|
图 6 [Bmim]HSO4催化DMF和丙烯酸合成pX Fig.6 Synthesis of pX from DMF and acrylic acid catalyzed by [Bmim]HSO4 |
|
图 7 [Bmim]HSO4可能的催化机理 Fig.7 Possible catalytic mechanism of [Bmim]HSO4 |
随着生物质能源利用技术的发展以及pX需求量的增加,生物基DMF制备pX的研究已起步并逐步深入,也取得了不少突破。然而,目前DMF制备pX仍存在着不少亟待解决的问题,如反应条件相对苛刻、副反应尤其是DMF的水解反应难以抑制、产物得率和选择性还有待提升等。整体上说目前生物质经DMF制备pX路线的研发还需进一步完善,制约该方法的最大难点是高效廉价的催化体系的开发。相比于其他反应,该反应条件较为苛刻,所以催化剂的催化活性对产物的选择性十分重要。需要筛选具有合适结构、合适酸性的催化剂以提升催化性能。同时,从经济角度考虑,DMF价格昂贵,以其为原料大规模生产pX,不具备良好的经济效益。而利用DMF的上游原料HMF甚至是葡萄糖或纤维素制备pX的研究也还处于起步阶段。为了更加高效经济地从DMF制备pX,提高产物选择性和得率,建议在今后的研究中重点关注以下两点:
(1) 加大力度优化催化反应体系,包括催化体系和溶剂体系的改进。研究开发高效廉价的催化剂,包括分子筛的改性和其他催化剂的开发,寻找合适的助催化剂和载体以提升催化效果,在此基础上进一步探索催化剂作用机制与失活机制;寻找新型、合适的溶剂以加快反应速率和抑制副反应,深入探究催化反应中的溶剂效应。
(2) 扩大反应原料的选择范围,包括双烯体和亲双烯体的原料拓展。可以考虑采用乙醇、丙烯酸、顺丁烯二酸酐等代替高压乙烯作为亲双烯体;同时,双烯体还可以考虑选择HMF及其衍生物或是以上游物质葡萄糖、纤维素为原料制备得到的含共轭二烯结构的其他呋喃类化合物。
| [1] |
ESPOSITO D, ANTONIETTI M. Redefining biorefinery:the search for unconventional building blocks for materials[J]. Chemical Society Reviews, 2015, 44(16): 5821-5835. DOI:10.1039/C4CS00368C |
| [2] |
CHEN L, XIN J Y, NI L L, et al. Conversion of lignin model compounds under mild conditions in pseudo-homogeneous systems[J]. Green Chemistry, 2016, 18(8): 2341-2352. DOI:10.1039/C5GC03121D |
| [3] |
VLACHOS D G, CHEN J G, GORTE R J, et al. Catalysis center for energy innovation for biomass processing:research strategies and goals[J]. Catalysis Letters, 2010, 140(3-4): 77-84. DOI:10.1007/s10562-010-0455-4 |
| [4] |
TOMAS R A, BORDADO J C, GOMES J F. p-Xylene oxidation to terephthalic acid:a literature review oriented toward process optimization and development[J]. Chemical Reviews, 2013, 113(10): 7421-7469. DOI:10.1021/cr300298j |
| [5] |
FONG Y Y, ABDULLAH A Z, AHMAD A L, et al. Development of functionalized zeolite membrane and its potential role as reactor combined separator for para-xylene production from xylene isomers[J]. Chemical Engineering Journal, 2008, 139(1): 172-193. DOI:10.1016/j.cej.2007.10.019 |
| [6] |
MANEFFA A, PRIECEL P, LOPEZ-SANCHEZ J A. Biomass-derived renewable aromatics:selective routes and outlook for p-xylene commercialisation[J]. ChemSusChem, 2016, 9(19): 2736-2748. DOI:10.1002/cssc.201600605 |
| [7] |
刘俊霞, 陈景润, 王军峰, 等. 生物质基呋喃制备对二甲苯研究进展[J]. 工业催化, 2017, 25(4): 13-16. LIU J X, CHEN J R, WANG J F, et al. Research progress in the preparation of p-xylene from biomass-based furan[J]. Industrial Catalysis, 2017, 25(4): 13-16. |
| [8] |
ZHAO P P, ZHANG Y Y, WANG Y, et al. Conversion of glucose into 5-hydroxymethylfurfural catalyzed by acid-base bifunctional heteropolyacid-based ionic hybrids[J]. Green Chemistry, 2018, 20(7): 1551-1559. DOI:10.1039/C7GC03821F |
| [9] |
刘迎新, 曾茂, 楼炯涛, 等. 5-羟甲基糠醛选择性加氢制备2, 5-二甲基呋喃研究进展[J]. 高校化学工程学报, 2018, 32(2): 255-265. LIU Y X, ZENG M, LOU J T, et al. Review on 2, 5-dimethylfuran synthesis via selective hydrogenation of 5-hydroxymethylfufural[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(2): 255-265. DOI:10.3969/j.issn.1003-9015.2018.02.002 |
| [10] |
BRANDVOLD T A. Carbohydrate route to para-xylene and terephthalic acid: US, 8314267 B2[P]. 2012-11-20.
|
| [11] |
WILLIAMS C L, VINTER K P, CHANG C C, et al. Kinetic regimes in the tandem reactions of H-BEA catalyzed formation of p-xylene from dimethylfuran[J]. Catalysis Science & Technology, 2016, 6(1): 178-187. |
| [12] |
NIKBIN N, FENG S, CARATZOULAS S, et al. p-Xylene formation by dehydrative aromatization of a Diels-Alder product in Lewis and brønsted acidic zeolites[J]. The Journal of Physical Chemistry C, 2014, 118(42): 24415-24424. DOI:10.1021/jp506027f |
| [13] |
XIONG R C, SANDLER S I, VLACHOS D G, et al. Solvent-tuned hydrophobicity for faujasite-catalyzed cycloaddition of biomass-derived dimethylfuran for renewable p-xylene[J]. Green Chemistry, 2014, 16(9): 4086-4091. DOI:10.1039/C4GC00727A |
| [14] |
WALKER T W, CHEW A K, LI H X, et al. Universal kinetic solvent effects in acid-catalyzed reactions of biomass-derived oxygenates[J]. Energy & Environmental Science, 2018, 11(3): 617-628. |
| [15] |
MELLMER M A, SENER C, GALLO J M R, et al. Solvent effects in acid-catalyzed biomass conversion reactions[J]. Angewandte Chemie, 2014, 53(44): 11872-11875. DOI:10.1002/anie.201408359 |
| [16] |
SALAVATI-FARD T, CARATZOULAS S, DOREN D J. Solvent effects in acid-catalyzed dehydration of the Diels-Alder cycloadduct between 2, 5-dimethylfuran and maleic anhydride[J]. Chemical Physics, 2017, 485-486: 118-124. DOI:10.1016/j.chemphys.2017.01.010 |
| [17] |
WILLIAMS C L, CHANG C C, DO P, et al. Cycloaddition of biomass-derived furans for catalytic production of renewable p-xylene[J]. ACS Catalysis, 2012, 2(6): 935-939. DOI:10.1021/cs300011a |
| [18] |
WIJAYA Y P, SUH D J, JAE J. Production of renewable p-xylene from 2, 5-dimethylfuran via Diels-Alder cycloaddition and dehydrative aromatization reactions over silica-alumina aerogel catalysts[J]. Catalysis Communications, 2015, 70: 12-16. DOI:10.1016/j.catcom.2015.07.008 |
| [19] |
CHIAPPE C, MALVALDI M, POMELLI C S. The solvent effect on the Diels-Alder reaction in ionic liquids:multiparameter linear solvation energy relationships and theoretical analysis[J]. Green Chemistry, 2010, 12(8): 1330-1339. DOI:10.1039/c0gc00074d |
| [20] |
AGGARWAL A, LANCASTER N L, SETHI A R, et al. The role of hydrogen bonding in controlling the selectivity of Diels-Alder reactions in room-temperature ionic liquids[J]. Green Chemistry, 2002, 4(5): 517-520. DOI:10.1039/B206472C |
| [21] |
VIDIŠ A, OHLIN C A, LAURENCZY G, et al. Rationalisation of solvent effects in the Diels-Alder reaction between cyclopentadiene and methyl acrylate in room temperature ionic liquids[J]. Advanced Synthesis & Catalysis, 2005, 347(2-3): 266-274. |
| [22] |
NI L L, XIN J Y, DONG H X, et al. A simple and mild approach for the synthesis of p-xylene from bio-based 2, 5-dimethyfuran by using metal triflates[J]. ChemSusChem, 2017, 10(11): 2394-2401. DOI:10.1002/cssc.201700020 |
| [23] |
NI L L, XIN J Y, JIANG K, et al. One-step conversion of biomass-derived furanics into aromatics by brønsted acid ionic liquids at room temperature[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(2): 2541-2551. |
| [24] |
CHANG C C, GREEN S K, WILLIAMS C L, et al. Ultra-selective cycloaddition of dimethylfuran for renewable p-xylene with H-BEA[J]. Green Chemistry, 2014, 16(2): 585-588. DOI:10.1039/C3GC40740C |
| [25] |
TEIXEIRA I F, LO B T W, KOSTETSKYY P, et al. From biomass-derived furans to aromatics with ethanol over zeolite[J]. Angewandte Chemie, 2016, 55(42): 13061-13066. DOI:10.1002/anie.201604108 |
| [26] |
WECKHUYSEN B M, YU J H. Recent advances in zeolite chemistry and catalysis[J]. Chemical Society Reviews, 2015, 44(20): 7022-7024. DOI:10.1039/C5CS90100F |
| [27] |
YU J Y, ZHU S Y, DAUENHAUER P J, et al. Adsorption and reaction properties of SnBEA, ZrBEA and H-BEA for the formation of p-xylene from DMF and ethylene[J]. Catalysis Science & Technology, 2016, 6(14): 5729-5736. |
| [28] |
PATET R E, FAN W, VLACHOS D G, et al. Tandem Diels-Alder reaction of dimethylfuran and ethylene and dehydration to para-xylene catalyzed by zeotypic Lewis acids[J]. ChemCatChem, 2017, 9(13): 2523-2535. DOI:10.1002/cctc.201601584 |
| [29] |
PACHECO J J, DAVIS M E. Synthesis of terephthalic acid via Diels-Alder reactions with ethylene and oxidized variants of 5-hydroxy-methylfurfural[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(23): 8363-8367. DOI:10.1073/pnas.1408345111 |
| [30] |
PACHECO J J, LABINGER J A, SESSIONS A L, et al. Route to renewable PET:reaction pathways and energetics of Diels-Alder and dehydrative aromatization reactions between ethylene and biomass-derived furans catalyzed by Lewis acid molecular sieves[J]. ACS Catalysis, 2015, 5(10): 5904-5913. DOI:10.1021/acscatal.5b01309 |
| [31] |
PATET R E, CARATZOULAS S, VLACHOS D G. Tandem aromatization of oxygenated furans by framework zinc in zeolites:a computational study[J]. The Journal of Physical Chemistry C, 2017, 121(40): 22178-22186. DOI:10.1021/acs.jpcc.7b07402 |
| [32] |
NIKBIN N, CARATZOULAS S, VLACHOS D G. On the Bronsted acid-catalyzed homogeneous hydrolysis of furans[J]. ChemSusChem, 2013, 6(11): 2066-2068. DOI:10.1002/cssc.v6.11 |
| [33] |
PATET R E, KOEHLE M, LOBO R F, et al. General acid-type catalysis in the dehydrative aromatization of furans to aromatics in H-[J]. The Journal of Physical Chemistry C, 2017, 121(25): 13666-13679. DOI:10.1021/acs.jpcc.7b02344 |
| [34] |
CHO H J, REN L M, VATTIPALLI V, et al. Renewable p-xylene from 2, 5-dimethylfuran and ethylene using phosphorus-containing zeolite catalysts[J]. ChemCatChem, 2017, 9(3): 398-402. DOI:10.1002/cctc.v9.3 |
| [35] |
ROHLING R Y, USLAMIN E, ZIJLSTRA B, et al. An active alkali-exchanged faujasite catalyst for para-xylene production via the one-pot Diels-Alder cycloaddition/dehydration reaction of 2, 5-dimethylfuran with ethylene[J]. ACS Catalysis, 2018, 8(2): 760-769. DOI:10.1021/acscatal.7b03343 |
| [36] |
PATET R E, NIKBIN N, WILLIAMS C L, et al. Kinetic regime change in the tandem dehydrative aromatization of furan Diels-Alder products[J]. ACS Catalysis, 2015, 5(4): 2367-2375. DOI:10.1021/cs5020783 |
| [37] |
ENNAERT T, AELST J V, DIJKMANS J, et al. Potential and challenges of zeolite chemistry in the catalytic conversion of biomass[J]. Chemical Society Reviews, 2016, 45(3): 584-611. DOI:10.1039/C5CS00859J |
| [38] |
LUO H Y, LEWIS J D, ROMAN-LESHKOV Y. Lewis acid zeolites for biomass conversion:perspectives and challenges on reactivity, synthesis, and stability[J]. Annual Review of Chemical and Biomolecular Engineering, 2016, 7: 663-692. DOI:10.1146/annurev-chembioeng-080615-034551 |
| [39] |
MOLINER M. State of the art of Lewis acid-containing zeolites:lessons from fine chemistry to new biomass transformation processes[J]. Dalton Transactions, 2014, 43(11): 4197-4208. DOI:10.1039/C3DT52293H |
| [40] |
NIKBIN N, DO P T, CARATZOULAS S, et al. A DFT study of the acid-catalyzed conversion of 2, 5-dimethylfuran and ethylene to p-xylene[J]. Journal of Catalysis, 2013, 297: 35-43. DOI:10.1016/j.jcat.2012.09.017 |
| [41] |
FENG X Q, SHEN C, TIAN C C, et al. Highly selective production of biobased p-xylene from 2, 5-dimethylfuran over SiO2-SO3H catalysts[J]. Industrial & Engineering Chemistry Research, 2017, 56(20): 5852-5859. |
| [42] |
KIM J C, KIM T W, KIM Y J, et al. Mesoporous MFI zeolites as high performance catalysts for Diels-Alder cycloaddition of bio-derived dimethylfuran and ethylene to renewable p-xylene[J]. Applied Catalysis B:Environmental, 2017, 206: 490-500. DOI:10.1016/j.apcatb.2017.01.031 |
| [43] |
KIM T W, KIM S Y, KIM J C, et al. Selective p-xylene production from biomass-derived dimethylfuran and ethylene over zeolite beta nanosponge catalysts[J]. Applied Catalysis B:Environmental, 2016, 185: 100-109. DOI:10.1016/j.apcatb.2015.11.046 |
| [44] |
FENG X Q, SHEN C, JI K Y, et al. Production of p-xylene from bio-based 2, 5-dimethylfuran over high performance catalyst WO3/SBA-15[J]. Catalysis Science & Technology, 2017, 7(23): 5540-5549. |
| [45] |
WANG D, OSMUNDSEN C M, TAARNING E, et al. Selective production of aromatics from alkylfurans over solid acid catalysts[J]. ChemCatChem, 2013, 5(7): 2044-2050. DOI:10.1002/cctc.v5.7 |
| [46] |
YIN J B, SHEN C, FENG X Q, et al. Highly selective production of p-xylene from 2, 5-dimethylfuran over hierarchical NbOx-based catalyst[J]. ACS Sustainable Chemistry & Engineering, 2017, 6(2): 1891-1899. |
| [47] |
KOZHEVNIKOV I V. Sustainable heterogeneous acid catalysis by heteropoly acids[J]. Journal of Molecular Catalysis A:Chemical, 2007, 262(1-2): 86-92. DOI:10.1016/j.molcata.2006.08.072 |
| [48] |
WANG S S, YANG G Y. Recent advances in polyoxometalate-catalyzed reactions[J]. Chemical Reviews, 2015, 115(11): 4893-4962. DOI:10.1021/cr500390v |
| [49] |
LU R, LU F, CHEN J Z, et al. Production of diethyl terephthalate from biomass-derived muconic acid[J]. Angewandte Chemie, 2016, 55(1): 249-253. DOI:10.1002/anie.201509149 |
| [50] |
WIJAYA Y P, WINOTO H P, PARK Y K, et al. Heteropolyacid catalysts for Diels-Alder cycloaddition of 2, 5-dimethylfuran and ethylene to renewable p-xylene[J]. Catalysis Today, 2017, 293-294: 167-175. DOI:10.1016/j.cattod.2016.12.032 |
| [51] |
BOKADE V V, YADAV G D. Heteropolyacid supported on montmorillonite catalyst for dehydration of dilute bio-ethanol[J]. Applied Clay Science, 2011, 53(2): 263-271. DOI:10.1016/j.clay.2011.03.006 |
| [52] |
ALHARBI W, BROWN E, KOZHEVNIKOVA E F, et al. Dehydration of ethanol over heteropoly acid catalysts in the gas phase[J]. Journal of Catalysis, 2014, 319: 174-181. DOI:10.1016/j.jcat.2014.09.003 |
| [53] |
SETTLE A E, BERSTIS L, RORRER N A, et al. Heterogeneous Diels-Alder catalysis for biomass-derived aromatic compounds[J]. Green Chemistry, 2017, 19(15): 3468-3492. DOI:10.1039/C7GC00992E |
| [54] |
TAO M L, XUE L F, SUN Z, et al. Tailoring the synergistic Bronsted-Lewis acidic effects in heteropolyacid catalysts:applied in esterification and transesterification reactions[J]. Scientific Reports, 2015, 5: 13764. DOI:10.1038/srep13764 |
| [55] |
KISHIDA T, YAMAUCHI T, KUBOTA Y, et al. Rare-earth metal triflates as versatile catalysts for the chloromethylation of aromatic hydrocarbons[J]. Green Chemistry, 2004, 6(1): 57-62. DOI:10.1039/b308227j |
| [56] |
SARMA D, KUMAR A. Rare earth metal triflates promoted Diels-Alder reactions in ionic liquids[J]. Applied Catalysis A:General, 2008, 335(1): 1-6. DOI:10.1016/j.apcata.2007.10.026 |
| [57] |
SONG S, WU G J, DAI W L, et al. Diels-Alder and dehydration reactions of furan derivatives with ethylene catalyzed by liquid Brønsted acids and Lewis acids[J]. Journal of Molecular Catalysis A:Chemical, 2016, 420: 134-141. DOI:10.1016/j.molcata.2016.04.023 |
| [58] |
SHUAI L, LUTERBACHER J. Organic solvent effects in biomass conversion reactions[J]. ChemSusChem, 2016, 9(2): 133-155. DOI:10.1002/cssc.v9.2 |
| [59] |
SHIRAMIZU M, TOSTE F D. On the Diels-Alder approach to solely biomass-derived polyethylene terephthalate (PET):conversion of 2, 5-dimethylfuran and acrolein into p-xylene[J]. Chemistry, 2011, 17(44): 12452-12457. DOI:10.1002/chem.v17.44 |
| [60] |
MAHMOUD E, WATSON D A, LOBO R F. Renewable production of phthalic anhydride from biomass-derived furan and maleic anhydride[J]. Green Chemistry, 2014, 16(1): 167-175. DOI:10.1039/C3GC41655K |
| [61] |
XIAO Y, MALHOTRA S V. Diels-Alder reactions in pyridinium based ionic liquids[J]. Tetrahedron Letters, 2004, 45(45): 8339-8342. DOI:10.1016/j.tetlet.2004.09.070 |




