2. 浙江大学 化学工程与生物工程学院,浙江 杭州 310027;
3. 白俄罗斯国立大学 国际萨哈罗夫环境研究所,明斯克 220070
2. College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China;
3. International Sakharov Environmental Institute, Belarusian State University, Minsk 220070, Republic of Belarus
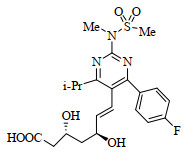
瑞舒伐他汀(图 1)的化学名称为(+)-(3R, 5S)-7-[4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰氨基)嘧啶-5-基]-3, 5-二羟基-6(E)-庚烯酸。通过研究发现,瑞舒伐他汀钙作为一种HMG-CoA抑制剂,与其他的他汀类药物相比具有更好的药理学活性[1],此外,还具有强效、安全性高、副作用少、耐受性良好的特点[2],在降低心血管疾病风险中发挥着重要作用。
|
图 1 瑞舒伐他汀分子结构图 Fig.1 Molecular structure of rosuvastatin |
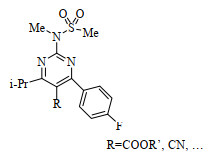
瑞舒伐他汀的母体骨架结构为4-(4-氟苯基)-6-异丙基-2-[甲基(甲磺酰基)氨基]-嘧啶-5-取代基(图 2),嘧啶环第5位取代基团通常为酯基或氰基,可通过官能团反应再与侧链进行拼接制得瑞舒伐他汀。根据文献报道,其合成主要有以下几种方法,一是尿素法,该方法以对氟苯甲醛、异丁酰乙酸甲酯(或异丁酰乙腈)和尿素为主要原料,通过环合、氧化、取代等步骤,得到4-(4-氟苯基)-6-异丙基-2-[甲基(甲磺酰基)氨基]-嘧啶-5-取代物[3-4]。以尿素为环合反应的原料,收率较高,但是过程中产生的嘧啶2位羟基难以脱去,必须经历酰化使其成为易离去基团,再以N-甲基甲磺酰胺取代,成本较高。二是异硫脲法,如KUMAR等[5]以苄基异硫脲与对氟苯甲醛和异丁酰乙酸甲酯反应产物3-(4-氟苯基)-2-(2-甲基丙酰基)-丙-2-烯酸甲酯进行反应合成嘧啶骨架。该路线反应路线很长,收率不高。三是盐酸胍法,胍的结构与2位含氮取代基嘧啶的结构非常契合,由此考虑到以盐酸胍作为成环的重要原料。该方法[6]减少了许多复杂反应步骤,可较容易得到目标化合物,但其中所用的2,3-二氯-5,6-二氰基苯醌(DDQ)等试剂毒性比较大[7]。四是硫脲法,该方法的优点在于多为室温反应,较尿素反应而言减少了羟基脱去的步骤。如END等[8]以对氟苯甲醛、异丁酰乙酸甲酯、硫脲为原料经环合、甲基化、氧化、取代、酰化等步骤合成了嘧啶环第5位取代基为酯基的瑞舒伐他汀母核,但在该方法中也使用了DDQ,且反应步骤相对较长。
|
图 2 瑞舒伐他汀骨架结构 Fig.2 Backbone structure of rosuvastatin |
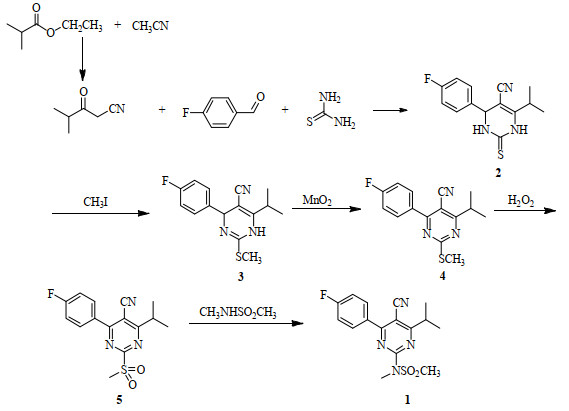
如图 3所示,本研究在上述硫脲法文献的基础上,以异丁酰乙腈取代异丁酰乙酸甲酯,合成嘧啶环第5位取代基为氰基的瑞舒伐他汀关键中间体4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰氨基)嘧啶-5-甲腈(图 3中化合物1),同时,在温和条件下,将取代、酰化一锅法进行,并用MnO2取代DDQ,以廉价的双氧水取代间氯过氧苯甲酸,以期为他汀类药物中间体的工业化生产提供理论依据和借鉴参考。
|
图 3 瑞舒伐他汀关键中间体4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰氨基)嘧啶-5-甲腈合成新工艺路线图 Fig.3 Synthetic route for the key intermediate of rosuvastatin 4-(4-fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino) pyrimidine-5-formonitrile |
安捷伦6820气相色谱仪(GC)、安捷伦1200高效液相色谱仪(HPLC)、AVNACE DM×500型核磁共振仪。
2.1.2 实验材料异丁酸乙酯、乙腈、四氢呋喃(THF)、二氯甲烷(DCM)、浓盐酸(质量分数为36.5 %)、乙酸乙酯、碳酸氢钠、氢化钠(质量分数为60 %,分散于石蜡油)、对氟苯甲醛、硫脲、乙醇、氯化亚铜、氯化镧七水合物、氯化铁六水合物、浓硫酸、碳酸钾、碘甲烷、甲苯、二氧化锰、甲醇、钨酸钠、四丁基溴化铵(TBAB)、聚乙二醇(PEG400)、双氧水(质量分数为30 %)、N-甲基甲磺酰胺等分析纯试剂购自中国国药集团有限公司,去离子水为自制。
2.2 典型实验 2.2.1 异丁酰乙腈的制备在60%氢化钠(8.93 g,0.22 mol)中加入四氢呋喃(150mL),加热至60 ℃,滴加异丁酸乙酯(21.6 g,0.186 mol)和乙腈(9.14 g,0.22 mol)混合物,1 h内滴完,继续反应6 h。气相色谱显示原料反应几乎完全,停止,减压蒸干,残余物加水(300 mL)溶解,用二氯甲烷洗涤(50 mL×2),用浓盐酸调节pH < 3,用乙酸乙酯萃取(100 mL×3),水洗(50 mL),用饱和碳酸氢钠溶液洗(50 mL),再水洗(50 mL),减压蒸干后获得红色油状物异丁酰乙腈(19.17 g,收率88.4%),经气相色谱分析,纯度达到95.2%。
1HNMR (500MHz,CDCl3):1.19(d,J=7.0Hz,6H);2.81(m,1H);3.55(s,2H)。
2.2.2 4-(4-氟苯基)-6-异丙基-2-硫代-1, 2, 3, 4-四氢嘧啶-5-甲腈的制备将异丁酰乙腈(1.00 g,9.00 mmol)、对氟苯甲醛(1.12 g,9.00 mmol)、硫脲(2.05 g,27.00 mmol)混合,加入乙醇(10 mL)、氯化亚铜(0.01 g,0.90 mmol)、浓硫酸(0.09 g,0.90 mmol),加热回流反应24 h,薄层色谱分析显示反应完全,加水(10 mL),过滤,用水:乙醇=1:1洗涤(20mL),获得黄色黏稠状物质4-(4-氟苯基)-6-异丙基-2-硫代-1, 2, 3, 4-四氢嘧啶-5-甲腈(见图 3中的化合物2) (2.00 g,收率81.0%)。
1HNMR (500MHz,d-DMSO):1.22(m,6H);2.90(m,1H);5.14(d,J=2.5Hz,1H);7.29(m,4H);9.73(s,1H);10.44(s,1H)。
2.2.3 4-(4-氟苯基)-6-异丙基-2-甲硫基-1, 4-二氢嘧啶-5-甲腈和4-(4-氟苯基)-6-异丙基-2-甲硫基嘧啶-5-甲腈的制备将四氢嘧啶硫酮(5.00 g,18.2 mmol)、碳酸钾(2.50 g,18.2 mmol)混合,加入乙腈(50 mL),室温下搅拌20 min,加入碘甲烷(2.80 g,20.0 mmol)和乙腈(10 mL)混合液,室温反应2 h,薄层色谱分析显示反应完全。过滤,减压蒸干除去溶剂,残余物中加入甲苯(100 mL),水洗(50 mL×2),减压蒸干溶剂即可得4-(4-氟苯基)-6-异丙基-2-甲硫基-1, 4-二氢嘧啶-5-甲腈(见图 3中的化合物3),基本为定量反应;所得的化合物3中加入甲苯(100 mL)溶解,然后加入活性二氧化锰(15.00 g),加热至100℃、反应3 h至薄层色谱分析显示化合物3反应完全,过滤,减压蒸干后获得黄色黏稠状物质4-(4-氟苯基)-6-异丙基-2-甲硫基嘧啶-5-甲腈(见图 3中的化合物4) (5.06 g,收率97.0%)。
化合物3核磁数据:1HNMR (500MHz,CDCl3):1.17(d,J=6.5Hz,6H);2.45(m,3H);3.00 (m,1H);7.06(m,2H);7.29(m,2H)。
化合物4核磁数据:1HNMR (500MHz,CDCl3):1.37(d,J=6.5Hz,6H);2.64(s,3H);3.53(m,1H);7.22(m,2H);8.05(m,2H)。
2.2.4 4-(4-氟苯基)-6-异丙基-2-甲磺酰基嘧啶-5-甲腈的制备在化合物4 (1.72 g,6 mmol)中加入甲醇(20mL)、钨酸钠(0.12 g)、30%双氧水(1.36 g,12.0 mmol)、盐酸1滴,加热至35 ℃搅拌24 h,薄层色谱分析显示反应完全,加水(50 mL),用乙酸乙酯(30 mL×3)萃取,水洗(30 mL),减压蒸干,用异丙醇重结晶后在低温下获得黄色固体4-(4-氟苯基)-6-异丙基-2-甲磺酰基嘧啶-5-甲腈(见图 3中的化合物5) (1.63 g,收率85.1%)。
1HNMR(500MHz,CDCl3):1.45(d,J=6.5Hz,6H);3.43(s,3H);3.71(m,1H);7.46(m,2H);8.20(m,2H)。
2.2.5 4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰氨基)嘧啶-5-甲腈的制备将化合物5 (5.0 g,15.6 mmol)、N-甲基甲磺酰胺(2.55 g,23.5 mmol)、碳酸钾(4.3 g,31.3 mmol)混合,加入乙腈(50 mL),加热至80 ℃反应2 h,薄层色谱分析显示反应完全,过滤,减压蒸干,用丙酮重结晶获得黄色固体4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰氨基)嘧啶-5-甲腈(见图 3中的化合物1) (4.91 g,收率90.0%,HPLC纯度98.0%)。熔点:211~212 ℃。
1HNMR(500MHz,CDCl3):1.38(d,J=7Hz,6H);3.52(s,3H);3.58(m,1H);3.63(s,3H);7.24(m,2H);8.10(m,2H)。
3 实验结果与讨论 3.1 不同溶剂对异丁酰乙腈制备的影响不同溶剂对异丁酰乙腈制备的影响见表 1。由表可知,当以甲苯或异丙醚为溶剂时,反应的转化率较低,这是因为这两种溶剂的极性较弱,钠氢拔氢作用后所形成的钠盐在溶剂中的溶解度较低,且在反应中发现随着反应的进行体系变得黏稠,故反应速率较慢。以乙腈为溶剂时,反应的选择性与其他三种溶剂相比较低,且大部分副产物为异丁酸。这可能是因为乙腈为溶剂时,NaH先与乙腈混合发生反应生成乙腈钠,乙腈钠不仅作为亲核试剂可与异丁酸乙酯反应生成目标产物异丁酰乙腈,同时可作为碱,在其作用下,异丁酸乙酯去质子后,经酮式与烯醇式互变异构[9]生成稳定的钠盐,后经水与酸处理后水解生成异丁酸。以不含活泼氢的极性THF为溶剂时[10-11]反应结果最佳,异丁酰乙腈的收率高达95.2%。
|
|
表 1 不同溶剂对异丁酰乙腈制备的影响a Table 1 Effects of different solvents on the preparation of isobutyryl acetonitrile a |
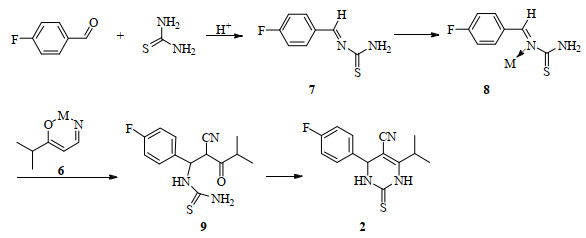
在质子酸的催化下,乙酰乙酸乙酯、芳香醛和脲的缩合反应被称为Biginelli反应[12]。该反应通常反应时间较长、收率低。在LaCl3·7H2O[13]、FeCl3·6H2O[14]、CuCl[15]等过渡金属盐的催化下,可有效提高反应的效率和收率。本文以异丁酰乙腈取代乙酰乙酸乙酯,提出可能的过渡金属盐催化的衍生Biginelli反应制备4-(4-氟苯基)-6-异丙基-2-硫代-1, 2, 3, 4-四氢嘧啶-5-甲腈(见图 3中的化合物2)机理(图 4):在质子酸的作用下,对氟苯甲醛和硫脲缩合并脱水生成亚胺中间体7,由于Mx+具有空轨道,亚胺中间体7与Mx+可通过配位键形成较稳定的配合物8, 然后与异丁酰乙腈的烯醇盐6发生缩合反应得到酰基硫脲9,后者经过环化脱水得到化合物2。
|
图 4 过渡金属盐催化衍生Biginelli反应制备化合物2机理图 Fig.4 Mechanism for transition metal promoted derivative Biginelli reaction for preparation of compound 2 |
本文考察了CuCl、LaCl3·7H2O、FeCl3·6H2O等3种不同过渡金属盐对化合物2制备促进的影响,结果见表 2。由表可知,在没有盐加入的情况下,反应收率较低,只有45.8%。当加入金属盐后,反应收率可显著提高至80%以上,且不同金属盐催化下化合物2的收率相当。
|
|
表 2 不同过渡金属盐对化合物2制备的影响a Table 2 Effects of different transition metal salts on the preparation of compound 2a |
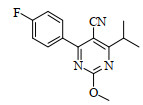
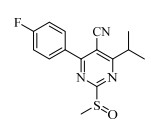
双氧水为硫醚氧化制备砜化合物常用的氧化试剂[16],钨酸钠为常用的金属盐催化剂[17]。本文以双氧水为氧化剂,以钨酸钠为催化剂,考察了不同反应条件对4-(4-氟苯基)-6-异丙基-2-甲硫基嘧啶-5-甲腈(化合物4)氧化制备4-(4-氟苯基)-6-异丙基-2-甲磺酰基嘧啶-5-甲腈(见图 3中的化合物5)的影响,结果见表 3。由表可知,以甲醇为溶剂时,因双氧水可溶于甲醇,无需加入相转移催化剂,且当反应温度为35 ℃时,收率最高;当反应温度降为25 ℃时,在相同反应时间内薄层色谱分析反应不完全,导致收率降低;当反应温度升为45 ℃时,因甲氧基与甲硫基交换发生副反应生成甲氧基嘧啶化合物(图 5),同样导致收率降低。当以二氯甲烷或甲苯为溶剂时,因双氧水不溶,故需添加相转移催化剂。然而,由于硫醚更易被双氧水氧化至亚砜阶段[18],故以TBAB或PEG400为相转移催化剂时,均有亚砜副产物(图 6)生成,从而导致收率降低。以甲醇为溶剂,在35 ℃下反应,化合物5的收率最高,可达85.2%。
|
|
表 3 不同条件对化合物5制备的影响a Table 3 Effects of different conditions on the preparation of compound 5 a |
|
图 5 4-(4-氟苯基)-6-异丙基-2-甲氧基嘧啶-5-甲腈的结构 Fig.5 Structure of 4-(fluorophenyl)- 6-isopropyl-2-methoxypyrimidine-5-formonitrile |
|
图 6 4-(4-氟苯基)- 6-异丙基-2-甲基亚磺酰基嘧啶-5-甲腈的结构 Fig.6 Structure of 4-(fluorophenyl)- 6-isopropyl-2-methylsulfinylpyrimidine-5-formonitrile |
以硫脲法,经环合、甲基化、氧化、取代等步骤制备了瑞舒伐他汀关键中间体4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰氨基)嘧啶-5-甲腈,该方法成本低、反应简单、收率高、易于实现工业化生产。
本文对路线中关键步骤进行了工艺探讨和优化:
(1) 溶剂的性质对异丁酰乙腈的制备具有较大影响,以不含活泼氢的极性THF为溶剂时反应结果最佳,异丁酰乙腈的收率高达95.2%。
(2) 在质子酸和过渡金属盐催化下,对氟苯甲醛、硫脲和异丁酰乙腈经缩合制备了4-(4-氟苯基)-6-异丙基-2-硫代-1, 2, 3, 4-四氢嘧啶-5-甲腈,并提出了可能的金属配位机理。该步反应的收率可达80%以上。
(3) 在35℃下,以双氧水为氧化剂,以钨酸钠为催化剂,以甲醇为溶剂,4-(4-氟苯基)-6-异丙基-2-甲硫基嘧啶-5-甲腈氧化制备4-(4-氟苯基)-6-异丙基-2-甲磺酰基嘧啶-5-甲腈的收率最高,为85.2%。
| [1] |
ZHANG X B, PENG J, HE C L, et al. A highly selective fluorescent sensor for Cu2+ based on 2-(2'-hydroxyphenyl) benzoxazole in a poly (vinyl chloride) matrix[J]. Analytical Chimica Acta, 2006, 567(2): 189-195. DOI:10.1016/j.aca.2006.03.025 |
| [2] |
QUE E L, DOMAILLE D W, CHANG C J. Metals in neurobiology:Probing their chemistry and biology with molecular imaging[J]. Chemical Reviews, 2008, 108(5): 1517-1549. DOI:10.1021/cr078203u |
| [3] |
MATSUSHITA A, ODA M, KAWACHI Y, et al. Preparation of aminopyrimidine compounds: WO, 03006439[P]. 2003-01-23.
|
| [4] |
HUANG Q Y. Preparation of 4-(fluorophenyl)-6-isopropyl-2-(N-methyl-N-methylsulfonylamino)-5-formyl-pyrimidine: WO, 2008151510[P]. 2008-12-18.
|
| [5] |
KUMAR Y, DE S, RAFEEQ M, et al. Process for the preparation of rosuvastatin: WO, 03097614[P]. 2003-11-27.
|
| [6] |
NEWTON L, BAILEY M. Compounds and processes: WO, 2004054986[P]. 2004-07-01.
|
| [7] |
唐振权, 莫卫民, 沈振陆, 等. DDQ/TBN催化分子氧氧化芳构化合成罗素伐他汀母核中间体[J]. 分子催化, 2012, 26(3): 211-215. TANG Z Q, MO W M, SHEN Z L, et al. The study on the synthesis of rosuvastatin intermediate via DDQ/TBN catalyzed aerobic oxidative aromatization[J]. Journal of Molecular Catalysis(China), 2012, 26(3): 211-215. |
| [8] |
END N, RICHTER Y. Process for the preparation of pyrimidine derivatives: WO, 2004103977[P]. 2004-12-02.
|
| [9] |
汪小兰. 有机化学[M]. 北京: 高等教育出版社, 2017. WANG X L. Organic chemistry[M]. Beijing: Higher Education Press, 2017. |
| [10] |
KIM B R, LEE H G, KANG S B, et al. Synthesis of β-ketonitriles, α, β-alkynones and biscabinols from esters using tert-butoxide-assisted C(=O)-C (i.e., acyl-C) coupling under ambient conditions[J]. Tetrahedron, 2013, 69(48): 10331-10336. DOI:10.1016/j.tet.2013.10.007 |
| [11] |
JI Y H, TRENKLE W C, VOWLES J V. A high-yielding preparation of α-ketonitriles[J]. Organic Letters, 2006, 8(6): 1161-1163. DOI:10.1021/ol053164z |
| [12] |
KAPPE C O. A reexamination of the mechanism of the biginelli dihydropyrimidine synthesis. Support for an N-acyliminium ion intermediate[J]. The Journal of Organic Chemistry, 1997, 62(21): 7201-7204. DOI:10.1021/jo971010u |
| [13] |
LU J, BAI Y, WANG Z, et al. One-pot synthesis of 3, 4-dihydropyrimidin-2(1H)-ones using lanthanum chloride as a catalyst[J]. Tetrahedron Letters, 2000, 41(47): 9075-9078. DOI:10.1016/S0040-4039(00)01645-2 |
| [14] |
路军, 马怀让, 李万华. 三氯化铁催化的一锅法合成3, 4-二氢嘧啶-2-酮[J]. 有机化学, 2000, 20(5): 815-819. LU J, MA H R, LI W H. A novel one-pot synthesis of 3, 4-dihydropyrimidine-2(1H)-ones by catalyzed ferric chloride hexahydrate[J]. Chinese Journal of Organic Chemistry, 2000, 20(5): 815-819. DOI:10.3321/j.issn:0253-2786.2000.05.037 |
| [15] |
HU E H, SIDLER D R, DOLLING U H. Unprecedented catalytic three component one-pot condensation reaction:An efficient synthesis of 5-alkoxycarbonyl-4-aryl-3, 4-dihydropyrimidin-2(1H)-ones[J]. The Journal of Organic Chemistry, 1998, 63(10): 3454-3457. DOI:10.1021/jo970846u |
| [16] |
YAMAZAKI S. Selective synthesis of sulfones and sulfoxides by methyltrioxorhenium-catalyzed oxidation of sulfides with hydrogen peroxide[J]. Bulletin of the Chemical Society of Japan, 1996, 69(10): 2955-2959. DOI:10.1246/bcsj.69.2955 |
| [17] |
SATO K, HYODO M, AOKI M, et al. Oxidation of sulfides to sulfoxides and sulfones with 30% hydrogen peroxide under organic-solvent and halogen-free conditions[J]. Tetrahedron, 2001, 57(13): 2469-2476. DOI:10.1016/S0040-4020(01)00068-0 |
| [18] |
谭晓军, 王党生, 李吉海. 由硫醚或亚砜氧化制砜的研究进展[J]. 化学研究, 2004, 15(3): 68-72. TAN X J, WANG D S, LI J H. Progress on synthesis of sulfones by oxidation of sulfides or sulfoxides[J]. Chemical Research, 2004, 15(3): 68-72. DOI:10.3969/j.issn.1008-1011.2004.03.021 |




