2. 浙江工业大学 绿色化学合成技术国家重点实验室培养基地, 浙江 杭州 310014;
3. 浙江工业大学 绿色制药技术与装备教育部重点实验室, 浙江 杭州 310023
2. State Key Laboratory Breeding Base of Green Chemistry Synthesis Technology, Zhejiang University of Technology, Hangzhou 310014, China;
3. Key Laboratory for Green Pharmaceutical Technologies and Related Equipment of Ministry of Education, Zhejiang University of Technology, Hangzhou 310023, China
苯乳酸是近年来发现的具有广谱抑菌性的新型生物防腐剂[1],能有效抑制革兰氏阴性菌、阳性菌和部分真菌的生长,同时也可以作为合成药物的中间体,用于心脑血管药物的合成,在化工、食品、材料、医药等领域具有重要用途[2-4]。目前,苯乳酸的合成主要有化学合成和微生物合成方法。前者耗能较大、副产物较多,通常需要采用毒性较大的溶剂提取,环境污染问题比较突出[5];后者合成条件温和,底物容易获得,对环境的污染较小,具有良好的发展前景,是近几年国内外重点关注的研究方向[6-8]。但是,发酵液的成分复杂,存在多种盐和菌体代谢过程中产生的其他物质,如何从发酵液中分离出高纯度的苯乳酸仍有待研究。多孔晶胶介质层析为解决上述问题提供了新的方向。
超大孔晶胶最早由瑞典隆德大学研发,是一种由单体和交联剂通过冷冻结晶致孔法得到的新型层析材料[9]。常规层析介质难以直接处理含细胞的复杂生物料液,而晶胶内部具有相互连接的超大孔隙,孔径尺寸在10~100 μm,当含有生物纳米颗粒和微粒(质粒、细胞器甚至完整的细胞)的复杂料液通过晶胶孔隙时,目标物会被吸附在孔道表面,起到层析分离的作用[10-12]。本课题组前期研究表明,晶胶材料可以用于对α-酮异己酸和苯乳酸的层析分离[13-14],但是采用接枝苄乙基三甲基氯化铵(VBTAC)整体柱分离苯乳酸的成本较高。因此,通过对多微管反应器制备的晶胶微球接枝修饰或引入低成本的配基,从副干酪乳杆菌发酵液中分离纯化苯乳酸,有待进一步研究。
细菌纤维素是由微生物发酵产生的一种可降解生物材料,与天然植物纤维素相比,细菌纤维素纯度高、组成单一,沿纤维方向强度大,生物相容性更佳,并且在生物法制备苯乳酸的过程中,细菌纤维素是其副产物之一。它由独特的丝状纤维组成,具有三维网状结构,同时具有高持水能力、高稳定性等特点。晶胶材料内部有丰富的多级次孔隙,适用于生物大分子的吸附。纳米纤维素具有较大的比表面,有利于提高吸附容量。但是基于纤维素的微球基质,存在着易收缩、吸附性能差与机械强度弱等缺点[15]。前人的研究表明将纳米纤维素与晶胶材料相结合,能融合纤维素与晶胶微球的优点,同时能有效提升晶胶材料的基础性能,如利用微通道将纤维素嵌入聚甲基丙烯酸乙酯晶胶中,成功从人血清中分离免疫球蛋白G和白蛋白[12],但是受限于微通道的几何结构,难以进行放大生产。
本研究利用多微管反应器内结晶致孔-低温聚合方法,制备纳米纤维素嵌合型晶胶微球,对晶胶微球与微球填充柱的基础性能进行研究,并对微球填充柱的苯乳酸吸附条件进行优化。
2 实验(材料与方法) 2.1 实验材料与仪器 2.1.1 实验材料实验中所用到的主要试剂见表 1。
|
|
表 1 主要试剂 Table 1 Chemicals used in the study |
实验中所用到的仪器设备见表 2。
|
|
表 2 仪器设备 Table 2 Instruments used in the study |
采用课题组建立的结晶致孔、低温聚合和接枝修饰的方法制备了纳米纤维素嵌合型晶胶微球[16-17]。将甲基丙烯酸羟乙酯(HEMA)与聚乙二醇二丙烯酸酯(PEGDA)按质量比77:23溶于去离子水,得到质量分数为15% 的单体溶液,加入研磨好的细菌纤维素(质量分数为1%、3%、5%,为避免堵塞多微管反应器,仅将纤维素质量分数增加到5%),在4 ℃条件下置于超声清洗仪中超声20 min,得到分散均匀的单体分散液;加入引发剂过硫酸铵(APS)和加速剂四甲基乙二胺(TEMED)(APS和TEMED质量分数分别占单体总量的6.0% 和1.0%),混合均匀;使用蠕动泵以5 cm⋅min−1的流速将反应液经多微管反应器滴入−30 ℃硅油中;将凝固的液滴捞出转移至−20 ℃冰柜,低温聚合48 h,用大量去离子水解冻并洗净,然后用浓度为1 mol⋅L−1的甲基丙烯酸二甲基氨基乙酯(DMAEMA)单体进行接枝而得,具体接枝操作如下:
(1) 配制强氧化剂Cu(Ⅲ)溶液:将7.08 g硫酸铜、14.64 g高碘酸钾、4.40 g过硫酸钾、18 g氢氧化钾溶于400 g去离子水中,在磁力搅拌器中充分搅拌溶解后,加热至140 ℃,反应40 min后抽滤,再用去离子水在500 mL容量瓶中完成定容,最后将配制好的Cu(Ⅲ)溶液置于棕色瓶中备用。
(2) 接枝DMAEMA:将在60 ℃恒温水浴锅预热完成的Cu(Ⅲ)和1 mol⋅L−1氢氧化钠混合溶液(两者体积比为2:1)泵入纳米纤维素嵌合型晶胶微球填充柱中(体积的3倍),然后静置于60 ℃水浴锅中反应2 h;再将提前预热好的1 mol⋅L−1的DMAEMA溶液泵入填充柱,静置于60 ℃水浴锅中反应2 h,使得DMAEMA上的乙烯键接枝到晶胶微球上;接枝反应完成后,往填充柱内泵入50 mL 0.1 mol⋅L−1的HCl溶液,除去未反应的单体,最后再用去离子水平衡填充柱。
2.2.2 晶胶微球的基础性能测试纳米纤维素嵌合型晶胶微球的孔隙率采用称重法测定:测量给定体积内的含水量确定孔隙率。晶胶微球的内部结构通过扫描电镜表征:将晶胶微球进行梯度脱水、冷冻干燥、喷金处理后用扫描电镜拍摄观察。通过统计100个晶胶微球的粒径,计算得到微球的尺寸分布[18]。
2.2.3 晶胶微球填充柱的基础性能测试将接枝后的晶胶微球填入内径为1.6 cm的层析柱中,通过测定不同压力下去离子水单位时间内流经层析柱的体积,得到层析柱两端的压差与体积流量的关系,再由达西定律计算出渗透率[19];采用脉冲示踪法测定填充柱的停留时间分布,进而参照停留时间分布曲线计算不同流速下层析柱的理论塔板数(N)、等板高度(HHETP)和轴向扩散系数(Dax)等;填充柱的吸附容量通过考察其对模型牛血清白蛋白(BSA)的吸附进行评价[11, 13]:用pH为7.2的磷酸盐缓冲液配制1 mg⋅mL−1的BSA溶液在1 cm⋅min−1的流速下进行层析吸附,测定晶胶微球填充柱对BSA吸附容量,蛋白浓度采用考马斯亮蓝法测定。
2.2.4 苯乳酸吸附条件的优化用缓冲液配制不同质量浓度(1、5、10 mg⋅mL−1)、pH值(2、4、6、8)的苯乳酸溶液,在不同流速(1.0、1.5、2.0 cm⋅min−1)下进行层析吸附,用1 mol⋅L−1的NaCl溶液洗脱,采用高效液相色谱法测定洗脱液中苯乳酸的含量,进而得到晶胶微球填充柱对苯乳酸的吸附容量,得到增加苯乳酸吸附容量的优化条件。
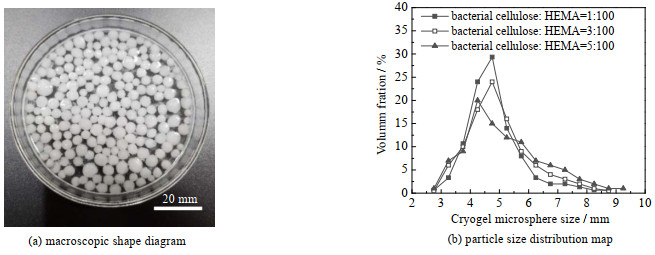
3 实验结果与讨论 3.1 晶胶微球的形态结构和基础性能接枝DMAEMA后的纳米纤维素嵌合型晶胶微球的宏观形态和粒径分布如图 1(a)、(b)所示,可见晶胶微球的球形度较好,粒径分布均匀,1%、3%、5% 纤维素质量分数的晶胶微球粒径主要分布在4~6 mm,平均粒径分别为4.83、4.99、5.24 mm。
|
图 1 纤维素嵌合型晶胶微球的宏观形态和粒径分布 Fig.1 Macroscopic morphology and particle size distribution of cellulose embedded cryogel microspheres |
内部微观结构如图 2所示,纳米纤维素嵌合型晶胶微球内部孔径分布在10~50 μm。通过测量给定体积晶胶微球的含水量,测得纤维素质量分数为1%、2%、3% 的晶胶微球的孔隙率如表 3所示,有效孔隙率可达70% 以上,绝干孔隙率在87%~91%,相互连通的大孔结构以及较高的孔隙率说明纳米纤维素嵌合型晶胶微球是生物分离领域与微生物贴壁生长的理想载体。

|
图 2 纤维素嵌合型晶胶微球的内部微观结构 Fig.2 Internal microstructure of cellulose-embedded cryogel microspheres |
|
|
表 3 晶胶微球的孔隙率 Table 3 Porosity of cryogel microspheres |
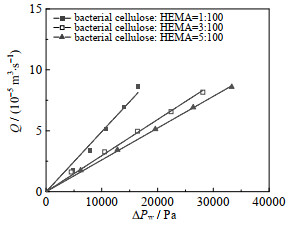
图 3表示了不同细菌纤维素含量的晶胶微球填充柱流量与压降之间的关系,结果表明流量随压降的变化呈线性关系,相同压降下内嵌纤维素比例高的晶胶微球填充柱单位时间内去离子水的流出量小,这可能是因为细菌纤维素的含量越高,晶胶微球内部的骨架强度越大,抗压能力也随之有所增加。由Darcy定律通过流量与压降之间的关系计算得到的晶胶微球填充柱渗透率如表 4所示,随着细菌纤维素含量的增加,晶胶微球填充柱的渗透率降低,渗透率分布在0.53×10−13~1.01×10−13 m2。
|
图 3 晶胶微球填充柱内压降与流量的关系 Fig.3 Relationship between pressure drop and flow rate in the cryogel microsphere packed column |
|
|
表 4 晶胶微球填充柱的渗透率 Table 4 Permeability of cryogel microsphere filled column |
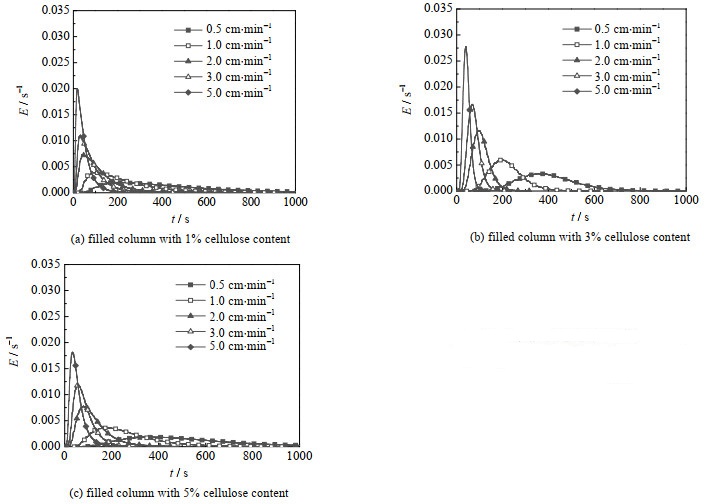
图 4为3种不同细菌纤维素含量晶胶微球填充柱在0.5、1.0、2.0、3.0、5.0 cm⋅min−1 5个不同流速下测得的停留时间分布曲线,可以看出在高流速下,3种晶胶微球填充柱分布曲线的峰型具有良好的对称性,无明显拖尾现象,且测试过程无壁流现象,说明晶胶微球填充柱具有良好的传质性能。在低流速下,纤维素质量分数为1% 的填充柱出现拖尾的现象,这可能是由于填充柱的尺寸较大使得晶胶微球未紧实填充,导致流体易从柱壁和颗粒间流过。
|
图 4 晶胶微球填充柱停留时间分布 Fig.4 Residence time distribution of cryogel microsphere packed column |
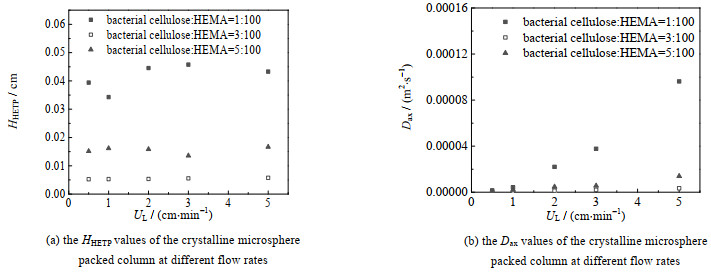
由停留时间分布曲线计算得到的晶胶微球填充柱在不同流速下的等板高度、轴向扩散系数分别如图 5(a)、(b)所示。图 5(a)中,在5个不同流速下晶胶微球填充柱等板高度的大小在0.005~0.045 cm波动,等板高度的大小能反映层析柱的分离效果,等板高度值越小,表示这一段的传质效果更佳。与其他类型的HEMA晶胶基质相比[19],纳米纤维素嵌合型晶胶微球填充柱的等板高度值更小,波动也更小,说明该基质具有良好的传质效果。
|
图 5 晶胶微球填充柱在不同流速下的HHETP和Dax值 Fig.5 HHETP and Dax values of the cryogel microsphere packed column at different flow rates |
图 5(b)反映了不同流速下的轴向扩散系数Dax的变化,轴向扩散系数Dax可以反映流体流经层析柱时在轴向上的返混程度,Dax越大返混程度就越大,柱效越差。图 5(b)中,随着流速的增大,Dax逐渐变大,流体在填充柱内部轴向上的返混程度变大,这一现象与其他类型的晶胶相似。纤维素质量分数为3% 与5% 的填充柱随着流速的增加,返混现象增强不明显,但1% 的填充柱随着流速增加,Dax迅速增大,这可能与晶胶微球填充未紧实以及实验过程中存在空气流入填充柱有关。
3.2.3 晶胶微球填充柱的层析性能文献中常以模型蛋白BSA来考察对晶胶介质的吸附性能[20]。因此,在1.0 cm⋅min−1的流速下,对3种不同细菌纤维素含量的晶胶微球填充柱进行BSA的上样吸附研究。用pH为7.2的磷酸盐缓冲液平衡填充柱、质量浓度为1 mg⋅mL−1的上样BSA、洗脱液为缓冲液配制的1 mol⋅L−1 NaCl溶液,得到的BSA吸附曲线如图 6所示,BSA浓度采用考马斯亮蓝法测得。
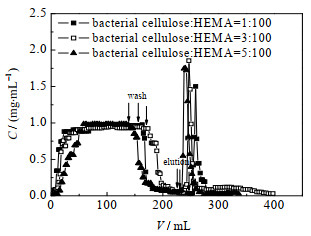
|
图 6 晶胶微球填填充柱对BSA的吸附曲线 Fig.6 BSA adsorption curves on the cryogel microsphere packed column |
通过BSA标准曲线计算得到3种不同细菌纤维素含量的晶胶微球填充柱对BSA的吸附容量,如表 5所示。随着内嵌细菌纤维素量的增加,吸附容量逐渐增大,这是因为细菌纤维素的添加使得晶胶微球表面呈现波纹状,孔隙表面变得更粗糙,单位面积内的DMAEMA接枝量增大,从而增大晶胶微球填充柱的吸附容量。
|
|
表 5 晶胶微球填充柱的BSA吸附容量 Table 5 BSA adsorption capacity of the cryogel microsphere packed column |
溶液的pH是影响苯乳酸分离效率和吸附容量的关键因素之一,采用BSA吸附容量最大的、纤维素质量分数为5% 的晶胶微球填充柱进行苯乳酸吸附研究,得到不同溶液pH下苯乳酸的吸附容量如图 7所示,可以看出较高的pH有利于苯乳酸的吸附,pH > 4后,苯乳酸的吸附容量出现波动,变化不明显。pH为6时吸附容量达到最大,为41.32 mg⋅mL−1,是pH为2时的1.59倍。这是因为晶胶微球填充柱接枝了DMAEMA链,能与苯乳酸的酸根离子实现静电吸附,而较高的pH能使苯乳酸分子在溶液中解离出更多的酸根离子,从而使晶胶微球填充柱对苯乳酸的吸附容量有所增加。
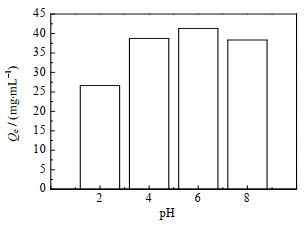
|
图 7 不同pH条件下晶胶微球填充柱对苯乳酸的吸附容量 Fig.7 Phenyllactic acid adsorption capacities of the cryogel microsphere packed column under different pH conditions |
表 6表示的是苯乳酸上样质量浓度为5 mg⋅mL−1、pH为2.0的条件下,不同层析流速下晶胶微球填充柱的苯乳酸吸附容量变化。随着流速的增大,苯乳酸的吸附容量略微有所下降,这是由于较低的流速可以使得固液两相有充足的接触时间,从而使得吸附容量有所增大。但过小的流速会使得操作周期增大,在工业的实际应用中需要适当提高流速以降低时间成本。表 6中,随着流速增加,吸附容量下降速度逐渐减缓,且流速从1.5 cm⋅min−1增加到2.0 cm⋅min−1,晶胶微球填充柱对苯乳酸的吸附容量无明显下降,说明晶胶微球填充柱可以在较高流速下实现料液的处理。
|
|
表 6 不同流速下晶胶微球填充柱的苯乳酸吸附容量 Table 6 Phenyllactic acid adsorption capacity of the cryogel microsphere packed column at different flow rates |
表 7表示的是不同苯乳酸上样液浓度下,晶胶微球填充柱的苯乳酸吸附容量变化。结果表明在低浓度下,随着上样液浓度的增大,晶胶微球填充柱的苯乳酸吸附容量随之增加。上样液质量浓度高于5 mg⋅mL−1后,晶胶微球填充柱的苯乳酸吸附容量基本不变。这可能是因为较高浓度的上样液中苯乳酸的酸根离子含量更多,更容易与晶胶微球填充柱实现静电吸附,当溶液浓度过大,可能存在吸附饱和的现象。
|
|
表 7 不同上样浓度下晶胶微球填充柱的苯乳酸吸附容量 Table 7 Phenyllactic acid adsorption capacity of the cryogel microsphere packed column at different sample concentrations |
在苯乳酸上样质量浓度为5 mg⋅mL−1、pH为2.0的条件下,以1 cm⋅min−1的流速对填充柱进行连续的5次动态吸附解吸附苯乳酸的实验研究,得到的苯乳酸吸附容量变化如图 8所示。5次动态吸附的苯乳酸吸附容量在24.17~26.31 mg⋅mL−1,说明填充柱具有优异的化学稳定性、稳固的机械结构、良好的重复使用性能,在苯乳酸的层析分离领域具有良好的应用前景。
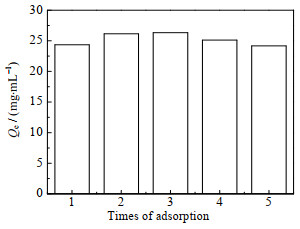
|
图 8 晶胶微球填充柱的重复使用性能 Fig.8 Reusability of cryogel microsphere filled column |
纳米纤维素嵌合型晶胶微球填充柱吸附苯乳酸的过程会逐渐饱和,从开始的接近完全吸附到最后的基本不吸附,因此上样不同体积的苯乳酸溶液对其回收率有着重要的影响。以晶胶微球填充柱的柱体积9.2 cm3为基础,在苯乳酸上样质量浓度为5 mg⋅mL−1、pH为6.0的条件下,以1 cm⋅min−1的流速分别上样1、2、4、5、6倍柱体积的苯乳酸溶液,最终得到的苯乳酸回收率的变化如表 8所示。随着上样体积的增大,苯乳酸回收率会随之减小,上样体积在2倍柱体积以内,苯乳酸的回收率能达到95% 以上;上样5倍柱体积时,苯乳酸回收率仍有92.36%;上样体积从5倍柱体积增加到6倍柱体积时,苯乳酸回收率出现明显下降,只有84.61%。从实验结果可以看出,纳米纤维素嵌合型晶胶微球填充柱对苯乳酸具有非常好的吸附效果,是苯乳酸层析分离领域的优质材料。
|
|
表 8 上样体积对苯乳酸回收率的影响 Table 8 Effects of loading volume on phenyllactic acid recovery |
本研究利用多微管反应器,采用结晶致孔-低温聚合方法制备了3种不同纤维素含量的纳米纤维素嵌合型晶胶微球,并对晶胶微球与晶胶微球填充柱基础性能进行了研究,探讨了纳米纤维素嵌合型晶胶微球填充柱对苯乳酸吸附的优化条件,得到的结论如下:
(1) 纳米纤维素嵌合型晶胶微球具有较好的球形度,粒径分布在4~6 mm,内部具有相互连通的大孔结构,孔径分布在10~50 μm;晶胶微球有效孔隙率达70% 以上,绝干孔隙率为87%~91%;接枝后对模型蛋白BSA吸附容量达1.72~4.49 mg⋅mL−1,是生物分离的有效介质。
(2) 纳米纤维素嵌合型晶胶微球填充柱的渗透率在0.53×10−13~1.01×10−13 m2,随着纤维素含量的增加有所下降;等板高度大小在0.005~0.045 cm,具有良好的传质效果;轴向扩散系数Dax随着流速的增加有所变大。
(3) 纳米纤维素嵌合型晶胶微球对苯乳酸的吸附受上样液pH影响。pH为6时吸附容量达到最大,为41.32 mg⋅mL−1,是pH为2时的1.59倍;具有稳定的重复使用性能,上样体积在2倍柱体积以内,苯乳酸的回收率能达到95% 以上,在苯乳酸的层析分离领域具有良好的应用前景。
符号说明:
C
⎯ BSA质量浓度,mg⋅mL−1
E
⎯ 停留时间分布函数,s−1
kw
⎯ 渗透率,m2
UL
⎯ 上样流速,cm⋅min−1
ΔPw
⎯ 压降,Pa
V
⎯ 洗脱液体积,mL
Qe
⎯ 苯乳酸吸附容量,mg⋅mL−1
| [1] |
贾以泽, 舒泉先, 丛瑞涛, 等. 苯乳酸与DNA相互作用及其抑菌机制研究[J]. 食品与发酵工业, 2024, 50(5): 67-74. JIA Y Z, SHU Q X, CONG R T, et al. Interaction between Phenyllactic acid and DNA and its antibacterial mechanism[J]. Food and Fermentation Industries, 2024, 50(5): 67-74. |
| [2] |
WU H, GUANG C E, ZHANG W L, et al. Recent development of Phenyllactic acid: physicochemical properties, biotechnological production strategies and applications[J]. Critical Reviews in Biotechnology, 2023, 43(2): 293-308. DOI:10.1080/07388551.2021.2010645 |
| [3] |
LEE M, KIM D, CHANG J Y. Metabolites of kimchi lactic acid bacteria, indole-3-lactic acid, Phenyllactic acid, and Leucic acid, inhibit obesity-related inflammation in human mesenchymal stem cells[J]. Journal of Microbiology and Biotechnology, 2024, 34(2): 306-313. DOI:10.4014/jmb.2308.08015 |
| [4] |
ZHANG S R, LI C Y, WANG M, et al. Phenyllactic acid maintains the storage quality of 'Zaosu' pears by regulating respiration and energy metabolism[J]. Postharvest Biology and Technology, 2024, 207: 112607. DOI:10.1016/j.postharvbio.2023.112607 |
| [5] |
GÖÇENOĞLU SARIKAYA A, OSMAN B, KARA A. Evaluation of the effectiveness of microparticle-embedded cryogel system in removal of 17 β-estradiol from aqueous solution[J]. Desalination and Water Treatment, 2016, 57(33): 15570-15579. DOI:10.1080/19443994.2015.1075161 |
| [6] |
邵宇, 张显, 胡孟凯, 等. 重组大肠杆菌全细胞催化合成L-苯乳酸[J]. 食品与发酵工业, 2021, 47(14): 1-8. SHAO Y, ZHANG X, HU M K, et al. Synthesis of L-phenyllactic acid catalyzed by recombinant Escherichia coli whole cell biotransformation[J]. Food and Fermentation Industries, 2021, 47(14): 1-8. |
| [7] |
ZHANG J M, ZHANG C C, LEI P, et al. Isolation, purification, identification, and discovery of the antibacterial mechanism of ld-phenyllactic acid produced by Lactiplantibacillus plantarum CXG9 isolated from a traditional Chinese fermented vegetable[J]. Food Control, 2022, 132: 108490. DOI:10.1016/j.foodcont.2021.108490 |
| [8] |
WANG X T, HOU Y, LIU L, et al. A new approach for efficient synthesis of phenyllactic acid from L-phenylalanine: Pathway design and cofactor engineering[J]. Journal of Food Biochemistry, 2018, 42(5): e12584. DOI:10.1111/jfbc.12584 |
| [9] |
PLIEVA F M, GALAEV I Y, NOPPE W, et al. Cryogel applications in microbiology[J]. Trends in Microbiology, 2008, 16(11): 543-551. DOI:10.1016/j.tim.2008.08.005 |
| [10] |
GUAN J T, GUAN Y X, YUN J X, et al. Chromatographic separation of phenyllactic acid from crude broth using cryogels with dual functional groups[J]. Journal of Chromatography A, 2018, 1554: 92-100. DOI:10.1016/j.chroma.2018.04.043 |
| [11] |
PAN M M, SHEN S C, CHEN L, et al. Separation of lactoperoxidase from bovine whey milk by cation exchange composite cryogel embedded macroporous cellulose beads[J]. Separation and Purification Technology, 2015, 147: 132-138. DOI:10.1016/j.seppur.2015.04.026 |
| [12] |
YE J L, YUN J X, LIN D Q, et al. Poly(hydroxyethyl methacrylate)-based composite cryogel with embedded macroporous cellulose beads for the separation of human serum immunoglobulin and albumin[J]. Journal of Separation Science, 2013, 36(24): 3813-3820. DOI:10.1002/jssc.201300911 |
| [13] |
曲兴, 楼小玲, 张颂红, 等. 半疏水基质阴离子交换晶胶对α-酮异己酸的层析吸附特性[J]. 高校化学工程学报, 2022, 36(1): 46-52. QU X, LOU X L, ZHANG S H, et al. Chromatographic and adsorption characteristics of α-ketoisocaproate in semi-hydrophobic anion exchange croygel[J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(1): 46-52. |
| [14] |
关今韬. 布氏乳杆菌转化合成苯乳酸及其晶胶分离特性研究[D]. 杭州: 浙江大学, 2018. GUAN J T. Biosynthesis of phenyllactic acid by Lactobacillus buchneri and the related separation performance with cryogel [D]. Hangzhou: Zhejiang University, 2018. |
| [15] |
WANG J M, SONG H C, REN L F, et al. Study on the preparation of cellulose acetate separation membrane and new adjusting method of pore size[J]. Membranes, 2021, 12(1): 9. DOI:10.3390/membranes12010009 |
| [16] |
ZHANG W, ZHAO F, LI Y B, et al. Suspension and transformation performance of poly(2-hydroxyethyl methacrylate)-based anion exchange cryogel beads with immobilized Lactobacillus paracasei cells as biocatalysts towards biosynthesis of phenyllactic acid in stirred tank bioreactors[J]. Chemical Engineering Research and Design, 2022, 181: 120-131. DOI:10.1016/j.cherd.2021.12.010 |
| [17] |
ZHANG W, YANG Y J, GUAN T T, et al. Formation dynamics of cell-loading alginate droplets in the microtube dripping and cryo-cross-linking process for cell-entrapped cryogel beads as the biocatalysts toward phenyllactic acid biosynthesis[J]. Industrial & Engineering Chemistry Research, 2018, 57(21): 7291-7300. |
| [18] |
DONG S S, CHEN L, DAI B, et al. Isolation of immunoglobulin G from bovine milk whey by poly(hydroxyethyl methacrylate)-based anion-exchange cryogel[J]. Journal of Separation Science, 2013, 36(15): 2387-2393. DOI:10.1002/jssc.201300306 |
| [19] |
周航, 李褀隆, 冯健, 等. 多介质多角度达西实验仪的研制[J]. 中国高新科技, 2017, 1(5): 95-96. ZHOU H, LI Q L, FENG J, et al. Development of multi-media and multi-angle Darcy experimental instrument[J]. China High-Tech, 2017, 1(5): 95-96. |
| [20] |
JAYANTHI K, PAZHANISAMY P. BSA Adsorption and Antibiofilm properties of (N-Cyclohexylacrylamide-co-Acrylamide/AMPSNa) Hydrogels[J]. Journal of Pharmaceutical Research International, 2021, 33(47A): 335-343. |




