光催化技术是解决日益严重的环境污染问题的有效技术手段。通过该技术处理污水具有效率高、无二次污染等优点。在现有的光催化剂中,TiO2因具有无毒、廉价以及抗腐蚀性强等优点而得到广泛关注。基于TiO2的光催化剂已经在污水处理[1]、空气净化[2]等方面得到深入的研究。但是TiO2只有在紫外光下才能激发,同时,激发后产生的电子和空穴复合率高,光子利用率低。
传统纳米TiO2的制备方法主要有水热法[3]、气相沉积法[4]。这些方法常常需要高温高压的反应条件,对反应器要求较高。在各种改进的纳米粒子制备方法中,反相微乳液法是在常温常压温和条件下制备纳米TiO2的有效方法[5]。微乳液是一个动态的胶束体系,这些胶束相互碰撞,并且进行物质的交换,为化学反应的进行提供了必要条件。这些由胶束组成的“微反应器”尺寸分布在1~10 nm,纳米粒子的形成与生长被限制在这些“微反应器”内,从而可以在适当条件下获得粒径分布较为均匀的纳米粒子[6]。
目前,诸多提高TiO2光催化活性的方法已经被报道,比如贵金属沉积[7]、半导体复合[8]、离子掺杂[9]以及染料敏化[10]等。石墨烯是2004年被发现的一种二维片状碳原子晶体材料,它具有比其他碳材料更加优良的导电、热学以及机械性能[11]。石墨烯的制备方法主要可分为四大类:机械剥离法、化学气沉积法、化学剥离法和化学合成法[12]。目前,多采用Hummers法制备氧化石墨烯[13]。因石墨烯具有优良的电子传输性能,将其与光催化剂TiO2复合后,不但可以减少光照激发后电子与空穴的复合几率,而且石墨烯的加入可以在一定程度上调节TiO2的禁带宽度,拓宽其对激发光源的响应范围,从而提高TiO2对光的利用率。
本文首先通过微乳液法制备粒径分布较为均匀的TiO2纳米粒子,并使用Hummers法制备氧化石墨烯。然后通过溶剂热法将TiO2与氧化石墨烯复合改性,获得TiO2-石墨烯 (TiO2-RGO) 复合光催化剂。最后,对制取的TiO2及TiO2-RGO复合催化剂进行了分析表征,并以甲基橙溶液为模拟污染物,对催化剂的催化活性进行了评价。
2 实验部分 2.1 试剂十八烷基三甲基氯化铵 (OTAC,AR),环己烷 (AR),正丁醇 (AR),钛酸四丁酯 (CP),浓硫酸 (AR),浓盐酸 (AR),高锰酸钾 (AR),过氧化氢 (30%,AR),硝酸钠 ((AR),甲基橙 (AR),无水乙醇 (AR),以上试剂均购于国药集团化学试剂有限公司。325目石墨粉 (AR) 购自阿拉丁试剂 (上海) 有限公司。实验用水均为去离子水。
2.2 TiO2-RGO纳米复合材料的制备 2.2.1 微乳液法制备纳米TiO21.5 g十八烷基三甲基氯化铵 (OTAC)、100 mL环己烷、6 mL正丁醇与一定量的去离子水 (水与OTAC的摩尔比为20) 混合配制微乳液,搅拌均匀形成透明体系,将钛酸丁酯逐滴缓慢加入微乳液中,继续搅拌,25℃恒温12 h后,离心分离,使用无水乙醇与去离子水洗涤除去TiO2表面吸附的有机物后,置于干燥箱中,60℃干燥,然后将制备的TiO2分别在350、450、550和650℃下于空气气氛中焙烧2 h。
2.2.2 GO的合成采用Hummers法制备氧化石墨烯[13]。具体制备过程如下:取50 mL浓H2SO4冷却到4℃以下,缓慢加入2 g石墨粉和1.0 g硝酸钠, 1 h后加入6 g高锰酸钾,保持温度在10℃以下反应2 h后移至恒温水浴锅中,在38℃反应30 min,整个过程保持搅拌;该阶段反应结束后,往混合液中缓慢加入100 mL去离子水,并控制体系温度90℃左右,反应30 min后,缓慢加入一定量的H2O2溶液,直至溶液呈现金黄色。反应后的溶液离心分离,并使用5%的稀盐酸与去离子水洗涤数次,洗涤后的氧化石墨烯置于干燥箱中60℃干燥备用。
2.2.3 TiO2-RGO纳米复合材料的制备室温下,量取40 mL去离子水与20 mL无水乙醇置于100 mL烧杯中,然后称取12.5 mg氧化石墨烯置于上述混合液中。25℃条件下,超声1 h得到均匀分散的氧化石墨烯混合液,然后加入0.25 g在450℃焙烧2 h的TiO2,保持体系温度在25℃,继续超声1 h,使TiO2在混合液中均匀分散,接着将烧杯取出置于磁力搅拌器上,室温下以500 r·min-1搅拌1 h,使其各相充分混合,最后将其转移到100 mL水热反应釜中,120℃反应5 h后,将混合液离心分离,所得催化剂使用去离子水洗涤后,置于干燥箱中60℃干燥,即得石墨烯掺杂质量分数为5%的TiO2-RGO复合光催化剂。
2.3 光催化实验光催化降解甲基橙的实验在石英冷阱夹套式反应器中进行,光源为500 W的低压汞灯,发光主波长为365 nm。反应过程中,向冷阱中通入循环水带走光源所散发的热量,保证反应在恒温条件下进行,同时反应器外层以铝箔包覆,以避免紫外光散射造成能量损失。准确称取0.1 g的催化剂置于250 mL浓度为40 mg·L-1的甲基橙溶液中。催化剂加入后,将混合液置于暗箱中搅拌处理30 min,使甲基橙在催化剂表面达到吸附-解吸平衡,然后将其在搅拌条件下光照反应2 h,每隔15 min取样一次,将其离心分离获取上清液后,通过紫外可见分光光度计对甲基橙的浓度进行分析。甲基橙的去除率由式 (1) 计算:
| $\eta =\frac{{{C}_{0}}-C}{{{C}_{0}}}\times 100\%$ | (1) |
式中C0为甲基橙的初始浓度,C为光照反应不同时间后的甲基橙浓度。
2.4 结构与性能表征催化剂的晶型表征使用荷兰帕纳科公司X'pert PROMPD型X射线衍射仪,Cu Kα辐射,连续扫描方式采样,扫描范围为5~75°。使用NEXUS FT-IR红外光谱仪表征样品的化学结构,扫描范围400~4000 cm-1。采用日本电子JEM-2100UHR型透射电子显微镜对样品进行粒径以及形貌的分析。催化剂的紫外可见漫反射光谱通过U-4100紫外可见光谱仪测定,采用积分球附件,扫描范围200~800 nm,以标准BaSO4粉末作为参比。催化剂拉曼光谱的测量使用DXR Microscope-拉曼光谱仪。荧光光谱在FluoroMax 4-荧光光谱仪上进行,激发光源为氙灯,激发波长取280 nm。使用上海佑科UV752紫外可见分光光度计测量甲基橙溶液在λ=464 nm处的吸光度。
3 结果与讨论 3.1 XRD分析图 1所示为不同焙烧温度下所制备TiO2的XRD谱图。60℃干燥后未经焙烧的TiO2晶型不明显,主要为无定型态。350℃焙烧2 h后,在25.3°出现了较为明显的锐钛矿衍射峰,随着焙烧温度的升高,TiO2的结晶度增大,衍射峰的强度越来越强。当焙烧温度升高到550℃时,谱图中开始出现了微弱的金红石型TiO2的衍射峰,随着焙烧温度的升高,金红石相所占的比例越来越高。TiO2中金红石相所占的比例可通过式 (2) 所示的经验关系式计算[14]
| $R(T)=0.679\frac{{{I}_{\text{R}}}}{{{I}_{\text{R}}}+{{I}_{\text{A}}}}+0.312{{(\frac{{{I}_{\text{R}}}}{{{I}_{\text{R}}}+{{I}_{\text{A}}}})}^{2}}$ | (2) |
式中R(T) 为不同焙烧温度下金红石相所占的比例,IA和IR分别代表的锐钛矿 (101) 和金红石 (110) 的衍射峰强度。计算如表 1所示。
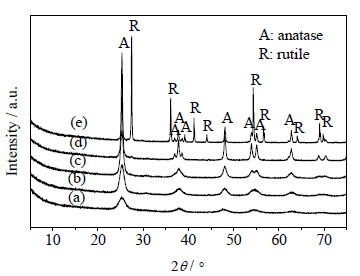
|
图 1 不同焙烧温度下TiO2的XRD谱图 Fig.1 XRD patterns of TiO2 samples calcined at different temperatures (a) no calcined (b) 350℃ (c) 450℃ (d) 550℃ (e) 650℃ |
| 表 1 不同焙烧温度TiO2的晶型及晶粒尺寸 Table 1 Crystal structure and size of TiO2 calcined at different temperatures |
除此之外,由图 1还可以看出,随着焙烧温度的升高,TiO2的衍射峰宽变窄,峰形越来越尖锐,说明TiO2的晶粒尺寸逐渐变大。TiO2的晶粒尺寸通过式 (3) 的谢乐公式计算[15]:
| $d=\frac{k\lambda }{\beta \text{cos}\theta }$ | (3) |
式中k为常数, λ为x射线的波长,θ为衍射角,本文选取TiO2中锐钛矿101晶面与金红石110晶面的衍射角进行计算,β为对应衍射峰的半峰宽。计算结果也列入表 1。由表中数据可以看出,350℃焙烧2 h后,TiO2的晶粒尺寸为10 nm。随着焙烧温度的升高,TiO2的晶粒逐渐长大,并且温度越高,晶粒长大的速率越快。由表还可以看出,所得金红石型TiO2的晶粒尺寸明显大于锐钛矿型TiO2的晶粒尺寸。
图 2所示为GO、TiO2以及石墨烯掺杂质量为5%的TiO2-RGO的XRD谱图。由图可以看出,GO在10.5°出现了强而尖锐的特征衍射峰。此外,GO在25.6°出现的微弱的衍射峰说明样品中存在少量的未氧化的石墨粉[16]。由TiO2与TiO2-RGO的谱图可以看出,两者的特征衍射峰完全重合,说明在水热反应过程中TiO2没有新相的生成。通过谢乐公式计算水热反应后TiO2-RGO复合物中TiO2的晶粒尺寸,发现水热过程中TiO2也没有明显变化。除此之外,在TiO2-RGO复合物中,没有检测到GO的特征衍射峰,说明在水热反应的过程中,GO已经被还原为RGO。而在TiO2-RGO复合物中,并没有出现RGO的特征衍射峰,可能是由于复合物中RGO的掺杂量太少而难以检测到,或者是被TiO2在25.3°的强衍射峰屏蔽遮掩而没有观察到[17]。
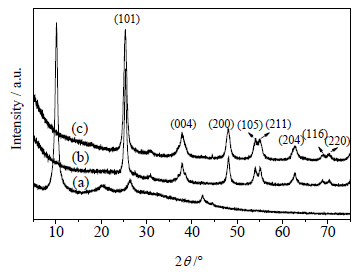
|
图 2 GO、TiO2与TiO2-RGO的XRD谱图 Fig.2 XRD patterns of GO, TiO2 and TiO2-RGO (a) GO (b) TiO2 (c) TiO2-RGO |
图 3所示为GO、TiO2以及石墨烯掺杂质量为5%的TiO2-RGO的FT-IR图。由图可以看出,制备的GO表面具有许多含氧官能团。1052 cm-1处的峰为C-O-C中C-O的伸缩振动引起的;1224 cm-1处的峰为C-OH的伸缩振动引起的;1404 cm-1处的吸收峰是由于C-OH中的O-H的扭曲振动引起的[18]。1622 cm-1处的吸收峰是由于O-H的伸缩振动或共轭C=C键的振动引起的;1732 cm-1处的峰为COOH中C=O的伸缩振动,并且这些羧基官能团位于氧化石墨烯片层的边缘处[19]。除此之外,由图还可以看出,TiO2与TiO2-RGO的谱图相似,二者在3000~3700 cm-1处宽的吸收峰和1622 cm-1处较窄的吸收峰都是由于O-H的伸缩振动与O-H的弯曲振动引起的,说明催化剂表面吸附有一定量的水[20]。TiO2在400~800 cm-1处宽的吸收峰为Ti-O-Ti键的伸缩振动。TiO2-RGO在1622 cm-1处的吸收峰是由于O-H的伸缩振动和石墨烯的骨架振动引起的,而且在复合物中没有观察到GO含氧官能团的峰,说明在水热反应的过程中,GO已经被充分还原为RGO[21],由此也可以进一步解释在TiO2-RGO复合物的XRD谱图中,没有检测到GO特征衍射峰的原因。
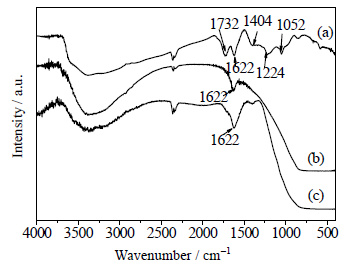
|
图 3 GO、TiO2和TiO2-RGO的FT-IR图 Fig.3 FT-IR spectra of GO, TiO2 and TiO2-RGO (a) GO (b) TiO2 (c) TiO2-RGO |
图 4所示为不同处理条件下TiO2与石墨烯掺杂质量为5%的TiO2-RGO的TEM图。其中图 (a) 为未焙烧TiO2的TEM图片,由图可以看出,未经焙烧的TiO2的粒径分布较为均匀,大部分集中在6~8 nm,说明通过微乳液法在常温常压的温和条件下可以制备出粒径分布均匀的纳米粒子。(b) 图所示为450℃焙烧2 h的TiO2的TEM图,由图可以看出,焙烧2 h后,TiO2的晶粒尺寸变大,其粒径大都分布在10~15 nm,与XRD分析中通过谢乐公式计算的晶粒尺寸基本一致。图 (c) 所示为450℃焙烧2 h的TiO2的HRTEM图,由图可以看出,450℃焙烧2 h得到TiO2的晶格发育完全,可以观察到TiO2明显的101晶面的晶格条纹。(d) 图为TiO2-RGO复合催化剂的TEM图,由图可以清晰看到石墨烯的片层结构,这种结构在一定程度上可以抑制TiO2粒子的团聚,使得TiO2与石墨烯复合后,TiO2粒子分散的更为均匀[22]。

|
图 4 TiO2与TiO2-RGO的TEM图 Fig.4 TEM micrographs of TiO2 and TiO2-RGO |
图 5所示为TiO2与石墨烯掺杂质量为5%的TiO2-RGO的紫外可见漫反射图谱。
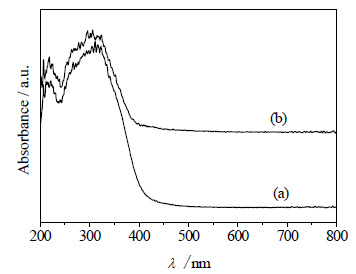
|
图 5 TiO2和TiO2-RGO的UV-Vis光谱图 Fig.5 UV-Vis spectra of TiO2 and TiO2-RGO UV-Vis spectra of TiO2 and TiO2-RGO |
由图可以看出,TiO2在350~400 nm存在明显吸收,并且与纯TiO2相比,TiO2-RGO复合催化剂的吸收强度有所上升,这是由于RGO的加入引起的[23]。而且TiO2与RGO复合后,催化剂的吸收带边明显红移,从而降低了催化剂的能带宽度,拓宽了TiO2对光源的响应范围,提高了光的利用效率[24]。催化剂的能带宽度可由式 (4) 作图计算[22]:
| $A=\frac{K{{(h\nu -{{E}_{g}})}^{n}}}{h\nu }$ | (4) |
式中A是吸收系数,K是常数,Eg是能带宽度值,n由半导体的性质决定。利用 (Ahv)2~hv作图,得图 6,由该图可以得出,TiO2的能带宽度为3.06 eV,TiO2-RGO复合催化剂的能带宽度降低为2.92 eV。该实验所得纯TiO2的能带宽度低于相关文献中报道的3.2 eV[25],原因可能是光子捕获引发的表面光散射导致的[26]。
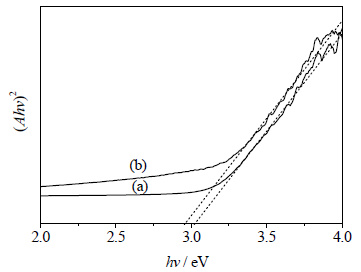
|
图 6 图 6 (Ahv)2~hv的曲线图 Fig.6 Profiles of (Ahv)2 as a function of hv (a) TiO2 (b) TiO2-RGO |
拉曼光谱是表征碳材料晶体结构的有效方法。图 7所示,为GO与石墨烯掺杂质量为5%的TiO2-RGO的拉曼谱图。图中在1341 cm-1处出现的峰是由于碳原子的sp3杂化引起的,与石墨烯的边缘结构、表面缺陷以及碳原子的无序程度有关,称为D带;而在1582 cm-1处的峰是由于碳原子sp2平面振动引起的,称为G带,两者的比值ID/IG可以反映石墨烯或GO表面碳原子的排列无序度及缺陷[27]。通过计算可得,GO的D带与G带的强度比是0.95,经溶剂热反应5 h后,TiO2-RGO复合催化剂中D带与G带的强度比增大为1.13,表明氧化石墨在水热反应的过程中被还原[28],由此也可以说明在TiO2-RGO复合催化剂的XRD与FTIR谱图中没有观察到GO特征峰的原因。除此之外,样品TiO2-RGO在395、512、629 cm-1位置出现了3个拉曼峰,归属于锐钛矿TiO2的B1g、A1g、Eg带的振动[29]。
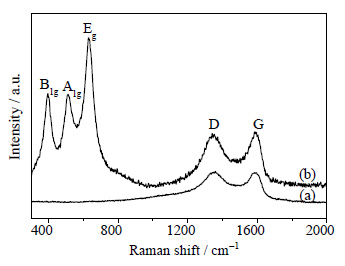
|
图 7 GO和TiO2-RGO的拉曼谱图 Fig.7 Raman spectra of GO and TiO2-RGO nanocomposite (a) GO (b) TiO2-RGO |
由于光催化剂的催化活性不仅与激发光的强度和波长范围有关系,而且也与电子与空穴的复合几率有关。荧光光谱可以表征载流子在半导体表面的俘获、迁移和传输效率,从而研究半导体中电子空穴对的复合。催化剂受一定波长的光源激发后,发光的强度越低,表明电子与空穴的复合几率越低[30, 31]。图 8所示为纯TiO2与石墨烯掺杂质量为5%的TiO2-RGO的荧光光谱,由图可以看出,在380 nm附近,TiO2的发光强度明显强于TiO2-RGO的强度,表明TiO2与石墨烯复合后,二者已经有效的键合在了一起,激发电子可以高效地由TiO2传输到石墨烯,从而降低电子空穴对的复合几率,进而提高催化剂的催化效率。
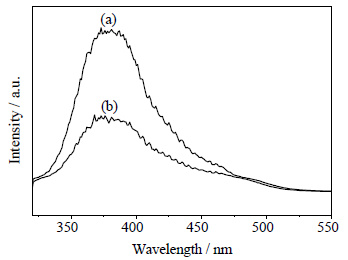
|
图 8 TiO2和TiO2-RGO的荧光光谱 Fig.8 Fluorescent spectra of TiO2 and RGO-TiO2 (a) TiO2 (b) TiO2-RGO |
图 9所示为不同焙烧温度的TiO2对甲基橙的去除曲线图。横坐标0~30 min表示首先将加入催化剂的甲基橙溶液置于暗箱中搅拌30 min,使甲基橙在催化剂表面达到吸附-解吸平衡,30~150 min表示光照条件下催化降解的反应时间。由图可以看出,不加催化剂,只在光源照射下,甲基橙在紫外光照2 h后仅去除了9.3%。加入0.1 g的TiO2光催化剂后,甲基橙的去除效果明显增强。其中450℃焙烧TiO2的催化活性最高,光照2 h后可以将95.3%的甲基橙去除,550℃焙烧TiO2的催化活性次之,光照2 h后可以达到89.4%,而350℃与650℃焙烧获得的TiO2的催化活性均相对较低,2 h后的去除率仅为64.6%与66.5%。TiO2作为光催化剂,主要有锐钛矿和金红石两种晶型,其锐钛矿相对有机物的吸附能力要强于金红石型的TiO2,而且光照激发后,锐钛矿型TiO2中电子与空穴的复合几率要小于金红石型的TiO2[32]。除此之外,结晶过程中锐钛矿具有较小的晶粒尺寸,这使得其具有更大的比表面积,有利于催化反应的进行[33],通过前述的XRD分析,可以证实金红石型的晶粒尺寸明显大于锐钛矿的晶粒尺寸。这些因素使得锐钛矿型的TiO2与金红石型的TiO2相比,具有更高的催化活性,所以450℃焙烧的TiO2的催化活性要优于550℃与650℃焙烧条件下获得的TiO2,而且金红石相所占的比例越高,催化剂的活性越低,这与XRD的分析结果一致。350℃焙烧条件下获得的TiO2结晶度较低,导致该温度下焙烧获得的TiO2的催化活性也相对较低。
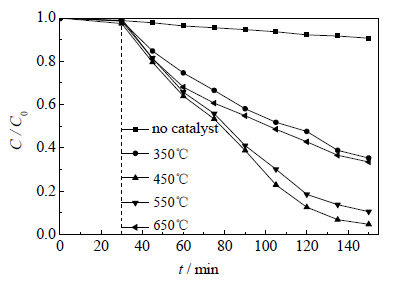
|
图 9 不同焙烧温度下TiO2对MO的去除曲线 Fig.9 MO removal profiles of TiO2 calcined at different temperatures |
图 10所示为450℃焙烧TiO2与石墨烯掺杂质量为5%的TiO2-RGO复合催化剂对甲基橙的去除曲线图。由图可以看出,通过溶剂热法制取的TiO2-RGO复合催化剂在紫外光照1 h后,甲基橙的去除率即可达到95.3%,光照2 h后的去除率可以达到99.1%,几乎完全被去除。而最佳焙烧温度下的纯TiO2在光照1 h后的去除率仅为61.1%,由此看出,TiO2-RGO复合催化剂的催化活性明显优于纯TiO2。而且黑暗条件下处理30 min过后,加入等量TiO2-RGO复合光催化剂的一组甲基橙的浓度明显下降。这是由于石墨烯表面有大量的π-π共轭双键,大量的甲基橙有机分子吸附在TiO2-RGO催化剂的表面,形成一个甲基橙浓度相对较高的富集中心,从而提高了催化剂对甲基橙的催化效率。由此可见,RGO在TiO2-RGO复合催化剂的作用主要体现在以下两个方面:一方面,石墨烯具有极其优良的导电性能,可以有效减少光照激发后TiO2中的电子和空穴的复合几率,提高催化剂对光源的利用率;另一方面主要是RGO对染料分子的吸附作用[34]。
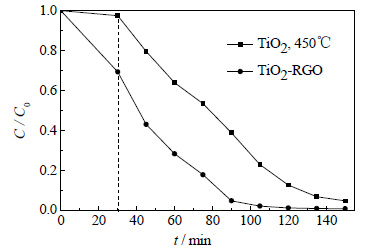
|
图 10 TiO2和TiO2-RGO对MO的去除曲线 Fig.10 MO removal profiles of TiO2 and TiO2-RGO |
本文首先通过微乳液法在常温常压的温和条件下制备了粒径分布均匀的纳米TiO2,然后将其在不同温度下焙烧,获得了催化活性较高的锐钛矿TiO2。在紫外光照射下,450℃条件下焙烧的TiO2在2 h内对甲基橙的去除率可以超过90%。为进一步提高TiO2的催化活性,将最佳焙烧温度下的TiO2与使用Hummers法制备的氧化石墨烯通过溶剂热法复合。在同样的条件下,复合后的催化剂与纯TiO2相比,催化活性明显提高,所制取的TiO2-RGO复合催化剂在1 h内对甲基橙的去除率就可以超过90%。这主要是因为石墨烯具有优良的电子传输性能,可以为光生电子的传输提供路径,降低TiO2激发后电子-空穴对的复合,除此之外,石墨烯还具有优良的吸附性能,这些因素都很大程度上提高了TiO2的光催化活性。由此可见,通过溶剂热法掺杂石墨烯对光催化剂进行改性是一种提高其催化活性行之有效的方法。
| [1] | Nor N A M, Jaafar J, Ismail A F, et al. Preparation and performance of PVDF-based nanocomposite membrane consisting of TiO2, nanofibers for organic pollutant decomposition in wastewater under UV irradiation[J]. Desalination , 2016, 391: 89-97. DOI:10.1016/j.desal.2016.01.015. |
| [2] | Chun H H, Jo W K. Adsorption and photocatalysis of 2-ethyl-1-hexanol over graphene oxide-TiO2 hybrids post-treated under various thermal conditions[J]. Applied Catalysis B Environmental , 2015, 180: 740-750. |
| [3] | YAN Wen-yuan(言文远), ZHOU Qi(周琪), CHEN Xing(陈星), et al. Preparation of reduced graphene oxide/nano TiO2 composites by two-step hydrothermal method and their photocatalytic properties(两步水热法制备还原氧化石墨烯/纳米TiO2复合材料及其光催化性能)[J]. Acta Materiae Compositae Sinica(复合材料学报) , 2016, 33(1): 123-131. |
| [4] | WU Jin-ling(吴金玲), XIE Hong-yong(谢洪勇), YANG Hai-feng(杨海峰). Research on nitrogen doped TiO2 nano-particles prepared by flame chemical vapor deposition(火焰化学气相沉积法制备氮掺杂纳米TiO2研究)[J]. China Powder Science and Technology(中国粉体技术) , 2011, 17(2): 57-60. |
| [5] | Zubieta C E, Soltero-Martínez J F A, Luengo C V, et al. Preparation, characterization and photoactivity of TiO2, obtained by a reverse microemulsion route[J]. Powder Technology , 2011, 212(3): 410-417. DOI:10.1016/j.powtec.2011.06.017. |
| [6] | Keswani R K, Ghodke H, Sarkar D, et al. Room temperature synthesis of titanium dioxide nanoparticles of different phases in water in oil microemulsion[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects , 2010, 369(1-3): 75-81. |
| [7] | YU Ling-min(喻灵敏), ZHU Rong-shu(朱荣淑), DONG Wen-yi(董文艺). Photocatalytic removal of bromates with noble metal-Modified titanium dioxide(贵金属改性二氧化钛光催化去除溴酸盐)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(4): 928-933. |
| [8] | DONG Yuan(董源), JIANG Qi-zhong(蒋淇忠), YANG Kai(杨开), et al. Preparation of CdS-TiO2NT composite catalysts by microwave irradiation method and its phtocatalytic performance of splitting water to H2 under visible light(微波法制备CdS-TiO2NT复合催化剂及其在可见光下分解水制氢的性能)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2010, 24(3): 416-421. |
| [9] | CHENG Zhuo-wei(成卓韦), ZHOU Ling-jun(周灵俊), YU Jian-ming(於建明), et al. Mechanism study on gaseous α-pinene photocatalyzed by lanthanum-doped titanium dioxide nanotubes(镧掺杂TiO2纳米管对α-蒎烯光催化性能及催化机理研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(2): 320-327. |
| [10] | Ping W, Jin W, Ming T, et al. Dye-sensitization-induced visible-light reduction of grapheneoxide for the enhanced TiO2 photocatalytic performance[J]. Acs Applied Materials & Interfaces , 2013, 5(8): 2924-2929. |
| [11] | Novoselov K S, Geim A K, Morozov S V, et al. Electric field effect in atomically thin carbon films[J]. Science , 2004, 306(5696): 666-669. DOI:10.1126/science.1102896. |
| [12] | REN Fang(任芳), ZHU Guang-ming(朱光明), REN Peng-gang(任鹏刚). The latest advances in preparation and application of nano graphene composites(纳米石墨烯复合材料的制备及应用研究进展)[J]. Acta Materiae Compositae Sinica(复合材料学报) , 2014, 31(2): 263-272. |
| [13] | Hummers W S, Offeman R E. Preparation of graphitic oxide[J]. Journal of the American Chemical Society , 1958, 80(6): 1339. DOI:10.1021/ja01539a017. |
| [14] | Chen D, Yang D, Qun Wang A, et al. Effects of boron doping on photocatalytic activity and microstructure of titanium dioxide nanoparticles[J]. Industrial & Engineering Chemistry Research , 2006, 45(12): 4110-4116. |
| [15] | He J, Ye J, Lavernia E J, et al. Quantitative analysis of grain size in bimodal powders by x-ray diffraction and transmission electron microscopy[J]. Journal of Materials Science , 2004, 39(23): 6957-6964. DOI:10.1023/B:JMSC.0000047538.95825.ad. |
| [16] | Trapalis A, Todorova N, Giannakopoulou T, et al. TiO2/graphene composite photocatalysts for NOx removal:a comparison of surfactant-stabilized graphene and reduced graphene oxide[J]. Applied Catalysis B:Environmental , 2016, 180: 637-647. DOI:10.1016/j.apcatb.2015.07.009. |
| [17] | Hong T, Liang X, Zhang Q, et al. Enhanced photoactivity of graphene/titanium dioxide nanotubes for removal of Acetaminophen[J]. Applied Surface Science , 2015, 324: 258-264. DOI:10.1016/j.apsusc.2014.10.129. |
| [18] | Adamu H, Dubey P, Anderson J A. Probing the role of thermally reduced graphene oxide in enhancing performance of TiO2, in photocatalytic phenol removal from aqueous environments[J]. Chemical Engineering Journal , 2016, 284: 380-388. DOI:10.1016/j.cej.2015.08.147. |
| [19] | Hou C, Zhang Q, Li Y, et al. P25-graphene hydrogels:room-temperature synthesis and application for removal of methylene blue from aqueous solution[J]. Journal of Hazardous Materials , 2012, 205(1): 229-235. |
| [20] | Wang H, Wan J, Zheng X, et al. The visible light degradation activity and the photocatalytic mechanism of tetra (4-carboxyphenyl) porphyrin sensitized TiO2[J]. Materials Research Bulletin , 2014, 57(23): 311-319. |
| [21] | Liu J, Lin W, Tang J, et al. Photocatalytic degradation of commercially sourced naphthenic acids by TiO2-graphene composite nanomaterial[J]. Chemosphere , 2016, 149: 328-335. DOI:10.1016/j.chemosphere.2016.01.074. |
| [22] | Pant B, Saud P S, Park M, et al. General one-pot strategy to prepare Ag-TiO2 decorated reduced graphene oxide nanocomposites for chemical and biological disinfectant[J]. Journal of Alloys & Compounds , 2016, 671: 51-59. |
| [23] | Miao Y, Zhai Z, Jiang L, et al. Facile and new synthesis of cobalt doped mesoporous TiO2 with high visible-light performance[J]. Powder Technology , 2014, 266(6): 365-371. |
| [24] | Tan L L, Ong W J, Chai S P, et al. Noble metal modified reduced graphene oxide/TiO2 ternary nanostructures for efficient visible-light-driven photoreduction of carbon dioxide into methane[J]. Applied Catalysis B:Environmental , 2015, s166-167: 251-259. |
| [25] | Serpone N. Is the band gap of pristine TiO2 narrowed by anion-and cation-doping of titanium dioxide in second-generation photocatalysts?[J]. Journal of Physical Chemistry B , 2006, 110(48): 24287-24293. DOI:10.1021/jp065659r. |
| [26] | Dvoranová D, Brezová V, Mazúr M, et al. Investigations of meta-doped titanium dioxide photocatalysis[J]. Applied Catalysis B Environmental , 2002, 37(2): 91-105. DOI:10.1016/S0926-3373(01)00335-6. |
| [27] | Gao Y, Pu X, Zhang D, et al. Combustion synthesis of graphene oxide-TiO2, hybrid materials for photodegradation of methyl orange[J]. Carbon , 2012, 50(11): 4093-4101. DOI:10.1016/j.carbon.2012.04.057. |
| [28] | Fu L. Carbon nanotube and graphene oxide directed electrochemical synthesis of silver dendrites[J]. Rsc Advances , 2014, 4(75): 39645-39650. DOI:10.1039/C4RA06156J. |
| [29] | Huang X, Yin Z, Wu S, et al. Graphene-based materials:synthesis, characterization, properties, and applications[J]. Small , 2011, 7(14): 1876-1902. DOI:10.1002/smll.201002009. |
| [30] | Wu N, Wang J, Tafen D N, et al. Shape-enhanced photocatalytic activity of single-crystalline anatase TiO2(101) nanobelts[J]. Journal of the American Chemical Society , 2010, 132(19): 6679-6685. DOI:10.1021/ja909456f. |
| [31] | Jing L, Yang Z Y, Zhao Y F, et al. Ternary polyaniline-graphene-TiO2 hybrid with enhanced activity for visible-light photo-electrocatalytic water oxidation[J]. Journal of Materials Chemistry A , 2013, 2(4): 1068-1075. |
| [32] | Li H S, Xu H, Wang S Y, et al. Preparation of nano-TiO2 using a sol-gel process mediated in reverse microemulsion combined with a solvent thermal technique[J]. Advanced Materials Research , 2011, 287-290: 1731-1734. DOI:10.4028/www.scientific.net/AMR.287-290. |
| [33] | TANG Yu-chao(唐玉朝), LI Wei(李薇), HU Chun(胡春), et al. Studies on morphological structure and photoactivity of TiO2 heterogeneous photocatalysts(TiO2形态结构与光催化活性关系的研究)[J]. Progress in Chemistry(化学进展) , 2003, 15(5): 379-384. |
| [34] | QI Qi(齐齐), WANG Yu-qiao(王育乔), WANG Sha-sha(王莎莎), et al. Preparation of reduced graphene oxide/TiO2 nanocomposites and their photocatalytic propertirs(还原氧化石墨烯/TiO2纳米复合物制备及其光催化性能)[J]. Acta Physico-Chimica Sinica(物理化学学报) , 2015, 31(12): 2332-2340. |




