3, 6-二氯水杨酸[1, 2],是制备农药除草剂麦草畏的主要有机中间体。近年来随着温室气体减排和环保要求的不断提高以及绿磺隆和甲磺隆制剂的禁用和限制使用,广泛应用于农作物生产的低毒农药麦草畏的需求不断增加,市场前景良好。因此,研究3, 6-二氯水杨酸的绿色合成方法,可对低毒、高效的除草剂麦草畏提供技术支撑。
合成3, 6-二氯水杨酸,首先要合成重要中间体2, 5-二氯苯酚。目前,合成方法主要有以下3种:(1) Sidney等[3, 4]以1, 2, 4-三氯苯为原料合成的方法。此工艺路线短,方法简单,但是反应过程中会使用大量的酸和碱,产生大量的工业三废,且产物为同分异构体的混合物,给提纯带来了困难。(2) 章小波、蒋永祥等[5~7]以2, 5-二氯苯胺为原料,经过重氮化及水解反应生成2, 5-二氯苯酚,该过程会使用大量的硫酸和亚硝酸盐,对设备腐蚀严重,污染环境,能耗高,难以回收利用和处理,不适合当今的绿色化生产。(3) 美国专利[8~16]报道用对二氯苯羟基化制备2, 5-二氯苯酚,但没有确定适宜反应过程。因此,鉴于它在农药合成中具有良好的应用前景,为该化合物开发一种简单实用、高效经济的绿色合成新方法是十分重要的。为此,本文选择以对二氯苯为原料、过氧化氢为氧化剂[17, 18],V2O5为催化剂,一步法催化氧化合成2, 5-二氯苯酚。考察了不同溶剂、催化剂用量、助催化剂用量、氧化剂用量、反应温度、以及反应时间对羟基化反应收率的影响, 确定了羟基化的适宜反应条件。2, 5-二氯苯酚再经过成盐脱水,通CO2羧基化,盐酸酸化等步骤合成3, 6-二氯水杨酸。考察了羧基化[19~21]反应条件,确定了适宜工艺路线。
2 实验 2.1 仪器与材料AVANCE Ⅲ型400 MHz核磁共振波谱仪 (瑞士Bruker公司);SHIMADZU GCMS-QP2010型质谱仪 (日本岛津);CP 3800型气相色谱仪 (美国瓦里安公司);WTERS 515型高效液相色谱仪 (美国Waters公司);XT4-100X型显微熔点测定仪 (上海申光仪器仪表有限公司)。
对二氯苯、30%(wt) 过氧化氢、85%磷酸、草酸、五氧化二钒、醋酸、丙酮、甲醇、四氢呋喃、乙腈、乙酸乙酯、对二甲苯、氢氧化钾、碳酸钾、盐酸 (分析纯,国药集团化学试剂有限公司)。
2.2 实验方法 2.2.1 2, 5-二氯苯酚的合成对二氯苯 (14.7 g,0.1 mol) 溶于醋酸 (100 mL) 中,搅拌升温至30℃,依次加入草酸 (0.9 g,0.01 mol),85%磷酸 (15 mL,0.25 mol)。溶解后,加入五氧化二钒 (0.23 g,1.25 mmol)。搅拌下缓慢滴加30%(wt) 过氧化氢 (57 mL,0.5 mol)。反应10 h,抽滤,用醋酸洗涤滤饼,滤液合并,滴加亚硫酸氢钠分解多余过氧化氢。加水使未反应的对二氯苯析出,抽滤,收集滤饼,干燥,得4 g未反应的对二氯苯 (杂质多,需提纯)。滤液用乙酸乙酯萃取4次,合并有机相,旋蒸去除乙酸乙酯。收集干燥得6.4 g白色针状晶体,即2, 5-二氯苯酚,收率39.3%.
2.2.2 3, 6-二氯水杨酸的合成2, 5-二氯苯酚 (5 g,0.03067 mol) 溶于对二甲苯 (45 mL) 中,70 ℃下缓慢滴加KOH (2.227 g,0.04 mol) 溶液。滴加完毕后,升温至90 ℃反应1 h,利用分水器回流脱水。继续反应4 h,直至水完全脱干,收集2.34 g水。同时蒸干溶剂,得2, 5-二氯苯酚盐。
将上述生成的苯酚盐转移至高压反应釜中,加入碳酸钾 (6.4 g,0.046 mol),加入对二甲苯 (5 mL),置换二氧化碳3次 (每次2 MPa)。通CO2至4 MPa,搅拌反应1 h,压力降至3.4 MPa,开启加热。当温度达到160 ℃时,压力升至6 MPa,维持压力6 MPa继续反应4 h。反应结束后,放空反应釜,加入去离子水,80 ℃下搅拌溶解,分层,分别取上下两相。
上层油相,140 ℃下回收对二甲苯。加水溶解,再加入28.8%的HCl (15 mL,自配),至pH=2~3,140℃下进行水蒸气蒸馏,收集干燥,得0.05 g未反应的2, 5-二氯苯酚。抽滤,收集滤饼,于70℃烘箱干燥10 h,得0.1072 g灰白色固体3, 6-二氯水杨酸。
下层水相转移至三口烧杯中,冷却至室温,滴加28.8%的HCl (15 mL,自配),至pH=2~3,140℃下水蒸气蒸馏。102℃时,开始有原料蒸出,直至原料全部蒸出,干燥,称重,得0.68 g未反应的2, 5-二氯苯酚。关闭加热,静置冷却8 h,抽滤,收集滤饼,于70℃烘箱干燥10 h,得4.25 g灰白色固体,即3, 6-二氯水杨酸。收率79.7%(扣除未反应的原料)。
2.3 产物结构表征2, 5-二氯苯酚:m.p.56℃~58℃ (m.p.56℃~58 ℃[22]); 1H-NMR (acetone-d6, 400 MHz) δ: 0.78 (t, J=8 Hz, 3H), 1.07 (d, J=8 Hz, 3H), 2.96(s, 1H), .36~7.34 (m, 1H), 6.90~7.10 (m, 1H); 13C-NMR (acetone-d6, 100 MHz)δ:189.92, 153.18, 151.96, 136.20, 135.35, 131.90, 128.84, 128.65, 128.44, 128.37, 127.86, 125.58, 125.26, 122.66, 115.34, 75.73, 71.50; MS (50 eV) m/z (%): 525 (M+, 46), 507 (30), 43 (100).
3, 6-二氯水杨酸:m.p.182℃~183℃ (m.p.181℃~183 ℃[23]); 1H-NMR (acetone-d6, 400 MHz) δ: 0.78 (t, J=8 Hz, 3H), 1.07 (d, J=8 Hz, 3H), 2.96(s, 1H), 3.6~7.34 (m, 1H), 6.90~7.10 (m, 1H); 13C-NMR (acetone-d6, 100 MHz) δ:189.92, 153.18, 151.96, 136.20, 135.35, 131.90, 128.84, 128.65, 128.44, 128.37, 127.86, 125.58, 125.26, 122.66, 115.34, 75.73, 71.50.
3 结果与讨论以对二氯苯为原料,过氧化氢为氧化剂,利用V2O5催化氧化合成2, 5-二氯苯酚。再按照文献[18]的方法成盐脱水,即2, 5-二氯苯酚溶解于对二甲苯中,滴加氢氧化钾溶液反应生成酚盐和少量水,升温使对二甲苯与水共沸脱除水;用碳酸钾做为催化剂,在高压下与二氧化碳进行羧化反应;在盐酸的作用下,析出产物,最后水蒸气蒸馏带出产物。具体合成路线如图 1所示。
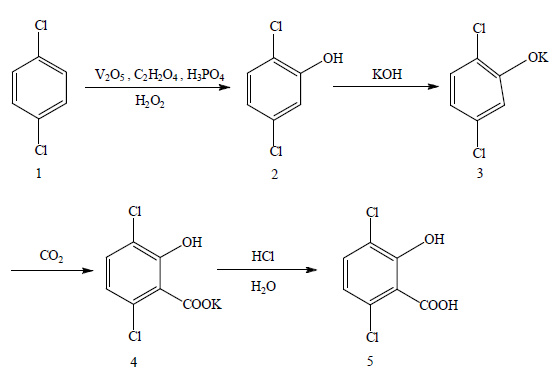
|
Scheme 1 |
以对二氯苯为原料,五氧化二钒为催化剂,草酸、磷酸为助催化剂,过氧化氢为氧化剂,羟基化一步法合成2, 5-二氯苯酚。系统的研究了该羟基化反应,考察了不同溶剂、催化剂用量、助催化剂用量、氧化剂用量、反应温度以及反应时间对羟基化反应收率的影响,确定了适宜反应条件。具体氧化过程如图 2所示。随着过氧化氢的缓慢加入,对二氯苯逐步羟基化生成2.5-二氯苯酚2,当反应进行到某一点时,该反应不再进行,而产物会被进一步氧化,生成苯二酚6和苯醌8。
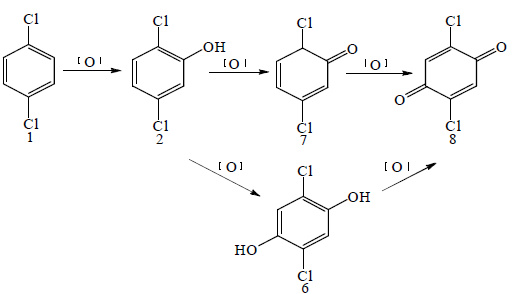
|
Scheme 2 |
首先对反应溶剂体系进行了探索, 考察了醋酸、丙酮、甲醇、四氢呋喃、乙腈五种溶剂对反应的影响。表 1中的结果显示,转化率依次为乙酸 > 丙酮 > 乙腈 > 甲醇 > 四氢呋喃,可见溶剂对该反应体系有显著的影响。以丙酮、乙腈、和乙酸为溶剂所进行的催化过程中,催化剂的状态经历了以下变化过程:固态的V2O5在滴入过氧化氢水溶液前,为红棕色的V5+,随着反应的继续进行,V2O5颜色逐渐转变为V4+的深绿色,反应为非均相反应。而当以四氢呋喃和甲醇为溶剂时,则没有该现象,几乎不反应。丙酮与过氧化氢作用易形成 (CH3)2C (OH)(OOH) 的化合物,这种化合物在溶液中是惰性的,从而抑制反应的进行。对于乙腈,则易与过氧化氢形成 (CH3) C (=NH)(OOH) 加合物,降低过氧化氢的选择性,从而影响对二氯苯转化率与产物的收率。由此可见,醋酸最适合做该反应的溶剂。
| 表 1 溶剂对反应的影响a Table 1 Effects of different solvents on hydroxylation reaction |
在确定了以醋酸为溶剂的体系下,又进一步对主催化剂、助催化剂、过氧化氢与对二氯苯的投料比进行了详细的考察。
首先在固定n(对二氯苯):n(草酸):n(磷酸):n(过氧化氢)=0.1:0.01:0.25:0.5情况下,考察了对二氯苯与主催化剂 (五氧化二钒) 的投料比对反应收率的影响 (表 2)。结果显示随着催化剂用量的增多,产率出现了先升后降的变化趋势。五氧化二钒达到1.25 mmol时,反应收率最高。可能由于催化剂用量增加,过氧化氢分解速度加快,转移到催化循环过程中的过氧化氢相对减少,造成过氧化氢的投入量增大,产物也被进一步氧化,选择性也下降,产物减少。所以,确定五氧化二钒与对二氯苯的适宜摩尔比为0.0125:1。
| 表 2 主催化剂量对反应的影响a Table 2 Effects of molar ratio of primary catalysts on hydroxylation reaction |
在此基础上,进一步考察了助催化剂 (磷酸、草酸) 的投料量对反应的影响。实验结果显示 (表 3),在固定摩尔比n(对二氯苯):n(五氧化二钒):n(过氧化氢)=0.1:0.00125: 0.5下,当磷酸达到0.25 mol,草酸0.01 mol时,反应收率最高,助催化剂量增加或者减少对反应的影响都很大。当不加草酸和磷酸时,该反应的收率很低,仅仅2.7%。这是因为,在该体系中加入少量的酸,可提高过氧化氢的转化率及产物苯酚的选择性,并抑制副产物苯二酚6和苯醌8的生成,从而提高产率。然而进一步提高草酸和磷酸的加入量却使过氧化氢的转化率下降,即酸催化过氧化氢分解,使其有效利用率下降。同时,适当的草酸和磷酸能促进对二氯苯的溶解性,并能使产物苯的质子化作用增强,抑制产物的进一步氧化。
| 表 3 助催化剂量对反应的影响a Table 3 Effects of molar ratio of promoter on hydroxylation reaction |
最后,对氧化剂的滴加量进行了考察,如表 4所示。随着过氧化氢量的增加,产率也在增加,当达到0.4~0.5 mol时,产率趋向于稳定。再滴加过氧化氢,产率反而下降,归因于产物的进一步氧化,生成苯二酚6与苯醌8。并且,随着过氧化氢的不断分解,体系中水分的不断提高,会使一部分原料析出,导致反应的无法正常进行。
| 表 4 过氧化氢量对反应的影响a Table 4 Effects of molar ratio of hydrogen peroxide on hydroxylation reaction |
综合以上结果,确定该羟基化反应的适宜物料的物质的量比为n(对二氯苯):n(草酸):n(磷酸):n(过氧化氢)=0.1:0.01:0.25:0.5,催化剂V2O5用量为原料摩尔量的1.25%。
3.1.3 温度对反应的影响在对二氯苯 (0.1 mol),草酸 (0.01 mol),磷酸 (0.25 mol),五氧化二钒 (1.26 mmol),醋酸 (100 mL) 为溶剂的条件下,考察了温度对该反应的影响,实验结果见表 5。
| 表 5 温度对反应的影响 Table 5 Effects of temperature on hydroxylation reaction |
由表 5可以得出,反应温度为20℃时得到了36.8%的收率, 随着温度升高,反应收率逐渐增加,30℃时可达到39.3%的收率;继续升高温度,收率则下降。其原因可能主要有两方面:一方面随着温度升高,过氧化氢的分解速度加快,其利用率降低;另一方面醋酸转移氧的能力也随着温度升高而减弱。可见该反应在30℃最合适。
3.1.4 反应时间对反应的影响在确定了反应物投料比、反应溶剂以及反应温度后, 又考察了反应时间对收率的影响,结果见表 6。
由表 6可以得出,反应8 h收率为34.1%,随着反应时间的延长,反应收率逐渐增加,反应10 h时可达39.3%的收率。继续延长反应时间,收率趋于稳定,甚至降低。这归因于反应体系中产物被进一步氧化,生成对苯二酚6和苯醌8。所以,反应时间以10 h最合适。
| 表 6 反应时间对反应的影响a Table 6 Effects of different times on hydroxylation reaction |
考察了催化剂的量,反应压力、温度等条件对2, 5-二氯苯酚与二氧化碳羧基化合成3, 6-二氯水杨酸反应收率的影响。实验发现,提高温度,可缩短反应时间,并提高总收率。于是,在确定了反应温度、时间的前提下,考察了催化剂的量对反应的影响。由表 7可看出,总收率随着催化剂的量的增大而增加,最后趋向于稳定。由此可知,催化剂的量对反应有很大的影响。最后,考察了压力对反应的影响。由表 7可看出,总收率随着压力的增大先增加后降低,当压力为8 MPa时,总收率达到了最大值。这是因为压力的升高有利于提高二氧化碳气体在液相中的浓度从而加快反应,提高总收率。但是压力过高时,会发生聚合反应,生成其他副产物而导致总收率下降。
| 表 7 各因素对反应的影响 Table 7 Effects of different factors on carboxylation reaction |
综上所述,羧基化的适宜反应条件是:0.045 mol量催化剂K2CO3,温度160℃,压力8 MPa,反应时间4 h。
4 结论以对二氯苯为起始原料,经羟基化、成盐脱水、羧基化、水蒸气蒸馏反应以较高收率合成了3, 6-二氯水杨酸,并对关键的对二氯苯的羟基化反应进行了系统考察,得到了对二氯苯的羟基化反应的适宜的反应条件:溶剂为醋酸,催化剂为五氧化二钒,助催化剂为磷酸和草酸,氧化剂为30%(wt) 过氧化氢,物料摩尔比为n(对二氯苯):n(草酸):n(磷酸):n(过氧化氢)=0.1:0.01:0.25:0.5,其中催化剂V2O5用量为原料的1.25%,反应温度为30℃,反应时间10 h,羟基化反应收率为39.3%,并且未反应的原料可以回收利用。该方法对其他羟基化反应也具有适用性。对羧基化反应进行了考察,确定了适宜工艺路线:0.045 mol量催化剂K2CO3,温度160℃,压力8 MPa,反应时间4 h,收率79.7%。
| [1] | ZHANG Si-gui(章思规), et al. Practical manual of fine chemicals(实用精细化学品手册)[M].Beijing(北京): Chemical Industry Press(化学工业出版社), 1996. |
| [2] | TIAN Lin(田琳), TAN Hai-jun(谭海军). Synthetic reviews on Dicamba and its intermediates(麦草畏及其中间体的合成评述)[J]. Modern Agrochemicals(现代农药) , 2011, 5(10): 12-15. |
| [3] | CAO Guang-hong(曹广宏). Research advances in 2, 5-dichlorophenol synthesis technology(2, 5-二氯苯酚生产工艺述评)[J]. Hubei Chemical Industry(湖北化工) , 1991(2): 30-32. |
| [4] | Sandoz L T D. Preparation of 2, 5-dichlorophenol:US, 4, 670, 610[P]. 1987-06-02. |
| [5] | Sidney B R. 2-methoxy-3, 6-dichlorobenzoates:US, 3, 013, 054[P]. 1961-12-12. |
| [6] | ZHANG Xiao-bo(章小波), JIANG Yong-xiang(蒋永祥), TANG Miao-rong(汤淼荣). The synthesis of herbicides Dicamba(安息香酸系除草剂--麦草畏的合成)[J]. Agrochemicals(农药) , 2002, 41(11): 13-14. |
| [7] | JIANG Yong-xiang (蒋永祥). The synthetic technology of antidepressant nefazodone intermediate-2-phenoxy-ethanamine and herbicides Dicamba (抗抑郁药奈法唑酮中间体及麦草畏的合成) [D]. Hangzhou (杭州): Zhejiang University (浙江大学), 2003. |
| [8] | Pittsburgh Plate Glass Company. Trichlorophenoxy alkanoic acid free of chlorinated diben-zo-p-dioxins:US, 4, 326, 882[P]. 1982-04-27. |
| [9] | Noelting E, Kopp E. Zur kenntniss des amido-p-dichlorbenzols[J]. Berichte der Deutschen Chemischen Gesellschaft , 1905, 38(3): 3506-3515. DOI:10.1002/(ISSN)1099-0682. |
| [10] | Jiangsu Shenghua pesticide Co Ltd (江苏生花农药有限公司). Improved Dicamba process for diazotizat-ion reaction (改进的麦草畏生产的重氮化工艺): CN, 1830943 [P]. 2006-09-13. |
| [11] | ZHANG Yong(张咏), LU Min(陆敏). Study on the synthesis of Dicamba(麦草畏合成工艺的究)[J]. Agrochemicals(农药) , 2002, 41(7): 15-17. |
| [12] | Novartis A G. Process for the hydroxylation of 1, 4-dichlorobenzene:WO, 9, 847, 843[P]. 1998-10-29. |
| [13] | Sandoz L T D. Oxidation process:US, 5, 648, 562[P]. 1997-07-15. |
| [14] | Syngenta Participations Ag. Oxidation process:US, 6, 274, 776[P]. 2001-08-14. |
| [15] | Syngenta Participations Ag. Oxidation process:US, 6, 323, 377[P]. 2001-11-27. |
| [16] | Syngenta Participations Ag. Oxidation process:US, 6, 586, 624[P]. 2003-07-01. |
| [17] | XU Wen-jun(徐文俊), JING Li(景丽), ZHANG Fu-min(张富民), et al. Kinetics of hydroxylation of benzene to phenol with hydrogen peroxide over organic molybdovanadophosphoric heteropolyacid salt catalysts(钼钒磷杂多酸有机盐催化下苯与过氧化氢羟基化制苯酚的动力学)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26(4): 624-628. |
| [18] | ZHANG Jing-chang(张敬畅), ZHANG Xin-fang(张信芳), CAO Wei-liang(曹维良), et al. Study on hydroxylation of phenol using iron-based composite oxides as catalysts(负载型铁基复合氧化物催化苯酚羟基化的研究)[J]. Molecule Catalysis(分子催化) , 2003, 17(1): 40-45. |
| [19] | Hussain S, Swaroop P A, Kifayatulla M. Process for the preparation of 2, 5-dichlorophenol of 99% purity:IN, 150341[P]. 1982-09-18. |
| [20] | JANG Yi-wen (蒋亦文). Study on Kolbc-Schmitt reaction mechanism of dichlorophenol in carbonation (二氯苯酚羧化的 Kolbe-Schmitt 反应机理研究) [D]. Shanghai (上海): East China University of Science and Technology (华东理工大学), 2011. |
| [21] | Kolbe H. On the synthesis of salieylic acid[J]. Liebigs Alln , 1860, 113: 125-127. |
| [22] | Galat Alexander. The preparation of 2, 4, 5-trichlorophenoxyacetic acid (2, 4, 5-T)[J]. Journal of the American Chemical Society , 1952, 74(15): 3890-3891. DOI:10.1021/ja01135a052. |
| [23] | ZHANG Yong(张咏). Study on the preparation of 3, 6-dichlorosalicylic acid(3, 6-二氯水杨酸合成工艺的研究)[J]. Technology and Testing(化工时刊) , 2001, 15(9): 27-31. |




