我国的天然气储量大,由于燃烧热值高、无污染物产生等优点受到人们的广泛关注[1-2]。甲烷作为天然气的主要成分,可转化为合成气(H2+CO)。合成气在工业上有着重要的用途,如使用费-托合成制取甲醇、乙醇、二甲醚等化工制品和液体燃料[3-6]。甲烷转化为合成气的方法主要有3种:甲烷水蒸气重整(SMR)、甲烷干重整(DRM)和甲烷部分氧化重整(POM)[7-9]。SMR是目前应用最广泛的方法,但该方法为强吸热过程,能耗过大、成本高昂;DRM与SMR一样,是强吸热过程,能耗高、转化率相对较低;POM是放热过程,能耗较低,但氧气会与甲烷直接接触,危险性高[10-12]。
近年来,在化学链基础上提出的甲烷化学链重整技术(chemical looping reforming,CLR)是一种新的甲烷制合成气技术,该技术以金属氧化物为氧载体,其中的晶格氧为氧源,与甲烷发生部分氧化生成合成气[13-14]。反应分2步进行,第1步是甲烷与氧载体部分氧化生成合成气(MeOx + CH4 → MeOx-δ +2H2 + CO),第2步是利用CO2为氧化剂将被还原的氧载体氧化再生(MeOx-δ + CO2 → MeOx + CO)。该技术有诸多优点:(1)使用氧载体中的氧代替氧气,氧气并不直接参与反应,避免了燃料与氧气的直接接触;(2)生成的合成气中H2与CO的体积比为2:1,有利于生产各种化学品;(4)使用CO2作为氧化剂,既解决了氧载体还原再生,又减少了温室气体CO2的排放;(5)反应为微吸热反应,反应温度比较低,能耗低。但氧载体在反应过程中可能会由于高温烧结和金属部位的氧化而失活[15-17]。选择储放氧能力强且稳定性好的氧载体成为甲烷化学链重整技术的关键[18]。
铈基氧载体是当前研究较广泛的氧载体之一。CeO2由于其独特的萤石型结构,具有良好的储氧放氧能力[18-21]。但纯CeO2氧载体的甲烷转化能力较差、合成气产量低、热稳定性较差,通过对其定向掺杂可以提高氧载体的反应活性和稳定性。Zhu等[22]利用共沉淀法制备了不同比例的Ce-Fe复合金属氧化物,发现Ce-Fe物种之间存在一定的协同作用,并且Ce-Fe复合氧载体在甲烷化学链蒸气重整中显示了优异的制氢与合成气的性能。Galvita等[23]研究表明在Fe2O3中加入适量的CeO2,能够有效抑制Fe2O3的烧结,提高其循环稳定性。
镍基氧载体具有反应活性和反应速率高、耐高温且不易团聚等优点[24-25]。Zhu等[26]发现高分散的Ni-CeO2体系具有很强的协同效应,提高了氧的迁移率,使氧更好地转移到负载的Ni上,有利于去除表面碳并同时抑制碳的形成。Löfberg等[27]将镍负载到CeO2上,经过CH4/CO2氧化还原循环反应后,发现Ni对氧载体的活化和供氧起着重要的作用。以上表明,镍的掺杂对于铈基氧载体的反应性能有积极的影响,而镍的掺杂量是影响氧载体反应活性的关键。
在本课题组的前期研究中发现,CeO2-NiO氧载体在不同Ce/Ni比例中有着较好的甲烷转化率和反应活性[28]。氧载体的结构特征是决定反应性能优劣的重要因素之一[29],而氧载体的焙烧温度对其结构特征有很大的影响。本研究制备了一系列不同温度焙烧的CeO2-NiO氧载体,对其物化特性进行了研究,同时探究了焙烧温度对CeO2-NiO氧载体化学链重整反应性能的影响。
2 实验部分 2.1 氧载体的制备使用共沉淀法制备CeO2-NiO氧载体,按照物质的量比n(Ce): n(Ni)=2:8称取Ce(NO3)3·6H2O(阿拉丁试剂有限公司,AR)和Ni(NO3)2·6H2O(天津风船化学试剂科技有限公司,AR),溶解于去离子水中,然后放置于恒温(25 ℃)水浴并使用机械搅拌器剧烈搅拌,同时用0.5 mol⋅L−1 NaOH缓慢滴定至pH=12~13,停止滴定后持续搅拌1 h,静置老化2 h。生成的沉淀物经过多次抽滤洗涤后,放入烘箱在80 ℃下干燥20 h,烘干后的固体放入马弗炉中,分别在600、650、700、750、800、850、900 ℃下焙烧2 h,即制得所需样品CeO2-NiO-600、CeO2-NiO-650、CeO2-NiO-700、CeO2-NiO-750、CeO2-NiO-800、CeO2-NiO-850和CeO2-NiO-900氧载体。
2.2 氧载体的表征 2.2.1 X射线衍射光谱分析(XRD)采用荷兰PANalytical公司X'Pert3Powder型X射线衍射仪进行X射线粉末衍射测试。测定条件设定为Cu Kα辐射,波长λ= 0.154 06 nm,管电压40 kV,管电流40 mA,扫描角度2θ=20°~80°,扫描速率1 (°)⋅min−1。
2.2.2 X射线光电子能谱分析(XPS)使用Al KA作为辐射源,使用PHI-5000VersaprobeIII X射线光电子能谱仪进行X射线光电子能谱(XPS)分析。其中C 1s(284.8 eV)作为XPS结合能校准的基准。
2.2.3 比表面积测试(BET)采用美国康塔公司NOVA 4200e物理吸附仪,样品在280 ℃下,加热4 h进行脱气处理,在液氮温度(−196 ℃)下进行氮气的吸脱附,实现样品的比表面积及孔径分布测定。
2.3 氧载体活性评价 2.3.1 活性评价装置氧载体的活性评价实验在自建的小型固定床反应装置上进行,主要有进气系统,反应系统,检测系统。进气系统通过阀门控制气瓶开关,转子流量计控制气速。反应系统采用合肥科晶材料技术有限公司生产的GLS-1100型管式炉进行温度控制,氧载体放置于内径为8 mm的石英管反应器中部。检测系统通过武汉立方光电有限公司生产的GASBOARD-3100型气体分析仪对尾气中各气体含量进行在线检测。
2.3.2 甲烷程序升温还原(CH4-TPR)甲烷程序升温还原实验所用反应气为CH4/N2混合气,其中甲烷的体积分数φ(CH4)为5%,气体流量控制在200 mL⋅min−1,氧载体用量0.5 g。以10 ℃⋅min−1的升温速率由室温先升至300 ℃,用N2吹扫30 min,再从300升至900 ℃,并由气体分析仪(GASBOARD-3100)在线检测反应过程中各气体体积分数。
2.3.3 甲烷部分氧化-CO2还原恒温反应甲烷部分氧化-CO2还原恒温反应所用反应气为CH4/N2(φ(CH4)=5%)混合气和CO2/N2(φ(CO2)=10%)混合气,气体流量控制在200 mL⋅min−1,氧载体用量为1 g。首先在高纯N2气氛中升温(10 ℃⋅min−1)至800 ℃,反应分为2步进行:第1步通入CH4/N2(φ(CH4)=5%)混合气与氧载体反应20 min;第2步,使用N2吹扫30 min排出其他气体,然后通入CO2/N2(φ(CO2)=10 %)混合气反应20 min。整个实验过程中的气体体积分数由气体分析仪(GASBOARD-3100)进行在线检测。
2.3.4 redox循环实验氧载体的redox循环性能实验条件与甲烷部分氧化-CO2还原恒温反应条件保持一致,在每次恒温反应结束后,通入高纯氮气吹扫30 min用来清除其他杂质气体,之后重复甲烷部分氧化-CO2还原恒温反应进行下一次循环。
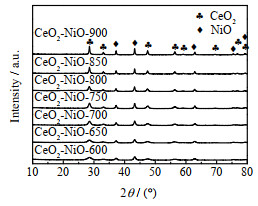
3 结果与讨论 3.1 氧载体的表征不同焙烧温度下的CeO2-NiO氧载体的XRD图谱如图 1所示。图中,位于28.74º、33.48º、47.79º、56.75º、59.28º、69.78º、77.12º 和79.27º的衍射峰对应CeO2的立方萤石结构。而在37.44º、43.47º、63.21º、75.37º和79.87º的衍射峰归属于NiO。所有样品均能检测到CeO2和NiO的特征峰,表明镍物种并未全部进入CeO2晶格,而是一部分以Ni2+形式进入CeO2结构中形成铈镍固溶体,另一部分以氧化镍的形式存在于CeO2的立方萤石结构表面[30-32]。较低的焙烧温度下氧载体的CeO2和NiO的特征峰并不明显,随着焙烧温度的升高,氧载体中CeO2和NiO的特征峰越来越尖锐,强度越来越大。这表明样品的晶粒尺寸随着焙烧温度升高而增加,焙烧温度的升高导致氧载体晶粒的团聚[33]。
|
图 1 不同焙烧温度下制备的CeO2-NiO氧载体的XRD图谱 Fig.1 XRD patterns of CeO2-NiO oxygen carriers calcined at different temperatures |
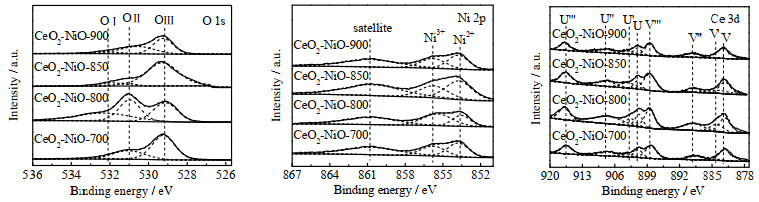
通过XPS分析可以确定材料表面的化学元素的价态变化以及各元素的相对含量。图 2为不同温度焙烧的CeO2-NiO氧载体的O 1s、Ni 2p和Ce 3d的XPS谱图,各元素的相对含量如表 1所示。在O 1s图中,529.29 eV处的峰属于晶格氧(Olatt,标记为OⅢ),在531.15 eV处的峰(标记为O Ⅱ)及在531.9 eV处的峰(标记为OⅠ)归属于表面吸附氧(Oads)[34]。从表 1可见,4个样品中,Oads与Olatt物质的量比n(Oads)/n(Olatt)的变化趋势为CeO2-NiO-800 > CeO2-NiO-900 > CeO2-NiO-700 > CeO2-NiO-850,这表明CeO2-NiO-800表面吸附氧较多,与甲烷反应会生成更多的CO2。而CeO2-NiO-850的n(Oads)/n(Olatt)最小,样品表面的吸附氧较少,晶格氧含量相对较高,这有利于提高合成气的选择性。在Ni 2p图中主要有3个峰,分别为归属于853.72 eV处的Ni2+、855.72 eV处的Ni3+和860.56 eV处Ni的卫星峰[35-36]。在Ce 3d图中,XPS曲线由4对3d5/2-3d3/2旋轨分裂峰组成,分别使用V、V'、V''、V'''和U、U'、U''、U'''表示Ce 3d3/2轨道和Ce 3d5/2轨道,其中标记为V'和U'处的峰归属于Ce3+,其他谱峰则归属于Ce4+ [37]。CeO2-NiO-850样品的n(Ni2+)/n(Ni3+)及n(Ce3+)/n(Ce4+)均较大,说明不饱和配位离子Ni2+及Ce3+物质的量较高,存在的氧空位浓度高,这有助于提高氧载体的储氧能力。
|
图 2 不同焙烧温度下制备的CeO2-NiO氧载体样品O 1s、Ni 2p及Ce 3d的XPS图谱 Fig.2 XPS spectra of O 1s, Ni 2p and Ce 3d on CeO2-NiO oxygen carriers calcined at different temperatures |
|
|
表 1 不同焙烧温度下制备的CeO2-NiO氧载体的XPS特性参数 Table 1 XPS characteristic parameters of CeO2-NiO oxygen carriers calcined at different temperatures |
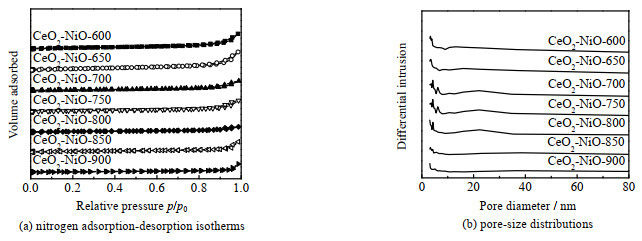
图 3为不同温度焙烧的CeO2-NiO氧载体的氮气吸脱附曲线和孔径分布图。各样品的平均孔径、比表面积和孔容如表 2所示。所有样品均呈现出IV型氮气吸脱附等温线,且在相对压力p/p0为0.6~1.0时存在H2型滞后环,这是由于毛细管凝聚作用使N2分子在低于常压下冷凝填充了介孔孔道,说明样品具有介孔结构。由表 2可见,样品的比表面积和孔容随着焙烧温度的升高逐渐变小,这主要是由于焙烧温度升高对氧载体表面的烧结作用[38]。CeO2-NiO-850(25.309 nm)和CeO2-NiO-900(32.562 nm)的平均孔径明显高于其他样品。
|
图 3 不同焙烧温度下制备的CeO2-NiO氧载体的氮气吸附-脱附等温曲线和孔径分布图 Fig.3 Nitrogen adsorption-desorption isotherms and pore-size distributions of CeO2-NiO oxygen carriers calcined at different temperatures |
|
|
表 2 在不同温度下焙烧的CeO2-NiO氧载体的平均孔径、比表面积和孔容 Table 2 Average pore diameter, surface area and total pore volume of CeO2-NiO oxygen carriers calcined at different temperatures |
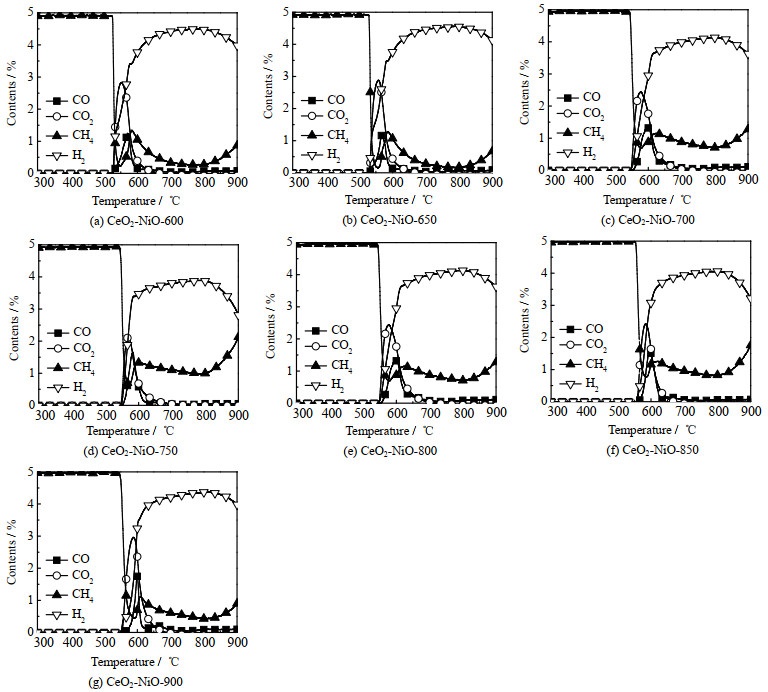
图 4为不同温度焙烧的CeO2-NiO氧载体的CH4-TPR曲线。由图可见,氧载体与甲烷在550 ℃左右开始反应,首先甲烷被氧载体的表面氧完全氧化,生成CO2和H2O;之后甲烷与氧载体的晶格氧发生反应,生成CO和H2;最后CO体积分数开始下降,而氢气体积分数继续上升,表明甲烷裂解产生C和H2。从700 ℃开始,CO的体积分数降至0,此时的产物气体只有H2,证明甲烷完全裂解。所有样品在800 ℃左右达到最高的甲烷转化率,选择800 ℃作为甲烷部分氧化-CO2还原恒温反应的反应温度。
|
图 4 不同焙烧温度下制备的CeO2-NiO氧载体的CH4-TPR图谱 Fig.4 CH4-TPR profiles of CeO2-NiO oxygen carriers calcined at different temperatures |
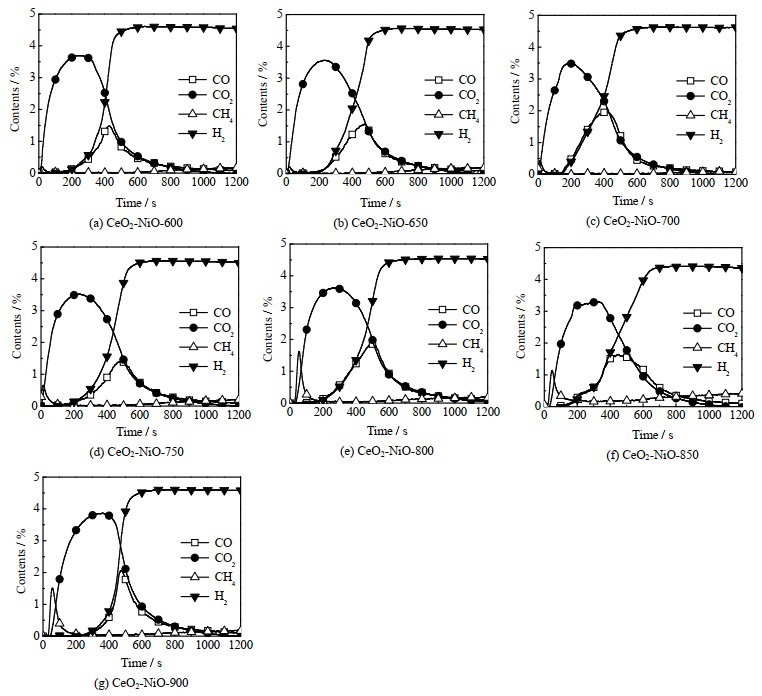
不同焙烧温度的CeO2-NiO氧载体在甲烷部分氧化恒温反应中气体体积分数变化如图 5所示。反应初期CO2体积分数急剧上升,这是由于CH4被氧载体的表面氧完全氧化所致。反应至200 s附近时,CO2体积分数开始降低,CO与H2体积分数开始上升,表明氧载体内部的晶格氧向表面迁移,将甲烷选择性氧化。反应至600 s时,H2体积分数基本维持不变,CO的体积分数持续下降,且此时H2与CO的体积比大于2,说明此时甲烷已开始裂解产生积炭和H2。所有样品都具有很高的甲烷转化率,这主要是由于被还原的Ni金属对甲烷具有较强的催化裂解效应[39]。在所有样品中CeO2-NiO-850样品(图 5(f))的合成气体积分数最高,积炭量最少。
|
图 5 不同焙烧温度下制备的CeO2-NiO氧载体在甲烷部分氧化恒温反应中各气体体积分数变化图 Fig.5 Gas contents of CH4 isothermal reactions over CeO2-NiO oxygen carriers calcined at different temperatures |
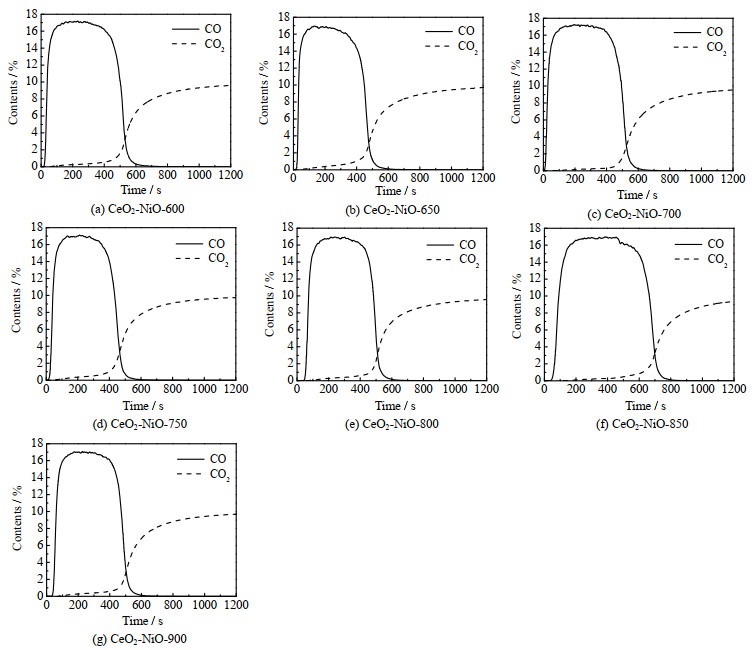
图 6为不同焙烧温度的CeO2-NiO氧载体样品在CO2还原阶段的CO和CO2含量变化图谱。由于氧载体在经过氧化反应后处于失氧状态,会从CO2中获取氧原子来弥补自身缺失的氧物种,进而生成CO。CO的产生主要有2个来源,分别是CO2与被还原的氧载体反应所形成(CO2+MeOδ-1→MeOδ+CO),以及CO2与第1步反应中甲烷裂解形成的积炭反应所生成(CO2+C→2CO)。在反应开始200 s内,CO2被还原生成的CO含量达到最大值,随后生成的CO含量在600 s后降至0,而在图 6(f)中CeO2-NiO-850样品直到反应后800 s左右CO含量才趋于0。上述现象表明CeO2-NiO-850的CO产率高于其他样品,这有利于消除甲烷裂解产生的积炭,从而保持氧载体的反应活性。CeO2-NiO-850样品在甲烷反应中的积炭量最低,说明该氧载体从CO2中获得的氧的量最多,储氧能力最强,拥有较好的储放氧性能。
|
图 6 不同焙烧温度下制备的CeO2-NiO氧载体在CO2还原恒温反应中各气体体积分数变化图 Fig.6 Gas contents of CO2 reduction reaction over CeO2-NiO oxygen carriers calcined at different temperatures |
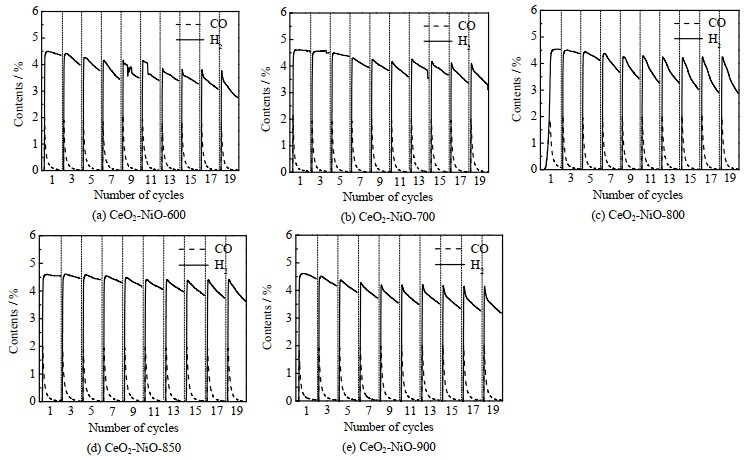
氧载体在800 ℃下20次氧化还原循环中甲烷部分氧化反应中的气体体积分数变化情况如图 7所示。从图谱中可以看出,在第一次循环中,H2体积分数较高,随着反应时间的进行,H2与CO的体积比大于2,说明有积炭产生。随着循环次数的增加,氢气体积分数开始逐渐下降,甲烷的转化率也随之降低,这表明积炭覆盖在氧载体表面,对氧载体的反应活性有较大的影响。在5个样品中,CeO2-NiO-600样品(图 7(a))的循环稳定性最差,这可以归因于积炭的累积导致氧载体活性下降。但随着氧载体焙烧温度的升高,循环稳定性有逐渐变好的趋势,当样品的焙烧温度达到900 ℃后,循环稳定性开始下降。CeO2-NiO-850样品(图 7(d))的氢气产量降低的幅度较小,甲烷平均转化率较高,活性受积炭的影响较小,说明CeO2-NiO-850在甲烷氧化反应中的稳定性优于其他几个样品。
|
图 7 不同焙烧温度下制备的CeO2-NiO氧载体在800 ℃下20次恒温氧化还原循环反应中的甲烷部分氧化反应的各气体体积分数 Fig.7 Gas contents of CH4 isothermal reactions over CeO2-NiO oxygen carrier at 800 ℃ during 20 redox cycles |
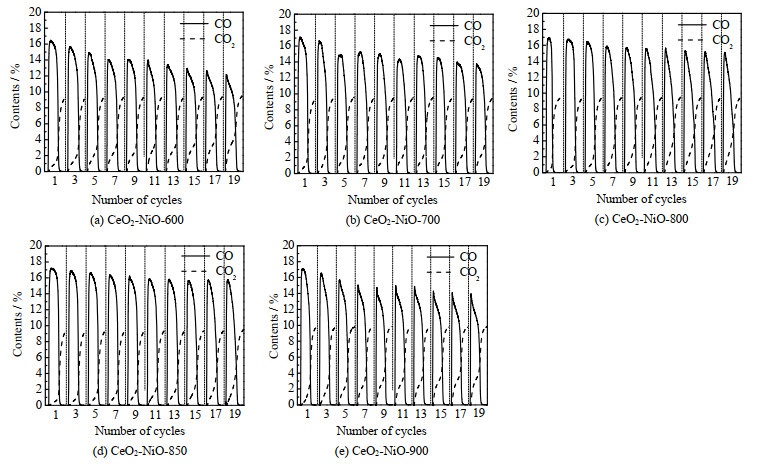
图 8为氧载体在800 ℃下20次氧化还原循环中CO2还原反应中的气体含量变化情况。反应初始,CO2与经甲烷还原后的氧载体及甲烷裂解产生的积炭均会发生反应,生成大量CO,随着循环次数的增加,CO体积分数呈下降趋势。采用CeO2-NiO-600、CeO2-NiO-700、CeO2-NiO-800、CeO2-NiO-900氧载体时的CO产量及CO2转化率相对较低且下降较为明显,循环稳定性较差。采用CeO2-NiO-850样品(图 8(d))在每次循环反应中都较其他样品具有更高的CO转化率,在CO2还原反应中循环稳定性明显优于其他4个样品,这表明在每次CO2还原反应后残留在氧载体表面的积炭相对较少,有利于消除下次甲烷氧化反应中积炭对氧载体反应活性的影响。CeO2-NiO-850在反应中不仅具有良好的反应活性还具备优异的抗积炭能力,这与之前的数据结果吻合。上述结果表明CeO2-NiO-850氧载体具有更优的反应活性和循环稳定性。
|
图 8 CeO2-NiO氧载体在800 ℃下20次恒温氧化还原循环反应中的CO2还原反应的各气体体积分数 Fig.8 Gas contents of CO2 reduction reaction over CeO2-NiO oxygen carrier at 800 ℃ during 20 redox cycles |
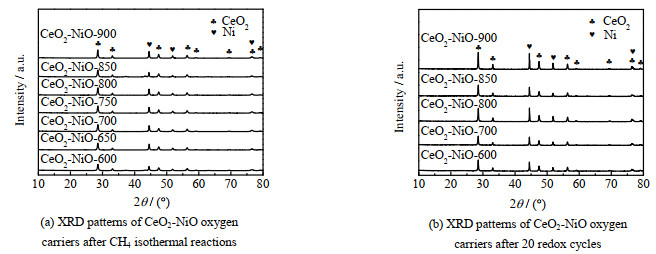
图 9为不同焙烧温度的CeO2-NiO氧载体在经过甲烷部分氧化恒温反应后和20次氧化还原循环反应后的XRD图谱。图 9(a)中,各样品均检测到Ni单质的特征峰,这是因为NiO中的氧原子在反应中被消耗,生成了Ni单质。甲烷氧化反应后仍能检测到明显的CeO2特征衍射峰,表明氧载体依然保持了良好的CeO2的晶体结构。由图 9(b)可见,循环后的样品的特征峰比新鲜样品更加尖锐,表明结晶度有所增加。反应后并没有出现NiO的特征峰,而是出现了Ni单质的特征衍射峰,是因为在第一步甲烷部分氧化反应中,NiO被CH4还原成Ni单质[40]。
|
图 9 甲烷部分氧化恒温反应后和20次redox循环后不同焙烧温度下制备的CeO2-NiO氧载体的XRD图谱 Fig.9 XRD patterns of CeO2-NiO oxygen carriers calcined at different temperatures after CH4 isothermal reactions and 20 redox cycles |
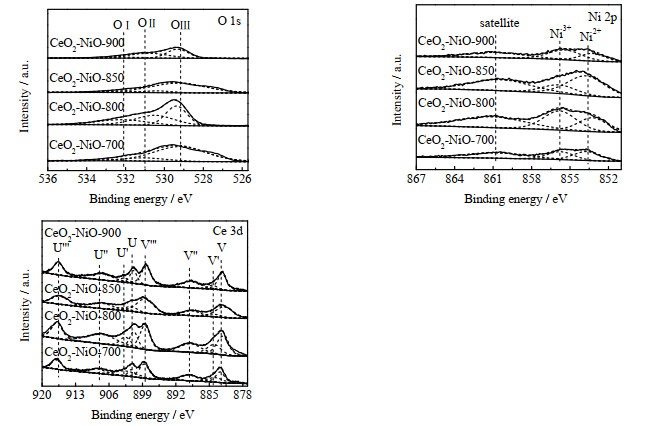
图 10是不同焙烧温度下CeO2-NiO氧载体在进行20次氧化还原循环后的O 1s、Ni 2p和Ce 3d的XPS谱图。各元素的相对含量如表 3所示。与新鲜样品相比,CeO2-NiO-800样品n(Oads)/n(Olatt)明显降低,其他样品的n(Oads)/n(Olatt)变化不大。CeO2-NiO-700、CeO2-NiO-800、CeO2-NiO-900在循环反应后n(Ce3+)/n(Ce4+)和n(Ni2+)/n(Ni3+)变化不大,而CeO2-NiO-850样品的n(Ni2+)/n(Ni3+)大幅度上升(由1.48升至6.72)。Ce3+和Ni2+的存在有利于氧空位的形成,表明经过20次循环后CeO2-NiO-850样品氧空位浓度升高。
|
图 10 20次redox循环后不同焙烧温度下制备的CeO2-NiO氧载体O 1s、Ni 2p及Ce 3d的XPS图谱 Fig.10 XPS spectra of O 1s, Ni 2p and Ce 3d on CeO2-NiO oxygen carriers calcined at different temperatures after 20 redox cycles |
|
|
表 3 不同焙烧温度下制备的CeO2-NiO氧载体经历20次redox循环后的XPS特性参数 Table 3 XPS characteristic parameters of CeO2-NiO oxygen carriers calcined at different temperatures after 20 redox cycles |
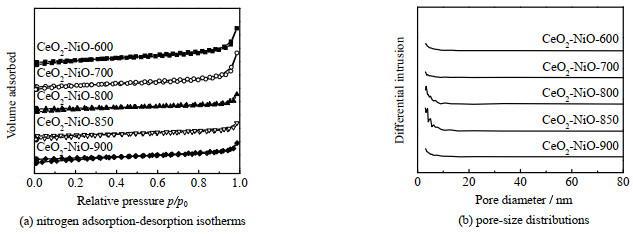
图 11为不同温度焙烧的CeO2-NiO氧载体在经过20次redox循环后的氮气吸脱附曲线和孔径分布图。各样品的平均孔径,比表面积和孔容如表 4所示。与新鲜样品相比,经过循环后的样品的平均孔径、比表面积和孔容都出现明显的下降,其中CeO2-NiO-850样品的比表面积与孔容下降的幅度最小,表明其经过循环后结构相对稳定。
|
图 11 20次氧化还原循环后不同焙烧温度下制备的CeO2-NiO氧载体的氮气吸附-脱附等温曲线和孔径分布图 Fig.11 Nitrogen adsorption-desorption isotherms and pore-size distributions of CeO2-NiO oxygen carriers calcined at different temperatures after 20 redox cycles |
|
|
表 4 不同温度焙烧的CeO2-NiO氧载体在20次redox循环后的平均孔径、比表面积和孔容 Table 4 Average pore diameter, surface area and total pore volume of CeO2-NiO oxygen carriers calcined at different temperatures after 20 redox cycles |
本研究通过共沉淀法和不同温度焙烧制备了CeO2-NiO-600、CeO2-NiO-650、CeO2-NiO-700、CeO2-NiO-750、CeO2-NiO-800、CeO2-NiO-850、CeO2-NiO-900系列氧载体,并对其物理性能和化学性能进行了表征。随着焙烧温度升高,氧载体晶粒尺寸增加;CeO2-NiO-850有较大的平均孔径,且循环后结构稳定。CeO2-NiO-850在循环前后均有较高的氧空位浓度,表明其储氧能力较强。在化学链重整反应中CeO2-NiO-850氧载体的合成气含量最高,积炭量最少,CO产量及CO2转化率最高,且在20次redox循环后依然具有更优的反应活性和循环稳定性。综上所述,850 ℃为CeO2-NiO氧载体最佳焙烧温度。
| [1] |
SAHA D, GRAPPE H A, CHAKRABORTY A, et al. Postextraction separation, on-board storage, and catalytic conversion of methane in natural gas: A review[J]. Chemical Reviews, 2016, 116(19): 11436-11499. DOI:10.1021/acs.chemrev.5b00745 |
| [2] |
CHONG M N, JIN B, CHOW C, et al. Recent developments in photocatalytic water treatment technology: A review[J]. Water Research, 2010, 44(10): 2997-3027. DOI:10.1016/j.watres.2010.02.039 |
| [3] |
孙长庚, 刘宗章, 张敏华. 甲烷催化部分氧化制合成气的研究进展[J]. 化学工业与工程, 2004, 21(4): 276-280. SUN C G, LIU Z Z, ZHANG M H. Progress on catalytic partial oxidation of methane to syngas[J]. Chemical Industry and Engineering, 2004, 21(4): 276-280. DOI:10.3969/j.issn.1004-9533.2004.04.010 |
| [4] |
JIAO F, LI J, PAN X, et al. Selective conversion of syngas to light olefins[J]. Science, 2016, 351(6277): 1065-1068. DOI:10.1126/science.aaf1835 |
| [5] |
LI K Z, WANG H, WEI Y G, et al. Partial oxidation of methane to syngas with air by lattice oxygen transfer over ZrO2-modified Ce-Fe mixed oxides[J]. Chemical Engineering Journal, 2011, 173(9): 574-582. |
| [6] |
齐心冰, 董新法, 林维明. 甲烷水蒸气重整和部分氧化反应制合成气[J]. 天然气工业, 2005, 25(6): 125-127. QI X B, DONG X F, LIN W M. Steam reforming and partial oxidation of methane to produce syngas[J]. Natural Gas Industry, 2005, 25(6): 125-127. DOI:10.3321/j.issn:1000-0976.2005.06.039 |
| [7] |
李航, 殷洁炜, 王幸宜, 等. 甲烷部分氧化制合成气催化剂的研究进展[J]. 广州化工, 2011, 39(15): 4-6. LI H, YIN J W, WANG X Y, et al. Progress on catalyst of partial oxidation of methane to syngas[J]. Guangzhou Chemical, 2011, 39(15): 4-6. DOI:10.3969/j.issn.1001-9677.2011.15.002 |
| [8] |
ENGER B C, LØDENG R, HOLMEN A. A review of catalytic partial oxidation of methane to synthesis gas with emphasis on reaction mechanisms over transition metal catalysts[J]. Applied Catalysis A-General, 2008, 346(1/2): 1-27. |
| [9] |
ZHANG F, ZHU L, RAO D. The evaluation of a methane autothermal chemical looping reforming experiment based on exergy analysis[J]. RSC Advances, 2019, 9(38): 22032-22044. DOI:10.1039/C9RA03315G |
| [10] |
苏小平, 王力, 杨武, 等. 甲烷化学链重整制合成气的研究进展[J]. 地下水, 2017, 39(4): 198-202. SU X P, WANG L, YANG W, et al. Advances in the study of methane chemical chain re-engineering synthesizers[J]. Groundwater, 2017, 39(4): 198-202. DOI:10.3969/j.issn.1004-1184.2017.04.075 |
| [11] |
魏永刚, 王华, 刘明春, 等. 用于部分氧化甲烷制合成气的铈基氧载体性能表征[J]. 分子催化, 2008, 22(1): 27-32. WEI Y G, WANG H, LIU M C, et al. Characterizations of ceria-based oxygen carriers for partial oxidation methane to syngas[J]. Molecular Catalysis, 2008, 22(1): 27-32. |
| [12] |
王奕然, 曾令志, 娄舒洁, 等. 天然气制氢技术研究进展[J]. 石化技术与应用, 2019, 37(5): 361-366. WANG Y R, ZENG L Z, LOU S J, et al. Review of hydrogen production from natural gas[J]. Petrochemical Technology and Applications, 2019, 37(5): 361-366. DOI:10.3969/j.issn.1009-0045.2019.05.021 |
| [13] |
FAN L S, ZENG L, LUO S. Chemical-looping technology platform[J]. AIChE Journal, 2015, 61(1): 2-22. DOI:10.1002/aic.14695 |
| [14] |
RYDÉN M, LYNGFELT A, MATTISSON T. Synthesis gas generation by chemical-looping reforming in a continuously operating laboratory reactor[J]. Fuel, 2006, 85(12/13): 1631-1641. |
| [15] |
ZHU X, IMTIAZ Q, DONAT F, et al. Chemical looping beyond combustion – A perspective[J]. Energy & Environmental Science, 2020, 13(3): 772-804. |
| [16] |
AY H, ÜNER D. Dry reforming of methane over CeO2 supported Ni, Co and Ni–Co catalysts[J]. Applied Catalysis B-Environmental, 2015, 179: 128-138. DOI:10.1016/j.apcatb.2015.05.013 |
| [17] |
TANG M, XU L, FAN M. Progress in oxygen carrier development of methane-based chemical-looping reforming: A review[J]. Applied Energy, 2015, 151: 143-156. DOI:10.1016/j.apenergy.2015.04.017 |
| [18] |
HE F, LI X, ZHAO K, et al. The use of La1-xSrxFeO3 perovskite-type oxides as oxygen carriers in chemical-looping reforming of methane[J]. Fuel, 2013, 108: 465-473. DOI:10.1016/j.fuel.2012.11.035 |
| [19] |
李孔斋, 王华, 魏永刚, 等. 铈铁复合氧化物的结构特征及其催化应用[J]. 化学进展, 2013, 25(10): 1691-1702. LI K Z, WANG H, WEI Y G, et al. Structural features of Ce-Fe mixed oxide and its applications in catalysis[J]. Chemical Progress, 2013, 25(10): 1691-1702. |
| [20] |
WANG Y, ZHENG Y, LI K, et al. Syngas production modified by oxygen vacancies over CeO2-ZrO2-CuO oxygen carrier via chemical looping reforming of methane[J]. Applied Surface Science, 2019, 481(3): 151-160. |
| [21] |
MA S W, LI M, WANG G B, et al. Effects of Zr doping on Fe2O3/CeO2 oxygen carrier in chemical looping hydrogen generation[J]. Chemical Engineering Journal, 2018, 346: 712-725. DOI:10.1016/j.cej.2018.03.171 |
| [22] |
ZHU X, WANG H, WEI Y G, et al. Hydrogen and syngas production from two-step steam reforming of methane over CeO2-Fe2O3 oxygen carrier[J]. Journal of Rare Earths, 2010, 28(6): 907-913. DOI:10.1016/S1002-0721(09)60225-8 |
| [23] |
GALVITA V V, POELMAN H, BLIZNUK V, et al. CeO2-modified Fe2O3 for CO2 utilization via chemical looping[J]. Industrial & Engineering Chemistry Research, 2013, 52(25): 8416-8426. |
| [24] |
魏国强, 何方, 黄振, 等. 化学链燃烧技术的研究进展[J]. 化工进展, 2012, 31(4): 713-725. WEI G Q, HE F, HUANG Z, et al. Research development in chemical-looping combustion[J]. Chemical Progress, 2012, 31(4): 713-725. |
| [25] |
SHEN L, GAO Z, WU J, et al. Sulfur behavior in chemical looping combustion with NiO/Al2O3 oxygen carrier[J]. Combustion & Flame, 2010, 157(25): 853-863. |
| [26] |
ZHU T, FLYTZANI-STEPHANOPOULOS M. Catalytic partial oxidation of methane to synthesis gas over Ni–CeO2[J]. Applied Catalysis A-General, 2001, 208(1/2): 403-417. |
| [27] |
LÖFBERG A, GUERRERO-CABALLERO J, KANE T, et al. Ni/CeO2 based catalysts as oxygen vectors for the chemical looping dry reforming of methane for syngas production[J]. Applied Catalysis B-Environmental, 2017, 212: 159-174. DOI:10.1016/j.apcatb.2017.04.048 |
| [28] |
赵林洲, 郑燕娥, 李孔斋, 等. Ce1-xNixOy氧载体在化学链甲烷重整耦合CO2还原中的应用[J]. 化工学报, 2021, 72(8): 4371-4380. ZHAO L Z, ZHENG Y E, LI K Z, et al. Application of Ce1-xNixOy oxygen carriers in chemical-looping reforming of methane coupled with CO2 reduction[J]. CIESC Journal, 2021, 72(8): 4371-4380. |
| [29] |
PEA M A, FIERRO J L. Chemical structures and performance of perovskite oxides[J]. Chemical Reviews, 2001, 101(7): 1981-2017. DOI:10.1021/cr980129f |
| [30] |
SHAN W J, LUO M F, YING P L, et al. Reduction property and catalytic activity of Ce1-xNixO2 mixed oxide catalysts for CH4 oxidation[J]. Applied Catalysis A-General, 2003, 246(1): 1-9. DOI:10.1016/S0926-860X(02)00659-2 |
| [31] |
李树娜, 朱刚, 石奇, 等. 富氢气氛下CeO2-NiO纳米棒催化剂的CO选择性氧化性能研究[J]. 燃料化学学报, 2019, 47(9): 1111-1118. LI S N, ZHU G, SHI Q, et al. Performance of CO preferential oxidation of CeO2 - NiO nanorod catalyst in H2-rich stream[J]. Journal of Fuel Chemistry and Technology, 2019, 47(9): 1111-1118. DOI:10.3969/j.issn.0253-2409.2019.09.011 |
| [32] |
薛鹏. 氧化铈与六铝酸盐复合氧载体用于甲烷的化学链重整制高品质合成气[D]. 西安: 西北大学, 2018. XUE P. Hexaaluminates supported cerium oxide compound oxygen carrier for high quality synthesis gas production from Chemical-looping reforming of methane [D]. Xi'an: Northwest University, 2018. |
| [33] |
ZHENG Y E, WEI Y G, LI K Z, et al. Chemical-looping steam methane reforming over macroporous CeO2-ZrO2 solid solution: Effect of calcination temperature[J]. International Journal of Hydrogen Energy, 2014, 39(25): 13361-13368. DOI:10.1016/j.ijhydene.2014.04.116 |
| [34] |
WANG X Y, KANG Q, LI D. Catalytic combustion of chlorobenzene over MnOx–CeO2 mixed oxide catalysts[J]. Applied Catalysis B-Environmental, 2009, 86(3): 166-175. |
| [35] |
CHEN J, WU J, LIU Y, et al. Assemblage of perovskite LaNiO3 connected with in situ grown nitrogen-doped carbon nanotubes as high-performance electrocatalyst for oxygen evolution reaction[J]. Physica Status Solidi A-Applications and Materials Science, 2018, 215(21): 1800380. |
| [36] |
WANG J, SHEN M, WANG J, et al. Effects of Ni-doping of ceria-based materials on their micro-structures and dynamic oxygen storage and release behaviors[J]. Catalysis Letters, 2010, 140(1/2): 38-48. |
| [37] |
ZHOU G L, LIU H R, CUI K K, et al. Role of surface Ni and Ce species of Ni/CeO2 catalyst in CO2 methanation[J]. Applied Surface Science, 2016, 383: 248-252. DOI:10.1016/j.apsusc.2016.04.180 |
| [38] |
邓贵先, 李孔斋, 程显名, 等. 赤泥作为氧载体用于甲烷化学链燃烧: 反应与循环性能[J]. 高等学校化学学报, 2018, 39(2): 327-336. DENG G X, LI K Z, CHENG X M, et al. Red mud as oxygen carrier for chemical looping combustion of methane: Reactivity and cyclic performance[J]. Journal of Chemistry of Higher Education, 2018, 39(2): 327-336. |
| [39] |
PINILLA J L, SUELVES I, LÁZARO M J, et al. Activity of NiCuAl catalyst in methane decomposition studied using a thermobalance and the structural changes in the Ni and the deposited carbon[J]. International Journal of Hydrogen Energy, 2008, 33(10): 2515-2524. DOI:10.1016/j.ijhydene.2008.02.041 |
| [40] |
SHAN W, FLEYS M, FRANCOⅠS L, et al. Syngas production from partial oxidation of methane over Ce1-xNixOy catalysts prepared by complexation-combustion method[J]. Applied Catalysis A-General, 2006, 311: 24-33. DOI:10.1016/j.apcata.2006.05.044 |




