糠醛由生物质中所含的半纤维素经水解、脱水环合而成[1, 2],而糠醇是一种重要的有机化工原料,主要用于生产糠醛树脂、呋喃树脂、糠醇-脲醛树脂、酚醛树脂等,也用于制备果酸、增塑剂、溶剂、药物和火箭燃料等,用途广泛。糠醇目前主要由糠醛气相[3]或液相[4, 5]催化加氢制备得到,该方法存在消耗大量高能量密度洁净的氢气、成本高等缺点,因而不消耗氢气的原位加氢技术和催化转移氢化技术用于糠醛制糠醇备受关注。
原位加氢是将含氧碳氢化合物水相重整制氢与加氢反应耦合的过程。曹晓霞等[6]和Xu等[7]都研究了Raney Ni催化下甲醇为供氢剂糠醛原位加氢制备糠醇,但是糠醇收率较低;Dong等[8]研究了Au/TiO2-R催化下以CO/水为氢源的糠醛还原制备糠醇。催化转移氢化反应是指在催化剂的作用下,供氢剂分子中的氢转移到氢受体分子的双分子反应。近年来利用催化转移氢化技术将糠醛还原成糠醇是国内外的研究热点之一,美国University of Delaware的Vlachos教授课题组[9, 10]较早开展了糠醛的氢转移反应,他们尝试的催化剂有Ru/RuO2/C、Sn-β、Zr-β等;美国农业部Agricultural Research Service的Boateng博士课题组[11]研究了Ni-Cu双金属催化下含氧生物油模型物质(对甲酚、糠醛)的氢转移还原;瑞士ETH Zürich的Hermans教授课题组[12]采用Fe2O3负载的Cu、Ni、Pd催化剂催化糠醛和5-HMF的氢转移还原;阿根廷UNL-CONICET的Marchi博士课题组[13]研究了Cu–Mg–Al催化糠醛液相转移氢化制备糠醇;印度CSIR -National Chemical Laboratory的Rode博士课题组[14]尝试了金属氧化物催化的糠醛一锅法氢转移和羟醛缩合反应;国内中国石油大学的Li等[15]采用氮掺杂碳负载铁催化剂、贵州大学的Li等[16]采用ZrPN催化剂研究了糠醛氢转移制备糠醇。但目前尚未找到效率高、廉价、可重复使用、适合工业化的催化剂用于糠醛转移氢化制备糠醇。
异丙醇的临界温度为234.9℃,本文的反应温度处于170~210℃,因而处于近临界状态,此时的异丙醇既作为反应物(供氢剂)也作为反应溶剂,同时利用近临界流体良好的传质性能,有利于减少传质阻力提高反应速率。Cu-Pd/Al2O3催化剂具有良好的水热稳定性、重复使用性能好,其制备工艺简单[17, 18]、易于实现工业化。Wang等[19]采用密度泛函理论研究表明Cu-Pd/Al2O3催化剂能有效地离解H2;Feng等[20]成功实现了Cu-Pd/Al2O3催化下邻硝基苯胺和醇通过氢转移反应和成环反应耦合制备苯并咪唑衍生物。基于上述文献结果,本文首次提出并实现了在近临界异丙醇介质中Cu-Pd/Al2O3催化转移氢化糠醛制备糠醇。
2 实验部分 2.1 实验试剂糠醛(99%(wt))、糠醇(99%(wt))购自美国Sigma-Aldrich公司;三水硝酸铜(AR)、二水硝酸钯(AR)、硝酸铝(AR)、氢氧化钠(AR)、碳酸钠(AR)、无水甲醇(AR)、异丙醇(AR)均购自国药集团化学试剂有限公司;去离子水自制。
2.2 装置与实验过程实验采用容积为14.5 mL的微型高压反应釜,其由釜体、锥堵和压帽组成,釜体和锥堵都选用316L不锈钢。反应釜最高使用压力为20 MPa,最高工作温度为300℃。加热装置是由大连科茂实验设备有限公司制造的电加热炉,采用控温程序(PID)调节加热温度,控温精度±1℃。
实验过程:在反应釜中加入一定量的糠醛、异丙醇和催化剂。密封后置于预先加热至反应温度的电加热炉中进行反应。待到达预定时间后,立即取出反应釜,放入冷水中冷却终止反应。待其完全冷却后,打开反应釜,用甲醇洗涤,将洗液转移到25 mL容量瓶中定容。溶液经0.22 µm微孔有机滤膜过滤后,用气相色谱(GC-FID)进行定量分析,用气质(GC-MS)进行定性分析。文中的数据为三次重复实验的平均值,标出的误差棒为三次数据的标准偏差。
2.3 产物分析方法实验样品使用气相色谱-氢火焰检测器(GC-FID,Aglient 7890A)进行定量分析。色谱柱为:Aglient HP-5毛细管柱(30 m × 0.32 mm × 0.25 µm);进样温度:300 ℃;进样量:1 µL;分流比:10:1;FID检测温度:300℃;程序升温:30℃保持4 min,之后以每分钟10℃的速度升温至140℃,再以每分钟20℃的速度升温至300℃并保持2 min。
2.4 催化剂制备Cu-Pd/Al2O3系列催化剂采用共沉淀法制备[17, 18],共制备了6种不同负载量的Cu-Pd/Al2O3催化剂,分别为:20% Cu/Al2O3,19% Cu-1% Pd/Al2O3,18% Cu-2% Pd/Al2O3,17% Cu-3% Pd/Al2O3,16% Cu-4% Pd/Al2O3,2% Pd/Al2O3,其中前5种Cu和Pd总的负载量为20%。具体制备过程如下:根据所需要的催化剂中各个组分所占的比例,配制一定浓度的硝酸铜、硝酸钯和硝酸铝的混合溶液,记为溶液A(400 mL)。配制0.8 mol·L-1氢氧化钠和0.25 mol·L-1碳酸钠混合溶液,记为溶液B(400 mL)。将溶液A与B同时缓慢滴加到含有100 mL去离子水的三角烧瓶(三角烧瓶放置在30℃的恒温水浴锅中)中,并不断搅拌维持pH值在9.5附近(用pH计进行实时监控)。当溶液A滴加完之后,停止滴加,继续搅拌3 h后静置陈化24 h,然后过滤、洗涤直至滤液pH接近7。再将得到的催化剂前躯体放入鼓风干燥箱中,在110℃下干燥12 h,接着在马弗炉中、450℃下焙烧4 h,升温速率为2℃·min-1。催化剂使用前,在管式炉中450℃下用氢气还原2 h,氢气流速为60 mL·min-1,升温速率为10℃·min-1。
2.5 催化剂表征催化剂的物相组成采用X-射线衍射(XRD)分析,使用荷兰PANalytical公司的Empyrean 200895 X-射线衍射仪分析样品,用镍滤过的Cu Kα射线源(λ=0.154 nm),管电流30 mA,管电压40 kV,催化剂样品的扫描范围为10~80°。
催化剂的比表面积、孔径和孔容的测定采用美国Micromeritics公司的ASAP2020静态容量法全自动分析仪。测定前,催化剂样品先在300℃下抽气预处理16 h,准确称量样品的实际重量后采用N2吸附法测得其吸附量。催化剂样品的比表面积采用Brunauer-Emmett-Teller(BET)方程计算,其孔径和孔容采用Barret-Joyner-Halenda (BJH)等效圆柱模型计算。
3 结果与讨论 3.1 催化剂的筛选对前面制备的6种不同负载量的Cu-Pd/Al2O3催化剂进行了近临界异丙醇中糠醛催化转移氢化反应效果的评价,结果如图 1所示,其中FAL代表糠醛、FOL代表糠醇,反应条件如下:异丙醇为5 mL,糠醛浓度为20 mg·mL-1,催化剂用量为25 mg,反应温度为190℃,反应时间为3 h。从图 1中可以看出,双负载Cu-Pd/Al2O3优于单独的Cu/Al2O3和Pd/Al2O3;随着Pd负载量的增加,糠醇的收率呈先增大后减小的趋势,其中含2~4%Pd的Cu-Pd/Al2O3催化剂催化效果相近,糠醇收率都在86%以上;考虑到Pd为贵金属,选用18%Cu-2% Pd/Al2O3催化剂开展后面的研究。

|
图 1 不同负载量的Cu-Pd/Al2O3催化剂对糠醛催化转移氢化反应的影响 Fig.1 Effects of Cu-Pd/Al2O3 catalyst with different Cu-Pd loadings on catalytic transfer hydrogenation of furfural to furfuryl alcohol |
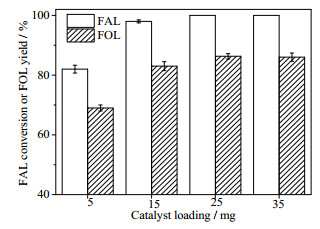
图 2为18%Cu-2%Pd/Al2O3催化剂用量对糠醛催化转移氢化反应的影响,其中异丙醇为5 mL,糠醛浓度为20 mg·mL-1,反应温度为190℃,反应时间为3 h。从图 2可以看出,随着催化剂用量的增加,糠醇收率增加,但催化剂用量25 mg以后变化不大,因而后面的研究选定催化剂用量为25 mg。
|
图 2 催化剂用量对糠醛催化转移氢化反应的影响 Fig.2 Effects of catalyst loading on catalytic transfer hydrogenation of furfural to furfuryl alcohol |
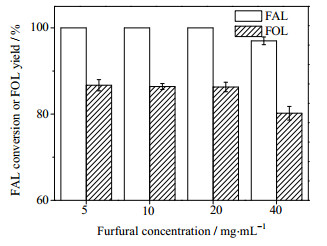
图 3为糠醛浓度对糠醛催化转移氢化反应的影响,其中异丙醇为5 mL,18% Cu-2%Pd/Al2O3催化剂用量为25 mg,反应温度为190℃,反应时间为3 h。从图 3可以看出,糠醛浓度在5~20 mg·mL-1范围内糠醇的收率变化不大,糠醛的浓度进一步增加时糠醇收率会减少,因而后面的研究选定糠醛浓度为20 mg·mL-1。
|
图 3 糠醛浓度对糠醛催化转移氢化反应的影响 Fig.3 Effects of furfural concentration on catalytic transfer hydrogenation of furfural to furfuryl alcohol |
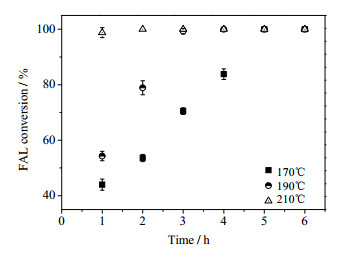
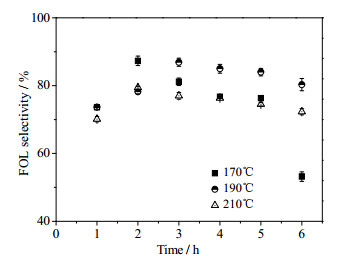
图 4~6分别为反应温度和反应时间对糠醛转化率、糠醇收率和糠醇选择性的影响,其中异丙醇为5 mL,糠醛浓度为20 mg·mL-1,催化剂用量为25 mg。从图 4可以看出,温度对糠醛催化转移氢化反应影响很大,在170℃时糠醛需要5 h才能完全转化,而190℃时只需要3 h,210℃时糠醛完全转化时间小于1 h;从图 5可见,糠醇的收率随反应时间的延长有一极大值,表明糠醛催化转移氢化制备糠醇的反应是一个连串反应,产物糠醇会进一步转化,糠醇收率的最大值出现在190℃、反应时间3 h,此时糠醇收率达到86.4%;从图 6可知,糠醇的选择性随反应时间的延长也有一极大值,反应温度为170℃、反应2 h时,糠醇的选择性最大为87.3%。
|
图 4 反应温度和反应时间对糠醛转化率的影响 Fig.4 Effects of temperature and time on furfural conversion |

|
图 5 反应温度和反应时间对糠醇收率的影响 Fig.5 Effects of temperature and time on furfuryl alcohol yield |
|
图 6 反应温度和反应时间对糠醇选择性的影响 Fig.6 Effects of temperature and time on furfuryl alcohol selectivity |
图 7为18% Cu-2%Pd/Al2O3催化剂的重复使用性能,其中异丙醇为5 mL,糠醛浓度为20 mg·mL-1,催化剂用量为25 mg,反应温度为190℃,反应时间3 h。催化剂重复使用前在管式炉中450℃下用氢气还原1 h。从图 7可以看出,催化剂重复使用4次后,催化剂依然有很好的催化活性,可见18% Cu-2%Pd/Al2O3催化剂的重复使用性能良好。
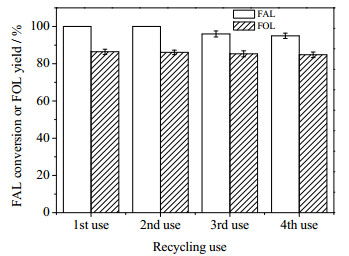
|
图 7 18% Cu-2%Pd/Al2O3催化剂的重复使用性能 Fig.7 Reusability of 18% Cu-2%Pd/Al2O3 catalyst |
为了探究不同Cu、Pd负载量的Cu-Pd/Al2O3催化剂催化性能差异的原因以及催化剂重复使用前后物相组成与孔结构的变化情况,本文还进行了X射线衍射和氮气吸脱附表征。
3.6.1 XRD图 8为不同Cu、Pd负载量的Cu-Pd/Al2O3催化剂的X射线衍射图谱,从图可见:20%Cu/Al2O3的晶相中Cu的出峰位置为2θ= 43.4°,50.6°和74.3°;2%Pd/Al2O3的晶相中Pd的出峰位置为2θ= 40.5°和47.8°;Al2O3的出峰位置为2θ= 67.4°。在不同Cu、Pd负载量的Cu-Pd/Al2O3中,随着Cu和Pd的负载量的增加,对应特征衍射峰强度也增加;18%Cu-2%Pd/Al2O3催化剂重复使用前后对应的特征衍射峰强度变化不大,表明催化剂物相组成基本不变;虽然载体氧化铝的在67.4°的衍射峰很弱,但仍可鉴别氧化铝的构型为γ型。
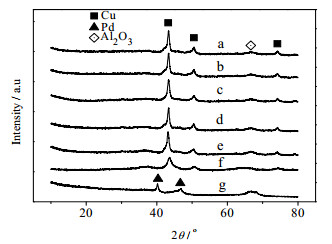
|
图 8 不同Cu、Pd负载量的Cu-Pd/Al2O3催化剂的X射线衍射图谱 Fig.8 XRD patterns of the Cu-Pd/Al2O3 catalysts |
表 1为不同Cu-Pd/Al2O3催化剂的比表面积、孔径和孔容数据,从表可见:2% Pd/Al2O3的比表面积为270 m2·g-1,而20%总负载量Cu-Pd/Al2O3的比表面积只有80~90 m2·g-1,即Cu和Pd的总负载量越大,比表面积越小;在20%总负载量Cu-Pd/Al2O3中Cu的占比越大比表面积越小,而孔容和孔径的变化规律正好相反;18% Cu-2% Pd/Al2O3催化剂重复使用前后孔结构变化不大。
| 表 1 Cu-Pd/Al2O3催化剂的比表面积、孔径和孔容数据 Table 1 Surface area, pore size and pore volume of Cu-Pd/Al2O3 catalysts |
从图 8和表 1可见,催化剂使用前后对应的特征衍射峰强度和孔结构的变化都不大,为催化剂重复使用性能的稳定提供了依据。
采用GC-MS(Agilent 7890B-5977A)对反应产物品进行定性分析,产物中除了糠醇外还检测出2-甲基呋喃和丙酮。丙酮由异丙醇脱氢产生,而2-甲基呋喃是糠醇进一步氢化的产物。因此,糠醛催化转移氢化制备糠醇的反应是一个连串反应,糠醛氢转移的产物糠醇会进一步发生氢转移反应生成2-甲基呋喃,反应途径如图 9所示。
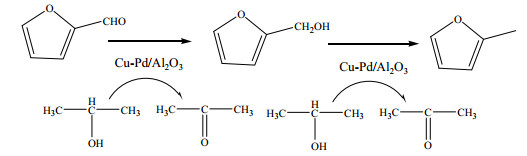
|
图 9 反应途径 Fig.9 Scheme of the reaction pathway |
(1) 提出并建立了一种近临界异丙醇中,Cu-Pd/Al2O3催化糠醛转移氢化制备糠醇的方法;
(2) 得到了较佳的工艺条件:在18%Cu-2%Pd/Al2O3催化下,反应温度为190℃、反应时间为3 h时,糠醛转化率为100%、糠醇收率达到86.4%;
(3) 18%Cu-2%Pd/Al2O3催化剂重复使用性能良好。
| [1] | Mamman A S, Lee J M, Kim Y C, et al. Furfural: Hemicellulose/xylose-derived biochemical[J]. Biofuels, Bioproducts and Biorefining, 2008, 2(5): 438-454.DOI:10.1002/bbb.v2:5. |
| [2] | XU Xiu-xiu(徐秀秀), LÜ Xi-lei(吕喜蕾), FU Jie(傅杰), et al. Catalytic decomposition of furfural residue with dilute sulfuric acid to produce levulinic acid in high temperature liquid water(高温液态水中稀硫酸催化糠醛渣降解制备乙酰丙酸)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2015, 29(6): 1377-1382. |
| [3] | Nagaraja BM, Padmasri AH, Raju BD, et al. Vapor phase selective hydrogenation of furfural to furfuryl alcohol over Cu-MgO coprecipitated catalysts[J]. Journal of Molecular Catalysis A: Chemical, 2007, 265(1): 90-97. |
| [4] | Sharma RV, Das U, Sammynaiken R, et al. Liquid phase chemo-selective catalytic hydrogenation of furfural to furfuryl alcohol[J]. Applied Catalysis A: General, 2013, 454: 127-136.DOI:10.1016/j.apcata.2012.12.010. |
| [5] | LI Dian-qing(李殿卿), ZHU Zhuo-qun(朱卓群), WANG Fu-rong(王福荣). Measurement of model parameters for furfuryl alcohol hydrogenation reaction with impulse-response technique(脉冲-应答技术测定糠醇加氢反应的模型参数)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 1993, 7(3): 262-266. |
| [6] | CAO Xiao-xia(曹晓霞), XIANG Yi-zhi(项益智), LU Chun-shan(卢春山), et al. In-situ reduction of furfural to furfuryl alcohol with hydrogen derived from aqueous-phase reforming of methanol(甲醇水相重整制氢原位还原糠醛制备糠醇)[J]. Rare Metal Materials and Engineering(稀有金属材料与工程), 2010, 39(Supplement 2): 516-520. |
| [7] | Xu Y, Qiu S, Long J, et al. In situ hydrogenation of furfural with additives over a RANEY Ni catalyst[J]. RSC Advances, 2015, 5(111): 91190-91195.DOI:10.1039/C5RA12844G. |
| [8] | Dong J, Zhu MM, Zhang GS, et al. Highly selective supported gold catalyst for CO-driven reduction of furfural in aqueous media[J]. Chinese Journal of Catalysis, 2016, 37(10): 1669-1675.DOI:10.1016/S1872-2067(16)62458-0. |
| [9] | Panagiotopoulou P, Martin N, Vlachos D G. Effect of hydrogen donor on liquid phase catalytic transfer hydrogenation of furfural over a Ru/RuO2/C catalyst[J]. Journal of Molecular Catalysis A: Chemical, 2014, 392: 223-228.DOI:10.1016/j.molcata.2014.05.016. |
| [10] | Panagiotopoulou P, Martin N, Vlachos D G. Liquid-phase catalytic transfer hydrogenation of furfural over homogeneous lewis acid-Ru/C catalysts[J]. ChemSusChem, 2015, 8(12): 2046-2054.DOI:10.1002/cssc.201500212. |
| [11] | Kannapu HPR, Mullen C A, Elkasabi Y, et al. Catalytic transfer hydrogenation for stabilization of bio-oil oxygenates: Reduction of p-cresol and furfural over bimetallic Ni-Cu catalysts using isopropanol[J]. Fuel Processing Technology, 2015, 137: 220-228.DOI:10.1016/j.fuproc.2015.04.023. |
| [12] | Scholz D, Aellig C, Hermans I. Catalytic transfer hydrogenation/hydrogenolysis for reductive upgrading of furfural and 5-(hydroxymethyl) furfural[J]. ChemSusChem, 2014, 7(1): 268-275.DOI:10.1002/cssc.v7.1. |
| [13] | Villaverde MM, Garetto TF, Marchi A J. Liquid-phase transfer hydrogenation of furfural to furfuryl alcohol on Cu-Mg-Al catalysts[J]. Catalysis Communications, 2015, 58: 6-10.DOI:10.1016/j.catcom.2014.08.021. |
| [14] | Biradar N S, Hengne A M, Sakate S S, et al. Single pot transfer hydrogenation and aldolization of furfural over metal oxide catalysts[J]. Catalysis Letters, 2016, 146(8): 1611-1619.DOI:10.1007/s10562-016-1786-6. |
| [15] | Li J, Liu J L, Zhou H J, et al. Catalytic transfer hydrogenation of furfural to furfuryl alcohol over nitrogen-doped carbon-supported iron catalysts[J]. ChemSusChem, 2016, 9(11): 1339-1347.DOI:10.1002/cssc.201600089. |
| [16] | Li H, He J, Riisager A, et al. Acid-base bifunctional zirconium N-alkyltriphosphate nanohybrid for hydrogen transfer of biomass-derived carboxides[J]. ACS Catalysis, 2016, 6(11): 7722-7727.DOI:10.1021/acscatal.6b02431. |
| [17] | Sanchez-Escribano V, Arrighi L, Riani P, et al. Characterization of Pd-Cu alloy nanoparticles on γ-Al2O3-supported catalysts[J]. Langmuir, 2006, 22(22): 9214-9219.DOI:10.1021/la0616101. |
| [18] | Lodziana Z, Nørskov J K. Adsorption of Cu and Pd on α-Al2O3 (0001) surfaces with different stoichiometries[J]. Journal of Chemical Physics, 2001, 115(24): 11261-11267.DOI:10.1063/1.1421107. |
| [19] | Wang H, Chen L, Lv Y, et al. H2 dissociation on gamma-Al2O3 supported Cu/Pd atoms: A DFT investigation[J]. Applied Surface Science, 2014, 290: 154-160.DOI:10.1016/j.apsusc.2013.11.019. |
| [20] | Feng F, Ye J, Cheng Z, et al. Cu-Pd/gamma-Al2O3 catalyzed the coupling of multi-step reactions: direct synthesis of benzimidazole derivatives[J]. RSC Advances, 2016, 6(76): 72750-72755.DOI:10.1039/C6RA13004F. |




