2. 聚烯烃催化技术与高性能材料国家重点实验室,上海 200062;
3. 上海市聚烯烃催化技术重点实验室,上海 200062
2. State Key Laboratory of Polyolefins and Catalysis, Shanghai 200062, China;
3. Shanghai Key Laboratory of Catalysis Technology for Polyolefins, Shanghai 200062, China
挥发性有机物(VOCs)是空气中的主要污染物之一。其中机动车尾气、工业涂料和化学生产用溶剂是其3大主要来源。这些化合物大部分具有毒性,会在大气中形成二次颗粒,间接导致光化学烟雾[1]。正庚烷是化学生产用溶剂主要成分之一,不仅会危害人体健康,还是光化学烟雾的来源之一[2]。
目前,燃烧法技术较为成熟,是市场上常用的VOCs处理方法之一[3]。相比蓄热燃烧法存在操作温度高(650~1100℃),燃烧不完全容易产生NOx而造成二次污染等问题。催化燃烧能在相对较低的温度下将VOCs完全降解为二氧化碳和水,被认为是一种环境友好型VOCs治理技术[4]。
负载型贵金属催化剂常用于VOCs催化燃烧中,具有优异的低温催化活性[5-6]。然而,它们价格昂贵,容易中毒失活[7]。过渡金属氧化物具有低成本、较高催化活性及较高的抗毒性等优点[8-10],被认为是贵金属催化剂的替代品之一。其中,具有尖晶石结构的Co3O4因其优异的催化性能以及在工业反应中的广泛应用而备受关注[11-13]。
众所周知,金属氧化物的取代会导致原材料性质显著变化。在最近的研究中,作者采用氨水-共沉淀法制备了Cu改性的Co3O4尖晶石型催化剂,优化制备条件使实际元素摩尔比例与理论值接近,并评估了其氧化挥发性有机化合物的可行性。结果表明,Cu进入尖晶石型Co3O4中,显著提升了催化剂的活性与稳定性。Wang等[14]制备了系列Ce-Co复合氧化物催化剂,研究发现Co3O4中Ce的存在对催化剂的氧化还原性能和化学状态有着显著影响;Chen等[15]发现La-Co复合材料催化活性明显优于单组分材料,这主要取决于还原性能及氧流动性的提升。
研究表明,不同价态金属掺杂会导致尖晶石电子性质和结构稳定性不同程度的变化[16-19],但对于同价或高价金属改性复合尖晶石型氧化物的系统性研究鲜有报道。因此,本文采用共沉淀法制备了系列Ce、La取代的Cu-Co复合氧化物,通式为MxCu1.5-xCo6-O(M=Ce、La,x=0.3~0.7),考察了其降解正庚烷活性,并通过XRD、BET、SEM、H2-TPR、O2- TPD和XPS等表征手段研究了与这些催化剂催化性能相关的理化性质。
2 实验(材料与方法) 2.1 试剂Co(NO3)2·6H2O、Cu(NO3)2·3H2O、La(NO3)3·6H2O、Ce(NO3)3·6H2O (分析纯,上海展云化工有限公司);NH4OH(分析纯,上海国药有限公司);正庚烷(C7H16,分析纯,国药集团化学试剂有限公司);去离子水(自制);氮气(纯度99.999%)。
2.2 实验方法 2.2.1 催化剂制备按一定物质的量比称取Cu、Co、Ce(La)硝酸盐溶解于45 mL去离子水中,保持{n(Cu)+n(M)}:n(Co)=1:4 (M: Ce、La),配制成金属离子浓度为0.12 mol·L-1的透明溶液,待用。以去离子水为溶剂,以NH4OH溶液(3 mol·L-1)作为沉淀剂,在室温下,边搅拌边缓慢滴加沉淀剂至硝酸盐溶液中,调节pH=8.5。陈化12 h后过滤,用去离子水洗涤若干次,于110℃干燥12 h,得到前驱体粉末。前驱体粉末置于马弗炉500℃焙烧5 h,得到催化剂材料。根据所用Ce(La)取代量不同,分别将样品标记为Ce 0.3、Ce 0.5、Ce 0.7、La 0.3、La 0.5、La 0.7。未改性催化剂作为空白样标记为Cu-Co。
2.2.2 催化剂表征分别采用X射线衍射仪(Arlx TRA型,瑞士Thermo Fisher科技公司)、扫描电子显微镜(Melin Compact型,德国Carl Zeiss公司)、物理吸附分析仪(V-Sorb 2800TP型,北京金埃谱科技有限公司)和光电子能谱仪(Escalab 250Xi型,瑞士Thermo Fisher科技公司)对催化剂进行结构(晶型、形貌、比表面积、元素结合态等)进行分析。采用氢气程序升温还原(H2⁃TPR)实验与氧气程序升温脱附(O2⁃TPD)实验考察了催化剂氧化还原性能和表面活性氧分布情况。
2.2.3 催化剂活性评价常温常压下,称取催化剂粉末0.15 g,与0.75 g石英砂均匀混合,装填于石英微反应器(ϕ=4 mm)中。反应气体为正庚烷/空气/氮气混合气体,其中体积空速为15000 h-1,正庚烷体积分数为0.18%。催化活性测定在150~225℃进行,正庚烷转化率根据入口和出口浓度之间的差异计算,公式如下:
| $ Y{\rm{ = }}\frac{{{C_1} - {C_2}}}{{{C_1}}} \times 100{\rm{\% }} $ | (1) |
式中:Y为正庚烷转化率;C1为正庚烷进口质量分数(%);C2为正庚烷出口质量分数(%)。
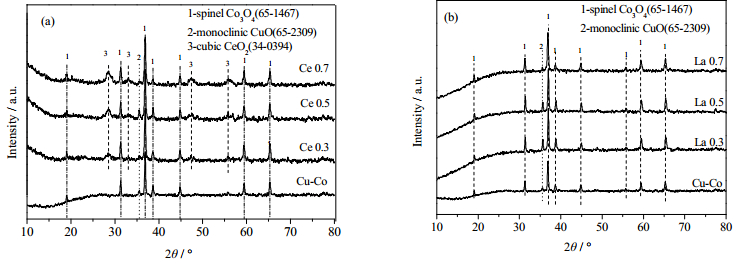
3 实验结果与讨论 3.1 晶型与晶体结构表 1为不同Ce、La改性的Cu-Co氧化物催化剂的晶体结构数据,图 1(a) (b)分别是Ce、La改性的Cu-Co氧化物催化剂的XRD图。所有样品在19.0°、31.4°、36.9°、38.6°、44.9°、55.7°、59.4°和65.4°处均出现衍射峰,归属于Co3O4尖晶石结构(PDF card No. 65-1467),均在2θ = 35.54°处出现CuO特征峰,表明未改性的Cu-Co催化剂与改性样品均存在Co3O4尖晶石相与CuO单斜晶相。Ce改性的Cu-Co氧化物在28.6、33.1、47.5、56.3、59.1°处出现衍射峰,归属于CeO2四方相(PDF card No. 34-0394),同时随着Ce含量的提高峰强度提升;而La改性催化剂未出现新的La2O3晶相。以谢尔公式计算(311)晶面可知:1)对于Ce改性催化剂,随Ce含量提高,晶面间距呈现先减小后增大的趋势,从Cu-Co的33.4 nm减小到Ce 0.5的30.8 nm,而继续提高Ce取代量,晶面间距提高;晶胞常数大小顺序为:Ce 0.5 > Ce 0.3 > Cu-Co > Ce 0.7 (见表 1),这意味着,Ce 0.5和Ce 0.3中更多Ce进入Co3O4尖晶石结构中,而Ce 0.7中更多Cu进入Co3O4尖晶石结构中。2)对于La改性催化剂,随La取代量提高,晶面间距先增大后减小,少量La取代的La 0.3晶面间距增大,而继续提高La取代量减小至La 0.7的26.8 nm;晶胞常数大小顺序为:La 0.3 > Cu-Co > La 0.7 > La 0.5,这意味着,La 0.3中更多La进入Co3O4尖晶石结构中,而La 0.7与La 0.5中更多Cu进入Co3O4尖晶石结构中。
|
|
表 1 不同Ce、La改性Cu-Co催化剂结构特征参数 Table 1 Structural properties of different Ce and La doped Cu-Co catalysts |
|
图 1 不同Ce(a)、La(b)改性Cu-Co催化剂XRD谱图 Fig.1 XRD patterns of different Ce (a) and La (b) doped Cu-Co catalysts |
综上可知,La(Ce)与Co、Cu间的相互作用会不同程度影响催化剂的晶型及晶体结构。不同量的La和Ce改性会呈现出不同的影响,少量Ce及较大量La的掺杂使催化剂晶粒尺寸减小并提高催化剂中相对高活性组分的含量。
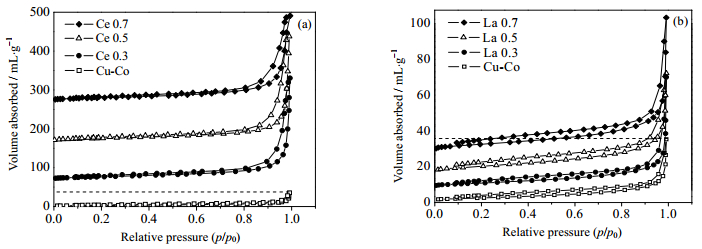
3.2 表面形貌与结构图 2(a) (b)分别为Ce、La改性的Cu-Co氧化物催化剂的氮气吸附-脱附等温线。从图 2中可以看出,所有样品均出现明显回滞环,Ce改性催化剂出现Ⅳ型等温线,而La改性催化剂均为Ⅲ型等温线,表明催化剂均具有介孔结构,而后者介孔结构主要由颗粒堆积产生的。样品比表面积、孔容及平均孔径列于表 2。结果表明,1) Ce改性催化剂比表面积与平均孔径显著提高,随Ce掺杂量提高,催化剂比表面积由9.25增加至43.74 m2·g-1;平均孔径先增大后减小,孔容先增大后减小。2) La改性催化剂比表面积稍有提高,随La取代量提高,比表面积先减小后增大,少量La取代的La 0.3比表面积增大,而继续提高La取代量,增大至La 0.7的20.19 m2·g-1;平均孔径与孔容都有所增大,但无明显变化趋势。
|
图 2 不同Ce、La改性Cu-Co催化剂N2吸附-脱附等温线 Fig.2 N2 adsorption-desorption isotherms of Ce (a) and La (b) doped Cu-Co catalysts |
|
|
表 2 不同Ce、La改性Cu-Co催化剂N2吸附-脱附实验结果 Table 2 N2 adsorption-desorption results of different Ce and La modified Cu-Co catalysts |
图 3为未改性及Ce、La改性的Cu-Co氧化物催化剂的SEM图。可以看出,1) Ce部分取代Cu后,催化剂形貌出现明显变化,随Ce取代量提高逐渐从“颗粒聚集”向“花瓣”形貌转变。有研究表明[20],Cu与Ce复合氧化物间的相互作用会导致具有纹理的形貌特征。这种形貌可能增加了催化剂的比表面积。2) La部分取代Cu后,催化剂形貌维持“颗粒聚集”形貌,这可能导致其较小程度的比表面积变化。

|
图 3 不同Ce、La改性Cu-Co催化剂扫描电镜图 Fig.3 SEM micrographs of Ce and La doped Cu-Co catalysts (a) Cu-Co catalyst (b) Ce 0.5 sample (c) Ce 0.7 sample (d) La 0.5 sample (e) La 0.7 sample |
综上可知,La(Ce)的掺杂会不同程度的影响催化剂的形貌及表面结构(包括比表面积、平均孔容和平均孔径的增大,以及转变为多级形貌),从而影响催化反应的扩散效应。
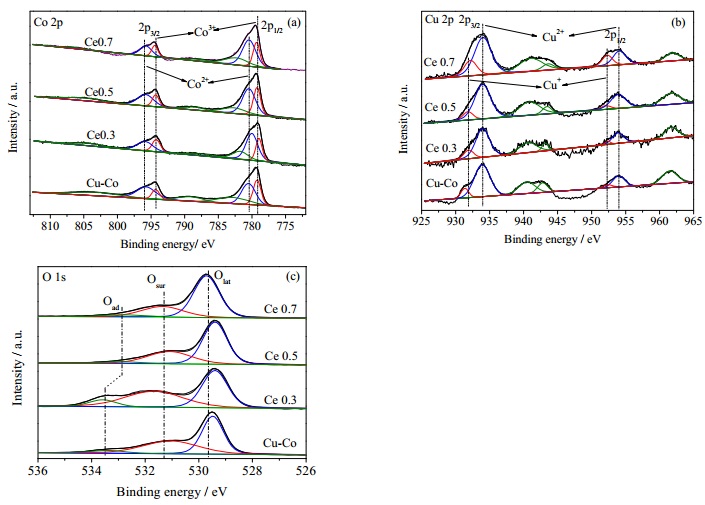
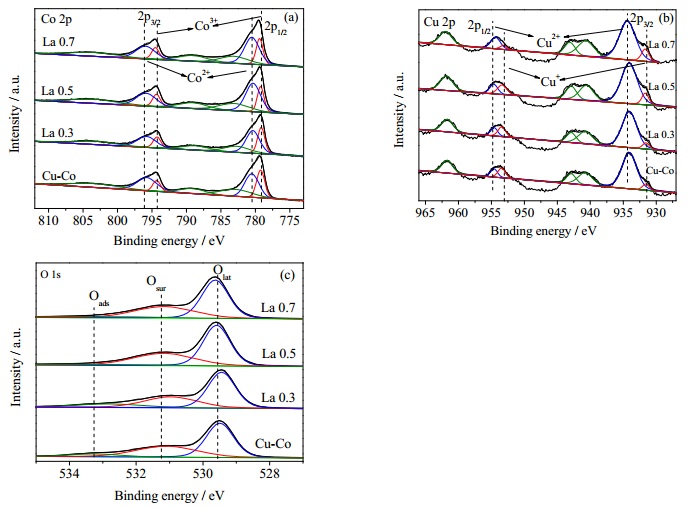
3.3 表面电子结构图 4和5分别为Ce、La改性Cu-Co催化剂的Co2p、Cu2p以及O1s的XPS谱图。通过峰拟合计算得出的表面元素分布数据列于表 3。可见,1) Ce改性催化剂表面Cu含量变化很小,而对于La改性催化剂,催化剂表面Cu含量先增大后减小,表明适量的La有利于Cu在催化剂表面分散。2)随Ce(La)含量的增加,Ce改性催化剂表面Co含量减小,而La改性催化剂表面Co含量提高且相对含量远大于理论值,表明La确实起到了助分散的作用,这与文献报告相符[21]。3)随Ce含量的增加,Ce改性催化剂表面Ce含量提高,表明越来越多的Ce富集于催化剂表面;随La含量的提高,La改性催化剂表面La反而降低,表明越来越多的La进入尖晶石晶格内。
|
图 4 Ce改性Cu-Co催化剂Co2p, O2p和O1s的XPS谱图 Fig.4 XPS spectra of Co2p, O2p and O1s for Ce doped Cu-Co catalysts |
|
图 5 La改性Cu-Co催化剂Co2p, O2p和O1s的XPS谱图 Fig.5 XPS spectra of Co2p, O2p and O1s for La doped Cu-Co catalysts |
|
|
表 3 不同Ce、La改性Cu-Co催化剂表面元素分布 Table 3 Element distribution of Ce and La doped Cu-Co catalysts |
由图 4(a)、5(a)可见,Co2p的XPS谱图中于795与780 eV附近出现明显的Co3O4峰位。根据文献,结合能(BE)分别位于779.6~780.1 eV附近,同时2p3/2和2p1/2之间出现15.1 eV的自旋–轨道分裂的峰被认为是Co3+特征峰;结合能(BE)位于780.9~781.4 eV同时2p3/2和2p1/2之间出现15.15 eV的自旋–轨道分裂的峰被认为是Co2+特征峰。催化剂样品表面Co2+的百分含量及结合能数值见表 3。可以看出,1)对于Ce改性Cu-Co催化剂,随着Ce含量的增加,Co2+的相对含量先增大后减小,相对含量顺序为:Ce 0.5 > Ce 0.7 > Ce 0.3 > Cu-Co。2)对于La改性Cu-Co催化剂,随着La含量的增加,Co2+的相对含量先减小后增大,相对含量顺序为:La 0.7 > La 0.5 > Cu-Co > La 0.3。
由图 4(b)、5(b)可见,在934.2和954.1 eV附近分别出现Cu2p3/2和Cu 2p1/2信号峰,Cu2p3/2和Cu2p1/2分别解构成两个峰,归属于931.4和951.9 eV附近的结合能低的Cu+信号峰与934.3和954.1 eV的结合能较高的Cu2+信号峰。催化剂样品表面Cu2+的百分含量见表 3。可见,Ce、La改性Cu-Co催化剂表面Cu+相对含量随着Ce、La掺杂量的提升而提高。这可能是由于越来越多的高价La、Ce离子为Cu2+提供额外的电子,使其还原为低价Cu+[22]。
由图 4(c)、5(c)可见,不同样品的O 1s XPS谱图均可解析为3个峰,即529~530 eV的晶格氧(Olatt)、530~532 eV的表面氧(Osur)及533~534 eV的羟基氧(Oads)[23]。催化剂样品表面晶格氧的百分含量及结合能数值见表 3。可见1)催化剂经过Ce修饰后,吸附氧相对含量先减小后增大,其中Ce 0.5含量最高;吸附氧结合能波动较大,对应的吸附氧绝对含量的变化趋势与O2-TPD结果相一致。2)催化剂经过La修饰后,吸附氧相对含量先增大后减小,其中La 0.7含量最高;表面吸附氧结合能随La掺杂量提高而提高,对应的吸附氧绝对含量的变化趋势与O2-TPD结果相一致。
综上可知,La(Ce)的掺杂会不同程度影响催化剂的表面电子结构,尤其对主要阳离子的Co2+/Co3+及氧物种的影响会直接影响催化氧化反应过程,从而影响催化剂活性。
3.4 氢气程序升温还原(H2-TPR)图 6为Ce、La改性Cu-Co催化剂的H2-TPR图。如图所示,Cu-Co催化剂存在三个特征还原峰[24]:α峰出现在189℃附近,其归属于Cu2+还原为Cu0;β峰出现在208℃附近,其归属于Co3+还原为Co2+;289℃附近的γ峰对应Co2+进一步还原为Co0。
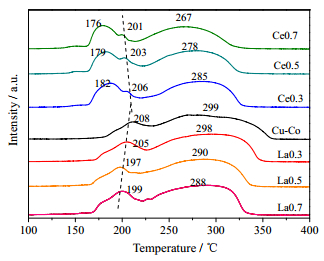
|
图 6 不同Ce、La改性Cu-Co催化剂H2-TPR图 Fig.6 H2-TPR results of Ce and La doped Cu-Co catalysts |
对于Ce改性催化剂,在低温范围内(175~185℃)出现了一个较强的还原峰,这可能归属于CoO(OH)物种还原为Co3O4的过程[25]。纯的CeO2通常很难还原为Ce0,只在800℃左右还原为Ce2O3[26],因而在本次测试的温度范围内没有出现CeO2还原峰。如图 6所示,Ce改性催化剂耗氢峰向低温区域移动,峰面积显著增加,随着样品中Ce含量的增大,还原峰均出现明显的低温方向偏移。表明Ce的修饰对Cu-Co催化剂氧化还原性能有着促进作用。有文献指出,Ce与Co之间存在强烈的相互作用,从而提升了CeO2表面氧的还原性能[27];同时,Cu与Co之间也存在类似的作用[28]。对于La改性催化剂,还原峰的形状变化不大,表明催化剂在还原性气氛中的行为改变不大。随着样品中La含量的增大,还原峰面积增大,同时还原峰向低温区移动,表明La改性后的催化剂氧化还原性能提高,这与Chen等[15]报道的结果一致。综上可知,随着La(Ce)的掺杂,催化剂的氧化还原性能逐渐提高,而对于氧化还原型催化反应,氧化还原性能是影响催化剂降解活性的重要因素。
3.5 氧气程序升温脱附(O2-TPD)通常,氧物种在催化过程中会发生如下变化:O2(物理吸附氧)→O2−(化学吸附氧)→O−(化学吸附氧)→O2− (晶格氧)[29]。其中吸附氧脱附温度较低,晶格氧脱附温度较高。图 7(a) (b)分别为Ce、La改性Cu-Co催化剂的O2-TPD图。一般来说,吸附氧的量可以作为氧空位的量度,而晶格氧脱附温度反映了晶格氧迁移率(活性)。
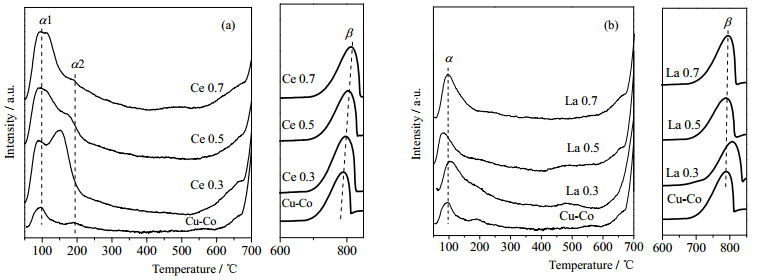
|
图 7 不同催化剂O2-TPD表征结果 Fig.7 O2-TPD results of different catalysts (a) Ce doped Cu-Co catalysts (b) La doped Cu-Co catalysts |
由图 7(a)可见,Ce改性催化剂均有两个明显的O2脱附峰(α峰与β峰):α峰位于300℃以下,且均存在一个低温区α1峰及一个高温区的α2峰,分别归属于物理吸附氧和氧空穴处化学吸附氧的脱附;β峰位于600℃以上,归属与Co离子氧化还原作用有关的晶格氧的脱附。相较于未改性催化剂,Ce改性后,表面吸附氧脱附峰强度显著增大,表明表面吸附氧含量提高,α2峰出现不同程度变化,其中Ce0.3峰面积最大,所处温度最低,表明其中存在含量最高且最活泼的化学吸附氧;β峰面积均较大,且随着Ce掺杂量提升,所处温度向高温区移动,晶格氧迁移率随之下降。
由图 7(b)可见,La改性催化剂均存在两个明显的O2脱附峰(α峰与β峰):α峰位于250℃以下,归属于物理吸附氧和氧空穴处化学吸附氧的脱附;β峰位于600℃以上,归属与Co离子氧化还原作用有关的晶格氧的脱附。相较于未改性催化剂,La改性后,α峰强度增大,表明表面吸附氧含量提高,其中La0.7峰面积最大,表明其存在高含量的表明吸附氧;随着La掺杂量提升,β峰面积呈现先减小后增大的趋势,其中La0.7面积最大,表明其中存在高含量晶格氧,而除了La0.3峰向高温区移动之外,其余样品所处温度基本不变,表明少量La改性会抑制晶格氧活性。
La、Ce改性催化剂的吸附氧含量均明显提高,可能的原因是,高价的La、Ce离子是路易斯碱,它们会吸附强的路易斯酸,如O2或X2(X为卤族元素)。由于La、Ce离子的碱度不强,气相O2不能完全被中和,从而与其他的路易斯碱反应。氧空位是强路易斯碱,当氧原子被除去时产生的未成对电子被转移到氧化物的阳离子上,减少了形成氧空位的能量,进而提高吸附氧含量[18]。丰富的氧物种会促进催化氧化反应向正方向进行。
3.6 催化剂活性分别考察了Ce、La二次改性Cu-Co催化剂降解正庚烷的性能。实验条件为:体积空速15000 h-1、正庚烷体积分数0.18%、O2体积分数10%,结果如图 8所示。各个催化剂降解正庚烷的T50和T90见表 4。(T50和T90为正庚烷转化率为50%或90%时的温度)。
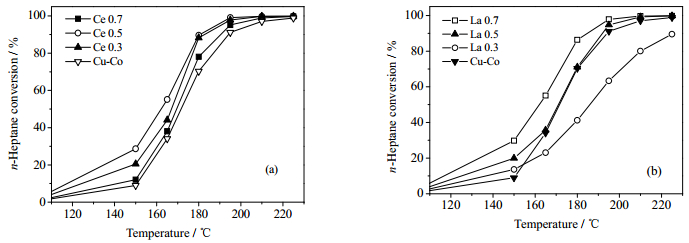
|
图 8 Ce 0.5 (a)和La 0.7 (b)上正庚烷的降解效果 Fig.8 Catalytic performance of catalysts Ce 0.5(a) and La 0.7(b) in n-heptane decomposition |
|
|
表 4 不同Ce、La改性Cu-Co催化剂降解正庚烷反应的T50和T90 Table 4 T50 and T90 of different Ce/La modified Cu-Co catalysts |
由图 8(a)与表 4可知,Ce二次改性Cu-Co氧化物对降解正庚烷活性均优于未改性Cu-Co催化剂,催化剂降解正庚烷的活性顺序为:Ce 0.5 > Ce 0.7 > Ce 0.3 > Cu-Co。随着Ce含量提高,催化剂活性先增后减。以Ce0.5催化剂活性最优,T50和T90分别为180.80和162.21℃。
由图 8(b)与表 4可知,La二次改性Cu-Co氧化物对降解正庚烷活性随La掺杂量增加先减小后增大,除La0.3之外,其他样品均表现出优于未改性Cu-Co催化剂的正庚烷降解活性。随着La含量提高,催化剂活性提高。以La0.7催化剂活性最优,T50和T90分别为161.99和184.73℃。
随着复合氧化物中Ce、La含量的增加,催化剂的BET比表面积和还原性能随之增加,这可能与Ce和Co物种的分散性逐渐增加有关,对材料的催化性能有着积极的影响。活性较好的样品,均有着较高的比表面积与还原性能。
根据文献[30]报道,较小晶粒尺寸的钴氧化物有利于提高其催化活性。图 9(a)表示不同Ce、La改性Cu-Co催化剂上催化燃烧正庚烷的T50与晶面间距间关系。由图可知,两者存在良好的正相关性。晶面间距越小,活性越高。有文献指出[31],催化剂晶粒尺寸的减小会提高低配位的氧缺陷位点数目,使活性氧物种含量提高,从而显著提高催化剂活性。另外,结合XRD结果可知,对于Ce改性催化剂,实际进入Co3O4尖晶石结构中的Ce相对于Cu含量高活性更高;对于La改性催化剂,实际进入Co3O4尖晶石结构中的La相对于Cu含量高活性降低。这与Ce、La单氧化物的活性存在一定联系。
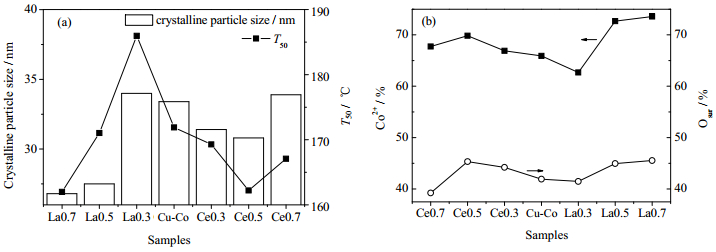
|
图 9 晶粒尺寸与T50的关系(a)及Co2+与Osur含量间关系(b) Fig.9 Relationship between T50 and crystalline particle size (a) relationship between Co2+ and Osur concentration (b) |
催化剂中Co2+的相对含量与催化剂表面化学吸附氧可能存在对应关系,从而影响催化活性,图 9(b)为催化剂表面Osur与Co2+相对含量随Ce、La取代量的变化趋势。由图可知,两者的变化趋势基本一致。图 10(a)、(b)分别为Ce、La改性Cu-Co催化剂表面Co2+相对含量与催化降解正庚烷T50(T90)的关系,可以看出,随着催化剂表面Co2+的提高T50(T90)下降。上述结果表明,Co2+对于提高催化剂吸附氧含量与活性都有着促进作用。一方面,Co-O-Co结构的存在维持了高的氧流动性。另一方面,Co2+具有最高的2p BE,尖晶石内四面体和八面体中的Co2+能在催化剂表面提供形成中间体最适合的结合能[32]。
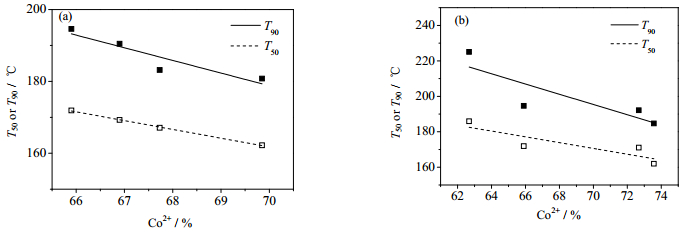
|
图 10 Ce (a)、La(b)改性Cu-Co催化剂中Co2+含量对T50和T90的影响 Fig.10 Effects of Co2+ concentrations of Ce (a) and La(b) doped Cu-Co catalysts on T50 and T90 |
基于表征与活性评价结果,Ce 0.5及La 0.7催化剂催化降解正庚烷的活性之所以最优,一方面是因为其较小的晶粒尺寸(La 0.7)或者多级形貌(Ce 0.5)导致反应时优良的扩散效应,另一方面可能与其较多的活性氧物种提高了活性位点的活性有关。
3.7 催化剂稳定性进一步考察了活性最优的Ce 0.5及La 0.7降解正庚烷的稳定性,以便为将来的工业应用提供基础数据。反应条件为:体积空速15000 h-1、温度200℃、氧气浓度10%、正庚烷浓度0.18%,连续反应500 min,实验结果如图 11所示。
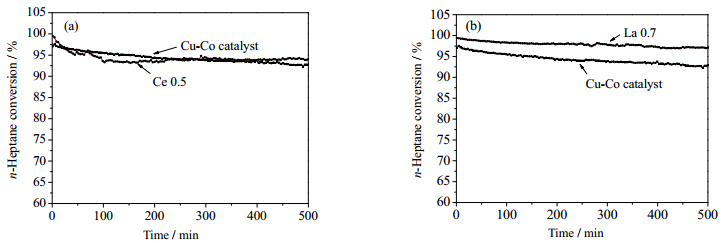
|
图 11 200℃下500min内对于Ce 0.5(a) and La 0.7 (b)的稳定性测试 Fig.11 Stability tests for Ce0.5 (a) and La 0.7 (b) at 200℃ over 500 min |
由图可见,500 min内,催化剂活性有所降低,但幅度不大,Ce 0.5上正庚烷转化率下降5.52%,La0.7上正庚烷转化率下降2.54%。对于含Ce、La改性的催化剂,催化剂的活性没有明显的失活,说明Ce、La修饰的Cu-Co催化剂Ce 0.5及La 0.7均具有一定的稳定性,其中La 0.7稳定性明显优于Cu-Co催化剂。
4 结论(1) 采用共沉淀法合成出了Ce、La改性的Cu-Co复合氧化物催化剂,与未改性Cu-Co催化剂相比,适量Ce、La的添加显著提高了催化剂物理与化学性能。
(2) Ce 0.5与La 0.7样品T90分别为180.80和184.74℃,相比于未改性Cu-Co催化剂,降解正庚烷的活性显著提高,关联表征结果,其高活性主要归结于助剂组分导致的大比表面积、强氧化还原性能和Co2+相关的吸附氧活性的增强。
(3) Ce 0.5和La 0.7的稳定性实验表明,在500 min内其对正庚烷活性变化较小,Ce 0.5上正庚烷转化率下降5.52%,La 0.7上正庚烷转化率下降2.54%,均具有一定的稳定性,且La 0.7稳定性明显优于Cu-Co催化剂。
| [1] | Kamal M S, Razzak S A, H M M. Catalytic oxidation of volatile organic compounds (VOCs)-a review[J]. Atmospheric Environment, 2016, 140: 117-134. DOI:10.1016/j.atmosenv.2016.05.031. |
| [2] | Carier W P L, Atkinson R. Atmospheric chemistry of alkanes[J]. Journal of Atmospheric Chemistry, 1985, 3(3): 377-405. DOI:10.1007/BF00122525. |
| [3] | Kolade M A, Kogelbauer A, Alpay E. Adsorptive reactor technology for VOC abatement[J]. Chemical Engineering Science, 2009, 64(6): 1167-1177. DOI:10.1016/j.ces.2008.11.005. |
| [4] | Zhou G, He X, Liu S, et al. Phenyl VOCs catalytic combustion on supported CoMn/AC oxide catalyst[J]. Journal of Industrial and Engineering Chemistry, 2015, 21(1): 932-941. |
| [5] | Bastos S S T, Carabineiro S A C, rf O J J M, et al. Total oxidation of ethyl acetate, ethanol and toluene catalyzed by exotemplated manganese and cerium oxides loaded with gold[J]. Catalysis Today, 2012, 180(1): 148-154. DOI:10.1016/j.cattod.2011.01.049. |
| [6] | Sp; spma B, Garcia T, Aul N E, et al. Promoting the activity and selectivity of high surface area Ni-Ce-O mixed oxides by gold deposition for VOC catalytic combustion[J]. Chemical Engineering Journal, 2011, 175(1): 271-278. |
| [7] | Kamiuchi N, Mitsui T, Yamaguchi N, et al. Activation of Pt/SnO2 catalyst for catalytic oxidation of volatile organic compounds[J]. Catalysis Today, 2010, 157(1-4): 415-419. DOI:10.1016/j.cattod.2010.02.063. |
| [8] | Lan H, Zhou G, Luo C, et al. High Efficiency CeCu composite oxide catalysts improved via preparation methods for propyl acetate catalytic combustion in air[J]. International Journal of Chemical Reactor Engineering, 2016, 14(3): 757-768. |
| [9] | Li X, Wang J, Liao C, et al. Catalytic combustion of ethyl acetate over CeMnOx and CeMnZrOx compounds synthesized by coprecipitation method[J]. Journal of Energy Chemistry, 2011, 20(6): 623-628. |
| [10] | He C, Xu B T, Shi J W, et al. Catalytic destruction of chlorobenzene over mesoporous ACeOx (A=Co, Cu, Fe, Mn or Zr) composites prepared by inorganic metal precursor spontaneous precipitation[J]. Fuel Processing Technology, 2015, 130(1): 179-187. |
| [11] | Tsoncheva T, Ivanova L, Rosnholm J, et al. Cobalt oxide species supported on SBA-15, KIT-5 and KIT-6 mesoporous silicas for ethyl acetate total oxidation[J]. Applied Catalysis B Environmental, 2009, 89(3-4): 365-374. DOI:10.1016/j.apcatb.2008.12.015. |
| [12] | Rubio-Marcos F, Calvino-Casilda V, Ba ares M A, et al. Control of the interphases formation degree in Co3O4/ZnO catalysts[J]. ChemCatChem, 2013, 5(6): 1431-1440. DOI:10.1002/cctc.v5.6. |
| [13] | Wang C A, Li S, An L. Hierarchically porous Co3O4 hollow spheres with tunable pore structure and enhanced catalytic activity[J]. Chemical communications, 2013, 49(67): 7427-7429. DOI:10.1039/c3cc43094d. |
| [14] | Wang C, Zhang C, Hua W, et al. Catalytic oxidation of vinyl chloride emissions over Co-Ce composite oxide catalysts[J]. Chemical Engineering Journal, 2017, 315: 392-402. DOI:10.1016/j.cej.2017.01.007. |
| [15] | Carabineiro S A C, Chen X, Konsolakis M, et al. Catalytic oxidation of toluene on Ce-Co and La-Co mixed oxides synthesized by exotemplating and evaporation methods[J]. Catalysis Today, 2015, 244: 161-171. |
| [16] | Jia A P, Hu G S, Meng L, et al. CO oxidation over CuO/Ce1-xCuxO2-δ and Ce1-xCuxO2-δ catalysts:synergetic effects and kinetic study[J]. Journal of Catalysis, 2012, 289: 199-209. DOI:10.1016/j.jcat.2012.02.010. |
| [17] | Mcfarland E W, Metiu H. Catalysis by doped oxides[J]. Chemical Reviews, 2013, 113(6): 4391-4427. DOI:10.1021/cr300418s. |
| [18] | Metiu H, Chrtien S, Hu Z, et al. Chemistry of lewis acid-base pairs on oxide surfaces[J]. The Journal of Physical Chemistry C, 2012, 116(19): 10439-10450. DOI:10.1021/jp301341t. |
| [19] | Hu Z, Li B, Sun X Y, et al. Chemistry of doped oxides:the activation of surface oxygen and the chemical compensation effect[J]. The Journal of Physical Chemistry C, 2011, 115(7): 3065-3074. DOI:10.1021/jp110333z. |
| [20] | Delimaris D, Ioannides T. Voc oxidation over CuO-CeO2 catalysts prepared by a combustion method[J]. Applied Catalysis B:Environmental, 2009, 89(1-2): 295-302. DOI:10.1016/j.apcatb.2009.02.003. |
| [21] | QIAN Ying(钱颖), MENG Ming(孟明), LUO Jin-yong(罗金勇), et al. Preparation, structures and properties of La-Co-Ce-O complex oxides(La-Co-Ce-O复合氧化物催化剂的制备、结构与性能)[J]. Journal of Molecular Catalysis(分子催化), 2005, 19(5): 321-326. DOI:10.3969/j.issn.1001-3555.2005.05.001. |
| [22] | Tan X, Lan H, Xie H, et al. Role of surface oxygen species of mesoporous CeCu oxide catalyst in OVOCs catalytic combustion[J]. Journal of Environmental Chemical Engineering, 2017, 5(2): 2068-2076. DOI:10.1016/j.jece.2017.03.033. |
| [23] | He C, Yu Y, Chen C, et al. Facile preparation of 3D ordered mesoporous CuOx-CeO2 with notably enhanced efficiency for the low temperature oxidation of heteroatom-containing volatile organic compounds[J]. RSC Advances, 2013, 3(42): 19639-19656. DOI:10.1039/c3ra42566e. |
| [24] | Luo J, Meng M, Li X, et al. Mesoporous Co3O4-CeO2 and Pd/Co3O4-CeO2 catalysts:Synthesis, characterization and mechanistic study of their catalytic properties for low-temperature CO oxidation[J]. Journal of Catalysis, 2008, 254(2): 310-324. DOI:10.1016/j.jcat.2008.01.007. |
| [25] | Tang C W, Wang C B, Chien S H. Characterization of cobalt oxides studied by FT-IR, Raman, TPR and TG-MS[J]. Thermochimica Acta, 2008, 473(1-2): 68-73. DOI:10.1016/j.tca.2008.04.015. |
| [26] | Gao J, Guo J, Liang D, et al. Production of syngas via autothermal reforming of methane in a fluidized-bed reactor over the combined CeO2 -ZrO2/SiO2 supported Ni catalysts[J]. International Journal of Hydrogen Energy, 2008, 33(20): 5493-5500. DOI:10.1016/j.ijhydene.2008.07.040. |
| [27] | Megarajan S K, Rayalu S, Teraoka Y, et al. High NO oxidation catalytic activity on non-noble metal based cobalt-ceria catalyst for diesel soot oxidation[J]. Journal of Molecular Catalysis A Chemical, 2014, 385(4): 112-118. |
| [28] | Michalis K, Zisis I. Surface/structure functionalization of Copper-based catalysts by metal-support and/or metal-metal interactions[J]. Applied Surface Science, 2014, 320: 244-255. DOI:10.1016/j.apsusc.2014.08.114. |
| [29] | Huang H, Dai Q, Wang X. Morphology effect of Ru/CeO2 catalysts for the catalytic combustion of chlorobenzene[J]. Applied Catalysis B Environmental, 2014, 158-159(3): 96-105. |
| [30] | Rivas B D, Lapez-Fonseca R, Jimenez-Gonzalez C, et al. Synthesis, characterisation and catalytic performance of nanocrystalline Co3O4 for gas-phase chlorinated VOC abatement[J]. Journal of Catalysis, 2011, 281(1): 88-97. DOI:10.1016/j.jcat.2011.04.005. |
| [31] | Solsona B, V Zquez I, Garcia T, et al. Complete oxidation of short chain alkanes using a nanocrystalline cobalt oxide catalyst[J]. Catalysis Letters, 2007, 116(3-4): 116-121. DOI:10.1007/s10562-007-9136-3. |
| [32] | Cai T, Huang H, Deng W, et al. Catalytic combustion of 1, 2-dichlorobenzene at low temperature over Mn-modified Co3O4 catalysts[J]. Applied Catalysis B:Environmental, 2015, 166-167: 393-405. DOI:10.1016/j.apcatb.2014.10.047. |




