As在元素周期表中属于第V主族,它是具有金属特性的非金属元素。砷的常见价态为三价和五价,其中三价砷的毒性约为五价砷的50倍[1]。砷及其化合物具有致癌、毒性大等特点。在我国,燃煤及垃圾焚烧造成的As排放是我国大气中As的主要来源。在燃烧、热解及气化过程中,燃煤和城市生活垃圾中的砷在较低的温度时大部分会进入气相。当燃煤和垃圾燃烧时,砷的主要存在形式为三价的氧化物(As2O3和As4O6)。当以热解、气化手段处理时[2, 3],温度较低(400~600 ℃)时砷的主要存在形式为As2、As4及AsH3。因此脱除砷及其污染物就是针对这些特征污染物采取经济、高效的处理措施。
As及其污染物的控制技术众多[4]。在燃煤电厂中可分为燃烧前脱砷、燃烧中脱砷及燃烧后脱砷,其中燃烧后脱砷可利用现有设备和吸附剂脱砷[5]。根据材料的不同,砷的吸附剂可分为活性炭[6-7]、金属氧化物及黏土矿物等[8-9]。Wang等[10-11]考察了多种添加剂,发现氧化铜与沸石、活性炭等的复合添加剂在低温条件及合成气中能够较好地去除砷。Lachas等[12]研究发现高岭土和活性炭在低温时(450 ℃)都能很好地保留气态的砷,而高岭土因较高的捕集率及较低的浸出率优于活性炭。吸附剂的改性及复合具有比单一吸附剂更加有效、稳定的去除效果。高岭土改性方法有插层、负载等[13],但其吸附作用的机理相对复杂[14]。赵鹏飞[15]基于密度泛函理论研究活性炭对Hg0的氧化机理,通过不同的改性手段可以增加汞的吸附途径及汞氧化物的稳定性。潘红[16]对铁载凹凸棒土吸附氧化砷前后的偏态密度进行分析,铁砷盐的曲线左移表明产物原子具有更加稳定的状态。本研究采用密度泛函理论(DFT)研究高岭土负载氧化铜后去除还原态砷的机理,为开发高效脱除砷的固体吸附剂提供理论依据。
2 实验与计算方法及模型 2.1 实验材料与试剂氧化铜、氧化铁、高岭土规格均为分析纯,购自阿拉丁上海有限公司。实验在固定床上进行,载气为N2。
2.2 计算方法计算采用Materials Studio 8.0计算软件中的CASTEP模块,高岭土晶体的几何优化的交换关联参数采用GGA-PBE(Perdew-Burke-Ernzerh of generalized gradient approximation)函数[17]。平面波截断能选取460 kJ·mol-1。自洽场的收敛精度设为Medium,具体参数为单位原子能量2.0×10-6 eV[18]。几何优化后高岭土原始晶胞具体参数为:a=0.514 9 nm,b=0.893 4 nm,c=0.738 4 nm,α=91.930°,β=105.042°,γ=89.791°,V=0.327 843 nm3。这些数值与Fang等[19]的计算值以及高岭土的实验测量值[20]接近,它们之间的误差不超过2%,说明计算结果合理[21]。
超晶胞表面模型由单晶胞沿(001)面切出,高岭土(001)面采用2×1×1的超晶胞模型。砷及其污染物:As2、As4及AsH3分子的几何优化在1 nm×1 nm×1 nm的立方体空间中进行。布里渊区k点采用Gamma only,与表面吸附模型的k点设置相同。其他具体几何优化参数与高岭土的原始晶胞几何优化参数保持一致[21]。
2.3 高岭土(001)面吸附还原态砷高岭土的原子数较多,表面复杂,因此需要考虑砷污染物在(001)面上不同的吸附位点的吸附情况。高岭土(001)面上的吸附位点可分为3种类型:空心位(H)、顶点位(T)及桥位(B)。又考虑到高岭土表面的对称性,因此选取16个吸附位点,如图 1所示。
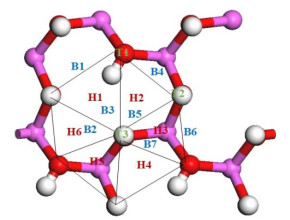
|
图 1 吸附位点示意图 Fig.1 Schematic diagram of adsorption sites |
经过超晶胞形成的(001)吸附表面,首先要确定高岭土(001)面上不同的放置位点,根据陈军等[22]的研究,高岭土(001)面上的空洞位置具有最小的吸附能,因此氧化铜初始放置在高岭土表面的空洞点上方。考虑吸附分子的2种吸附方式:水平吸附和垂直吸附。计算后高岭土-氧化铜模型最稳定的构型结合能为-139.58 kJ·mol-1,模型结构如图 2所示。
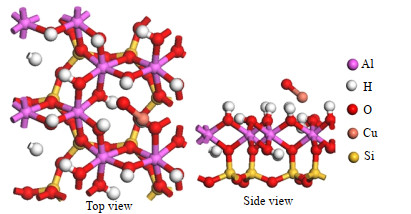
|
图 2 高岭土-氧化铜模型 Fig.2 Configuration of CuO/kaolinite |
As2、As4及AsH3的分子模型及吸附方式如图 3所示[23]。
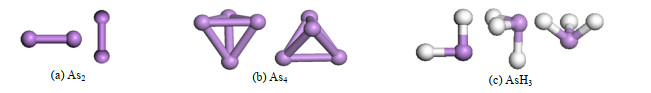
|
图 3 砷污染物的分子模型及吸附方式 Fig.3 Configurations and patterns of arsenic molecular |
如图 4所示为还原气氛下3种砷污染物分子以及高岭土-氧化铜表面的前线轨道示意图,该计算采用Materials Studio 8.0计算软件中DMOL3模块进行能量优化。As2分子的最高占有分子轨道(HOMO)位于该分子2个原子的一侧;As4分子的HOMO则是集中处在As原子中间;AsH3分子的最高占有分子轨道分布于3个氢原子形成的三角面上。高岭土-氧化铜结合后形成的最低空分子轨道(LUMO)主要分布于氧原子的上方及铜原子的外侧,其次在高岭土(001)面上的位于氧化铜下方的第二层氧原子上分布。根据前线轨道理论[24],物质在最高占有轨道(HOMO)和最低空分子轨道(LUMO)具有高反应活性,通常反应发生在一种反应物的HOMO和另一反应物的LUMO之间。由此可以看出3种砷污染物分子在高岭土-氧化铜表面上发生的反应,将优先与氧原子和铜原子进行。依此分为2个吸附位点,Ⅰ点和Ⅱ点。
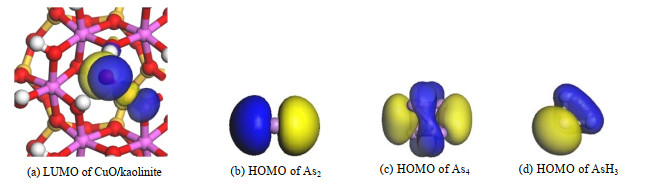
|
图 4 前线轨道示意图 Fig.4 Frontier orbital of arsenic molecular and CuO/kaolinite |
高岭土-氧化铜吸附还原气氛下砷污染物的吸附能计算公式为
| $ {E_{\rm{a}}} = {E_{\rm{t}}} - \left( {{E_{{\rm{CuO/kaolinite}}}} + {E_{{\rm{ad}}}}} \right) $ | (1) |
式中:Ea为体系的吸附能,kJ·mol-1;Et为砷污染物吸附在高岭土-氧化铜表面上的总能量,kJ·mol-1;ECuO/kaolinite为氧化铜与高岭土结合后体系总能量,kJ·mol-1;Ead为吸附前砷污染物的总能量,kJ·mol-1;吸附能的大小表示吸附作用的强弱,吸附能越小表示吸附剂对污染物的吸附作用越强。
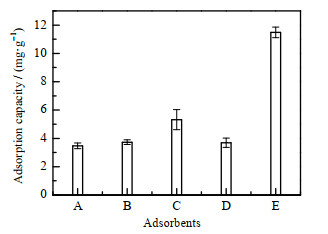
3 结果与讨论 3.1 高岭土负载氧化铜吸附实验结果如图 5所示为不同吸附剂对还原态砷的吸附量。从图中可以看出,与单组分添加剂相比,相同条件下高岭土-氧化铜复合添加剂具有更高的吸附量,单独组分高岭土、氧化铜的吸附量分别为3.55、3.84 mg·g-1,而复合后的添加剂的吸附量升高至11.65 mg·g-1,去除效果得到显著增强。
|
图 5 不同吸附剂对还原态砷的吸附量 Fig.5 Adsorption capacities of reduced arsenic by different adsorbents A. CuO B. Fe2O3 C. CuO/Fe2O3 D. kaolinite E. CuO/kaolinite |
如表 1所示为As2、As4及AsH3在高岭土(001)面上不同吸附位点的吸附能计算结果。表中Vertical为单个砷原子朝下放置,Vertical1为单个H原子朝下放置。
|
|
表 1 3种分子的吸附能及位点 Table 1 Adsorption energies and sites of three molecules |
3种分子在高岭土表面上吸附产生的吸附能皆为正值,吸附能为负值时表示吸附剂能够与吸附质产生较强的物理、化学作用。而吸附能为正值,有以下推测:1) 高岭土对于还原气氛下砷及其污染物不能产生吸附效果或吸附效果较差;2) 高岭土与此3种污染物反应时需要外来能量参与,来克服吸附这些物质时存在的能量壁垒。吸附前后位点没有发生改变也验证这一推测。不同的吸附方式会影响高岭土(001)面对这3种物质的吸附效果。
3.3 高岭土-氧化铜吸收砷污染物的吸附能如表 2所示为还原气氛下3种砷污染物分子As2、As4及AsH3在高岭土-氧化铜表面上吸附稳定后得出的吸附能。吸附前3种分子共7种方式放置在吸附Ⅰ点和Ⅱ点,从表中可以看出,吸附计算完成后,As2及As4分子在高岭土-氧化铜面上的几何最优化位置为吸附Ⅱ点,即靠近铜原子端的位点,两者在该点处吸附能最小,分别为-180.48和-154.46 kJ·mol-1。AsH3分子的几何最优吸附点则位于吸附Ⅰ点,即靠近氧原子端的位点,吸附能为-130.27 kJ·mol-1。与3.1中结论相似,在不同的吸附方式下,As2、As4及AsH3以垂直方式放置时,最终的吸附能较小,说明垂直吸附更加稳定。As4体系的4个吸附能整体相对其他体系的吸附能较小,说明高岭土负载氧化铜对As4的吸附效果最好。
|
|
表 2 3种分子在高岭土-氧化铜上的吸附能 Table 2 Adsorption energies of three arsenic molecules on CuO/kaolinite |
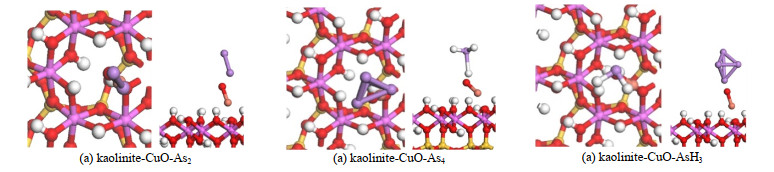
根据吸附能的大小,初步可以得出3种分子在高岭土-氧化铜表面上吸附的最稳定模型。如图 6所示为As2、As4及AsH3分子在高岭土-氧化铜上的稳定构型。从图 6中可以看出在这些稳定的的构型中砷污染物的分子与负载在高岭土上的氧化铜均发生了结构改变,但没有发生分子结构的解离。在As2、As4形成的构型中,氧化铜出现了不同程度的翘起,As4的分子结构也发生了改变。AsH3形成的构型中As-H键变长,氧化铜翘起程度较小。3种稳定的构型与前线轨道理论的推测相符合。
|
图 6 3种分子吸附在高岭土-氧化铜表面上的稳定构型 Fig.6 Stable configurations of three arsenic molecules on CuO/kaolinite surface |
如表 3所示为As2、As4及AsH3 3种分子分别在高岭土-氧化铜上吸附后,形成的稳定构型中它们的Mulliken电荷分析和键布分析。表中AP(Arsenic Pollution)为3种砷污染物。
|
|
表 3 3种稳定构型的Mulliken电荷分析和键布居 Table 3 Mulliken charge and bond population of three stable configurations |
通过对吸附前后砷污染物、CuO及高岭土的Mulliken电荷分析,得到吸附剂与吸附质在吸附反应前后原子的电子得失,进而比较三者在反应前后的电荷变化。电荷变化根据式(2)得到[25]
| $ \Delta q = {q_{\rm{a}}} - {q_{\rm{b}}} $ | (2) |
式中:∆q为反应前后的电荷变化,C;qa为吸附后净Mulliken电荷,C;qb为吸附前净Mulliken电荷,C。As2、As4及AsH3在各自体系失去了电子,其值分别为4.48×10-20、5.92×10-20、4.48×10-20 C。其失去的电子分别由吸附剂中的CuO和高岭土得到,分别为4.32×10-20、5.76×10-20、4.96×10-20、1.60×10-21 C。CuO得到了较多的电子,表现出较强的氧化作用[26]。体系中AsH3与高岭土表面均失去电荷,CuO得到了所有电子。可能与AsH3的组成结构和AsH3与氧化铜上形成的键不同有关。
在3种体系中高岭土得到或失去的电荷相对较少,CuO承担了大部分的电荷变化,说明氧化铜是吸附作用的主要活性物质。表 2中列出了负载在高岭土表面的氧化铜上的活性氧原子分别与3种还原气氛下污染物中As原子及H原子形成了较强作用的化学键(O37为氧化铜上O原子,As1、As2和H19分别为不同污染物上的原子)。三者的布居数较大,分别为0.29、0.31及0.58。与之对应的O─As键和O─H键的键长分别为0.179、0.179、0.099 nm。键长的计算值与Steckel等[27-30]的研究结果接近,说明体系中O和As原子可能形成了与As2O3、AsO及AsO2相同的键。
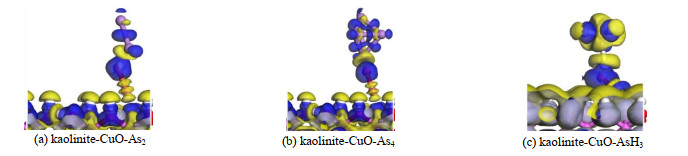
3.4 差分电荷密度如图 7所示为As2、As4及AsH3几何优化后形成3种稳定构型的差分电荷密度图,蓝色表示电子的获得,黄色表示电子的损失,体现出反应中电子密度的变化[33]。从图中可看出,3种分子中与氧化铜翘起一端上的O原子靠近的As原子、H原子具有明显的电子的消耗情形。转移的电子均聚积在O原子上。3种分子的吸附体系的电荷转移程度相差不大,与此同时,As2和As4体系中高岭土表面上氧原子周围也存在一定体积的电荷转移,而AsH3体系中基本上只能看到代表电子消耗的黄色区域。综上与3.3节中3种体系的Mulliken电荷布居分析相符合。
|
图 7 吸附后三体系的差分电荷密度图 Fig.7 Electron density difference of three systems after adsorption |
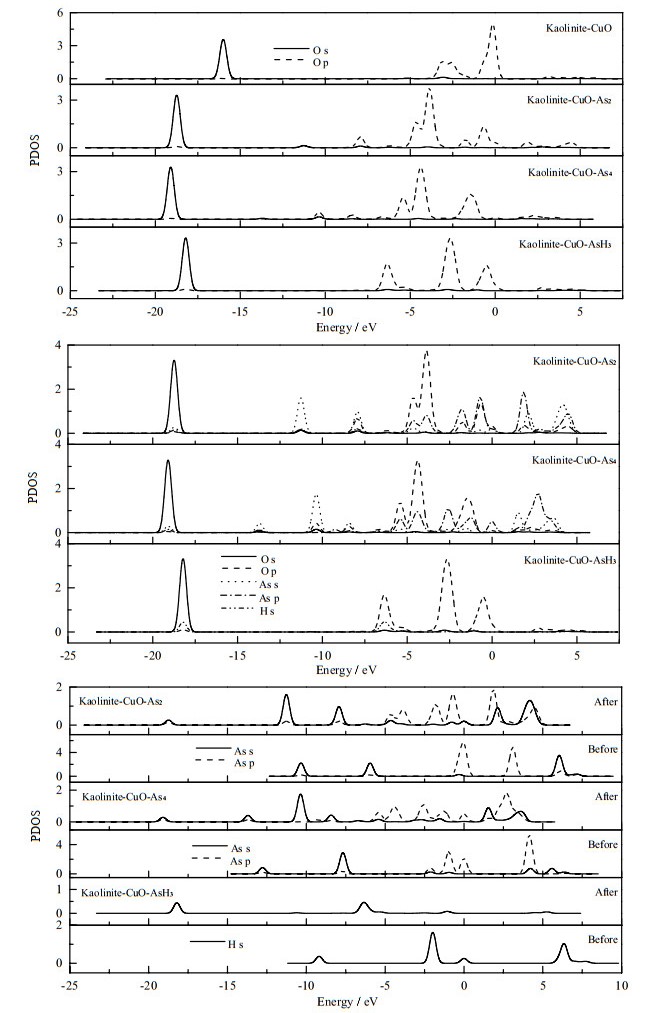
如图 8所示为As2、As4及AsH3与高岭土-氧化铜吸附前后各原子的态密度变化,图中,PDOS为单位能量的电子数偏态密度。对于As2构成的Kaolinite-CuO-As2体系中,O原子的s轨道与As原子的s、p轨道分别在-18.7、-11.2、-7.9、-3.9、-1.8 eV处重叠,O原子的p轨道与As原子的s、p轨道于-18.7、-11.2、-7.9、-6.9、-4.6、-0.6、+2.0、+4.5 eV发生共振,O和As的p轨道在-1.6、-3.8 eV的能量处也发生了重叠现象。O原子的p轨道与As原子的s、p轨道在多处重叠地较好,说明成键的强度较高[31]。在AsH3吸附形成的表面上,H和O的轨道共振仅发生在2个能量处,且相互共振的幅度较小,这可能是氢键的作用较弱。
|
图 8 吸附前后稳定构型中O原子、As原子与H原子的偏态密度 Fig.8 PDOS results of atoms before and after adsorption on CuO/kaolinite |
高岭土负载氧化铜吸附As4(Kaolinite-CuO-As4)体系中的O原子和As原子的s、p轨道均互相发生了共振,在能量为-20 ~5 eV,其重叠的区域较为密集,局部区域O原子的p轨道与As原子的s轨道共振幅度相同。As原子的p轨道成键在+1.2~ +4.3 eV处跨度较大,说明As p的离域性较强[32]。离域性越强,成键作用越强,键长也越短,此与表 2中键布分析O-As键的键长结果一致。从图中可以看出As2、As4及AsH3与CuO有较强的成键作用。成键强度大小为As4>As2>AsH3。
比较吸附前后3种分子中的As、H以及高岭土-氧化铜上的O原子的分波态密度,可以得出统一的规律:吸附后成键的各原子的偏态密度(PDOS)整体向更低能量处迁移,表明吸附后原子的状态更加稳定。各原子的PDOS跨度变大,离域性增强,而AsH3的离域性较小,表明其更难被吸附。
4 结论As2、As4及AsH3以垂直方式吸附的吸附能最小。氧化铜主要得到电子,As2、As4及AsH3则失去大部分电子,高岭土的电荷变化相对较小。砷及其化合物与氧化铜中的O原子形成了强度较高的共价键和氢键。As2、As4及AsH3的成键强度从大到小为As4 > As2 > AsH3。吸附后体系的差分电荷密度图直观地表现了成键原子及(001)面上相邻原子的电荷转移情况,As原子失去电子被氧化。比较高岭土单独吸附和高岭土负载氧化铜后吸附3种还原态砷的吸附能,可以看出,负载形成的复合添加剂对于砷的化学吸附作用得到显著增强。研究结果为还原气氛下砷的吸附剂开发提供了可靠的依据。
| [1] |
鲁真真, 孙文涛, 郭远峰, 等. 氧气摩尔分数和紫外光照射对烟气浸出煤中砷的影响[J]. 高校化学工程学报, 2019, 33(4): 989-997. LU Z Z, SUN W T, GUO Y F, et al. Effect of O2 mole fraction and ultraviolet irradiation on arsenic leaching from coal with flue gas[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(4): 989-997. |
| [2] |
崔帅, 唐晓宁, 张彬, 等. 煤气化和燃烧过程中砷元素迁移热力学分析[J]. 计算机与应用化学, 2015, 32(8): 921-925. CUI S, TANG X N, ZHANG B, et al. Thermodynamic analysis of migration of arsenic during coal gasification and combustion[J]. Computers and Applied Chemistry, 2015, 32(8): 921-925. |
| [3] |
沈锋华. 煤气化过程中痕量元素释放的动力学特性及炭基吸附剂脱除的研究[D]. 武汉: 华中科技大学, 2016. SHEN F H. Studies on release kinetics and carbon-based sorbent removal of trace elements during coal gasification[D]. Wuhan: Huazhong University of Science and Technology, 2016. |
| [4] |
JIANG Y, AMEH A, LEI M, et al. Solid-gaseous phase transformation of elemental contaminants during the gasification of biomass[J]. Science of the Total Environment, 2016, 563/564: 724-730. DOI:10.1016/j.scitotenv.2015.11.017 |
| [5] |
WANG C B, LIU H M, ZHANG Y, et al. Review of arsenic behavior during coal combustion: volatilization, transformation, emission and removal technologies[J]. Progress in Energy and Combustion Science, 2018, 68: 1-28. |
| [6] |
JIANG M, BAI Y W, NING P, et al. Adsorption removal of arsine by modified activated carbon[J]. Adsorption, 2015, 21(1/2): 135-141. |
| [7] |
LÓPEZ-ANTÓN M A, DÍAZ-SOMOANO M, FIERRO J L G, et al. Retention of arsenic and selenium compounds present in coal combustion and gasification flue gases using activated carbons[J]. Fuel Processing Technology, 2007, 88(8): 799-805. DOI:10.1016/j.fuproc.2007.03.005 |
| [8] |
SONG B, SONG M, CHEN D D, et al. Retention of arsenic in coal combustion flue gas at high temperature in the presence of CaO[J]. Fuel, 2020, 259: 116249. DOI:10.1016/j.fuel.2019.116249 |
| [9] |
IIDA K, PIERMAN J, TOLAYMAT T, et al. Control of chromated copper arsenate wood incineration air emissions and ash leaching using sorbent technology[J]. Journal of Environmental Engineering, 2004, 130(2): 184-192. DOI:10.1061/(ASCE)0733-9372(2004)130:2(184) |
| [10] |
WANG X Q, ZHANG Y J, NING P, et al. Arsine adsorption in copper-exchanged zeolite under low temperature and micro-oxygen conditions[J]. Royal Society of Chemistry, 2017, 7(89): 56638-56647. |
| [11] |
QUINN R, DAHL T A, DIAMOND B W, et al. Removal of arsine from synthesis gas using a copper on carbon adsorbent[J]. Industrial & Engineering Chemistry Research, 2006, 45(18): 6272-6278. |
| [12] |
LACHAS H, HEROD A A, REED G P, et al. Trace element removal from hot gases: Screening sorbents for performance and product leachability[J]. Energy & Fuels, 2003, 17(3): 521-531. |
| [13] |
张超, 王幸, 宋西亮, 等. 水合肼在高岭石层间插层行为的量子化学研究[J]. 化学学报, 2013, 71(11): 1553-1562. ZHANG C, WANG X, SONG X L, et al. Quantum chemical study of intercalation of hydrazine hydrate in kaolinite[J]. Acta Chim Sinica, 2013, 71(11): 1553-1562. |
| [14] |
KARINL, BOSTROM D, Nordin A, et al. Fate of Cu, Cr, and As during combustion of impregnated wood with and without peat additive[J]. Environmental Science & Technology, 2007, 41(18): 6534-6541. |
| [15] |
赵鹏飞. 固体吸附剂脱除燃煤烟气汞的实验与机理研究[D]. 武汉: 华中科技大学, 2010. ZHAO P F. Experiment and mechanism study of elemental mercury removal from coal combustion flues gases by solid sorbents [D]. Wuhan: Huazhong University of Science and Technology, 2010. |
| [16] |
潘红. 铁载凹凸棒土对砷的吸附行为与机制研究[D]. 武汉: 华中科技大学, 2018. PAN H. Insight into adsorption of arsenic by iron modified attapulgite (Fe/ATP)[D]. Wuhan: Huazhong University of Science and Technology, 2018. |
| [17] |
PERDEW J P, ERNZERHOF M. Generalized gradient approximation to the angle- and system-averaged exchange hole[J]. The Journal of Chemical Physics, 1998, 109(9): 3313-3320. DOI:10.1063/1.476928 |
| [18] |
韩永华, 刘文礼, 陈建华, 等. 羟基钙在高岭石两种(001)晶面的吸附机理[J]. 煤炭学报, 2016, 41(3): 743-750. HAN Y H, LIU W L, CHEN J H, et al. Adsorption mechanism of hydroxyl calcium on two kaolinite (001) surface[J]. Journal of China Coal Society, 2016, 41(3): 743-750. |
| [19] |
FANG F, MIN F F, LIU L Y, et al. Adsorption of Al(OH)n(3-n)+(n=2-4) on kaolinite (001) surfaces: A DFT study[J]. Applied Clay Science, 2020, 187: 105455. DOI:10.1016/j.clay.2020.105455 |
| [20] |
BISH D L. Rietveld refinement of the kaolinite structure at 1.5 K[J]. Clays and Clay Minerals, 1993, 41(6): 738-744. DOI:10.1346/CCMN.1993.0410613 |
| [21] |
CHEN J, MIN F F, LIU L Y, et al. Experimental investigation and DFT calculation of different amine/ammonium salts adsorption on kaolinite[J]. Applied Surface Science, 2017, 419(15): 241-251. |
| [22] |
陈军, 闵凡飞, 刘令云, 等. 不同铵/胺阳离子在高岭石(001)面吸附的密度泛函计算[J]. 煤炭学报, 2016, 41(12): 3115-3121. CHEN J, MIN F F, LIU L Y, et al. DFT calculations of different amine/ammonium cations adsorption on kaolinite (001) surface[J]. Journal of China Coal Society, 2016, 41(12): 3115-3121. |
| [23] |
NOBLE-EDDY R, MASTERS S L, RANKIN D, et al. Molecular structures of vinylarsine, vinyldichloroarsine and arsine studied by gas-phase electron diffraction and quantum chemical calculations[J]. Journal of Molecular Structure, 2010, 978(1/2/3): 26-34. |
| [24] |
HOFFMANN R. 固体与表面[M]. 郭洪猷, 李静, 译. 北京: 化学工业出版社, 1996: 66-68. HOFFMANN R. Solid and surface [M]. GUO H Y, LI J, trans. Beijing: Chemical Industry Press, 1996: 66-68. |
| [25] |
KUNASETHA M, MUDCHIMO T, NAMUANGRUK S, et al. A DFT study of arsine adsorption on palladium doped graphene: Effects of palladium cluster size[J]. Applied Surface Science, 2016, 367: 552-558. DOI:10.1016/j.apsusc.2016.01.139 |
| [26] |
周长松, 杨宏旻, 孙佳兴, 等. Fe3O4协同H2O2气相高级氧化单质汞的机理[J]. 化工学报, 2018, 69(5): 1840-1845. ZHOU C S, YANG H M, SUN J X, et al. Mechanism of Hg removal by gaseous advanced oxidation process with Fe3O4 and H2O2[J]. CIESC Journal, 2018, 69(5): 1840-1845. |
| [27] |
STECKEL J A. Density functional theory study of mercury adsorption on metal surfaces[J]. Physical Review B, 2008, 77(11): 115-412. |
| [28] |
ZHANG B K, LIU J, ZHENG C G, et al. Theoretical study of mercury species adsorption mechanism on MnO2(110) surface[J]. Chemical Engineering Journal, 2014, 256: 93-100. DOI:10.1016/j.cej.2014.07.008 |
| [29] |
MONAHAN-PENDERGAST M T, PRZYBYLEK M, LINDBLAD M, et al. Theoretical predictions of arsenic and selenium species under atmospheric conditions[J]. Atmospheric Environment, 2008, 42(10): 2349-2357. DOI:10.1016/j.atmosenv.2007.12.028 |
| [30] |
闫傲, 张月, 王春波, 等. O2对燃煤烟气中As2O3均相反应生成途径影响研究[J]. 燃料化学学报, 2020, 48(1): 11-17. YAN A, ZHANG Y, WANG C B, et al. Influence of O2 on the formation of As2O3 by homogeneous reaction with As and AsO in the coal-fired flue gas[J]. Journal of Fuel Chemistry and Technology, 2020, 48(1): 11-17. DOI:10.3969/j.issn.0253-2409.2020.01.002 |
| [31] |
MIZUSHIMA M A. Molecular parameters of OH free radical[J]. Physical Review A, 1972, 5(1): 143-157. DOI:10.1103/PhysRevA.5.143 |
| [32] |
XING J Y, WANG C B, ZOU C, et al. DFT study of Se and SeO2 adsorbed on CaO (001) surface: Role of oxygen[J]. Applied Surface Science, 2020, 510: 145488. DOI:10.1016/j.apsusc.2020.145488 |
| [33] |
ZOU C, WANG C B, ANTHONY E. The effect of CO on the transformation of arsenic species: A quantum chemistry study[J]. Energy, 2019, 187: 116024. DOI:10.1016/j.energy.2019.116024 |




