2. 河北省绿色化工与高效节能重点实验室,天津 300130
2. Hebei Provincial Key Laboratory of Green Chemical Technology and High Efficient Energy Saving, Tianjin 300130, China
随着化石燃料使用引发的空气污染和全球变暖问题的日趋严重,开发清洁高效、可持续的能源迫在眉睫。氢作为地球上含量最丰富的元素之一,是一种理想的清洁能源载体,具有单位质量能量密度高、绿色环保和可循环利用等优点,是最有希望替代化石燃料的能源之一[1]。此外,氢气还可用作燃料电池能源[2],从而引起人们的广泛关注,氢气的高效制备和转化利用也日益成为一项重要的研究课题。然而,寻找适宜的储氢材料以确保氢气安全高效地储运与快速释放,一直是氢能利用的难点[3-4]。甲酸作为一种重要的可再生化学储氢材料[5-8],常温下为液态,含氢量为w=4.4% (53 g·L-1),与其他储氢材料如甲醇、氨硼烷、水合肼等相比较,具有无毒、价格低廉、挥发性低且不易燃烧,以及便于安全储存和运输等优势。此外,甲酸是生物精炼中的主要副产物[9],来源广泛;还可将甲酸分解与CO2加氢反应集成,从而实现氢气的储存、生产、利用的零排放循环过程[10-12]。
早在1912年,SABATIER等[13]就报道了甲酸气相分解产氢的反应。甲酸分解过程通常包含两种路径[14-15],一种为脱氢(HCOOH→CO2+H2);另一种为脱水(HCOOH→CO+H2O)。脱水路径产生的CO可以使燃料电池催化剂中毒,应该避免此反应的发生。因此,设计高效高选择性的催化剂是利用甲酸作为储氢材料的关键。均相催化剂通常具有很高的甲酸分解催化活性[16-19],但也存在着一些不足,例如难以分离与循环使用,且重金属离子及配体的毒性对环境污染较为严重,一定程度上限制了其实际应用。因此,设计与开发高效非均相催化剂的对于甲酸分解的应用就十分必要[20]。
非均相催化剂包含负载型和非负载型两种类型,负载型催化剂因性能远优于非负载型而得到广泛的研究。其中,载体作为非均相负载型催化剂的分散介质,对提高催化剂活性组分的分散度、稳定活性中心起到重要作用;且载体的酸碱性、亲疏水性及孔结构对反应底物的吸附有一定影响;此外,还可以通过对载体进行元素掺杂、官能团接枝等表面改性处理,强化金属载体间相互作用或使其具有电子效应,进而调变催化剂活性组分的电子结构,提高催化性能。总之,不同性质的载体会影响金属的分散程度、颗粒大小及金属与载体间的相互作用力,优化金属局部的几何和电子结构,从而对非均相负载型催化剂的性能产生重要的影响。本文以载体分类为主线,总结了近十年以碳材料、金属氧化物、二氧化硅(含分子筛)、复合材料及树脂、金属有机框架材料(MOFs)为载体制备的非均相催化剂在甲酸液相分解中的应用,以期为设计与开发高活性、高稳定性且廉价的甲酸分解制氢催化剂提供思路和参考。
2 碳材料为载体的催化体系碳材料通常具有较大的比表面积、高孔隙率、低密度以及优良的化学稳定性,是常用的催化剂载体。下面主要概述了分别以多孔碳及碳纳米管、氧化石墨烯、氮掺杂碳等3种碳材料为载体制备的催化剂,在甲酸液相分解制氢中的应用。
2.1 多孔碳及碳纳米管ZHOU等[21]以活性炭作载体,通过向Pd纳米粒子中引入第2种金属Ag或Au制备了双金属合金负载型催化剂,发现催化剂稳定性明显提高。随后在制备过程中引入CeO2(H2O)x作为促进剂,合成的Pd-Au/C-CeO2(10%Pd,50%CeO2,nPd:nAu=1:1)催化剂催化甲酸分解活性进一步提高。在9.94 mol·L-1 HCOOH-3.33 mol·L-1 HCOONa反应体系中,92 ℃时甲酸分解制氢TOF为227 h-1。HUANG等[22]以XC-72碳材料作为载体,制备了以PdAu为核、Au为壳的core-shell型结构PdAu@Au/C催化剂,用于甲酸分解制氢,取得不错的效果。WANG等[23]使用柠檬酸作为稳定剂,通过在HCOOH-HCOONa混合溶液中原位还原的方式制备出Pd/C催化剂,甲酸分解转化率可达85%以上,TOF为64 h-1。研究发现,柠檬酸在Pd纳米粒子的成核和生长的过程中起到非常重要的作用,且柠檬酸的浓度对催化性能有一定影响,柠檬酸用量存在一个最优值。2013年,WANG等[24]制备了以活性炭为载体担载含有非贵金属Co的3金属合金纳米催化剂CoAuPd/C,实现了在室温(25 ℃)下催化甲酸完全分解。随后,WANG等[25]又采用相同的合成方法制备了NiAuPd/C、FeAuPd/C和CuAuPd/C催化剂,在非贵金属含量相同条件下,NiAuPd/C展示出最优的催化活性。2014年,ZHU等[26]利用氢氧化钠辅助还原方式,选用商业多孔炭MSC-30作载体,合成出金属纳米粒子粒径仅为2~3 nm的高分散Pd/MSC-30催化剂。通过在反应体系中添加甲酸钠助剂,50 ℃时甲酸分解产氢TOF可达2 623 h-1,这是当时催化甲酸分解活性最高的非均相催化剂。研究表明,氢氧化钠可作为一种有效的分散剂实现对Pd纳米粒子成核及生长过程的调控,进而控制Pd纳米粒子的尺寸分布。同时,MSC-30具有独特的纳米孔结构且与纳米粒子之间有较强的相互作用,与其他碳材料相比具有明显的优势。ZHU等[27]采用非原位负载且不使用任何表面活性剂的方法,在无水甲醇溶液中合成Pd溶胶,然后将其负载到活性炭上,合成了表面清洁的超细Pd纳米粒子(1.7 nm)催化剂。甲醇在催化剂合成过程中不仅作为溶剂,还是一种弱的稳定剂和温和的还原剂用于调控Pd粒子的成核并降低纳米金属颗粒的团聚程度。所制得的催化剂对甲酸液相分解具有很好的催化活性,60 ℃时TOF高达7 256 h-1。JIANG等[28]采用共还原方法,以碳纳米管(9CNTs)为载体,制备了La2O3修饰的高分散PdAu双金属合金催化剂AuPd-La2O3/CNTs,室温催化甲酸分解取得很好的催化效果。2016年,LI等[29]以活性炭为载体,柠檬酸钠作为弱稳定剂,通过调节液相还原温度及柠檬酸钠用量,制备出5种不同粒径的单金属Pd纳米粒子催化剂,发现粒径为2.1 nm的Pd/C催化剂效果最佳,在甲酸-甲酸钠反应体系中,25 ℃反应条件下,TOF为835 h-1。ZHANG等[30]同样以活性炭作载体,通过采用NaBH4还原前分别用Na2CO3、NH3·H2O、NaOH调节液相pH值的方式,实现了在不添加表面活性剂及稳定剂条件下,制备粒径可调、表面清洁的Pd/C(2.0~5.2 nm)催化剂。实验数据显示,2.0 nm Pd/C催化效果最佳。即在贵金属担载量相同的条件下,金属纳米粒子粒径越小,催化效果越优。最近,ZHU等[31]采用丙酮作为溶剂溶解金属前驱体乙酸钯,先将其浸渍在MSC-30载体上,然后通过在甲酸-甲酸钠溶液中原位还原的方式固载Pd纳米粒子(平均粒径1.75 nm),制备得到表面清洁的Pd基催化剂。60 ℃催化甲酸分解的TOF即可高达9 110 h-1。
2.2 氧化石墨烯氧化石墨烯表面具有丰富的含氧官能团,如羟基、羰基、羧基等,可有效起到锚定和分散金属纳米粒子的作用,还可对其进行表面官能团修饰,因而使用氧化石墨烯作载体在多相催化中极具吸引力[32-33]。JIANG等[34]采用一锅水热法,制备了氧化石墨烯负载的AgPd双金属空心球催化剂AgPd-Hs/G。通过实验及表征,证实了氧化石墨烯载体和添加柠檬酸三钠对空心球结构催化剂的形成具有重要作用。该催化剂高活性可归因于:空心球结构大大增加了催化活性位点分散度;载体对活性组分的电子修饰及载体与活性组分间的强相互作用;超微AgPd空心球在石墨烯载体上均匀高分散等因素。CHEN等[35]以牺牲非贵金属钴Co的方式,将高分散的超微AgPd纳米粒子负载在未经功能化的还原氧化石墨烯上,发现在还原过程中生成Co3(BO3)2沉淀可有效阻止贵金属AgPd纳米粒子的团聚;随后,用磷酸刻蚀制得(Co6)Ag0.1Pd0.9/RGO催化剂。将其用于甲酸分解制氢反应,50 ℃时TOF可达2 739 h-1。最近,YAN等[36]在室温下将-NH2功能化的N掺杂石墨烯与PdNi双金属超细纳米粒子复合,得到高分散的超细(1.8 nm)PdNi/NH2-N-rGO催化剂。催化剂良好的亲水性及丰富的电子活性位点使得在没有任何添加剂作用下,室温即可高效催化甲酸分解。
2.3 氮掺杂碳ZHU等[37]曾以氨水作氮源,水热处理多孔碳制得氮修饰的碳载体。随后,其所在小组LI等[38]采用尿素作氮源,通过连续两步热处理MSC-30得到氮掺杂的N-MSC-30碳材料。并通过化学还原法,制备出Pd纳米粒径仅为1.4 nm的Pd/N-MSC催化剂。用于甲酸分解制氢反应,在反应温度60 ℃时,TOF高达8 414 h-1。FENG等[39]以ZIF-8为牺牲模板,惰性气氛下热解合成MOF衍生的含氮碳基材料,并以此为载体制备了PdAg双金属催化剂,在甲酸分解中取得优异的催化效果。BI等[40]以热解生物质基壳聚糖制备吡啶型N修饰的碳载体,结合表征证实了载体中富电子的吡啶N与Pd之间存在电子转移,起到了调变Pd的表面电子结构的作用,从而提高了催化效率。
3 金属氧化物为载体的催化体系BI等[41]采用氨水沉积沉淀法,首次以具有酸碱两性的ZrO2为载体,制备了亚纳米Au(1.8 nm)催化剂。在甲酸-三乙胺反应体系中,50 ℃时即可高效高选择性地催化甲酸分解,TOF为1 593 h-1;在室温条件下,TOF也可达252 h-1。作者给出了甲酸在Au/ZrO2上分解可能的反应路径(如图 1)。在HCOOH-NEt3体系中,碱性助剂促使甲酸去质子化,进而在Au颗粒表面形成HCOO-中间体,以及+HNEt3物种。吸附在Au表面的HCOO-分解生成CO2和H-,H-和溶液中的+HNEt3反应,最终生成氢气和三乙胺。三乙胺的加入起到了中间桥梁作用,有利于生成对反应进行非常重要的中间体HCOO-,使得甲酸分解的活性变好。在此基础上,BI[42]继续探索了不同晶型的ZrO2担载Au制备的Au/ZrO2催化剂在无碱体系下对甲酸分解活性的影响。80 ℃时,以单斜相m-ZrO2作为载体制备的催化剂在开放体系下产氢速率可达81.8 LH2 gAu-1·h-1,封闭体系中可产生5.9 MPa的压力,展示出优于四方相t-ZrO2和无定型ZrO2的催化性能。作者采用原位红外(DRIFT)和CO2-TPD表征证实,m-ZrO2拥有更高的碱性位密度,而表面碱性位的存在更有利于促进甲酸去质子化生成反应活性中间体,进而展现更优异的反应活性。AKBAYRAK等[43]制备了Pd0/CeO2催化剂,考察了Pd负载量在(1.0~5.0) %对反应活性的影响,优化出在担载量为2.27%时活性最高,25 ℃下TOF即可达1 400 h-1。略有不足的是,反应体系HCOONa/HCOOH=9:1比例偏高,即需要较高的甲酸钠浓度。
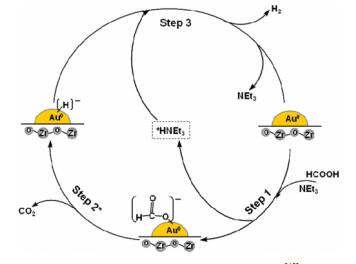
|
图 1 Au/ZrO2催化甲酸分解的原理示意图[42] Fig.1 Possible reaction pathway for formic acid decomposition with Au/ZrO2 catalysts[42] |
YADAV等[44-45]先后制备了Pd@SiO2及胺修饰的Au@SiO2和Pd@SiO2催化剂,实现了无机碱存在下液相甲酸分解制氢过程。BULUT等[46-48]以胺基官能团改性的SiO2为载体,采用湿法浸渍液相化学还原方法合成了MnOx掺杂的单金属Pd基催化剂Pd-MnOx/NH2-SiO2,Pd基金属和MnOx单独成核。同时,在此基础上又制备了MnOx掺杂的双金属PdAu-MnOx/NH2-SiO2和PdAg-MnOx/NH2-SiO2催化剂。实验结果表明,催化剂在低浓度的甲酸分解制氢体系中具有不错的催化活性。LIU等[49]于2015年合成了席夫碱修饰的SiO2担载Au催化剂Au@Schiff-SiO2,其催化甲酸分解的原理如图 2所示。席夫碱较强的供电子能力使得Au纳米粒子呈现电负性,有助于甲酸分子中O-H键的断裂,同时质子化的席夫碱可促进中间产物甲酸盐物种发生β-H消除。催化剂在无碱添加体系中展现出非常优异的甲酸分解产氢催化活性,50 ℃反应条件下,TOF即可达到4 368 h-1。WANG等[50]以乙二胺为配体,四丙基氢氧化铵为模板,通过水热合成的方式,首次实现MFI结构的纯硅Silicalite-1分子筛原位封装亚纳米Pd金属纳米粒子,制备得到Pd@S-1催化剂,在甲酸分解反应中展现出极高的产氢效率。且作者研究发现,通过在催化剂制备过程中加入KOH引入更多的碱性位,可使得Pd纳米粒子粒径减小,催化活性进一步提高,50 ℃时催化甲酸分解产氢的TOF高达3 027 h-1。2017年,SUN等[51]通过在上述原位合成过程中加入非贵金属Ni,实现在Silicalite-1分子筛内孔道内封装亚纳米级的Pd-Ni(OH)2双金属杂化物种,制备出Pd-Ni(OH)2@S-1催化剂。在60 ℃且不添加任何碱性助剂的反应条件下,0.8 Pd 0.2Ni(OH)2@S-1催化甲酸分解制氢的初始TOF即可高达5 830 h-1,表现出极佳的催化活性。MORI[52]课题组探究了以5种弱碱性硅烷偶联剂改性介孔SBA-15作载体,担载PdAg双金属纳米粒子催化剂,在HCOOH-HCOONa反应体系中催化甲酸分解的反应活性,发现使用含有苯胺的硅烷偶联剂改性SBA-15作为载体时催化效果最优。XU等[53]将AgPd双金属纳米粒子负载在石墨相氮化碳(g-C3N4)修饰的SBA-15上,制备了AgPd/mCND/SBA-15催化剂,考察了Ag、Pd含量配比及含氮前体双氰胺用量对催化效果的影响。筛选出最优催化剂Ag10Pd90/0.2CND/SBA-15,50 ℃时其催化甲酸分解TOF可达893 h-1。WANG等[54]制备了一系列胺基改性的ZrSBA-15担载PdAu双金属催化剂,不同种类的有机胺通过与Au、Pd阳离子配合,生成具有不同结构稳定性和氧化还原性能的金属配合物,最终形成不同粒径和分散度的PdAu合金纳米粒子,在室温下对甲酸分解制氢具有很好的催化性能。JIN等[55]制备了氨基改性的三维结构二氧化硅(KIE-6)作载体,考察了不同种类的Pd前驱体及液相浸渍时间对催化活性的影响,使用硝酸钯作前体及相对长的浸渍时间对于减小Pd纳米粒径效果最佳。同时,发现在不加碱性助剂条件下,甲酸分解活性高于添加碱性助剂时,说明载体表面化学环境对催化性能具有一定的影响。
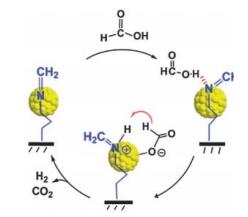
|
图 2 Au@Schiff-SiO2催化甲酸分解的原理示意图[49] Fig.2 Possible reaction pathway for formic acid decomposition with Au@Schiff-SiO2 catalysts [49] |
MORI小组[56]制备了一系列采用不同官能团(-SO3H、-COOH、-NMe2、-NMe3Cl)修饰的树脂,使用其作为载体制备了负载型Pd催化剂。实验数据表明,以具有弱碱性官能团(-NMe2)的树脂为载体制备的催化剂效果最佳。在75 ℃时,HCOOH-HCOONa体系中TOF可达820 h-1。作者进行了Pd的X射线近边吸收结构表征(XANES),发现不同种类树脂的特质导致产生不同类型的钯前驱体物种,进而影响了Pd纳米粒子的成核长大过程,最终形成不同粒径的富电子金属纳米颗粒。在甲酸分子的氘代实验中,发现碱性载体上的氨基官能团有利于促进甲酸分子中O-H键的断裂生成甲酸根离子,即在氨基作用下,甲酸分子更容易脱附O-H键上的氢正离子生成甲酸根(HCOO-),吸附在金属纳米粒子的表面;随后甲酸根分解生成二氧化碳脱离催化体系;最后,吸附在金属纳米粒子表面的氢负离子与氨基上的氢正离子结合形成氢气,完成了整个反应过程。其协同HCOOH脱氢机理见图 3。YAN等[57]将非贵金属氧化物MnOx引入到ZIF-8和石墨烯的复合载体中,合成了具有高催化活性的AuPd-MnOx/ZIF-8-r GO催化剂,在25 ℃时TOF为381 h-1。2017年,SONG等[58]以UiO-66为牺牲模板,氧化石墨烯为基底制备了复合材料,在惰性气氛下焙烧得到ZrO2/C/r GO载体;然后,采用液相化学还原法制备了PdAg@ZrO2/C/rGO催化剂。通过优化金属配比,50 ℃时TOF高达2 700 h-1。作者通过XPS表征证实ZrO2与PdAg纳米粒子间存在电子转移,形成富电子PdAg双金属合金,进而利于甲酸分子中O-H键断裂,提高反应催化活性。
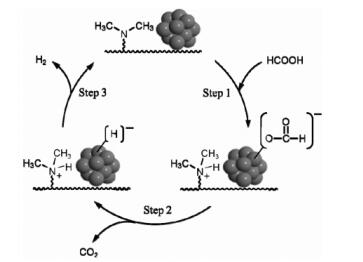
|
图 3 碱性树脂担载Pd催化甲酸分解的原理示意图[56] Fig.3 Possible reaction pathway for formic acid decomposition with Pd loaded basic resins[56] |
金属-有机框架材料(Metal-Organic Frameworks)是一类由过渡金属离子与有机配体自组装形成的具有周期性网络结构的多孔晶体材料。它通常具有高孔隙率、超高比表面积、孔道规则、孔径可调等优点,并且具有结构多样性和可裁剪性,在电化学及催化领域的应用越来越受到青睐[59-62]。2011年,GU等[63]采用浸渍的方法将Au-Pd纳米合金负载在介孔MIL-101上,制得Au-Pd/MIL-101催化剂,Au、Pd双金属的协同作用使其在催化甲酸分解制氢反应中展现了非常高的催化活性。为了增强金属前体与载体之间的相互作用,他们又将含富电子官能团的乙二胺引入到MIL-101骨架上进行功能化修饰得到ED-MIL-101,以其为载体制得负载Pd催化剂,90 ℃时应65 min,甲酸即可100%转化为H2和CO2。高角环形暗场扫描透射电镜(HAADF-STEM)表征表明,乙二胺的引入使得AuPd纳米颗粒粒径减小,进一步提高了催化活性,这也是首次关于MOFs负载金属纳米颗粒在甲酸分解制氢反应中的应用报道。2013年,MARTIS等[64]采用光辅助沉积法成功制备了氨基功能化的NH2-MIL-125封装高分散的Pd纳米金属催化剂,选择MIL-125(Ti)作载体因其具有较大的孔径和孔窗尺寸,有助于封装金属纳米粒子,且骨架中含有光敏Ti离子。氨基的引入可起到稳定Pd纳米粒子的作用,同时提高分解制氢的催化活性。在相同条件下,对比了Pd-TS-1、Pd-Ti-MCM-41、Pd-MIL-125及离子交换法制备的Pd-NH2-MIL-125,证实光辅助沉积法制备的Pd-NH2-MIL-125催化剂催化效果最优。这是首次采用氨基功能化的MOF负载单金属在环境温度下(32℃)实现甲酸分解制氢。KE等[65]采用简便的一步合成法,以PVP作为纳米颗粒保护剂合成了以双金属合金纳米颗粒为核且形貌和尺寸可控的核壳型AgPd@MIL-100(Fe)催化剂,在室温下、不添加任何碱性助剂条件下催化分解甲酸制氢,催化剂展示出非常优异的循环稳定性。在重复5次评价后,催化活性基本没有下降。考察了不同浓度的双金属合金前驱体对制备核壳结构的形貌和尺寸的影响,并进一步探讨了壳层厚度对反应的影响,发现具有7 nm壳层厚度的AgPd@MIL-100(Fe)展现出最优的催化效率,TOF为58 h-1。实现了以MOF核壳型结构催化剂应用于室温条件下分解甲酸脱氢,也为基于MOF制备高催化活性核壳纳米催化剂开拓了方向。DAI等[66]采用浸渍法制备了高分散的AgPd合金负载在ZIF-8上。通过调控Ag、Pd的组成配比,得到最优催化剂Ag18Pd82@ZIF-8,80 ℃时TOF达580 h-1。GAO等[67]合成了Ag-Pd纳米合金负载于NH2-UiO-66上,在室温无碱性助剂添加条件下,氢气选择性100%,TOF为103 h-1。CHENG等[68]将过渡金属Co插入到贵金属AuPd中形成合金,并负载在NH2-MIL-101上,25 ℃反应TOF为347 h-1,实现了在提高催化活性的同时,降低催化剂的成本。总结如表 1所示,由表中数据可知,以MOFs作载体制备的催化剂用于甲酸分解的催化活性还有待进一步提高。
|
|
表 1 以MOFs为载体制备的非均相催化剂在甲酸分解中的催化活性 Table 1 Catalytic activities of MOF supported heterogeneous catalysts in formic acid dehydrogenation |
目前,关于甲酸液相分解制氢比较公认的催化反应路径可分为以下几个步骤[69-70]:首先,甲酸分子在催化剂表面脱质子(载体的碱性位及金属纳米粒子表面富电子有助于甲酸去质子化),即O-H键首先发生断裂,形成中间产物金属-甲酸盐物种和H+离子;然后甲酸盐中间物种发生β-H消除即C-H键断裂,分解生成二氧化碳并脱离催化体系,剩下的H-离子吸附在金属纳米粒子表面;最后,金属表面吸附的H-离子很容易与第一步生成的H+离子结合生成氢气,完成了整个反应脱氢过程。其中,HCOO-是甲酸分解过程非常重要的活性中间物种,因此可以通过加入甲酸钠碱性助剂的方式增加HCOO-浓度,进而提高甲酸分解反应动力学速率。BI小组[42]、LIU小组[49]及MORI小组[56]分别给出了甲酸液相分解可能的反应路径,如图 1、2、3所示。
8 结语与展望甲酸是一种可再生化学储氢材料,其分解制氢反应研究对于人类的可持续发展具有重要的意义。本文按载体进行分类,对近年来非均相甲酸液相分解制氢催化剂的研究进展进行了综述。为提高催化剂性能,可以对载体进行表面改性、元素掺杂改性及采用纳米复合材料做载体,通过调变载体与活性组分之间相互作用,优化催化剂电子结构,使金属相表面富电子,从而提高甲酸分解催化活性。此外,为了提高催化效率、降低成本,开发室温条件下可催化甲酸高效分解的负载型单原子贵金属催化剂,以及采用非贵金属替代贵金属作为活性组分是未来甲酸分解制氢反应催化剂研究的重要方向。
| [1] |
SCHLAPBACH L, ZÜTTEL A. Hydrogen-storage materials for mobile applications[J]. Nature, 2002, 414(6861): 353-358. |
| [2] |
YANG J, SUDIK A, WOLVERTON C, et al. High capacity hydrogen storage materials: attributes for automotive applications and techniques for materials discovery[J]. Chemical Society Reviews, 2010, 39(2): 656-75. DOI:10.1039/B802882F |
| [3] |
TURNER J A. Sustainable Hydrogen Production[J]. Science, 2004, 305(5686): 972-974. DOI:10.1126/science.1103197 |
| [4] |
FELDERHOFF M, WEIDENTHALER C, VON H R, et al. Hydrogen storage: the remaining scientific and technological challenges[J]. Physical Chemistry Chemical Physics, 2007, 9(21): 2643-2653. DOI:10.1039/b701563c |
| [5] |
JIANG H L, SINGH S K, YAN J M, et al. Liquid-phase chemical hydrogen storage: catalytic hydrogen generation under ambient conditions[J]. ChemSusChem, 2010, 3(5): 541-549. DOI:10.1002/cssc.v3:5 |
| [6] |
GRASEMANN M, LAURENCZY G. Formic acid as a hydrogen source-recent developments and future trends[J]. Energy & Environmental Science, 2012, 5(8): 8171-8181. |
| [7] |
PETIT J F, MIELE P, DEMIRCI U B. Ammonia borane H3N-BH3 for solid-state chemical hydrogen storage: different samples with different thermal behaviors[J]. International Journal of Hydrogen Energy, 2016, 41(34): 15462-15470. DOI:10.1016/j.ijhydene.2016.06.097 |
| [8] |
DU Y, SU J, WEI L, et al. Graphene-supported nickel-platinum nanoparticles as efficient catalyst for hydrogen generation from hydrous hydrazine at room temperature[J]. ACS Applied Materials & Interfaces, 2015, 7(2): 1031-1034. |
| [9] |
柳翔, 李舒爽, 刘永梅, 等. 利用多功能、多用途的可再生甲酸实现化学品的绿色与可持续合成[J]. 催化学报, 2015, 36(9): 1461-1475. LIU X, LI S S, LIU Y M, et al. Formic acid: a versatile renewable reagent for green and sustainable chemical synthesis[J]. Chinese Journal of Catalysis, 2015, 36(9): 1461-1475. |
| [10] |
GABOR L. Hydrogen Storage and Delivery: The carbon dioxide-formic acid couple[J]. CHIMIA International Journal for Chemistry, 2011, 65(9): 663-666. DOI:10.2533/chimia.2011.663 |
| [11] |
ENTHALER S. Carbon dioxide-the hydrogen-storage material of the future?[J]. ChemSusChem, 2008, 1(10): 801-804. DOI:10.1002/cssc.v1:10 |
| [12] |
Singh A K, Singh S, Kumar A. Hydrogen energy future with formic acid: a renewable chemical hydrogen storage system[J]. Catalysis Science & Technology, 2015, 6(1): 12-40. |
| [13] |
SABATIER P, MAILHE A. Catalytic decomposition of formic acid[J]. Compt rend, 1912, 152: 1212-1215. |
| [14] |
TRILLO J M, MUNUERA G, CRIADO J M. Catalytic decomposition of formic acid on metal oxides[J]. Catalysis Reviews, 1972, 1(7): 51-86. |
| [15] |
BLAKE P G, DAVIES H H, Jackson G E. Dehydration mechanisms in the thermal decomposition of gaseous formic acid[J]. Journal of the Chemical Society B Physical Organic, 1971(10): 1923-1925. |
| [16] |
GUERRIERO A, BRICOUT H, SORDAKIS K, et al. Hydrogen production by selective dehydrogenation of HCOOH catalyzed by ru-biaryl sulfonated phosphines in aqueous solution[J]. ACS Catalysis, 2014, 4(9): 3002-3012. DOI:10.1021/cs500655x |
| [17] |
FUKUZUMI S, KOBAYASHI T, SUENOBU T. Unusually large tunneling effect on highly efficient generation of hydrogen and hydrogen isotopes in pH-selective decomposition of formic acid catalyzed by a heterodinuclear iridium-ruthenium complex in water[J]. Journal of the American Chemical Society, 2010, 132(5): 1496-1497. DOI:10.1021/ja910349w |
| [18] |
BERTINI F, MELLONE I, IENCO A, et al. Iron(Ⅱ) Complexes of the linear rac-tetraphos-1 ligand as efficient homogeneous catalysts for sodium bicarbonate hydrogenation and formic acid dehydrogenation[J]. ACS Catalysis, 2015, 5(2): 1254-1265. DOI:10.1021/cs501998t |
| [19] |
MONTANDON-CLERC M, DALEBROOK A F, LAURENCZY G. Quantitative aqueous phase formic acid dehydrogenation using iron (Ⅱ) based catalysts[J]. Journal of Catalysis, 2016, 343: 62-67. DOI:10.1016/j.jcat.2015.11.012 |
| [20] |
杨新春, 徐强. 含金金属纳米颗粒用于液相化学氢化物催化制氢[J]. 催化学报, 2016, 37(10): 1594-1599. YANG X C, XU Q. Gold-containing metal nanoparticles for catalytic hydrogen generation from liquid chemical hydrides[J]. Chinese Journal of Catalysis, 2016, 37(10): 1594-1599. |
| [21] |
ZHOU X, HUANG Y, XING W, et al. High-quality hydrogen from the catalyzed decomposition of formic acid by Pd-Au/C and Pd-Ag/C[J]. Chemical Communications, 2008, 44(30): 3540-3542. |
| [22] |
HUANG Y, ZHOU X, YIN M, et al. Novel PdAu@Au/C core-shell catalyst: superior activity and selectivity in formic acid decomposition for hydrogen generation[J]. Chemistry of Materials, 2010, 22(18): 5122-5128. DOI:10.1021/cm101285f |
| [23] |
WANG Z L, YAN J M, WANG H L, et al. Pd/C Synthesized with citric acid: an efficient catalyst for hydrogen generation from formic acid/sodium formate[J]. Scientific Reports, 2012, 2: 598. DOI:10.1038/srep00598 |
| [24] |
WANG Z, YAN J, PING Y, et al. An efficient CoAuPd/C catalyst for hydrogen generation from formic acid at room temperature[J]. Angewandte Chemie-International Edition, 2013, 52(16): 4406-4409. DOI:10.1002/anie.201301009 |
| [25] |
WANG Z, PING Y, YAN J, et al. Hydrogen generation from formic acid decomposition at room temperature using a NiAuPd alloy nanocatalyst[J]. International Journal of Hydrogen Energy, 2014, 39(10): 4850-4856. DOI:10.1016/j.ijhydene.2013.12.148 |
| [26] |
ZHU Q, TSUMORI N, XU Q. Sodium hydroxide-assisted growth of uniform Pd nanoparticles on nanoporous carbon MSC-30 for efficient and complete dehydrogenation of formic acid under ambient conditions[J]. Chemical Science, 2014, 5(1): 195-199. |
| [27] |
ZHU Q L, TSUMORI N, XU Q. Immobilizing extremely catalytically active palladium nanoparticles to carbon nanospheres: a weakly-capping growth approach[J]. Journal of the American Chemical Society, 2015, 137(36): 11743-11748. DOI:10.1021/jacs.5b06707 |
| [28] |
JIANG Y, FAN X, XIAO X, et al. La2O3-modified highly dispersed AuPd alloy nanoparticles and their superior catalysis on the dehydrogenation of formic acid[J]. International Journal of Hydrogen Energy, 2017, 42(15): 9353-9360. DOI:10.1016/j.ijhydene.2017.01.078 |
| [29] |
LI J, CHEN W, ZHAO H, et al. Size-dependent catalytic activity over carbon-supported palladium nanoparticles in dehydrogenation of formic acid[J]. Journal of Catalysis, 2017, 352: 371-381. DOI:10.1016/j.jcat.2017.06.007 |
| [30] |
ZHANG S, JIANG B, JIANG K, et al. Surfactant-free synthesis of carbon-supported palladium nanoparticles and size-dependent hydrogen production from formic acid-formate solution[J]. ACS Applied Materials & Interfaces, 2017, 9(29): 24678-24687. |
| [31] |
ZHU Q L, SONG F Z, WANG Q J, et al. A solvent-switched in situ confinement approach for immobilizing highly-active ultrafine palladium nanoparticles: boosting catalytic hydrogen evolution[J]. Journal of Materials Chemistry A, 2018, 6(14): 5544-5549. DOI:10.1039/C8TA01093E |
| [32] |
MARCANO D C, KOSYNKIN D V, BERLIN J M, et al. Improved Synthesis of Graphene Oxide[J]. ACS Nano, 2010, 4(8): 4806-4814. DOI:10.1021/nn1006368 |
| [33] |
何光裕, 侯景会, 黄静, 等. ZnO/氧化石墨烯复合材料的制备及其可见光催化性能[J]. 高校化学工程学报, 2013, 27(4): 663-668. HE G Y, HOU J H, HUANG J, et al. Preparation and visible-light driven photocatalytic properties of zno/graphene oxide composite[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(4): 663-668. |
| [34] |
JIANG Y, FAN X, XIAO X, et al. Novel AgPd hollow spheres anchored on graphene as an efficient catalyst for dehydrogenation of formic acid at room temperature[J]. Journal of Materials Chemistry A, 2016, 4(2): 657-666. DOI:10.1039/C5TA09159D |
| [35] |
CHEN Y, ZHU Q, TSUMORI N, et al. Immobilizing highly catalytically active noble metal nanoparticles on reduced graphene oxide: a non-noble metal sacrificial approach[J]. Journal of the American Chemical Society, 2015, 137(1): 106-109. DOI:10.1021/ja511511q |
| [36] |
YAN J M, LI S J, YI S S, et al. Anchoring and upgrading ultrafine nipd on room-temperature-synthesized bifunctional NH2 -N- rGO toward low-cost and highly efficient catalysts for selective formic acid dehydrogenation[J]. Advanced Materials, 2018, 30(12): 1703038. DOI:10.1002/adma.v30.12 |
| [37] |
ZHU D, WEN Y, XU Q, et al. Surface-amine-implanting approach for catalyst functionalization: prominently enhancing catalytic hydrogen generation from formic acid[J]. European Journal of Inorganic Chemistry, 2017, 2017(40): 4808-4813. DOI:10.1002/ejic.201701108 |
| [38] |
LI Z, YANG X, TSUMORI N, et al. Tandem nitrogen functionalization of porous carbon: toward immobilizing highly active palladium nanoclusters for dehydrogenation of formic acid[J]. ACS Catalysis, 2017, 7(4): 2720-2724. DOI:10.1021/acscatal.7b00053 |
| [39] |
FENG C, HAO Y, ZHANG L, et al. AgPd nanoparticles supported on zeolitic imidazolate framework derived N-doped porous carbon as an efficient catalyst for formic acid dehydrogenation[J]. RSC Advances, 2015, 5(50): 39878-39883. DOI:10.1039/C5RA04157K |
| [40] |
BI Q, LIN J, LIU Y, et al. Dehydrogenation of formic acid at room temperature: boosting palladium nanoparticle efficiency by coupling with pyridinic-nitrogen-doped carbon[J]. Angewandte Chemie International Edition, 2016, 55(39): 11849-11853. DOI:10.1002/anie.201605961 |
| [41] |
BI Q, DU X, LIU Y, et al. Efficient subnanometric gold-catalyzed hydrogen generation via formic acid decomposition under ambient conditions[J]. Journal of the American Chemical Society, 2012, 134(21): 8926-8933. DOI:10.1021/ja301696e |
| [42] |
BI Q, LIN J, LIU Y, et al. Gold supported on zirconia polymorphs for hydrogen generation from formic acid in base-free aqueous medium[J]. Journal of Power Sources, 2016, 328: 463-471. DOI:10.1016/j.jpowsour.2016.08.056 |
| [43] |
AKBAYRAK S, TONBUL Y, OZKAR S. Nanoceria supported palladium(0) nanoparticles: superb catalyst in dehydrogenation of formic acid at room temperature[J]. Applied Catalysis B: Environmental, 2017, 206: 384-392. DOI:10.1016/j.apcatb.2017.01.063 |
| [44] |
YADAV M, SINGH A K, TSUMORI N, et al. Palladium silica nanosphere-catalyzed decomposition of formic acid for chemical hydrogen storage[J]. Journal of Materials Chemistry, 2012, 22(36): 19146-19150. DOI:10.1039/c2jm32776g |
| [45] |
YADAV M, AKITA T, TSUMORI N, et al. Strong metal-molecular support interaction (SMMSI): amine-functionalized gold nanoparticles encapsulated in silica nanospheres highly active for catalytic decomposition of formic acid[J]. Journal of Materials Chemistry, 2012, 22(25): 12582-12586. DOI:10.1039/c2jm31309j |
| [46] |
BULUT A, YURDERI M, KARATAS Y, et al. Pd-MnOx nanoparticles dispersed on amine-grafted silica: Highly efficient nanocatalyst for hydrogen production from additive-free dehydrogenation of formic acid under mild conditions[J]. Applied Catalysis B: Environmental, 2015, 164: 324-333. DOI:10.1016/j.apcatb.2014.09.041 |
| [47] |
BULUT A, YURDERI M, KARATAS Y, et al. MnOx-promoted PdAg alloy nanoparticles for the additive-free dehydrogenation of formic acid at room temperature[J]. ACS Catalysis, 2015, 5(10): 6099-6110. DOI:10.1021/acscatal.5b01121 |
| [48] |
KARATAS Y, BULUT A, YURDERI M, et al. PdAu-MnOx nanoparticles supported on amine-functionalized SiO2 for the room temperature dehydrogenation of formic acid in the absence of additives[J]. Applied Catalysis B: Environmental, 2016, 180: 586-595. DOI:10.1016/j.apcatb.2015.06.060 |
| [49] |
LIU Q, YANG X, HUANG Y, et al. A schiff base modified gold catalyst for green and efficient h2 production from formic acid[J]. Energy & Environmental Science, 2015, 11(8): 3204-3207. |
| [50] |
WANG N, SUN Q, BAI R, et al. In situ confinement of ultrasmall pd clusters within nanosized silicalite-1 zeolite for highly efficient catalysis of hydrogen generation[J]. Journal of the American Chemical Society, 2016, 138(24): 7484-7487. DOI:10.1021/jacs.6b03518 |
| [51] |
SUN Q, WANG N, BING Q, et al. Subnanometric hybrid Pd-M(OH)2, M = Ni, Co, clusters in zeolites as highly efficient nanocatalysts for hydrogen generation[J]. Chem, 2017, 3(3): 477-493. |
| [52] |
MORI K, MASUDA S, TANAKA H, et al. Phenylamine-functionalized mesoporous silica supported PdAg nanoparticles: a dual heterogeneous catalyst for formic acid/CO2-mediated chemical hydrogen delivery/storage[J]. Chemical Communications, 2017, 53(34): 4677-4680. DOI:10.1039/C7CC00864C |
| [53] |
XU L, JIN B, ZHANG J, et al. Efficient hydrogen generation from formic acid using AgPd nanoparticles immobilized on carbon nitride-functionalized SBA-15[J]. RSC Advances, 2016, 6(52): 46908-46914. DOI:10.1039/C6RA06071D |
| [54] |
WANG Z, HAO X, HU D, et al. PdAu bimetallic nanoparticles anchored on amine-modified mesoporous ZrSBA-15 for dehydrogenation of formic acid at ambient conditions[J]. Catalysis Science & Technology, 2017, 7(11): 2213-2220. |
| [55] |
JIN M H, PARK J H, OH D, et al. Pd/NH2-KIE-6 catalysts with exceptional catalytic activity for additive-free formic acid dehydrogenation at room temperature: controlling Pd nanoparticle size by stirring time and types of Pd precursors[J]. International Journal of Hydrogen Energy, 2018, 43(3): 1451-1458. DOI:10.1016/j.ijhydene.2017.10.117 |
| [56] |
MORI K, DOJO M, YAMASHITA H. Pd and Pd-Ag Nanoparticles within a macroreticular basic resin: an efficient catalyst for hydrogen production from formic acid decomposition[J]. ACS Catalysis, 2013, 3(6): 1114-1119. DOI:10.1021/cs400148n |
| [57] |
YAN J, WANG Z, GU L, et al. AuPd-MnOx/MOF-graphene: an efficient catalyst for hydrogen production from formic acid at room temperature[J]. Advanced Energy Materials, 2015, 5(10): 1500107. DOI:10.1002/aenm.201500107 |
| [58] |
SONG F, ZHU Q, YANG X, et al. Metal-organic framework templated porous carbon-metal oxide/reduced graphene oxide as superior support of bimetallic nanoparticles for efficient hydrogen generation from formic acid[J]. Advanced Energy Materials, 2018, 8(1): 1701416. DOI:10.1002/aenm.v8.1 |
| [59] |
黄刚, 陈玉贞, 江海龙. 金属有机骨架材料在催化中的应用[J]. 化学学报, 2016, 74(2): 113-129. HUANG G, CHEN Y Z, JIANG H L. Metal-Organic Frameworks for Catalysis[J]. Acia Chimica. Sinica, 2016, 74(2): 113-129. |
| [60] |
黎林清, 吕迎, 李军, 等. 金属-有机骨架材料在烯烃氧化中的应用[J]. 化学进展, 2012, 24(5): 747-756. LI L Q, LV Y, LI J, et al. Application of Metal-Organic Frameworks in Olefin Oxidation[J]. PROGRESS IN CHEMISTRY, 2012, 24(5): 747-756. |
| [61] |
周颖, 隆继兰, 李映伟. 金属有机骨架衍生Ni基材料催化烷烃选择氧化[J]. 催化学报, 2016, 37(6): 955-962. ZHOU Y, LONG J L, LI Y W. Ni-based catalysts derived from a metal-organic framework for selective oxidation of alkanes[J]. Chinese Journal of Catalysis, 2016, 37(6): 955-962. |
| [62] |
邱健豪, 何明, 贾明民, 等. 金属有机骨架材料制备双金属或多金属催化材料及其应用[J]. 化学进展, 2016, 28(7): 1016-1028. QIU J H, HE M, JIA M M, et al. Metal organic frameworks for bi- and multi-metallic catalyst and their applications[J]. Progress in Chemistry, 2016, 28(7): 1016-1028. |
| [63] |
GU X, LU Z, JIANG H, et al. Synergistic catalysis of metal-organic framework-immobilized au-pd nanoparticles in dehydrogenation of formic acid for chemical hydrogen storage[J]. Journal of the American Chemical Society, 2011, 133(31): 11822-11825. DOI:10.1021/ja200122f |
| [64] |
MARTIS M, MORI K, FUJIWARA K, et al. Amine-functionalized MIL-125 with imbedded palladium nanoparticles as an efficient catalyst for dehydrogenation of formic acid at ambient temperature[J]. The Journal of Physical Chemistry C, 2013, 117(44): 22805-22810. DOI:10.1021/jp4069027 |
| [65] |
KE F, WANG L, Zhu J. An efficient room temperature core-shell AgPd@MOF catalyst for hydrogen production from formic acid[J]. Nanoscale, 2015, 7(18): 8321-8325. DOI:10.1039/C4NR07582J |
| [66] |
DAI H, XIA B, WEN L, et al. Synergistic catalysis of AgPd@ZIF-8 on dehydrogenation of formic acid[J]. Applied Catalysis B:Environmental, 2015, 165: 57-62. DOI:10.1016/j.apcatb.2014.09.065 |
| [67] |
GAO S, LIU W, FENG C, et al. A Ag-Pd alloy supported on an amine-functionalized UiO-66 as an efficient synergetic catalyst for the dehydrogenation of formic acid at room temperature[J]. Catalysis Science & Technology, 2016, 6(3): 869-874. |
| [68] |
CHENG J, GU X, LIU P, et al. Controlling catalytic dehydrogenation of formic acid over low-cost transition metal-substituted AuPd nanoparticles immobilized by functionalized metal-organic frameworks at room temperature[J]. Journal of Materials Chemistry A, 2016, 4(42): 16645-16652. DOI:10.1039/C6TA05790J |
| [69] |
TEDSREE K, CHAN C W, JONES S, et al. 13C NMR guides rational design of nanocatalysts via chemisorption evaluation in liquid phase[J]. Science, 2011, 332(6026): 224-228. DOI:10.1126/science.1202364 |
| [70] |
TEDSREE K, LI T, JONES S, et al. Hydrogen production from formic acid decomposition at room temperature using a Ag-Pd core-shell nanocatalyst[J]. Nature Nanotechnology, 2011, 6(5): 302-307. DOI:10.1038/nnano.2011.42 |




