2. 大连理工大学 化工学院 高分子系, 辽宁 大连 116024;
3. 辽宁省肿瘤医院 肿瘤内科, 辽宁 沈阳 110042
2. Department of Polymer Science and Engineering, School of Chemical Engineering, Dalian University of Technology, Dalian 116024, China;
3. Department of Medical Oncology, Liaoning Cancer Hospital and Institute, Shenyang 110042, China
抗体功能化纳米粒子(antibody functionalized nanoparticles,Ab-NPs)是表面固定有抗体或抗体片段的具有特异性识别抗原功能的纳米粒子[1],因其亲和力和特异性的优势被广泛应用于临床诊断、生物分离纯化和环境与食品检测等领域[2-5]。Ab-NPs已经应用于市售的多种快速检测试剂条,例如在金纳米粒子表面固定抗体的商用胶体金免疫试剂条(如胶体金法验孕棒、胶体金法检测HIV等),以及用于检测心肌标志物、感染炎症和传染病等的商用免疫探针。此外Ab-NPs也能够有效降低检测下限[6-8]。如Baniukevic等[9]将牛白血病gp51抗体片段直接偶联至磁性金纳米粒子上,通过表面增强拉曼散射检测牛奶样品中的gp51,检测下限可达0.95 μg·mL-1。Preechakasedkit等[10]通过共价偶联方式将伤寒沙门氏菌O901多糖的多克隆兔抗体固定在金纳米粒子表面,开发了一种用于快速检测人血清中伤寒沙门氏菌的免疫色谱条测试技术,其检测下限可达1.14×105 cfu·mL-1(样品中菌落数)。尽管Ab-NPs在多种应用中有着显著的优势,但是其抗原结合能力仍受表面抗体分子状态和非特异性吸附的影响。
抗体蛋白质在纳米粒子表面的固定方法直接影响抗体的分子状态(密度、取向等),进而影响Ab-NPs的抗原结合能力[11-14]。共价偶联法可以实现抗体的稳定固定,然而这样的随机固定会导致部分抗原结合域被遮蔽,进而影响抗原结合能力[15-18]。物理吸附是通过静电相互作用、范德华力、憎水作用等将抗体固定在纳米粒子表面[19-21]。Chen等[22]对2种抗HCG抗体(IgG1和IgG2a)在正电(11-氨基十一烷硫醇)和负电(十六烷酸硫醇)封端自组装膜表面吸附取向的研究显示,IgG1在氨基表面的抗原/抗体比值较羧基表面高约0.3,说明IgG1在正电表面更有序,而IgG2a在2种表面的抗原/抗体比值相近。这归因于IgG2a的偶极矩小于IgG1。表面电荷对IgG1取向的影响更大,证明了通过静电相互作用调控抗体取向的可行性。Lou等[23]通过研究溶液pH对聚苯乙烯微球上抗小鼠心肌钙蛋白抗体的电荷分布、亲水性和吸附速率的影响,发现当pH为5.8时,抗体的电荷分布和疏水面积有利于抗体Fc片段朝向纳米粒子,具有抗原结合位点的Fab片段朝向溶液,最终实现了抗体取向的调整,且心肌钙蛋白检测限低于0.1 ng·mL-1。本组先前的研究[24]构筑了不同表面电荷密度的硅纳米粒子,证明了官能团的密度可以显著影响硅纳米粒子的细胞毒性。高官能团密度可以改善硅纳米粒子对巨噬细胞(如J774A.1和N9细胞)的细胞毒性。综上所述,通过对表面官能团进行定性和定量调控,可以调节纳米-生物界面的相互作用。
Ab-NPs的抗原结合能力也受非特异性吸附的干扰[25-26]。体液(血液、尿液等)中蛋白质的非特异性吸附会导致表面抗体的脱落、遮蔽,以至于显著降低抗原结合能力[27]。Feiner-Gracia等[28]通过共价偶联方法将抗B220抗体固定于二氧化硅纳米粒子上,在10% 的胎牛血清中孵育18 h后抗体脱落40%,并且随着孵育时间延长靶向性逐渐降低,在孵育12 h后完全丧失靶向性。Tonigold等[29]分别通过共价偶联和物理吸附两种方法将抗CD63抗体固定于聚苯乙烯纳米粒子上,非特异性吸附会使共价偶联抗体的纳米粒子丧失靶向能力,然而通过物理吸附法固定抗体的纳米粒子仍能保持靶向性,这是吸附的抗体在表面的有序取向引起的。因此,需要研究不同表面电性和电荷密度的纳米粒子如何调控抗体分子状态,并与血清共同作用影响抗原结合能力。
本研究利用3种硅烷偶联剂和丁二酸酐制备了不同氨基和羧基密度的纳米粒子,并进行了表征。在所制备的纳米粒子表面通过静电吸附和共价偶联2种方式对同一种单克隆抗体(抗α-HCG抗体)进行了固定,量化了不同表面电性和电荷密度的纳米粒子的抗体固定和血清吸附。通过酶联免疫吸附分析(enzyme linked immunosorbent assay,ELISA)评价了不同纳米粒子的抗原结合能力和抗非特异性吸附干扰性能,提出了纳米粒子表面电性、电荷密度及非特异性吸附与抗原结合能力之间的构效关系。
2 实验材料与方法 2.1 实验材料与仪器实验试剂:二氧化硅纳米粒子(100 nm,Alfa Aesar公司);3-氨丙基二乙氧基甲基硅烷(APDEs,分析纯,Alfa Aesar公司);3-(二甲基乙氧基硅基)正丙烷(APEs,分析纯,北京百灵威科技有限公司);3-氨丙基三乙氧基硅烷(APTEs,分析纯,FluoroChem公司);丁二酸酐(分析纯,天津光复精细化工研究所);酸性橙Ⅱ(OA Ⅱ,分析纯,伊诺凯科技有限公司);邻苯二酚紫(PV,分析纯,伊诺凯科技有限公司);人绒毛促性腺激素(HCG,95%,华龙正阳生物科技有限公司);抗α-HCG单克隆抗体(95%,杭州隆基生物有限公司);牛血清白蛋白(BSA,98%,源叶生物科技有限公司);TMB显色液(北京索莱宝科技有限公司);BCA试剂盒(Yeasen Biotech);胎牛血清(Serana Corporation);N-羟基琥珀酰亚胺(NHS,98%,北京百灵威科技有限公司);1-(3-二甲基丙基)-3-乙基碳二亚胺盐酸盐(EDC,98%,北京百灵威科技有限公司);辣根过氧化物酶标记物的蛋白L(HRP-Protein L,南京金斯瑞科技有限公司);百分数均为质量分数。其他试剂均为分析纯,购买于当地经销商。
仪器:动态光散射仪(Brookhaven 90 plus PALS,美国布鲁克海文仪器公司);酶联免疫检测仪(Synergy H1 MFD,美国伯腾仪器有限公司);X-射线光电子能谱(ESCALAB250Xi,Thermo Scientific,X射线源采用Al Kα(光电子能hv = 1486.6 eV),采用污染碳C 1s(结合能BE = 285.0 eV) 作为能量校正。采用XPS Peaker对元素组成和高分辨谱图进行分析)。
2.2 氨基纳米粒子制备取二氧化硅纳米粒子原液1 mL,无水甲醇稀释至30 mL,得10 mg·mL-1的二氧化硅纳米粒子分散液。加入HNO3调pH至3.0,40 ℃搅拌2 h,加入300 μL APTEs、APDEs或APEs,40 ℃反应4 h。反应完成后离心除去上清液,依次用30 mL乙醇和去离子水各清洗2次,11 000 r·min-1离心除上清液,并重新分散于30 mL去离子水,得10 mg·mL-1的SiO2-T-NH2、SiO2-D-NH2、SiO2-E-NH2分散液。
2.3 羧基纳米粒子制备取三种氨基纳米粒子分散液(SiO2-T-NH2、SiO2-D-NH2、SiO2-E-NH2)各10 mL,11 000 r·min-1离心除上清液,沉淀分散于10 mL DMF。加入与纳米粒子等质量的丁二酸酐,37 ℃反应12 h。反应结束后,11 000 r·min-1离心除去上清液,依次用10 mL无水乙醇和去离子水分别离心洗涤3次,最终将产物分别分散在10 mL去离子水中,得10 mg·mL-1的SiO2-T-COOH,SiO2-D-COOH,SiO2-E-COOH分散液。
2.4 纳米粒子表面氨基定量3种氨基纳米粒子分散液(SiO2-T-NH2,SiO2-D-NH2,SiO2-E-NH2)各取1 mL,离心除上清液。将纳米粒子分散于1 mL盐酸溶液(pH 3.0)稳定体系pH,离心除上清液,将沉淀物分散于1 mL酸性橙Ⅱ的盐酸溶液(pH 3.0,0.5 mmol·L-1),37 ℃震荡反应6 h。反应结束后,11 000 r·min-1离心除上清液,并用pH 3.0的盐酸溶液洗涤1次,1 mL氨水(5 mmol·L-1)洗涤2次,收集洗脱溶液待用。
配制标准溶液:制备500.0 μmol·L-1酸性橙Ⅱ的氨水溶液(氨水浓度为500.0 μmol·L-1),用500.0 μmol·L-1的氨水逐级稀释配制浓度为250.0、125.0、62.5、31.3、0 mol·L-1的酸性橙Ⅱ溶液。将样品洗脱液和标准溶液转移至96孔板中,每孔200 μL,每个样品平行3个孔,利用酶标仪检测495 nm的吸光度,绘制标准曲线,根据标准曲线通过式(1)和(2)对纳米粒子表面氨基密度进行计算:
| $\frac{s}{m}{\rm{ = }}\frac{{\rm{6}}}{{\rho {\rm{ \times }}d}}{\rm{ }}$ | (1) |
| $D\left( {{\rm{N}}{{\rm{H}}_2}} \right){\rm{ = }}\frac{{c\left( {{\rm{OA }}II} \right) \times V\left( {{\rm{OA }}II} \right)}}{{m\left( {{\rm{Si}}{{\rm{O}}_2} - {\rm{N}}{{\rm{H}}_2}} \right) \times \frac{s}{m}}}{\rm{ }}$ | (2) |
式中:D(NH2)为纳米粒子表面氨基密度(即纳米粒子表面单位面积氨基量,μmol·m-2),c(OA Ⅱ)为上清液中OA Ⅱ浓度(μmol·L-1),V(OA Ⅱ)为上清液体积(mL),m(SiO2-NH2)为与OA Ⅱ共同孵育的氨基功能化的纳米粒子质量(mg),s/m为氨基功能化的纳米粒子比表面积(m2·g-1),ρ为二氧化硅纳米粒子的质量密度(ρ=2.73 g·cm-3),d为二氧化硅纳米粒子的直径(nm)。
2.5 纳米粒子表面羧基定量分别配制10.0 mmol·L-1的HEPEs缓冲液(pH 7.5)(溶液1)、200.0 μmol·L-1氯化镍的HEPEs溶液(溶液2)和80.0 μmol·L-1邻苯二酚紫的HEPEs溶液(溶液3)待用。
各取1 mL羧基纳米粒子(SiO2-T-COOH、SiO2-D-COOH、SiO2-E-COOH),11 000 r·min-1离心15 min,除上清液,并重新分散于600 μL溶液2中孵育2 min,11 000 r·min-1离心15 min,取500 μL上清液,用溶液3稀释至1 mL;用溶液1逐级稀释配制镍离子浓度为100.0、50.0、25.0、12.5、10.0 μmol·L-1的溶液2,再与等体积的溶液3均匀混合。将样品和标准溶液转移至96孔板中,每孔200 μL,每个样品平行3个孔,酶标仪测得其在495 nm下的吸光度,绘制标准曲线。通过式(3)对纳米粒子表面羧基密度进行计算:
| $D\left( {{\rm{COOH}}} \right){\rm{ = }}\frac{{2.65 \times \left( {0.2 - 2c\left( {{\rm{N}}{{\rm{i}}^{2 + }}} \right) \times V\left( {N{i^{2 + }}} \right)} \right)}}{{m\left( {{\rm{Si}}{{\rm{O}}_2} - {\rm{COOH}}} \right) \times \frac{s}{m}}}$ | (3) |
式中:D(COOH)为纳米粒表面羧基密度(即纳米粒子表面单位面积羧基量,μmol·m-2),c(Ni2+)为Ni2+的浓度(μmol·L-1),V(Ni2+)为离心后上清液的体积(mL),m(SiO2-COOH)为与Ni2+共同孵育的羧基纳米粒子质量(mg)。
2.6 纳米粒子表面抗体固定取1 mL纳米粒子分散液,11 000 r·min-1离心除上清液,再用MES缓冲液(50 mmol·L-1,pH 6.1)稳定体系的pH,离心除上清液,重新分散于1 mL的0.5 mg·mL-1的抗α-HCG抗体溶液(MES,50 mmol·L-1,pH 6.1),37 ℃震荡1 h。11 000 r·min-1离心洗涤,上清留样待测,得吸附抗体的纳米粒子。
取羧基纳米粒子1 mL,去离子水离心洗涤以调节体系pH至中性,再用MES缓冲液(50 mmol·L-1,pH 6.1)稳定体系的pH,离心除上清液。将羧基纳米粒子重新分散于含羧基活化基团的缓冲溶液中(纳米粒子、NHS、EDC质量比为1:3:1),冰浴条件下反应60 min。MES缓冲液离心洗涤3次。将活化后的纳米粒子分散至1 mL含0.5 mg·mL-1抗体的MES缓冲液中(50 mmol·L-1,pH 6.1),37 ℃反应1 h,离心,用MES洗涤。得共价偶联抗体的羧基纳米粒子(SiO2-COOH/covalent)。
2.7 非特异性吸附实验取500 μL纳米粒子(10 mg·mL-1),离心除去上清液。用500 μL的PBS缓冲液(20 mmol·L-1,pH 7.4)稳定体系pH后,离心除去上清液待用。用PBS缓冲液(20 mmol·L-1,pH 7.4)配制10%胎牛血清溶液,并将纳米粒子重新分散至1 mL的10% 胎牛血清中,37℃孵育1 h,离心留上清待测。用0.3 mL的孵育缓冲液离心洗涤3次,收集上清液,合并上清液待测。
2.8 BCA检测配制BCA试剂盒中蛋白标准品,将蛋白标准品、抗体原液和上清液加入96孔板。在96孔板中每孔分别加入200 μL工作液,并于振荡仪上振荡30 s混匀。用封板膜将96孔板密封,37 ℃条件下孵育30 min。将96孔板冷却至室温。酶标仪测定在562 nm波长处样品的吸光值。根据标准品吸光度绘制标准曲线,得到待测样品浓度。通过做差的方法,计算纳米粒子表面蛋白的吸附量:
| $m{\rm{ = }}{\rho _0}{V_0} - {\rho _1}{V_1}$ | (4) |
式中:m为纳米粒子表面蛋白吸附量(g); 0为蛋白质原液质量浓度(μg·mL-1);V0为蛋白质原液体积(mL); 1为孵育后离心洗涤得到上清液质量浓度(μg·mL-1);V1为孵育后,离心洗涤得到上清液体积(mL)。
2.9 ELISA实验在96孔板中分别加入10 IU·mL-1的HCG溶液(MES,50 mmol·L-1,pH 6.1),每孔100 μL,4 ℃孵育过夜后,用MES缓冲溶液(50 mmol·L-1,pH 6.1)洗涤5次。每孔加入150 μL 3% BSA溶液(MES,50 mmol·L-1,pH 6.1),4 ℃孵育过夜,MES洗5次。用MES缓冲液配制浓度梯度的NPs分散液(5、2.5、1.0、0.5、0.1、0.02 mg·mL-1),每孔100 μL。37 ℃孵育1 h,利用含0.1%(质量分数)吐温20的MES洗3次,MES洗2次。加入1.25 μg·mL-1 HRP-Protein L溶液(MES,50 mmol·L-1,pH 6.1),每孔100 μL,37 ℃孵育1 h,MES洗5次。每孔加入100 μL的TMB显色剂,25 ℃避光反应10 min,加入100 μL 1 mol·L-1硫酸终止反应。检测450 nm处吸光度。等温吸附曲线利用希尔方程进行拟合,如式(5)所示:
| $y{\rm{ = }}\frac{{\left( {{R_{{\rm{max}}}} \cdot {\rho ^n}} \right)}}{{\left( {{K_d} + {\rho ^n}} \right)}}$ | (5) |
式中:y为固定抗α-HCG抗体纳米粒子的平衡结合量;为纳米粒子质量浓度(μg·mL-1);Rmax为抗α-HCG抗体纳米粒子的最大结合质量(g);Kd为解离平衡常数(μg·mL-1);n为希尔系数。
3 实验结果与讨论 3.1 不同电性纳米粒子制备及表征为了制备不同表面电性和电荷密度的纳米粒子,选择了3种不同乙氧基数量的硅烷偶联剂(APTEs、APDEs、APEs)对二氧化硅纳米粒子进行修饰。其中,APTEs、APDEs、APEs分别含有3个、2个、1个乙氧基基团。制备的3种氨基纳米粒子(SiO2-T-NH2、SiO2-D-NH2、SiO2-E-NH2)进一步与丁二酸酐反应制得3种羧基纳米粒子(SiO2-T-COOH、SiO2-D-COOH、SiO2-E-COOH)(图 1)。由于硅烷偶联剂的乙氧基数量不同,其与纳米粒子的反应存在差异,以此可以获得不同表面官能团密度的纳米粒子。
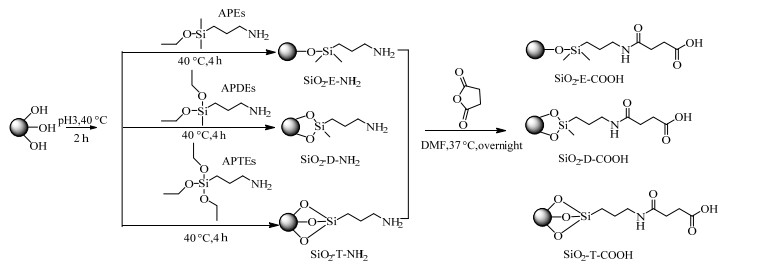
|
图 1 不同氨基和羧基密度纳米粒子的制备过程 Fig.1 Preparation of nanoparticles with different amino and carboxyl densities |
利用XPS对制备的纳米粒子进行了表征。从图 2和表 1可以看出在利用硅烷偶联剂修饰纳米粒子后,C元素相对含量升高,Si元素相对含量降低,归因于表面修饰的有机层屏蔽了Si原子的部分信号。同时检测到了N元素,归属于硅烷偶联剂中的氨基,证明成功制备了氨基纳米粒子。根据氨基纳米粒子N元素含量变化,推测依表面氨基密度大小排序SiO2-T-NH2SiO2-D-NH2SiO2-E-NH2。氨基纳米粒子与丁二酸酐反应后,C元素相对含量增加,并观察到了C═O特征峰(图 2(b)),说明成功制备了羧基纳米粒子。根据C元素变化可以推测依羧基密度大小排序SiO2-T-COOHSiO2-D-COOHSiO2-E-COOH。XPS表征结果表明基于以上方法(如图 1所示)成功制备了不同官能团种类和密度的纳米粒子。
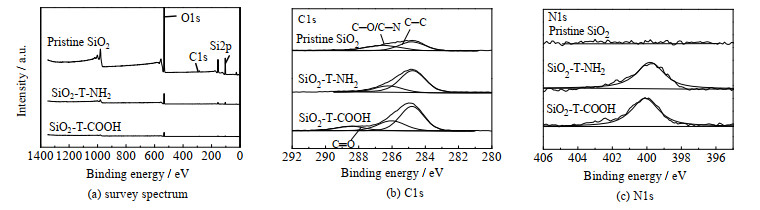
|
图 2 Pristine SiO2、SiO2-T-NH2、SiO2-T-COOH的XPS谱图 Fig.2 XPS spectra of pristine SiO2, SiO2-T-NH2, SiO2-T-COOH |
|
|
表 1 PS检测不同纳米粒子的元素质量分数 Table 1 Elemental compositions of different nanoparticles determined by XPS |
利用DLS对纳米粒子修饰前后的电位、粒径进行表征(见表 2)。PDI均小于0.2,说明纳米粒子在水中有良好的分散性。硅烷偶联剂修饰后,纳米粒子的粒径与电位的变化趋势一致,SiO2-T-NH2 SiO2-D-NH2SiO2-E-NH2,证明成功制备了不同正电荷密度的氨基纳米粒子。在与丁二酸酐反应后,纳米粒子的粒径减小,可能是由于随着羧基的修饰,纳米粒子表面氢键数量减少[30-31],因此纳米粒子的水力学直径DH变小。表面电位变为负值,电荷值相近。
|
|
表 2 纳米粒子水力学直径与ζ电位 Table 2 Hydrodynamic diameters and ζ potential of different nanoparticles |
为了进一步定量表征纳米粒子表面官能团密度,分别利用酸性橙Ⅱ和邻苯二酚紫对表面氨基密度D(NH2)和羧基密度D(COOH)进行了定量检测,结果如图 3所示。SiO2-E-NH2、SiO2-D-NH2、SiO2-T-NH2表面氨基密度分别为(0.50 ± 0.01),(1.64 ± 0.08)和(2.60 ± 0.05) μmol·m-2,氨基密度的变化趋势与XPS所测定的氮元素含量变化趋势一致。SiO2-E-COOH、SiO2-D-COOH、SiO2-T-COOH表面羧基密度分别为(0.11 ± 0.04)、(0.63 ± 0.03)和(1.41 ± 0.01) μmol·m-2,与XPS中C元素相对含量变化趋势一致。因羧基纳米粒子制备是在氨基纳米粒子基础之上,故氨基密度越大,羧基密度越大。由于表面氨基无法完全与丁二酸酐反应,因此同一纳米粒子在反应后羧基密度低于氨基密度。
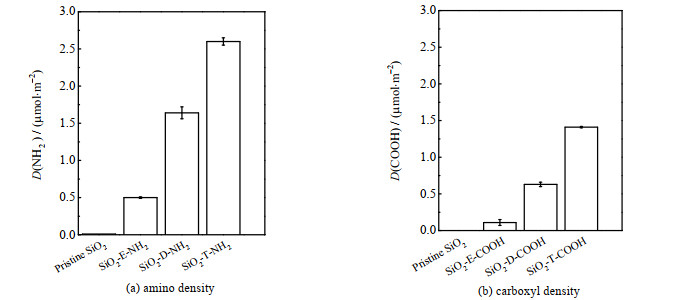
|
图 3 纳米粒子表面官能团密度 Fig.3 Functional group density of different nanoparticles |
由图 3可以看出,SiO2-E-NH2与SiO2-D-COOH官能团密度分别为(0.50±0.01)、(0.63 ± 0.03) μmol·m-2,SiO2-D-NH2与SiO2-T-COOH官能团密度分别为(1.64 ± 0.08)、(1.41 ± 0.01) μmol·m-2,尽管2组纳米粒子官能团种类不同,但具有相近的官能团密度。因此,本研究选择这2组具有相近官能团密度的纳米粒子考察表面电性和电荷密度对抗体固定及抗原结合强度的影响。
3.2 硅纳米粒子表面抗体固定及抗原结合强度绒毛促性腺激素(human chorionic gonadotropin,HCG)是由胎盘绒毛膜的合体滋养层产生,含量随妊娠周期的变化而变化,可用于妊娠早期及胚胎发育情况的辅助诊断。在此选择了作用于HCG的α-亚基的单克隆抗体(抗α-HCG抗体)用于研究不同表面电性和电荷密度对纳米粒子表面抗体取向的影响。本研究分别采用上述两组纳米粒子(SiO2-E-NH2与SiO2-D-COOH、SiO2-D-NH2与SiO2-T-COOH)通过物理吸附固定抗α-HCG抗体。此外,在相应的羧基纳米粒子表面通过NHS/EDC活化羧基共价偶联抗α-HCG抗体。利用BCA试剂盒评价了纳米粒子表面抗体固定量,进一步通过ELISA研究抗原结合强度。从图 4可以看出低官能团密度的3种纳米粒子的抗体固定量相近,每mg NPs约120.0 μg。由于官能团密度低,推测抗体吸附主要受二氧化硅纳米粒子自身表面性质影响,故低官能团纳米粒子的抗体吸附量相近。对于高官能团密度的3种纳米粒子(图 4),SiO2-T-COOH/covalent的抗体固定量最大,为每mg NPs (145.3 ± 3.0) μg,SiO2-T-COOH抗体吸附量大于SiO2-D-NH2,分别为每mg NPs (125.3 ± 2.6) μg和(101.2 ± 2.5) μg。官能团密度升高后,抗体吸附主要受官能团静电作用影响,因此抗体吸附量由于表面电荷的不同产生了差异。原因可能与抗α-HCG抗体的等电点(pI 6.8)有关[22],在实验条件(pH 6.1)下抗体电性为正,更易吸附在带负电荷的羧基纳米粒子表面。随着氨基密度升高(SiO2-E-NH2→SiO2-D-NH2),纳米粒子表面正电荷密度增加,对抗体的静电排斥力增加,因此抗体吸附量降低。不同密度羧基纳米粒子(SiO2-D-COOH→SiO2-T-COOH)由于表面ζ电位相近,故抗体吸附量相近。
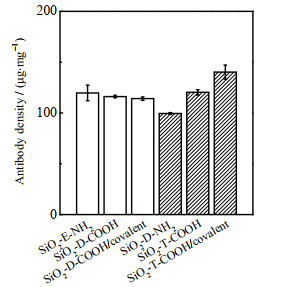
|
图 4 高、低官能团密度纳米粒子的抗体固定量 Fig.4 The amount of immobilized antibody blank: nanoparticles with low functional group density, stripe: nanoparticles with high functional group density |
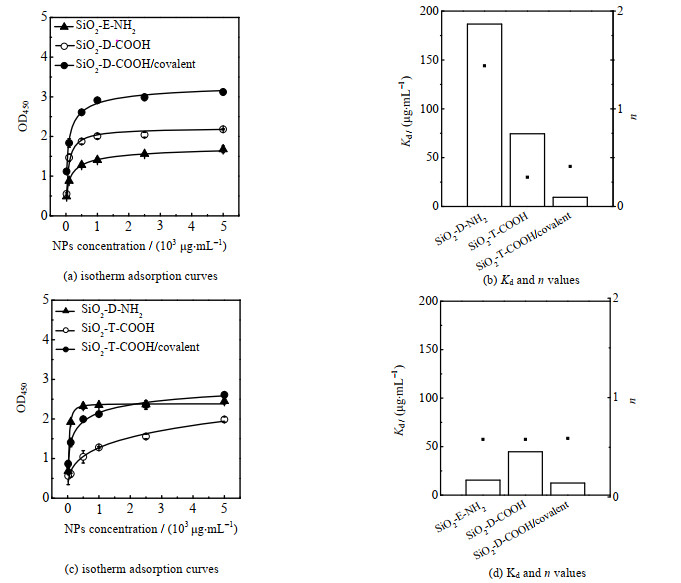
通过ELISA研究了不同Ab-NPs与抗原的结合强度,利用希尔方程(式(5))拟合得其等温吸附曲线(图 5 (a)、(c)),经计算得到Kd、n(图 5(b)、(d)和表 3)。在低官能团密度下,SiO2-E-NH2和SiO2-D-COOH的Kd值分别为15.4和35.9 μg·mg-1,说明SiO2-E-NH2的抗原结合强度高于SiO2-D-COOH,而且两者n值相近,均小于1,说明负协同作用相近,即纳米粒子在表面的结合会抑制后续纳米粒子的结合。在高官能团密度下,SiO2-D-NH2和SiO2-T-COOH的Kd值均有所增加,分别为186.7和74.4 μg·mg-1,说明氨基和羧基密度升高后,抗原结合强度均发生了降低,SiO2-D-NH2和SiO2-T-COOH的n值分别为1.41和0.30,说明SiO2-T-COOH负协同作用发生了增加,而SiO2-D-NH2则变为正协同作用。由于羧基密度提高后抗体在纳米粒子表面的共价偶联位点增加,抗体固定量增大,其Kd值有所降低(SiO2-D-COOH/covalent和SiO2-T-COOH/ covalent的Kd值分别为12.4和9.4 μg·mg-1),抗原结合强度增大。
|
图 5 ELISA检测得到的纳米粒子在HCG包被的孔板上的等温吸附曲线和Kd值与n值 Fig.5 Isotherm adsorption curves of nanoparticles on HCG coated plate detected by ELISA together with corresponding Kd and n values |
|
|
表 3 拟合数据(Kd,n) Table 3 Fitting data (Kd, n) |
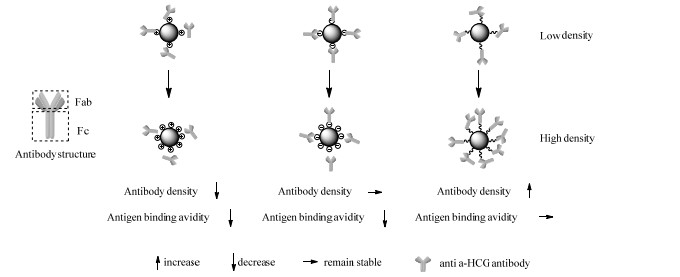
基于以上的结果,推测官能团密度可以调控Ab-NPs表面抗体取向(图 6)。抗α-HCG抗体的Fab片段和Fc片段的等电点分别在8~9和5~6,所以在pH=6.1的实验条件下,其Fab片段带正电,Fc片段带负电。Fc片段更易吸附在氨基表面,使Fab片段朝向溶液,暴露出更多抗原结合位点。羧基纳米粒子更易吸附带正电的Fab片段,使Fc片段朝向溶液,遮蔽抗原结合位点。在低官能团密度条件下3种纳米粒子的抗体固定量相近,抗体取向受到表面电性影响,因此低羧基密度纳米粒子的抗原结合强度小于低氨基密度纳米粒子。表面氨基密度升高后,抗体吸附量降低,抗原结合位点减少,故抗原结合强度降低。羧基密度升高后,抗体吸附量基本不变,而抗体更趋向于Fab片段吸附在纳米粒子表面,导致更多抗原结合位点被遮蔽,最终导致纳米粒子的抗原结合强度降低。共价偶联法固定抗体反应发生时抗体首先物理吸附至纳米粒子表面,再与表面的羧基进行反应。在实验条件下,溶液pH接近Fc片段的等电点,因此Fc片段更易与Ab-NPs表面NHS/EDC活化的羧基反应,进而使得抗体倾向于Fab朝向溶液。羧基密度增加后,羧基纳米粒子抗体偶联量增大,因此抗原结合强度增大。
|
图 6 不同官能团密度纳米粒子表面抗体取向图 Fig.6 Antibody orientation on the surface of nanoparticles with different functional group densities |
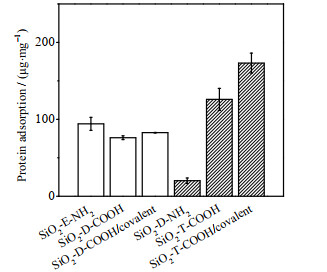
在实际应用中抗原的检测往往是在复杂的生物溶液中进行。因此本研究通过将Ab-NPs在胎牛血清(fetal bovine serum,FBS)中孵育来模拟实际检测环境,以考察非特异性吸附对Ab-NPs的抗原结合强度的影响。从图 7可以看出,在10% FBS中孵育1 h后,3种低官能团密度的纳米粒子表面蛋白非特异性吸附量相近,均为每mg NPs 85.1 μg左右,原因可能是在低官能团密度条件下,因纳米粒子表面的抗体吸附量相近,吸附抗体后的纳米粒子表面状态相近,故在FBS中孵育后,蛋白非特异性吸附量相近。官能团密度升高后,氨基纳米粒子表面非特异性吸附量显著降低,为每mg NPs 20.0 μg,羧基纳米粒子和共价偶联法均有所升高,分别为每mg NPs 125.2和173.1 μg。高羧基密度纳米粒子的血清蛋白非特异性吸附量远大于高氨基密度纳米粒子。可能是在高官能团密度条件下,3种纳米粒子的表面电荷、疏水性、抗体吸附量及抗体的表面状态等均存在显著差异,因此在成分复杂的FBS溶液(含有约180多种血清蛋白[32]、无机盐等)中,不同纳米粒子表面的蛋白非特异性吸附量会存在较大差异。并且已有文献证明在不同表面性质的纳米粒子上,蛋白冠的组成也存在差异[33]。
|
图 7 10% FBS孵育后,高、低官能团密度纳米粒子血清蛋白吸附量 Fig.7 The amount of adsorbed serum protein after incubation with 10% FBS |
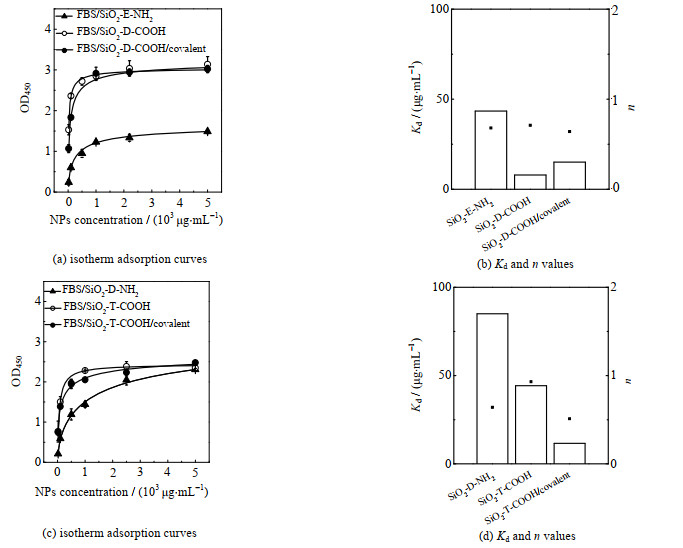
用ELISA研究了10% FBS孵育后,非特异性吸附对纳米粒子的抗原结合能力的干扰,由图 8和表 3可以看出低氨基密度纳米粒子(SiO2-E-NH2)在FBS中孵育后,Kd由15.4增大至43.4 μg·mL-1。本研究认为抗体分子在纳米粒子表面的重排和FBS的非特异性吸附共同作用,导致抗原结合强度降低(图 9)。n值从0.58增大至0.68,说明负协同作用减弱。而SiO2-D-COOH、SiO2-D-NH2和SiO2-T-COOH在FBS孵育后的Kd值变化分别为44.7→7.9 μg·mL-1,186.7→85.0 μg·mL-1,74.4→44.3 μg·mL-1,Kd值均有所降低,说明在FBS孵育后3者抗原结合强度均有所增加。原因可能是SiO2-D-NH2吸附血清蛋白后,静电作用在一定程度上调节了其表面抗体的吸附取向,暴露了更多的结合位点,从而增强了抗原结合强度。SiO2-D-COOH和SiO2-T-COOH在吸附了血清蛋白后,纳米粒子表面蛋白密度的增加使抗体在纳米粒子表面发生重排,更多的抗体取向通过重排变为Fc片段朝向纳米粒子,Fab片段朝向溶液,抗原结合强度增大。由于共价偶联法固定的抗体具有较好的稳定性,在FBS孵育后,抗体取向不变,抗原结合强度基本保持不变。
|
图 8 10% 胎牛血清孵育后ELISA检测得到的纳米粒子在HCG包被的孔板上的等温吸附曲线、Kd值与n值 Fig.8 Isotherm adsorption curves of nanoparticles on HCG coated plate detected by ELISA together with corresponding Kd and n values (after incubation with 10% FBS) |
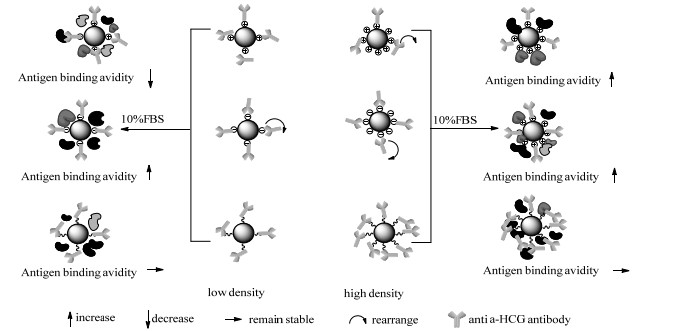
|
图 9 胎牛血清孵育后,不同官能团密度纳米粒子表面抗体取向示意图 Fig.9 Antibody orientation on the surface of nanoparticles with different functional group densities after incubation with 10% FBS |
本研究成功构筑了一系列不同表面电性和电荷密度的硅纳米粒子,并分别通过静电吸附和共价偶联2种方式进行了抗α-HCG抗体固定。利用两组不同电荷密度的纳米粒子评价了抗体固定量和抗原结合强度,抗体在正电荷纳米粒子表面倾向于Fab朝外,随电荷密度升高抗体固定量减少;在负电荷纳米粒子表面抗体取向随电荷密度的增高逐渐趋向于Fc片段朝外,抗原结合强度降低。对非特异性吸附干扰的研究显示,高密度氨基纳米粒子和羧基纳米粒子表面在非特异性吸附血清蛋白后抗原结合强度反而增加,推测是由于血清蛋白的吸附引起了表面抗体取向的重排,使得更多的抗体呈现出Fab片段朝外的取向。本研究对电性和电荷密度与Ab-NPs表面抗体取向、固定量及抗原结合强度之间关系的研究有助于提高Ab-NPs的检测灵敏度和准确性,对开发高灵敏度和高特异性的检测方法具有一定指导作用。
| [1] |
THIRUPPATHI R, MISHRA S, GANAPATHY M, et al. Nanoparticle functionalization and its potentials for molecular Imaging[J]. Advanced Science, 2017, 4(3): 1600279. DOI:10.1002/advs.201600279 |
| [2] |
MONDANI L, DELANNOY S, MATHEY R, et al. Fast detection of both O157 and non-O157 shiga-toxin producing escherichia coli by real-time optical immunoassay[J]. Letters in Applied Microbiology, 2016, 62(1): 39-46. DOI:10.1111/lam.12503 |
| [3] |
SHEN M, RUSLING J F, DIXIT C K. Site-selective orientated immobilization of antibodies and conjugates for immunodiagnostics development[J]. Methods, 2017, 116: 95-111. DOI:10.1016/j.ymeth.2016.11.010 |
| [4] |
DIXIT C K, VASHIST S K, MACCRAITH B D, et al. Multisubstrate-compatible ELISA procedures for rapid and high-sensitivity immunoassays[J]. Nature Protocols, 2011, 6(4): 439-445. DOI:10.1038/nprot.2011.304 |
| [5] |
CHAPPELL D L, MCAVOY T, WEISS B, et al. Development and validation of an ultra-sensitive method for the measurement of plasma renin activity in human plasma via LC-MS/MS[J]. Bioanalysis, 2012, 4(23): 2843-2850. DOI:10.4155/bio.12.268 |
| [6] |
LV S, SHENG J, ZHAO S, et al. The detection of brucellosis antibody in whole serum based on the low-fouling electrochemical immunosensor fabricated with magnetic Fe3O4@Au@PEG@HA nanoparticles[J]. Biosensors and Bioelectronics, 2018, 117: 138-144. DOI:10.1016/j.bios.2018.06.010 |
| [7] |
MUSTAFAOGLU N, KIZILTEPE T, BILGICER B. Site-specific conjugation of an antibody on a gold nanoparticle surface for one-step diagnosis of pros, tate specific antigen with dynamic light scattering[J]. Nanoscale, 2017, 9(25): 8684-8694. DOI:10.1039/C7NR03096G |
| [8] |
HU T, CHEN C, HUANG G, et al. Antibody modified-silver nanoparticles for colorimetric immuno sensing of Aβ(1-40/1-42) based on the interaction between β-amyloid and Cu2+[J]. Sensors and Actuators, B: Chemical, 2016(234): 63-69. |
| [9] |
BANIUKEVIC J, HAKKI BOYACI I, GOKTUG BOZKURT A, et al. Magnetic gold nanoparticles in SERS-based sandwich immunoassay for antigen detection by well oriented antibodies[J]. Biosensors and Bioelectronics, 2013, 43(1): 281-288. |
| [10] |
PREECHAKASEDKIT P, PINWATTANA K, DUNGCHAI W, et al. Development of a one-step immunochromatographic strip test using gold nanoparticles for the rapid detection of Salmonella typhi in human serum[J]. Biosensors and Bioelectronics, 2012, 31(1): 562-566. DOI:10.1016/j.bios.2011.10.031 |
| [11] |
YU Q, WANG Q, LI B, et al. Technological development of antibody immobilization for optical immunoassays: Progress and prospects[J]. Critical Reviews in Analytical Chemistry, 2015, 45(1): 62-75. DOI:10.1080/10408347.2014.881249 |
| [12] |
RUIZ G, TRIPATHI K, OKYEM S, et al. pH impacts the orientation of antibody adsorbed onto gold nanoparticles[J]. Bioconjugate Chemistry, 2019, 30(4): 1182-1191. DOI:10.1021/acs.bioconjchem.9b00123 |
| [13] |
PUERTAS S, MOROS M, FERNANDEZ-PACHECO R, et al. Designing novel nano-immunoassays: Antibody orientation versus sensitivity[J]. Journal of Physics D: Applied Physics, 2010, 43(47): 470012. |
| [14] |
YANG S, LIU J, ZHOU J, et al. Simulated revelation of the adsorption behaviours of acetylcholinesterase on charged self-assembled monolayers[J]. Nanoscale, 2020, 12(6): 3701-3714. DOI:10.1039/C9NR10123C |
| [15] |
CONDE J, DIAS J T, GRAZÚ V, et al. Revisiting 30 years of biofunctionalization and surface chemistry of inorganic nanoparticles for nanomedicine[J]. Frontiers in Chemistry, 2014, 2: 48. |
| [16] |
ARRUEBO M, VALLADARES M, GONZÁLEZ-FERNÁNDEZ A. Antibody-conjugated nanoparticles for biomedical applications[J]. Journal of Nanomaterials, 2009, 2009(2): 439389. |
| [17] |
MARQUES A C, COSTA P J, VELHO S, et al. Functionalizing nanoparticles with cancer-targeting antibodies: A comparison of strategies[J]. Journal of Controlled Release, 2020(320): 180-200. |
| [18] |
ZHENG H, YANG S J, ZHOU J, et al. Electrostatic effect of functional surfaces on the activity of adsorbed enzymes: Simulations and experiments[J]. ACS Applied Materials and Interfaces, 2020, 12(31): 35676-35687. DOI:10.1021/acsami.0c08080 |
| [19] |
TALLAWI M, ROSELLINI E, BARBANI N, et al. Strategies for the chemical and biological functionalization of scaffolds for cardiac tissue engineering: A review[J]. Journal of the Royal Society Interface, 2015, 12(108): 20150254. DOI:10.1098/rsif.2015.0254 |
| [20] |
LIÉBANA S, DRAGO G A. Bioconjugation and stabilisation of biomolecules in biosensors[J]. Essays in Biochemistry, 2016, 60(1): 59-68. DOI:10.1042/EBC20150007 |
| [21] |
ZHOU J, CHEN S, JIANG S. Orientation of adsorbed antibodies on charged surfaces by computer simulation based on a united-residue model[J]. Langmuir, 2003, 19(8): 3472-3478. DOI:10.1021/la026871z |
| [22] |
CHEN S, LIU L, ZHOU J, et al. Controlling antibody orientation on charged self-assembled monolayers[J]. Langmuir, 2003, 19(7): 2859-2864. DOI:10.1021/la026498v |
| [23] |
LOU D, JI L, FAN L, et al. Antibody-oriented strategy and mechanism for the preparation of fluorescent nanoprobes for fast and sensitive immunodetection[J]. Langmuir, 2019, 35(14): 4860-4867. DOI:10.1021/acs.langmuir.9b00150 |
| [24] |
LI M, CHENG F, XUE C, et al. Surface modification of stöber silica nanoparticles with controlled moiety densities determines their cytotoxicity profiles in macrophages[J]. Langmuir, 2019, 35(45): 14688-14695. DOI:10.1021/acs.langmuir.9b02578 |
| [25] |
SCHÖTTLER S, BECKER G, WINZEN S, et al. Protein adsorption is required for stealth effect of poly(ethylene glycol)-and poly(phosphoester)-coated nanocarriers[J]. Nature Nanotechnology, 2016, 11(4): 372-377. DOI:10.1038/nnano.2015.330 |
| [26] |
ZHANG X, LIN W, CHEN S, et al. Development of a stable dual functional coating with low non-specific protein adsorption and high sensitivity for new superparamagnetic nanospheres[J]. Langmuir, 2011, 27(22): 13669-13674. DOI:10.1021/la202566d |
| [27] |
De PUIG H, BOSCH I, CARRÉ-CAMPS M, et al. Effect of the protein corona on antibody-antigen binding in nanoparticle sandwich immunoassays[J]. Bioconjugate Chemistry, 2017, 28(1): 230-238. DOI:10.1021/acs.bioconjchem.6b00523 |
| [28] |
FEINER-GRACIA N, BECK M, PUJALS S, et al. Super-resolution microscopy unveils dynamic heterogeneities in nanoparticle protein corona[J]. Small, 2017, 13(41): 1701631. DOI:10.1002/smll.201701631 |
| [29] |
TONIGOLD M, SIMON J, ESTUPIÑÁN D, et al. Pre-adsorption of antibodies enables targeting of nanocarriers despite a biomolecular corona[J]. Nature Nanotechnology, 2018, 13(9): 862-869. DOI:10.1038/s41565-018-0171-6 |
| [30] |
MOROKDMA K. Molecular orbital studies of hydrogen bonds. Ⅲ. C=OH…H-O hydrogen bond in H2CO…H2O and H2CO…2H2O[J]. The Journal of Chemical Physics, 1971, 55(3): 1236-1244. DOI:10.1063/1.1676210 |
| [31] |
CAO L J, LI A Y, JI H B, et al. Theoretical study on the ring stretching modes of pyridine in the hydrogen bonding with H2O, HCONH2and CH3COOH[J]. Journal of Molecular Structure: THEOCHEM, 2010, 959(1/2/3): 80-86. |
| [32] |
FRANQUI L S, De FARIAS M A, PORTUGAL R V, et al. Interaction of graphene oxide with cell culture medium: Evaluating the fetal bovine serum protein corona formation towards in vitro nanotoxicity assessment and nanobiointeractions[J]. Materials Science and Engineering C, 2019, 100: 363-377. DOI:10.1016/j.msec.2019.02.066 |
| [33] |
BAIMANOV D, CAI R, CHEN C. Understanding the chemical nature of nanoparticle-protein interactions[J]. Bioconjugate Chemistry, 2019, 30(7): 1923-1937. DOI:10.1021/acs.bioconjchem.9b00348 |




