2. 浙江省生物燃料利用技术研究重点实验室,浙江 杭州 310032
2. Zhejiang Province Key Laboratory of Biofuel, Hangzhou 310032, China
CO2在离子液体中溶解度是气体吸收剂选择的重要依据,也是离子液体在气体贮存、分离和吸收等方面应用的基本数据[1-2]。该溶解度数据有助于研究CO2和离子液体之间的相互作用,为设计满足工业需求的离子液体设计提供重要的指导[3]。目前,获得该溶解度数据的方法主要有实验测取法和模型化方法。虽然实验测取法是获得溶解度数据的首要手段和来源,但由于离子液体体系繁杂,完全通过实验测取法获得溶解度数据的难度较大,不仅耗时、耗资,而且很难做到对实际应用中所需要的操作点进行逐个测定。因此常采用建立CO2在离子液体中溶解度预测模型的方法,该模型化方法可分为经验建模方法和机理建模方法[4-5]。
一些研究者采用经验建模方法开展了CO2在离子液体中溶解度的建模研究,BAGHBAN等[6]建立了多层感知器神经网络和自适应神经-模糊干扰系统,并成功应用于CO2在离子液体中溶解度的预测;薛妮等[7]提出一种支持向量机与粒子群算法相结合的建模方法,并建立了稳定、可靠的CO2在离子液体中溶解度预测模型。虽然此类方法具有建模难度小和模型内插性好的优点,但由于缺乏可靠的机理知识支撑,且模型性能依赖于训练数据的分布,都会导致模型的外推性较差。
机理建模方法虽然具有工程背景清晰、可解释性强和外推性较好等优点,但仍存在较多不足。ZHAO等[8]成功建立了气体在离子液体中溶解度的UNIFAC–VISCO模型,但由于离子液体繁多,部分离子液体的分子结构参数不全,导致模型推广应用受限;WLAZŁO等[9]开发了一种COSMO-RS先验预测方法,但COSMO-RS还不能得到精确的预测结果,只能与实验数据进行定性比较,仍需进一步开发更佳预测性能的热力学模型;LEI等[10]采用PR状态方程,建立了CO2在离子液体溶液中的气液相平衡数据预测模型,但当CO2摩尔分数较大时,该模型的预测偏差较大,模型的适用范围较窄。
为了克服目前CO2在离子液体中溶解度的模型化方法研究所存在的不足,需充分汲取机理模型和经验模型的优点,进一步开发预测精度高且适用范围广的预测模型。将传统机理模型作为先验条件,融合亨利常数经验Valentiner式和无限稀释偏摩尔体积经验多项式,提出一种基于半经验半机理模型的CO2在离子液体中溶解度预测方法,并通过仿真研究进行方法性能测试。
2 CO2在离子液体中溶解度的预测模型气液相平衡是表示在一定的温度和压力下,气态组元与液态组元之间的平衡关系。CO2在离子液体中溶解度是根据热力学理论及合理的假设,所得到的一个气液相平衡热力学方程。根据气液相平衡过程的内部机理知识构建的Krichevsky-Kasarnovsky机理模型,模型形式简单、计算方便,可应用于Henry定律适用范围内的CO2在离子液体中溶解度计算[11]。其基本原理是在一定压力下,利用CO2在离子液体中溶解度的数据获得亨利常数和无限稀释偏摩尔体积,然后再计算得到某温度下的CO2在离子液体中溶解度。若不考虑CO2在离子液体中的非理想性,该方程的具体形式如下:
| $\ln \frac{{{{{f}}_2}}}{{{{{x}}_2}}}{\text{ = }}\ln (H_{2, 1}^{(p_1^S)}) + \frac{{{{\mathop \nu \limits^{ - \infty } }_2}(p - p_1^S)}}{{RT}}$ | (1) |
在CO2/离子液体二元体系中,由于离子液体的饱和蒸气压几乎可以忽略,CO2在离子液体溶剂中的逸度可以用纯气相代替,此项可以由Soave–Redlich–Kwong状态方程获取,离子液体的饱和蒸气压可认为近似为零,因此式(1)可简化为[12]:
| $\ln \frac{{{{{f}}_2}}}{{{{{x}}_2}}}{\text{ = }}\ln (H_{2, 1}^{}) + \frac{{{{\mathop \nu \limits^{ - \infty } }_2}p}}{{RT}}$ | (2) |
利用Krichevsky-Kasarnovsky机理模型计算溶解度存在以下难点:难以获得部分离子液体的亨利常数和无限稀释偏摩尔体积。为了克服机理建模所存在的模型自身结构难以确定、预测精度较差等问题,将机理知识作为先验条件融入到离子液体亨利常数和无限稀释偏摩尔体积的经验模型中,构建半经验半机理模型,充分利用经验模型来弥补机理知识缺失的部分,并以先验条件对经验模型的输出进行制约,使其满足相平衡过程的内在机理知识。该预测模型能有效地结合机理建模方法和经验建模方法的优点,以实现有效降低模型复杂性、提高模型预测性能的目的。
无限稀释偏摩尔体积是溶液理论中重要的热力学性质,其受压力影响作用非常小,CO2在不同离子液体溶剂中的无限稀释偏摩尔体积同时受溶剂种类和温度的影响,通常可将
| $\mathop {{\nu _2}}\limits^{ - \infty } = A + BT + C{T^2}$ | (3) |
亨利常数与温度的经验模型有多种,其中较为常用的经验模型如下[14]:
| $ \ln ({H_{21}}) = \sum\limits_{l = 1}^n {{a_l}} {T^{ - l + 1}} $ | (4) |
以式(2),(3)为基础,当式(4)中的n = 2时,LIU等提出了一种改进Krichevsky-Kasarnovsky模型[15]:
| $\ln \frac{{{f_2}}}{{{x_2}}} = {a_1} + \frac{{{a_2}}}{T} + \frac{{({A_1} + {B_1}T + {C_1}{T^2})p}}{{RT}}$ | (5) |
同理,当式(4)中的n=3时,Howlader等提出了一种改进Krichevsky-Kasarnovsky模型[16]:
| $\ln \frac{{{f_2}}}{{{x_2}}} = {{{b}}_1} + \frac{{{b_2}}}{T} + \frac{{{b_3}}}{{{T^2}}} + \frac{{({A_2} + {B_2}T + {C_2}{T^2})p}}{{RT}}$ | (6) |
式(5)和式(6)都可以用于表示CO2在离子液体中溶解度与温度、压力之间的量化关系,并用于估算不同温度和压力下的CO2在离子液体中溶解度,其不足之处在于:其模型参数在压力大于2 MPa时出现失真,同时在预测精度上也存在一些难以克服的问题,其适用范围存在一定局限。
为了使根据Krichevsky-Kasarnovsky模型拟合得到的模型参数,能在一定的条件范围内通过关联或外推得到较高精度的CO2在离子液体中溶解度数据,可采用以下亨利常数经验Valentiner式[17-18]:
| $\ln (H_{2, 1}^{}) = {c_1} + \frac{{{c_2}}}{T} + {c_3}\ln T$ | (7) |
利用Ionic Liquids Database – IL Thermo数据库中的CO2/[C6mim][Tf2N]气液平衡数据,对式(4) (n = 2和n = 3)、式(7)中的模型参数进行估计,发现其相关系数数值依次递增,这表明式(7)可以更好地关联CO2的溶解特性ln(H2, 1)。根据式(2)、式(3)和式(7),在Krichevsky-Kasarnovsky机理模型基础上,融合亨利常数经验Valentiner式和无限稀释偏摩尔体积经验多项式,可以建立一种用于预测CO2在离子液体中溶解度的半经验半机理模型,具体模型如下:
| $\ln \frac{{{{{f}}_2}}}{{{{{x}}_2}}}{\text{ = }}{{{c}}_1} + \frac{{{c_2}}}{T} + {c_3}\ln T + \frac{{({A_3} + {B_3}T + {C_3}{T^2})p}}{{RT}}$ | (8) |
通过查阅数据库和相关文献资料,Krichevsky-Kasarnovsky模型可推广应用于溶解度较高的情形[19-20]。本文收集了大量CO2与不同离子液体所组成二元体系的溶解度数据,其中溶解度范围是0.016~0.635,符合Krichevsky-Kasarnovsky模型的溶解度适用范围[14, 21-22]。由于这些数据通常是研究者使用不同的实验方法和仪器得到的,为了保证所收集数据的可靠性,采用莱以特准则剔除异常数据,共得到了386组样本数据,其中包含CO2在8种不同离子液体中的溶解度(液相摩尔分数)及其温度、压力范围,具体数据情况及其参考文献来源如表 1所示。根据不同的离子液体,从总样本数据集中随机抽取271组作为训练数据集,用于建立CO2在离子液体中溶解度的预测模型,剩余115组数据作为测试数据集,用于测试模型的预测性能。
|
|
表 1 CO2在不同离子液体中溶解度及其温度、压力范围 Table 1 Solubility and corresponding temperature/pressure ranges of CO2 in different ionic liq |
利用训练样本集的271组样本数据估计式(8) (模型Ⅲ)的未知模型参数,可以得到8种离子液体的对应模型参数,其中采用的参数估计方法是非线性最小二乘优化算法。为了评价模型Ⅲ的预测效果,同时采用271组样本数据估计式(5) (模型Ⅰ)和式(6) (模型Ⅱ)中的未知模型参数。模型Ⅰ、模型Ⅱ、Ⅲ的具体参数估计结果分别如表 2、3、4所示。
|
|
表 2 模型Ⅰ的参数估计结果 Table 2 Parameter prediction results of model Ⅰ |
|
|
表 3 模型Ⅱ的参数估计结果 Table 3 Parameter prediction results of model Ⅱ |
|
|
表 4 模型Ⅲ的参数估计结果 Table 4 Parameter prediction results of model Ⅲ |
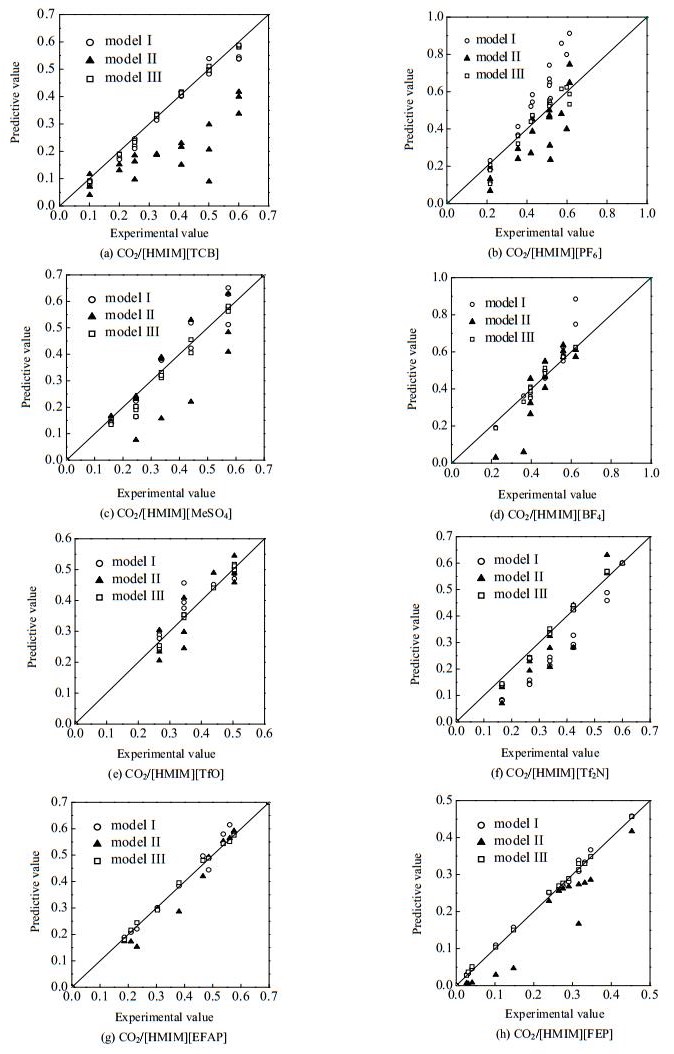
利用测试数据集的115组样本数据进行模型Ⅰ、Ⅱ和Ⅲ的预测性能测试,具体结果如图 1所示,其中子图(a)~(h)分别表示8种离子液体。由图 1可知,对于8种离子液体,模型Ⅰ与模型Ⅱ的实验值与模型计算值相比偏差较大,且随着溶解度范围的扩大,其模型预测误差越来越大,而模型Ⅲ的预测性能则较为稳定,具有更好的预测精度。
|
图 1 模型Ⅰ、Ⅱ和Ⅲ的预测结果 Fig.1 Prediction results of model Ⅰ, Ⅱ and Ⅲ |
为了定量评价模型Ⅰ、Ⅱ和Ⅲ的预测性能,采用MRE (平均相对误差)、MAE (平均绝对误差)和R2 (相关系数)作为量化评价指标,评估CO2在离子液体中溶解度实验值和预测值的一致性,3种量化评价指标的具体计算式分别如下:
| ${\rm{MRE}} = \frac{1}{N}\sum\limits_{k = 1}^N {\left| {({x_{{\rm{cal}}, k}} - {x_{\exp , k}})/{x_{\exp , k}}} \right|} $ | (9) |
| ${\rm{MAE}} = \frac{1}{N}\sum\limits_{k = 1}^N {\left| {({x_{{\rm{cal}}, k}} - {x_{\exp , k}})} \right|} $ | (10) |
| ${R^2} = [\sum\limits_{k = 1}^N {{{({x_{\exp , k}} - \frac{1}{N}\sum\limits_{k = 1}^N {{x_{\exp , k}}} )}^2} - \sum\limits_{k = 1}^N {{{({x_{\exp , k}} - {x_{{\rm{cal}}, k}})}^2}} } ]/\sum\limits_{k = 1}^N {{{({x_{\exp , k}} - \frac{1}{N}\sum\limits_{k = 1}^N {{x_{\exp , k}}} )}^2}} $ | (11) |
针对[HMIM][TCB]、[HMIM][PF6]、[HMIM][MeSO4]、[HMIM][BF4]、[HMIM][TfO]、[HMIM][Tf2N]、[HMIM][EFAP]和[HMIM][FEP]这8种离子液体,3种模型的预测性能指标数值如表 5所示。由表 5可知,在整体预测性能方面,模型Ⅲ优于模型Ⅰ,模型Ⅰ优于模型Ⅱ。模型Ⅰ、Ⅱ、Ⅲ的整体平均MRE分别为0.140、0.237和0.059,整体平均MAE分别为0.055、0.075和0.016,R2分别高于0.921、0.793和0.981。模型Ⅰ和模型Ⅱ的预测效果较差,主要原因在于测试样本数据范围超限,导致模型的稳定性难以保证。与模型Ⅰ和Ⅱ相比,模型Ⅲ的预测值与实验值吻合度更高,在测试样本数据范围较大时,模型仍具有较为稳定的预测性能,由此表明模型Ⅲ能够更准确地预测CO2在离子液体中溶解度。
|
|
表 5 模型预测性能比较 Table 5 Comparison of model prediction performance |
(1) 以Krichevsky-Kasarnovsky机理模型为基础,融合亨利常数Valentiner经验式和无限稀释偏摩尔体积经验多项式,建立了一种用于预测CO2在离子液体中溶解度的半经验半机理模型;
(2) 收集了CO2在8种离子液体中的溶解度及其温度、压力数据,得到了上述模型的参数估计结果;
(3) 仿真研究表明,与改进前的两种模型相比,该半经验半机理模型具有更佳的预测精度;
(4) 本研究工作为准确预测CO2在离子液体中溶解度提供了一种可行的方法,可以为评价与筛选高选择性离子液体提供重要的基础条件。
符号说明:
|
|
| [1] |
BRENNECKE J F, GURKAN B E. Ionic liquids for CO2 capture and emission reduction[J]. Journal of Physical Chemistry Letters, 2017, 1(24): 3459-3464. |
| [2] |
GURKAN B, GOODRICH B F, MINDRUP E M, et al. Molecular design of high capacity, low viscosity, chemically tunable ionic liquids for CO2 capture[J]. Journal of Physical Chemistry Letters, 2017, 1(24): 3494-3499. |
| [3] |
张锁江, 刘晓敏, 姚晓倩, 等. 离子液体的前沿、进展及应用[J]. 中国科学, 2009, 39(10): 1134-1144. ZHANG S J, LIU X M, YAO X Q, et al. The front, progress and application of ionic liquids[J]. Science China Chemistry, 2009, 39(10): 1134-1144. |
| [4] |
丁靖, 熊焰, 虞大红, 等. CO2在离子液体中溶解度的实验测定与模型化方法[J]. 化工进展, 2012, 31(4): 732-741. DING J, XIONG Y, YU D H, et al. Solubility of CO2 in ionic liquids-measuring and modeling methods[J]. Chemical Industry and Engineering Progress, 2012, 31(4): 732-741. |
| [5] |
许青青, 苏宝根, 陈蔚, 等. 链甾醇在五种有机溶剂中溶解度的测定、关联及预测[J]. 高校化学工程学报, 2014, 28(3): 443-448. XU Q Q, SU B G, CHEN W, et al. Determination, correlation and prediction of solubilities of desmosterol in five organic solvents[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(3): 443-448. DOI:10.3969/j.issn.1003-9015.2014.03.001 |
| [6] |
BAGHBAN A, AHMADI M A, SHAHRAKI B H. Prediction carbon dioxide solubility in presence of various ionic liquids using computational intelligence approaches[J]. Journal of Supercritical Fluids, 2015, 98: 50-64. DOI:10.1016/j.supflu.2015.01.002 |
| [7] |
薛妮, 蒋军成, 倪磊, 等. 基于PSO-SVM的咪唑类离子液体捕集CO2性能预测[J]. 安全与环境学报, 2016, 16(6): 265-269. XUE N, JIANG J C, NI L, et al. Prediction of CO2 capture performance based on PSO-SVM for imidazole-based ionic liquids[J]. Journal of Safety and Environment, 2016, 16(6): 265-269. |
| [8] |
ZHAO N, JACQUEMIN J, OOZEERALLY R, et al. New method for the estimation of viscosity of pure and mixtures of ionic liquids based on the UNIFAC-VISCO model[J]. Journal of Chemical & Engineering Data, 2016, 61(6): 2160-2169. |
| [9] |
WLAZLO M, ALEVIZOU E I, VOUTSAS E C, et al. Prediction of ionic liquids phase equilibrium with the COSMO-RS model[J]. Fluid Phase Equilibria, 2016, 424: 16-31. DOI:10.1016/j.fluid.2015.08.032 |
| [10] |
LEI Z, DAI C, CHEN B. Gas solubility in ionic liquids[J]. Chemical Reviews, 2014, 114(2): 1289-1326. DOI:10.1021/cr300497a |
| [11] |
CARROLL J J, MATHER A E. The system carbon dioxide-water and the Krichevsky-Kasarnovsky equation[J]. Journal of Solution Chemistry, 1992, 21(7): 607-621. DOI:10.1007/BF00650756 |
| [12] |
ZHOU L, FAN J, SHANG X. CO2 capture and separation properties in the ionic liquid 1-n-butyl-3-methylimidazolium nonafluorobutylsulfonate[J]. Materials, 2014, 7(5): 3867-3880. DOI:10.3390/ma7053867 |
| [13] |
KUMELAN J, TUMA D, MAURER G. Partial molar volumes of selected gases in some ionic liquids[J]. Fluid Phase Equilibria, 2009, 275(2): 132-144. DOI:10.1016/j.fluid.2008.09.024 |
| [14] |
JALILI A H, SAFAVI M, GHOTBI C, et al. Solubility of CO2, H2S, and their mixture in the ionic liquid 1-octyl-3- methylimidazolium bis(trifluoromethyl)sulfonylimide[J]. Journal of Physical Chemistry B, 2012, 116(9): 2758-2774. DOI:10.1021/jp2075572 |
| [15] |
LIU X, HE M, LV N, et al. Solubilities of isobutane and cyclopropane in ionic liquids[J]. Journal of Chemical Thermodynamics, 2015, 88: 30-35. DOI:10.1016/j.jct.2015.04.013 |
| [16] |
HOWLADER M S, FRENCH W T, TOGHIANI H, et al. Measurement and correlation of solubility of carbon dioxide in triglycerides[J]. Journal of Chemical Thermodynamics, 2017, 104: 252-260. DOI:10.1016/j.jct.2016.09.035 |
| [17] |
马沛生, 华超, 夏淑倩. 甲烷在烷烃中溶解性质的研究[J]. 高校化学工程学报, 2002, 16(6): 680-685. MA P S, HUA C, XIA S Q. Study of the solubility of methane in alkanes[J]. Journal of Chemical Engineering of Chinese Universities, 2002, 16(6): 680-685. DOI:10.3321/j.issn:1003-9015.2002.06.016 |
| [18] |
小岛和夫. 化工过程设计的相平衡[M]. 北京: 化学工业出版社, 1981. KOSHIMA K. Phase equilibrium of the design of chemical process[M]. Beijing: Chemical Industry Press, 1981. |
| [19] |
JOU F Y, MATHER A E. Solubility of hydrogen sulfide in[J]. International Journal of Thermophysics, 2007, 28(2): 490-495. DOI:10.1007/s10765-007-0185-z |
| [20] |
PEREZ SALADO KAMPS Á, MAURER G. Comment on "Solubility of CO2, H2S, and their mixture in the ionic liquid 1-octyl-3-methylimidazolium bis(trifluoromethyl)sulfonylimide"[J]. Journal of Physical Chemistry B, 2012, 116(50): 14731-14733. DOI:10.1021/jp305719w |
| [21] |
SAKHAEINIA H, JALILI A H, TAGHIKHANI V, et al. Solubility of H2S in ionic liquids 1-ethyl-3-meth-ylimidazolium- hexafluorophosphate ([J]. Journal of Chemical & Engineering Data, 2010, 55: 5839-5845. |
| [22] |
HOWLADER M S, FRENCH W T, TOGHIANI H, et al. Measurement and correlation of solubility of carbon dioxide in triglycerides[J]. Journal of Chemical Thermodynamics, 2017, 104: 252-260. DOI:10.1016/j.jct.2016.09.035 |
| [23] |
MOTA-MARTINEZ M T, ALTHULUTH M, KROON M C, et al. Solubility of carbon dioxide in the low-viscosity ionic liquid 1-hexyl-3-meth-ylimidazolium tetracyanoborate[J]. Fluid Phase Equilibria, 2012, 332: 35-39. DOI:10.1016/j.fluid.2012.06.014 |
| [24] |
肖利.含离子液体体系的预测模型热力学模型及其在化工分离中的应用[D].北京: 北京化工大学, 2012. XIAO L. Predict thermodynamic models of the ionic liquids system and their applications in the chemical separation science[D]. Beijing: Beijing University of Chemical Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10010-1012414939.htm |
| [25] |
YIM J H, LIM J S. CO2 solubility measurement in 1-hexyl-3-methy-limidazolium ([J]. Fluid Phase Equilibria, 2013, 352(12): 67-74. |
| [26] |
LIU X, HE M, LV N, et al. Selective absorption of CO2, from H2, O2, and N2, by 1-hexyl-3-methylimidazolium tris (pentafluoroethyl) trifluorophosphate[J]. Journal of Chemical Thermodynamics, 2016, 97: 48-54. DOI:10.1016/j.jct.2016.01.013 |
| [27] |
张晓春.用于吸收CO2的功能化离子液体的分子设计研究[D].北京: 北京化工大学, 2009. ZHANG X C. Molecular design of functional ionic liquids for CO2 absorption[D]. Beijing: Beijing University of Chemical Technology, 2009. http://d.wanfangdata.com.cn/Thesis/Y1558716 |




