2. 浙江普洛康裕制药有限公司,浙江 东阳 322100
2. Zhejiang Apeloa Kangyu Pharmaceutical Co. Ltd., Dongyang 322100, China
酒石酸是一种重要的化工产品,广泛应用于食品、医药、轻工等行业[1]。作为一种优良的酸味剂,其酸味是柠檬酸的1.2~1.3倍,风味独特,是目前唯一被允许加入到葡萄酒中的酸味剂[2-3]。酒石酸市场前景广阔,有报道指出,在全世界范围内,仅食品和医药两个行业,酒石酸年消耗量就高达3万吨[4]。
酒石酸分子中有两个相同的不对称碳原子,故存在左旋酒石酸(l-TA)、右旋酒石酸(d-TA)、内消旋酒石酸(Meso-TA)及外消旋酒石酸(dl-TA) 4种同分异构体[5-6]。酒石酸主要以钾盐的形式存在于多种植物和果实中,最早是Hayyan从酿造葡萄酒的副产物酒石中提取出来,后来由瑞典化学家Scheele进一步改进,该法成为如今最常用的酒石酸提取工艺[7]。迄今为止,酒石酸的生产方法除了天然提取法[8],还有生物酶转化法[9-10]和化学合成法[11-12]。目前,国内工业化生产dl-酒石酸以化学合成法为主:以顺丁烯二酸酐为原料,w=30%过氧化氢为氧化剂,二水合钨酸钠为催化剂,升温4 h至72 ℃,恒温回流18 h催化环氧化生成环氧丁二酸,再通过水解反应得到目标产物,抽滤,向滤液中滴加w=48%氢氧化钾溶液调节其pH值,得到产物酒石酸氢钾。两步总收率为70%。该工艺反应周期长、收率较低,而且母液中含有大量未反应完全的原料,若直接排放,则会造成资源浪费,环境污染,增加生产成本。因此,对dl-酒石酸的传统合成工艺开展研究并进行优化具有重要价值。
由于环氧丁二酸的水解反应较易进行,dl-酒石酸的收率高低主要取决于顺丁烯二酸的环氧化反应。本文借鉴合成环氧丁二酸钠的相关报道[13-15],着眼于环氧化反应的改进,在原有工艺的基础上进行优化。以顺丁烯二酸酐为原料,以过氧化氢为绿色氧化剂,引入钙离子将其先转化为环氧丁二酸(氢)钙,再通过酸化、水解反应得到产品dl-酒石酸,并将母液回收套用,进一步提高产品收率。多次套用后的母液用氢氧化钾溶液调节pH值获得产物酒石酸氢钾。dl-酒石酸的工艺流程图如图 1所示。
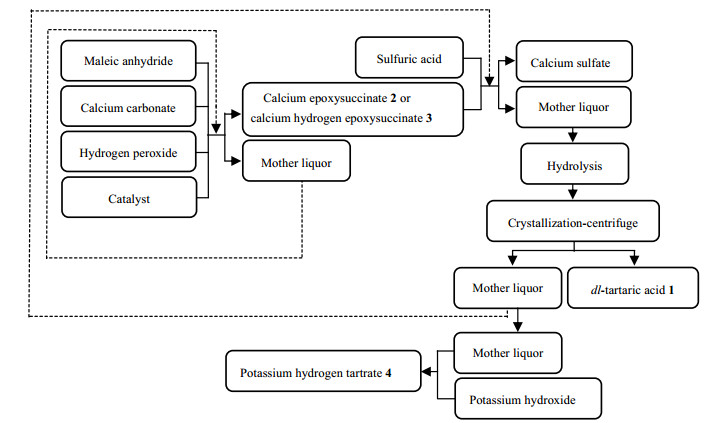
|
图 1 工艺流程图 Fig.1 Flow chart of the preparation process |
本实验所用试剂为顺丁烯二酸酐、碳酸钙、w=30%过氧化氢、二水合钨酸钠、w=98%浓硫酸、氢氧化钾等。以上样品均为分析纯。实验用水为去离子水。
2.2 分析仪器WRS-1B数字熔点仪;IRAffinity-1S傅里叶红外光谱仪。
2.3 典型实验dl-酒石酸的合成路线如图 2所示。先以顺丁烯二酸酐为原料通过环氧化反应分别合成环氧丁二酸钙(2)和环氧丁二酸氢钙(3),再分别以(2)、(3)为原料通过酸化、水解反应合成dl-酒石酸(1),根据生产需求进行母液回收循环或者用氢氧化钾溶液处理母液合成产物酒石酸氢钾(4)。
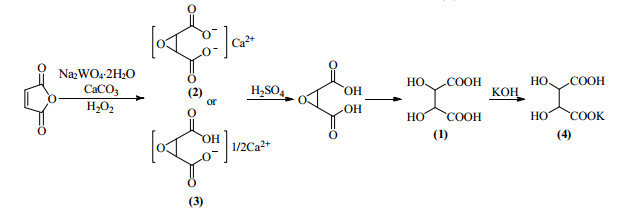
|
图 2 dl-酒石酸的改进合成路线 Fig.2 An improved synthetic route of dl-tartaric acid |
250 mL四口烧瓶中加入12.50 g(0.128 mol)顺丁烯二酸酐,50 mL水,预热至40 ℃(θ1),在机械搅拌下缓慢加入12.50 g(0.125 mol)碳酸钙,待其充分混合,加入0.25 g(x=0.60%)二水合钨酸钠,同时流加20 mL (0.192 mol) w=30%过氧化氢。然后升温至50 ℃(θ2),回流4 h(t1),冷却至室温,经抽滤、水洗,在60 ℃下烘干,得到白色晶体32.80 g,收率92.5%。母液经3次套用,每次套用补加0.025 g (x=0.06%)二水合钨酸钠,16 mL(0.154 mol) w=30%过氧化氢,不补加额外的溶剂,重复上述步骤,每次套用收率均大于90%。IR(KBr, cm-1): 3 552.94 (O─H)、3 261.15 (O─H)、3 037.94 (C─H)、1 684.85 (C═O)、1 411.92 (COO-)、1 301.01 (COO-)、1 074.37 (C─H),产物IR谱图与环氧丁二酸钙样品谱图相符,证明产品为环氧丁二酸钙。
2.3.2 环氧丁二酸氢钙(3)的合成250 mL四口烧瓶中加入12.50 g(0.128 mol)顺丁烯二酸酐,50 mL水,预热至50 ℃(θ3),在机械搅拌下缓慢加入6.88 g(0.069 mol)碳酸钙,待其充分混合后,加入0.25 g(x=0.60 %)二水合钨酸钠,同时流加20 mL (0.192 mol) w=30%过氧化氢。然后升温至70 ℃(θ4),回流4 h(t2),冷却至室温,经抽滤、水洗,在60 ℃下烘干,得到白色粉末20.47 g,收率95.0%。母液经3次套用,每次套用补加0.025 g (x=0.06 %)二水合钨酸钠,16 mL(0.154 mol) w=30%过氧化氢,不补加额外的溶剂,重复上述步骤,每次套用收率均大于95%。IR(KBr, cm-1): 3 454.57 (O─H)、3 243.35 (O─H)、3 026.36 (C─H)、1 647.24 (C═O)、1 447.60 (COO-)、1 339.59 (COO-)、1 186.24 (C─C),产物IR谱图与环氧丁二酸氢钙样品谱图相符,证明产品为环氧丁二酸氢钙。
2.3.3 dl-酒石酸(1)的合成250 mL四口烧瓶中加入44.88 g(0.161 mol)环氧丁二酸钙(2),45 mL水,搅拌使之成为悬浊液。冰水浴冷却至0 ℃,缓慢滴加23.74 g(0.242 mol)浓硫酸。滴毕,撤去冰浴,于室温下反应4 h(t3)。抽滤,滤液在100~105 ℃(θ5)下回流3.5 h(t4),冷却结晶,经抽滤、水洗,在100 ℃下烘干,得到白色晶体13.00 g。母液经3次套用,控制每次反应液用量相同,每次套用补加19.00 g (0.193 mol)浓硫酸,不补加额外的溶剂,重复上述步骤,3次套用分别得到白色晶体23.70、23.16、23.22 g,收率分别为97.9%、95.7%、95.9%。以环氧丁二酸氢钙为原料制备dl-酒石酸的实验过程同上,摩尔比n(Ca2+):n(H2SO4)=1:1.50,得到白色晶体,母液经3次套用收率分别为76.4%、71.3%、73.8%。熔点204.2~204.8 ℃(文献值[16]: 204~206 ℃)。IR(KBr, cm-1): 3 410.20 (O─H)、3 356.20 (O─H)、2 968.50 (C─H)、1 735.96 (C═O)、1 453.39 (COO-)、1 400.34 (COO-)、1 141.88 (C─C)、1 096.62 (C─H),产物IR谱图与标准谱图相符[17],证明产品为dl-酒石酸。
2.3.4 酒石酸氢钾(4)的合成多次套用后的母液中边搅拌边滴加w=48%氢氧化钾溶液,调节pH至3.5~3.7,冷却抽滤,在60 ℃下烘干,得到白色粉末6.90 g。熔点253.8~254.3 ℃(文献值[18]: 254~256 ℃)。IR(KBr, cm-1): 3 339.80 (O─H)、2 960.78 (C─H)、1 701.24 (C═O)、1 558.51 (COO-)、1 411.92 (COO-)、1 217.10 (C─C)、1 073.40 (C─H),产物IR谱图与标准谱图相符[19],证明产品为酒石酸氢钾。
2.3.5 酒石酸氢钾产物中硫酸盐的测定标准比浊溶液的配制:量取0.2 mL 0.01 mol·L-1硫酸溶液及2 mL 4 mol·L-1盐酸溶液,转移至50 mL比色管中,用水稀释至50 mL;样品溶液配制:称取0.50 g酒石酸氢钾样品,加入2 mL 4 mol·L-1盐酸溶液及30 mL水,加热使之溶解,转移至50 mL比色管中,用水稀释至50 mL。两只比色管中分别加入2 mL 0.49 mol·L-1氯化钡溶液,充分混合,放置10 min,在黑色背景下由侧面及上方观察并比较其浊度。
3 实验结果与讨论本文主要考察了反应温度、反应时间、催化剂用量、过氧化氢用量和投料比对反应速率的影响,对dl-酒石酸(1)的合成进行了优化。
3.1 环氧丁二酸钙(2)的工艺优化 3.1.1 环氧化反应温度对收率的影响如表 1所示,当维持θ1、θ2中一个温度不变时,反应收率随另一个温度的升高先增加后降低。升高温度既加快了环氧化反应的反应速率,同时也促进了过氧化氢的分解。温度过高还会导致环氧丁二酸钙的形态发生改变。结果表明,当θ1=40 ℃,θ2=50 ℃时,反应收率最高且环氧丁二酸钙的形态未发生改变。
|
|
表 1 环氧化反应温度对收率的影响 Table 1 Effects of epoxidation reaction temperature on reaction yieldsa |
顺丁烯二酸酐与过氧化氢的接触时间延长,有利于顺丁烯二酸酐的转化,提高反应收率。但环氧化时间过长也可能导致过氧化氢的分解。从表 2可以看出,反应4 h后继续延长环氧化时间,反应收率基本不再增加,因此为提高生产效率,选择环氧化时间为4 h。
|
|
表 2 环氧化时间t1对收率的影响 Table 2 Effects of epoxidation time t1 on reaction yields#° |
在确定了环氧化反应温度和环氧化时间后,又进一步对碳酸钙、催化剂和过氧化氢用量进行了考察,结果如表 3所示。
|
|
表 3 碳酸钙、催化剂和过氧化氢用量对收率的影响 Table 3 Effects of calcium carbonate/catalyst/hydrogen peroxide dosage on reaction yieldsa |
首先在n(顺丁烯二酸酐):n(二水合钨酸钠):n(过氧化氢)=1:0.006:0.154情况下,考察了碳酸钙用量对反应收率的影响。反应收率随着碳酸钙用量的增加而增加,当使用0.125 mol的碳酸钙时,收率最高。进一步增加碳酸钙用量至0.128 mol,收率反而有所降低。所以,选择碳酸钙用量为0.125 mol,效果最佳。
在此基础上,进一步考察了催化剂二水合钨酸钠用量对收率的影响。反应初期,反应收率随着催化剂用量的增加而增加,当催化剂用量达到x=0.60%后,收率增长变缓。为节约生产成本,降低重金属污染,因此选择催化剂用量x=0.60%。
在环氧化反应中,过氧化氢用量会对收率产生较大影响。过量过氧化氢能显著提高反应收率,当过氧化氢用量大于0.192 mol时,反应收率增长不明显,仅由92.5%增至94.0%,综合考虑所增加的成本和取得的收益,选择过氧化氢用量为0.192 mol。
3.2 环氧丁二酸氢钙(3)的工艺优化确定反应时间t2为4 h,n(顺丁烯二酸酐):n(过氧化氢):n(催化剂)=1:1.50:0.006,保持其它条件不变,考察了环氧化反应温度θ3、θ4以及碳酸钙的用量对环氧丁二酸氢钙的反应收率的影响。
3.2.1 环氧化反应温度对收率的影响结果如表 4所示,随着环氧化反应温度的升高,反应收率先增加后减小,环氧丁二酸氢钙的最佳环氧化反应温度θ3=50 ℃,θ4=70 ℃,可能与溶液的酸碱度以及产物物性有关。
|
|
表 4 环氧化反应温度对收率的影响 Table 4 Effects of epoxidation reaction temperature on reaction yields° |
从表 5可以看出,当碳酸钙用量为理论值(0.064 mol)时,反应收率为84.7%。随着碳酸钙用量的增加,当用量达到0.069 mol时,反应收率最高。进一步增加用量,反应收率减小,而且碳酸钙用量过多会生成部分环氧丁二酸钙。因此,选择碳酸钙用量为0.069 mol较适宜。
|
|
表 5 碳酸钙用量对收率的影响 Table 5 Effects of calcium carbonate dosage on reaction yields#° |
dl-酒石酸的合成主要分为两条路线,第1条路线是以环氧丁二酸钙为原料,第2条路线是以环氧丁二酸氢钙为原料。本文着重对以环氧丁二酸钙为原料合成dl-酒石酸的路线进行条件优化,分别考察浓硫酸用量以及酸化时间t3等对反应收率的影响。
3.3.1 浓硫酸用量对收率的影响浓硫酸用量过少,会导致钙离子无法完全沉淀;浓硫酸用量过多,则会引入过多的硫酸根离子,导致在后续的氢氧化钾溶液处理过程中生成较多的副产物硫酸钾,所以浓硫酸的用量对反应收率有较大的影响。由表 6可以看出,随着浓硫酸用量的增加,dl-酒石酸的收率不断增加,当浓硫酸用量为0.24 mol时,收率为82.2%。随着用量进一步增加,钙离子已完全沉淀,收率无明显变化。为了尽可能减少浓硫酸的用量,因此,选择浓硫酸用量为0.242 mol。
|
|
表 6 硫酸用量对收率的影响 Table 6 Effects of sulfuric acid dosage on reaction yields#° |
由表 7可以看出,酸化时间越长,钙离子沉淀越完全,得到的沉淀二水合硫酸钙的质量与理论值越接近,反应收率越高。生成的副产物二水合硫酸钙可作为工业废气CO2的矿化剂或将其转化为半水合硫酸钙,可作为强化材料、药物载体等,具有高附加值[20]。当t3=4 h时,钙离子几乎完全沉淀,沉淀质量与理论值一致,反应收率为82.2%,当酸化时间进一步延长,反应收率几乎不再增加。因此,选择酸化时间t3为4 h。
|
|
表 7 酸化时间t3对收率的影响 Table 7 Effects of acidification time t3 on reaction yieldsa |
在最佳反应条件下,以环氧丁二酸氢钙为原料合成dl-酒石酸的反应收率为64.4%。
3.4 母液套用反应 3.4.1 环氧丁二酸(氢)钙的母液套用反应结束后,母液中的钨酸根离子仍处于较高浓度。若直接排放,废液中含有的重金属(钨)会对环境造成较大污染。为减少污染,同时降低生产成本,对环氧丁二酸(氢)钙的母液进行了回收套用。每次套用,氧化剂过氧化氢用量从0.192 mol减少至0.154 mol,催化剂二水合钨酸钠用量从x=0.60%减少至x=0.06%,降低了90.0%。由图 3可以看出,对环氧丁二酸(氢)钙的母液进行了3次套用,环氧丁二酸钙和环氧丁二酸氢钙的收率始终维持稳定,收率均大于90.0%。
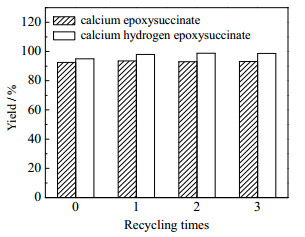
|
图 3 母液套用对收率的影响 Fig.3 Effects of mother liquor circulation on reaction yields |
由于dl-酒石酸在水中的溶解度较大,无法通过冷却结晶完全获得,反应液中仍含有较高浓度的dl-酒石酸,通过一次反应收率始终低于85.0%。为了使溶液尽可能达到饱和,以析出更多的dl-酒石酸产物,对dl-酒石酸合成反应的母液进行了套用。每次套用,补加0.193 mol浓硫酸。由图 4可以看出,以环氧丁二酸钙为原料的合成路线母液套用收率均大于95.0%,以环氧丁二酸氢钙为原料的合成路线母液套用收率均大于75.0%。3次套用后的母液用氢氧化钾溶液处理,得到产物酒石酸氢钾。母液套用工艺大大提高了原料利用率和反应收率。由于以环氧丁二酸钙为原料的dl-酒石酸合成路线反应收率远大于以环氧丁二酸氢钙为原料的合成路线。因此,选用以环氧丁二酸钙为原料的合成路线。
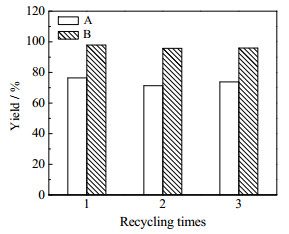
|
图 4 母液套用对dl-酒石酸收率的影响
Fig.4 Effects of mother liquor circulation on dl-tartaric acid yields
A. calcium hydrogen epoxysuccinate as a raw material; B. calcium epoxysuccinate as a raw material |
用氢氧化钾溶液处理的过程中,氢氧化钾会与过量硫酸以及dl-酒石酸发生反应,分别生成硫酸钾和酒石酸氢钾,如反应式(1)、(2)所示。
| $ \mathrm{H}_{2} \mathrm{SO}_{4}+2 \mathrm{KOH} \longrightarrow \mathrm{K}_{2} \mathrm{SO}_{4}+2 \mathrm{H}_{2} \mathrm{O} $ | (1) |
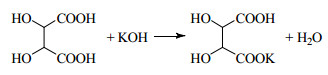
|
(2) |
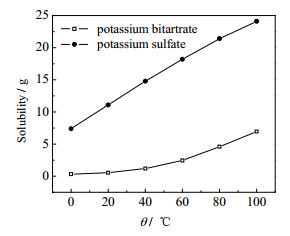
由于酒石酸氢钾与硫酸钾的溶解度差异较大,因此选择水洗的方法纯化酒石酸氢钾产品。理论上,已消耗SO42-摩尔nc(SO42-)= n(Ca2+)=0.161 mol,因此剩余SO42-摩尔nr(SO42-)=0.080 mol,根据式(1)生成n(K2SO4)=nr(SO42-)=0.080 mol,即生成硫酸钾的质量为14.10 g。由图 5可以看出,20 ℃下硫酸钾的溶解度为11.10 g[21]。因此,溶解14.10 g硫酸钾需要127 mL水。由于反应液中含有45 mL的水,因此采用100 mL水对酒石酸氢钾产品洗涤4次。同时由于酒石酸氢钾在水中的溶解度极低,20 ℃下溶解度仅为0.54 g,损失可以忽略不计。然后按2.3.5节方法对酒石酸氢钾产物中硫酸盐含量进行测定,结果表明样品溶液呈现的浊度低于标准溶液,即酒石酸氢钾产物中硫酸盐浓度符合标准。
|
图 5 酒石酸氢钾和硫酸钾的溶解度曲线 Fig.5 Solubility curves of potassium hydrogen tartrate and potassium sulfate |
将环氧丁二酸钙产物经水洗、醇洗、干燥后,检测环氧基的含量,从而推测产物中结晶水含量。
0.1 mol·L-1氯化镁饱和溶液-盐酸试剂的制备:取150 g六水合氯化镁,加入45 mL水和1.2 mL浓盐酸,在室温下振荡使其饱和,静置3 h,取上清液,储存于玻璃瓶中备用。
称取环氧丁二酸钙产物0.5~0.6 g,准确到0.000 1 g,置于磨口锥形瓶中,用移液管移取36 mL氯化镁饱和溶液-盐酸试剂,振荡使样品溶解,在60 ℃下反应45 min。冷却至室温,加入3滴溴甲酚绿指示剂,用0.1 mol·L-1的NaOH标准溶液滴定至终点(由黄色变蓝色),同时做空白试样。

|
(3) |
| $ \mathrm{HCl}+\mathrm{NaOH} \longrightarrow \mathrm{NaCl}+\mathrm{H}_{2} \mathrm{O} $ | (4) |
环氧基含量的检测原理如反应式(3)、(4)所示,环氧基与盐酸反应生成相应的氯代醇,然后用氢氧化钠标准溶液滴定过量的盐酸,从而计算环氧丁二酸钙的含量。环氧丁二酸钙含量X(%)按式(5)计算:
| $X = \frac{{({V_0} - {V_1}) \times C \times M}}{{10 \times m}} \times 100\% $ | (5) |
结果如表 8所示,取3次平行检测结果的算术平均值,结晶水个数为5.8个,即环氧丁二酸钙结晶水个数为6个。
|
|
表 8 环氧丁二酸钙结晶水的个数 Table 8 Numbers of crystal water of calcium epoxysuccinate |
在298.15 K下硫酸钙的溶度积为9.10×10-6,根据溶液中硫酸根离子浓度,可以推出溶液中钙离子含量最大为1.70×10-6 mol·L-1。用乙二胺四乙酸二钠(EDTA)滴定法对产物dl-酒石酸中的钙离子含量进行了检测,进一步证明了钙离子含量极少,符合标准。
4 结论本文以顺丁烯二酸酐为起始原料,碳酸钙为钙源,过氧化氢为绿色氧化剂,二水合钨酸钠为催化剂,水为溶剂,通过环氧化反应合成了环氧丁二酸(氢)钙中间体,再经酸化、水解反应获得目标产物dl-酒石酸,并对母液进行3次回收套用,套用3次后的母液用氢氧化钾溶液调节pH获得产物酒石酸氢钾。相较于传统合成工艺,该路线将反应时间从25.5 h缩短至11.5 h,将环氧化温度降低了22 ℃,有效地将dl-酒石酸的收率提高了近6%,并增加了母液回收套用流程,实现了溶剂、催化剂和氧化剂的回收套用,减少了废液的排放,使dl-酒石酸的收率进一步提高了15%左右,具有较好的工业应用前景。
在反应过程中,对反应条件进行了优化,得到了最优反应条件:制备环氧丁二酸钙(2),反应体系中n(顺丁烯二酸酐):n(碳酸钙):n(过氧化氢):n(二水合钨酸钠)=1:0.98:1.50:0.006,预热温度为40 ℃,反应温度为50 ℃,反应时间为4 h,收率为92.5%,并对母液进行3次套用,催化剂用量减少90.0%,氧化剂用量减少了20%,套用收率均大于90.0%;制备环氧丁二酸氢钙(3),反应体系中n(顺丁烯二酸酐):n(碳酸钙) =1:0.54,预热温度为50 ℃,反应温度为70 ℃,收率为95.0%,并对母液进行3次套用,收率均大于95.0%;制备dl-酒石酸(1),反应体系中n(环氧丁二酸钙):n(浓硫酸)=1:1.50,室温下反应4 h,抽滤,滤液在100~105 ℃下回流3.5 h,冷却结晶,过滤干燥,并对母液进行3次套用,补加80%浓硫酸,套用收率均大于95.0%。将套用3次后的母液用w=48%氢氧化钾调节pH值,得到产物酒石酸氢钾(4)。
符号说明:
|
|
| [1] |
VIKARTOVSKA A, BUCKO M, GEMEINER P, et al. Flow calorimetry-A useful tool for determination of immobilized cis-epoxysuccinate hydrolase activity from nocardia tartaricans[J]. Artificial Cells, Blood Substitutes and Biotechnology, 2004, 32(1): 77-89. |
| [2] |
TAKAHASHI H, OHBA K, KIKUCHI K I. Sorption of di- and tricarboxylic acids by an anion-exchange membrane[J]. Journal of Membrane Science, 2003, 222(1/2): 103-111. |
| [3] |
XIAO C N, DAI H, LIU H B, et al. Revealing the metabonomic variation of rosemary extracts using 1H NMR spectroscopy and multivariate data analysis[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 10142-10153. |
| [4] |
TARDIO J, BHARGAVA S, PRASAD J, et al. Catalytic wet oxidation of the sodium salts of citric, lactic, malic and tartaric acids in highly alkaline, high ionic strength solution[J]. Topics in Catalysis, 2005, 33(1/2/3/4): 193-199. |
| [5] |
HARAZIN J, BERIGAN T R. Zolpidem tartrate and somnambulism[J]. Military Medicine, 1999, 164(9): 669-670. |
| [6] |
TAN B, LUO G S, WANG J D. Extractive separation of amino acid enantiomers with co-extractants of tartaric acid derivative and Aliquat-336[J]. Separation and Purification Technology, 2007, 53(3): 330-336. |
| [7] |
LOW L L, O'NEILL B, FORD C, et al. Economic evalution of alternative technologies for tartrate stabilization of wines[J]. International Journal of Food Science and Technology, 2008, 43(7): 1202-1216. |
| [8] |
MOLETTA R. Winery and distillery wastewater treatment by anaerobic digestion[J]. Water Science & Technology, 2005, 51(1): 137-144. |
| [9] |
BAO W N, PAN H F, ZHANG Z H, et al. Isolation of the stable strain Labrys sp. BK-8 for l(+)-tartaric acid production[J]. Journal of Bioscience and Bioengineering, 2015, 119(5): 538-542. |
| [10] |
WANG Z Q, WANG Y S, SHI H, et al. Improvement of the production efficiency of l-(+)-tartaric acid by heterogeneous whole-cell bioconversion[J]. Applied Microbiology and Biotechnology, 2014, 172(8): 3989-4001. |
| [11] |
HARRUP M K, KIM G S, ZENG H D, et al. Triniobium polytungstophosphates syntheses, structures, clarification of isomerism and reactivity in the presence of H2O2[J]. Inorganic Chemistry, 1998, 37(21): 5550-5556. |
| [12] |
QUARTARARO C E, HAZRA S, HADI T, et al. Structural, kinetic and chemical mechanism of isocitrate dehydrogenase-1 from mycobacterium tuberculosis[J]. Biochemistry, 2013, 52(10): 1765-1775. |
| [13] |
TANG M J, LI J B, YE Z R, et al. A novel eco-friendly scale and corrosion inhibitor modified by β-cyclodextrin[J]. Australian Journal of Chemistry, 2017, 70(8): 933-942. |
| [14] |
LI H M, ZHU H J, JIN H, et al. Preparation and crystal structure of sodium hydrogen epoxysuccinate[J]. Chinese Journal of Structural Chemistry, 2005, 24(3): 259-262. |
| [15] |
SHI S Q, CHEN Y G, GONG J, et al. Syntheses, characterization and catalytic activity of peroxo tantalum poloxotungstates[J]. Transition Metal Chemistry, 2005, 172(30): 136-140. |
| [16] |
ROMER S, BEHZADI B, FASEL R, et al. Homochiral conglomerates and racemic crystals crystals in two dimensions: tartaric acid on Cu(110)[J]. Chemistry-A European Journal, 2005, 11(14): 4149-4154. |
| [17] |
WITKO E M, KORTER T M. Investigation of the low-frequency vibrations of crystalline tartaric acid using terahertz sepectroscopy and solid-state density functional theory[J]. The Journal of Physical Chemistry A, 2011, 115(35): 10052-10058. |
| [18] |
QUASIM I, FIRDOUS A, SAHNI N, et al. Characterization of pure and doped potassium hydrogen tartrate single crystals grown in silica gel[J]. Crystal Research & Technology, 2009, 44(5): 539-547. |
| [19] |
GVANI J, JOSHI M J. Growth and characterization of gel grown potassium hydrogen levo-tartrate crystals[J]. Indian Journal of Physics, 2008, 82(11): 1485-1494. |
| [20] |
孙祥斌, 张楠, 窦焰, 等. 柠檬酸铵对水热合成α-CaSO4·0.5H2O结晶过程的影响[J]. 高校化学工程学报, 2019, 33(1): 98-102. SUN X B, ZHANG N, DOU Y, et al. Effects of ammonium citrate on crystallization of α-CaSO4·0.5H2O in hydrothermal synthesis processes[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(1): 98-102. |
| [21] |
邱龙会, 王励生, 金作美. 钾长石-石膏-碳酸钙热分解烧成物中硫酸钾的浸取过程[J]. 高校化学工程学报, 2000, 14(5): 465-469. QIU L H, WANG L S, JIN Z M. Leaching process of potassium sulfate from roasts of potash feldspar, gypsum and calcium carbonate[J]. Journal of Chemical Engineering of Chinese Universities, 2000, 14(5): 465-469. |
| [22] |
LIU Z F, LI H H, GAO Y H, et al. Optimizing synthetic process of epoxysuccinic acid[C]//WU M L. 5th International Conference on Information Engineering for Mechanics and Materials. France: Atlantis Press, 2015: 285-290.
|




