2. 唐山三友化工股份有限公司, 河北 唐山 063305;
3. 河北省绿色化工与高效节能重点实验室, 河北工业大学 化工学院, 天津 300130
2. Tangshan Sanyou Chemical Industry Co. Ltd., Tangshan 063305, China;
3. Hebei Provincial Key Lab of Green Chemical Technology and High Efficient Energy Saving, College of Chemical Engineering, Hebei University of Technology, Tianjin 300130, China
海水淡化已成为缓解人类淡水资源严重匮乏的重要手段。我国海水淡化技术及产业发展迅速,近十几年来,全国海水淡化累计产能逐年增加,海水淡化总规模达到每日百万吨以上[1]。海水淡化副产大量浓海水,其中含有丰富的化学资源,若处理不当直接排海,不仅污染海洋生态环境,还会造成大量资源浪费。因此,对淡化副产浓海水的治理和综合利用具有重要的经济和社会价值[2-3]。浓海水主要成分为NaCl溶液,经精制化盐工艺得高浓度盐水,满足制碱原料标准要求[4-5]。然而,对于制碱生产行业来说,增加副产浓海水浓度,最大化利用浓海水,是实现副产浓海水利用效益最大化的关键技术之一。目前,多效蒸馏(MED)[6-9]、多级闪蒸(MSF)[10-11]等热蒸馏法[12-14]和反渗透(RO)[15-16]、电渗析(ED)等膜法[17-18]在工业海水浓缩和淡化中应用最为广泛。然而,热蒸馏法技术仍受限于结构材料的腐蚀和水垢的生成,RO和ED技术需解决膜上污垢生成和对原水进行严格预处理等问题。水合物法能从原理上避免海水浓缩淡化过程中的结垢、设备腐蚀和膜污染等问题,现有技术主要采用C3H8、CO2、一氟二氯乙烷(HCFC)等一些烃类及其取代物气体为水合剂进行海水淡化技术研究[19-23]。受生成水合物稳定性的影响,水合物法浓缩海水技术对操作压力和温度环境要求较为苛刻,且有些水合反应具有一定的爆炸潜能值、可燃性和毒性。在一定温度条件下的过饱和水溶液中,无机盐水合物的析出可达到浓缩海水的目的,过程具有低耗能、化学性质稳定等优点。因而,在海水体系浓缩过程中,选择的无机盐水合剂能够结合多个结晶水,且具有安全环保、廉价易得等特点。海水淡化排放的浓海水中主要含有氯离子、硫酸根离子、钠和镁离子。硫酸钠在32.38 ℃以下低温条件下,过饱和水溶液以Na2SO4·10H2O结晶物形式析出,所以选用硫酸钠为水合剂进行海水增浓技术研究。基于水盐体系相平衡理论,Na+, Mg2+//Cl−, SO42−-H2O四元交互体系相平衡研究多用于室温或高温条件下等温蒸发析盐规律的研究[24-29]。由于硫酸钠水合物结晶析出条件为低温过饱和状态,本研究对5 ℃时Na+, Mg2+//Cl−, SO42−-H2O四元交互体系相平衡特征进行研究,分析Na2SO4·10H2O结晶水合物的析出规律,设计硫酸钠水合物法增浓海水的工艺。
2 实验材料与方法 2.1 试剂和仪器实验所用试剂:氯化钠、氯化镁、无水硫酸钠、硫酸镁及分析所用试剂均为分析纯,所用水均为去离子水。
所用仪器:CHD-0530低温恒温水浴,江苏中大仪器科技有限公司,控温精度为±0.1 ℃。
2.2 实验装置及方法实验装置及实验方法见参考文献[30],其温度在设定温度(5±0.1) ℃范围波动。以三元体系等温共饱点为基础加入另外一种盐,进行等温溶解实验,定期进行化学分析,直至各化学组分质量分数保持不变,可判定5 ℃时相平衡反应时间为12 h。
2.3 分析测定方法等温法测定5 ℃时Na+, Mg2+//Cl−, SO42−-H2O四元体系相平衡溶解度,其中Mg2+质量分数w(Mg2+)采用乙二胺四乙酸(EDTA)络合滴定法测定,SO42−浓度c(SO42−)采用加入BaCl2生成BaSO4重量法测定,Cl−浓度c(Cl−)采用硝酸银滴定法测定,Na+质量分数w(Na+)用差减法计算得出。三元子体系等温共饱点与平衡固相组成采用湿固相法相图分析得出。四元体系固相鉴定采用湿渣法并结合X 射线衍射法(XRD)共同确定。
XRD 采用日本理学smartlab X 射线衍射仪测定,Cu 靶Kα射线,管电压 40 kV,管电流100 mA,扫描速度10 (°)⋅min−1,扫描范围10°~90°。
3 结果与讨论牛自得等[31]未提供5 ℃时Mg2+//Cl−, SO42−-H2O和Na+, Mg2+//Cl−, SO42−-H2O三元子体系相平衡溶解度数据,需对此三元体系溶解度进行测定和研究。
3.1 5 ℃时Mg2+//Cl−, SO42−-H2O三元体系相平衡5 ℃时Mg2+//Cl−, SO42−-H2O三元体系相图如图1所示。图中w(MgSO4)为MgSO4质量分数,w(MgCl2)为MgCl2质量分数,a、e点分别表示MgSO4⋅7H2O
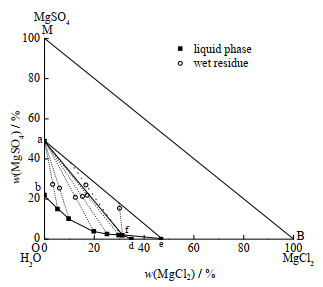
|
图 1 5 ℃时Mg2+//Cl−, SO42−-H2O三元体系相图 Fig.1 Phase diagram of the Mg2+//Cl−, SO42−-H2O system at 5 ℃ |
|
|
表 1 5 ℃时Mg2+//Cl−, SO42−-H2O三元体系相平衡数据 Table 1 Phase equilibrium data of the Mg2+//Cl−, SO42−-H2O system at 5 ℃ |
5 ℃时Na+, Mg2+//Cl−-H2O
|
|
表 2 5 ℃时Na+,Mg2+//Cl−-H2O三元体系相平衡数据 Table 2 Phase equilibrium data of the Na+,Mg2+//Cl−-H2O system at 5 ℃ |
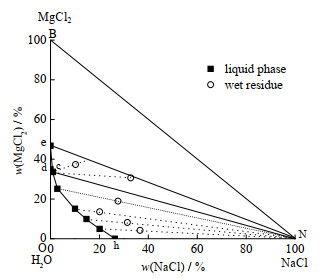
|
图 2 5 ℃时Na+, Mg2+//Cl−-H2O三元体系相图 Fig.2 Phase diagram of the Na+, Mg2+//Cl−-H2O system at 5 ℃ |
以三元子体系溶解度数据[31]为基础,测定5 ℃时Na+, Mg2+//Cl−, SO42−-H2O四元体系相平衡溶解度数据,Na+、SO42− 和H2O的耶涅克指数J以100摩尔总干盐为基础计算得出。以J(SO42−)为横坐标,J(2Na+)为纵坐标,绘制5 ℃时Na+, Mg2+//Cl−, SO42−-H2O
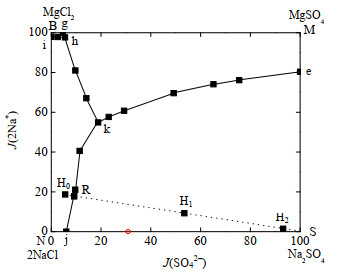
|
图 3 5 ℃时Na+, Mg2+//Cl−, SO42−-H2O四元体系相图 Fig.3 Phase diagram of the Na+, Mg2+//Cl−, SO42−-H2O system at 5 ℃ |
|
|
表 3 5 ℃ 时Na+, Mg2+//Cl−, SO42−-H2O四元体系相平衡数据 Table 3 Phase equilibrium data of the Na+, Mg2+//Cl−, SO42−-H2O system at 5 ℃ |
由图3和表3分析得出,5 ℃时Na+, Mg2+//Cl−, SO42−-H2O
2个三盐等温共饱点k、h对应平衡固相的 XRD 表征如图4所示。从图中分析可知:等温共饱点k对应的平衡固相组成为Na2SO4⋅10H2O、MgSO4⋅7H2O和NaCl;等温共饱点h对应的平衡固相组成为NaCl、MgSO4⋅7H2O和MgCl2⋅6H2O。
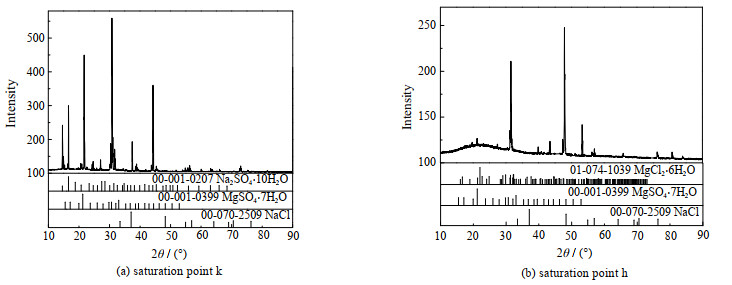
|
图 4 等温共饱点的XRD表征图 Fig.4 XRD patterns of samples at co-saturation points |
相平衡特征分析表明,5 ℃时Na+, Mg2+/Cl−, SO42−-H2O四元体系可形成面积较大的Na2SO4⋅10H2O结晶区。对于海水体系来说,可选择硫酸钠做水合剂,进行硫酸钠水合物法的海水增浓技术研究。
3.4 5 ℃时硫酸钠水合物法增浓海水工艺以曹妃甸浓海水作为研究对象进行增浓工艺研究,浓海水中各离子的质量浓度ρB和耶涅克指数J(2Na+)和J(SO42−),如表4所示。
|
|
表 4 浓海水体系成分含量数据 Table 4 Compositions of concentrated seawater |
根据5 ℃时Na+, Mg2+/Cl−, SO42−-H2O
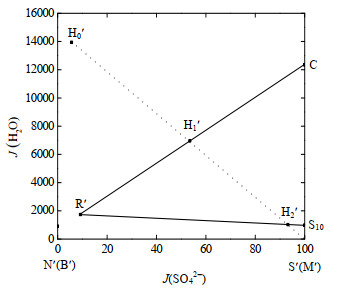
|
图 5 浓缩过程工艺水图 Fig.5 Water-content diagram of the enrichment process |
5 ℃条件下,向曹妃甸浓海水中逐渐投加无水硫酸钠,形成混合体系。混合体系的组成点落在浓海水组成点和Na2SO4组成点的连线上,即干盐图线段H0S上,且由H0向S移动;工艺水图线段H0'S',由H0'向S'移动。干盐图上,浓缩工艺线H0S与5 ℃时Na+, Mg2+/Cl−, SO42−-H2O四元体系相图的Na2SO4•10H2O和NaCl的两盐共饱和线相交于点R,对应于工艺水图为点R'。
以工艺水图中水量变化过程进行水合物形成和海水浓缩过程分析。连接CR',与浓缩工艺线H0'S'相交于H1';连接S10R',与浓缩工艺线H0'S'相交于H2'。由直线规则可知,当混合体系点落在线段H0'H1'之间时,加入的硫酸钠完全溶解,Na2SO4⋅10H2O结晶尚未析出,混合溶液为未饱和状态;随着无水硫酸钠投加量逐渐增大,混合体系点落在H1'H2'之间时,Na2SO4⋅10H2O开始结晶析出,且析出量随无水硫酸钠加入量增大而增大;当混合体系点落在H2'时,此时Na2SO4⋅10H2O析出量最大,NaCl固相同时达到共饱和状态,且即将与Na2SO4⋅10H2O共同析出。对于浓海水增浓工艺来说,选取H2'为最佳无水硫酸钠和浓海水的混合体系组成点,此时Na2SO4⋅10H2O结晶析出量最大,且不析出氯化钠固相。
硫酸钠水合物法增浓海水工艺流程如图6所示。向曹妃甸浓海水中加入适量无水硫酸钠,组成混合体系。在5 ℃条件下,混合体系置于恒温水浴中,机械搅拌反应12 h,反应平衡后,离心分离,去除Na2SO4⋅10H2O固体,可得增浓海水。增浓海水经精制处理,去除镁离子和硫酸根离子后,可用于制碱生产。Na2SO4⋅10H2O经热分解得无水硫酸钠和水,无水硫酸钠可重复利用,继续进行浓海水增浓工艺,实现循环生产。
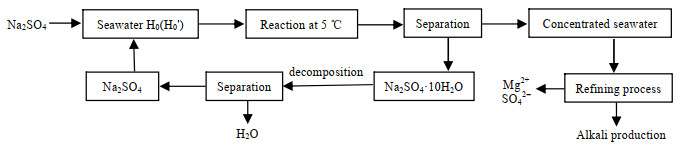
|
图 6 5 ℃时硫酸钠水合物法增浓海水工艺流程图 Fig.6 Flow chart of seawater enrichment process by the Na2SO4 hydrate method at 5 ℃ |
以1 000 kg曹妃甸浓海水为基准,依据直线规则和物料守恒,对5 ℃时硫酸钠水合物法浓缩海水工艺进行计算,计算结果如表5所示。
|
|
表 5 硫酸钠水合物法浓缩海水工艺计算 Table 5 Phase diagram results of seawater enrichment by the Na2SO4 hydrate method |
相图计算结果表明,每处理1 000 kg曹妃甸浓海水,需投加657.2 kg无水硫酸钠,形成混合体系。在5 ℃条件下搅拌反应平衡后,离心分离得Na2SO4⋅10H2O结晶固相1 485.0 kg,增浓后海水质量172.2 kg。Na2SO4⋅10H2O固相经热分解得654.7 kg无水Na2SO4和830.3 kg H2O。此工艺可使曹妃甸浓海水浓缩率高达82.78%,无水硫酸钠回收率为99.6%。
4 结论(1) 等温法测定了5 ℃时Na+, Mg2+/Cl−, SO42−-H2O四元交互体系及其子体系相平衡溶解度数据,相图特征分析表明:该体系存在2个等温共饱点和4个结晶区。生成较大面积的 Na2SO4⋅10H2O结晶区,可用于硫酸钠水合物法增浓海水技术的研究。
(2) 以曹妃甸浓海水为研究对象,进行硫酸钠水合物法增浓海水技术工艺分析和计算,结果表明:每处理1 000 kg曹妃甸浓海水,需投加657.2 kg无水硫酸钠,反应平衡后,可得增浓后海水172.2 kg。曹妃甸浓海水浓缩率高达82.78%,无水硫酸钠回收率为99.6%。
(3) 硫酸钠水合物法浓缩海水技术能够高效增浓海水,可用于氨碱法的制碱生产原料,最大化利用浓海水,减少或替代化盐过程,实现淡化副产浓海水利用效益最大化。
| [1] |
王玉杰, 马俊涛. 关于海水淡化浓海水综合利用的研究[J]. 盐科学与化工, 2019, 48(11): 9-10, 13. WANG Y J, MA J T. Study on comprehensive utilization of seawater desalination concentrated seawater[J]. Journal of Salt Science and Chemical Industry, 2019, 48(11): 9-10, 13. DOI:10.3969/j.issn.2096-3408.2019.11.003 |
| [2] |
黄鹏飞, 王小军, 张寅, 等. 我国海水淡化现状与开发方案研究[J]. 盐科学与化工, 2020, 49(8): 6-10. HUANG P F, WANG X J, ZHANG Y, et al. The state of the art of desalination development and research on exploration scheme in China[J]. Journal of Salt Science and Chemical Industry, 2020, 49(8): 6-10. DOI:10.3969/j.issn.2096-3408.2020.08.003 |
| [3] |
刘骆峰, 张雨山, 黄西平, 等. 淡化后浓海水化学资源综合利用技术研究进展[J]. 化工进展, 2013, 32(2): 446-452. LIU L F, ZHANG Y S, HUANG X P, et al. Research progress of multipurpose utilization technologies of brine from seawater desalination plant[J]. Chemical Industry and Engineering Progress, 2013, 32(2): 446-452. |
| [4] |
王亚敏, 刘杰, 袁俊生. 海水淡化副产浓海水资源化利用制备NaCl[J]. 水处理技术, 2020, 46(5): 60-64. WANG Y M, LIU J, YUAN J S. Preparation of NaCl from concentrated seawater of seawater desalination by-products[J]. Technology of Water Treatment, 2020, 46(5): 60-64. |
| [5] |
云玉娥, 刘艳娟, 王秉钧. 浓海水化盐精制工艺实验研究[J]. 山东化工, 2016, 45(16): 39-41. YUN Y E, LIU Y J, WANG B J. Study on the refining process of desalination seawater[J]. Shangdong Chemical Industry, 2016, 45(16): 39-41. DOI:10.3969/j.issn.1008-021X.2016.16.014 |
| [6] |
沈胜强, 周士鹤, 牟兴森, 等. 大型低温多效蒸发海水淡化装置传热过程热力损失分析[J]. 化工学报, 2014, 65(9): 3666-3674. SHEN S Q, ZHOU S H, MU X S, et al. Analysis of thermodynamic losses of heat transfer process in large-scale LT-MED desalination plant[J]. CIESC Journal, 2014, 65(9): 3666-3674. |
| [7] |
马学虎, 兰忠, 温荣福, 等. 低温多效蒸发海水淡化系统性能的实验研究[J]. 高校化学工程学报, 2014, 28(6): 1210-1216. MA X H, LAN Z, WEN R F, et al. Experimental study on the performance of low temperature multi-effect distillation platform for seawater desalination[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(6): 1210-1216. DOI:10.3969/j.issn.1003-9015.2014.06.005 |
| [8] |
LIU X H, LIU D W, SHEN S Q, et al. Performance analysis of mixed feed LT-MED desalination system with thermal vaporcompressor[J]. Desalination and Water Treatment, 2012, 42(1/2/3): 248-255. |
| [9] |
DASTGERDI H R, WHITTAKER P B, CHUA H T. New MED based desalination process for low grade waste heat[J]. Desalination, 2016, 395: 57-71. DOI:10.1016/j.desal.2016.05.022 |
| [10] |
LIU R J, ZHANG T Z, ZHANG H X, et al. Thermodynamic analysis of multistage flash seawater desalination system[J]. Journal of Coastal Research, 2020, 105(SI): 237-241. |
| [11] |
ALAMRI A H, OBOT I B. Highly efficient corrosion inhibitor for C1020 carbon steel during acid cleaning in multistage flash (MSF) desalination plant[J]. Desalination, 2019, 470: 1-15. |
| [12] |
CHOI S H. Thermal type seawater desalination with barometric vacuum and solar energy[J]. Energy, 2017, 141(1): 1332-1349. |
| [13] |
PETERSON E L, GRAY S R. Effectiveness of desalination powered by a tracking solar array to treat saline bore water[J]. Desalination, 2012, 293(1): 94-103. |
| [14] |
齐春华, 冯厚军, 孙靖, 等. 热法海水淡化前沿技术及其应用进展[J]. 中国给水排水, 2015, 31(24): 34-38. QI C H, FENG H J, SUN J, et al. Overview of advanced technologies for thermal seawater desalination and their applications[J]. China Water& Wastewater, 2015, 31(24): 34-38. |
| [15] |
HE W, WANG Y, SHAHEED M H. Stand-alone seawater RO (reverse osmosis) desalination powered by PV (photovoltaic) and PRO (pressure retarded osmosis)[J]. Energy, 2015, 86(15): 423-435. |
| [16] |
张金赫, 李花, 沈驭臣, 等. 膜蒸馏海水淡化过程中的两相流强化实验研究[J]. 高校化学工程学报, 2018, 32(1): 38-43. ZHANG J H, LI H, SHEN Y C, et al. Experimental investigation on two-phase flow enhancement of desalination processes via membrane distillation[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(1): 38-43. |
| [17] |
王奔, 秦英杰, 王彬, 等. 多效膜蒸馏过程用于海水和浓海水的深度浓缩[J]. 化工进展, 2013, 32(9): 2233-2241. WANG B, QIN Y J, WANG B, et al. Study on deep concentration of seawater and brine by multiple-effect membrane distillation[J]. Chemical Industry and Engineering Progress, 2013, 32(9): 2233-2241. |
| [18] |
郑智颖, 李凤臣, 李倩, 等. 海水淡化技术应用研究及发展现状[J]. 科学通报, 2016, 61(21): 2344-2370. ZHENG Z Y, LI F C, LI Q, et al. State-of-the-art of R&D on seawater desalination technology[J]. Chinese Science Bulletin, 2016, 61(21): 2344-2370. |
| [19] |
徐政涛, 谢应明, 孙嘉颖, 等. 水合物法海水淡化技术研究进展及展望[J]. 热能动力工程, 2020, 35(7): 1-11. XU Z T, XIE Y M, SUN J Y, et al. Research progress and prospect of hydrate based desalination technology[J]. Journal of Engineering for the Thermal Energy and Power, 2020, 35(7): 1-11. |
| [20] |
喻志广, 祁影霞, 姬利明, 等. CO2水合物法淡化海水影响因素的实验研究[J]. 低温与特气, 2013, 31(1): 21-25. YU Z G, QI Y X, JI L M, et al. Experimental study of effects on hydrate seawater desalination by CO2[J]. Low Temperature and Specialty Gases, 2013, 31(1): 21-25. DOI:10.3969/j.issn.1007-7804.2013.01.005 |
| [21] |
FAKHARIAN H, GANJI H, NADERIFAR A. Saline produced water treatment using gas hydrates[J]. Journal of Environmental Chemical Engineering, 2017, 5(5): 4269-4273. DOI:10.1016/j.jece.2017.08.008 |
| [22] |
杨西萍, 刘煌, 李赟. 水合物法分离混合物技术研究进展[J]. 化工学报, 2017, 68(3): 831-840. YANG X P, LIU H, LI Y. Research progress of separation technology based on hydrate formation[J]. CIESC Journal, 2017, 68(3): 831-840. |
| [23] |
李士凤, 谭哲, 申延明, 等. 水合物溶液分离技术研究进展[J]. 化工进展, 2014, 33(6): 1387-1391, 1396. LI S F, TAN Z, SHEN Y M, et al. Progress in aqueous solution concentration by forming clathrate hydrate[J]. Chemical Industry and Engineering Progress, 2014, 33(6): 1387-1391, 1396. |
| [24] |
黄雪莉, 宋彭生, 王雪枫, 等. Na+, K+, Mg2+/Cl−, SO42−, NO3−, H2O体系液固相平衡研究[J]. 高校化学工程学报, 2008, 22(2): 188-192. HUANG X L, SONG P S, WANG X F, et al. Study on liquid-solid equilibrium of Na+, K+, Mg2+/Cl−, SO42−, NO3−, H2O system[J]. Journal of Chemical Engineering of Chinese Universities, 2008, 22(2): 188-192. DOI:10.3321/j.issn:1003-9015.2008.02.002 |
| [25] |
张洪翠, 陈建新, 张林栋. 海水浓缩Na+, K+, Mg2+/Cl−, SO42−-H2O体系的分离方法研究进展[J]. 现代化工, 2011, 31(S1): 82-85, 87. ZHANG H C, CHEN J X, ZHANG L D. Separation progress in mixed salt concentrated from seawater[J]. Modern Chemical Industry, 2011, 31(S1): 82-85, 87. |
| [26] |
李东东, 高丹丹, 边绍菊, 等. Na+, K+, Mg2+, Ca2+//Cl-, SO42--H2O六元体系中杂卤石形成条件的再认识[J]. 地学前缘, 2021, 53(1): 1-14. LI D D, GAO D D, BIAN S J, et al. Revisiting the crystallization field of polyhalite in the six-component system Na+, K+, Mg2+, Ca2+//Cl−, SO42−-H2O[J]. Earth Science Frontiers, 2021, 53(1): 1-14. |
| [27] |
刘燕, 王建达, 张继军, 等. 浓海水提钾蒸发过程的工艺设计及优化[J]. 现代化工, 2018, 38(12): 218-221. LIU Y, WANG J D, ZHANG J J, et al. Process design and optimization on evaporation process of potassium extraction from concentrated seawater[J]. Modern Chemical Industry, 2018, 38(12): 218-221. |
| [28] |
ZHOU H, BAO Y J, BAI X Q, et al. Salt-forming regions of seawater type solution in the evaporation and fractional crystallization process[J]. Fluid Phase Equilibria, 2014, 362: 281-287. DOI:10.1016/j.fluid.2013.10.025 |
| [29] |
COHEN-ADAD R, BALAREW C, TEPAVITCHAROVA S, et al. Sea-water solubility phase diagram. Application to an extractive process[J]. Pure and Applied Chemistry, 2013, 74(10): 1811-1821. |
| [30] |
GONG X M, QIAO H, ZHAO B, et al. Phase diagrams of Na2SO4-MgSO4-CO(NH2)2-H2O system at 60 ℃ and their application[J]. Fluid Phase Equilibria, 2016, 410: 23-30. |
| [31] |
牛自得, 程芳琴. 水盐体系相图及其应用[M]. 天津: 天津大学出版社, 2001. NIU Z D, CHENG F Q. Water salt system phase diagram and its application[M]. Tianjin: Tianjin University Press, 2001. |




