2. 赣州哈克生物科技有限公司, 江西 赣州 341008;
3. 江西环境工程职业学院, 江西 赣州 341000
2. Ganzhou Hake Biotech Co. Ltd., Ganzhou 341008, China;
3. Jiangxi Environmental Engineering Vocational College, Ganzhou 341000, China
茶皂素又称茶皂苷,属于齐敦果烷型五环三萜类皂苷,由亲水糖基、有机酸和疏水苷元配基3部分组成[1],具有抗菌[2-3]、消炎[4]、抗氧化[5-6]等药理作用。但因其分子量大、结构复杂、难以分离纯化等限了其应用。茶皂素经碱水解、酸水解可以得到茶皂苷元。本课题组前期研究表明,相比于茶皂素,茶皂苷元分子结构更简单,更易分离纯化,药理作用更强[7-10]。由于茶皂苷元分子结构中存在多个配位点与金属离子配位,形成配合物后不仅能强化其原有的功能作用,而且有可能产生新的生物活性。对茶皂苷元进行一定的结构修饰后,其抗炎镇痛活性明显增强,有望成为新型抗神经退行性疾病的药物[11]。在茶皂苷元C28位引入杂环、芳环、吸电子基团等基团,经修饰后得到的一系列茶皂苷元衍生物的抗菌活性均得到提升[12]。但相比于其他天然产物,茶皂苷元衍生物的研究报道并不多。为了更有效地利用油茶皂苷类天然产物,拓展其在生物医药领域的应用,可对茶皂苷元进行改性,以期提高其生物活性。
缩氨基硫脲(TSC)是一类重要的提供N、S的配体,是过渡金属(如Fe、Cu、Zn、Ga、Pd、Pt、Ni、Co等)的一类极佳的螯合剂。缩氨基硫脲类化合物的医疗应用首次出现于20世纪50年代,用于抗结核杆菌和麻风杆菌[13],20世纪60年代后,开始被用作抗癌药[14]和抗病毒药[15]。由于缩氨基硫脲可变的供体特性、结构多样性及广泛的生物应用,一直是研究的热点。缩氨基硫脲类化合物及其金属配合物均具有良好的抗肿瘤[16-17]、抗菌[18]、抗病毒[19]等活性。硫脲本身具有一定的毒性,本课题组研究茶皂苷元缩氨基硫脲及其锌配合物的合成工艺,制备了一种新的茶皂苷元衍生物,既可降低硫脲的毒性,又能通过协同作用增强茶皂苷元的生物活性,同时探讨其抗氧化活性和作用机制。
2 材料与方法 2.1 实验材料与仪器油茶皂素粗品(纯度60%)购自杭州中野植物技术公司;AB-8型大孔树脂购自天津市化学试剂一厂;200~300目柱层析硅胶购自青岛海洋化工有限公司;硫代氨基脲、1, 1-二苯基-2-三硝基苯肼(DPPH)、2, 2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)均为分析纯,购自麦克林试剂公司;甲醇(色谱纯)购自天津富宇精细化工有限公司;溴化钾(光谱纯)购自天津科密欧化学试剂有限公司;其他试剂均为分析纯,购自广州芊荟化玻仪器公司。
Agilent-1260高效液相色谱仪(安捷伦科技有限公司,美国);UV-3010紫外可见分光光度仪(日立有限公司,日本);TENSOR27傅里叶红外光谱仪(布鲁克科技有限公司,德国),Vario ELⅢ元素分析仪(Elementar公司,德国);Ascend-500 500M超导核磁共振波谱仪(布鲁克科技有限公司,德国)。
2.2 茶皂苷元缩氨基硫脲及其锌配合物的合成按照前期研究的方法[10],以油茶皂素粗品为原料制备了茶皂苷元,其纯度为95%(高效液相色谱(HPLC))。茶皂苷元缩氨基硫脲及其锌配合物的合成路线如图 1所示,茶皂苷元(1) 0.5 g(1 mmol)、硫代氨基脲(2)0.11 g(1.2 mmol)溶解于20 mL无水乙醇,滴加3~5滴冰乙酸,75 ℃回流8 h(薄层色谱法检测)。反应结束后旋蒸除去无水乙醇,得到的固体用少量乙酸乙酯溶解,过滤除去不溶物。经质量分数为0.5% 的氨水浸泡(防止产物分解)的硅胶柱层析,洗脱剂石油醚、乙酸乙酯体积比为2:1,将洗脱液旋蒸除去溶剂,50 ℃真空干燥得茶皂苷元缩氨基硫脲(3)。以产率(实际产量/理论产量)为指标,对配料比、催化剂种类、反应温度和反应时间进行优化。
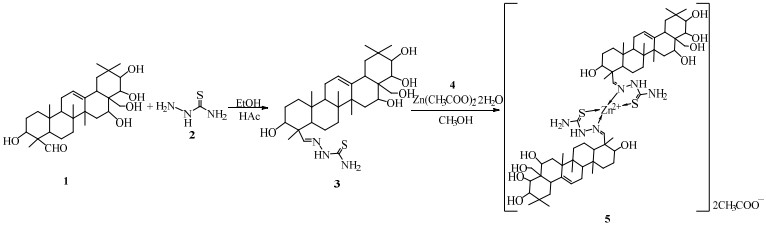
|
图 1 茶皂苷元缩氨基硫脲和及其锌配合物的合成路线 Fig.1 Synthesis of sapogenin thiosemicarbazone and its zinc complex |
茶皂苷元缩氨基硫脲(3) 0.29 g(0.5 mmol)、二水合醋酸锌0.066 g(0.3 mmol),分别溶于10 mL甲醇,再往茶皂苷元缩氨基硫脲溶液中边搅拌边滴加醋酸锌溶液,65 ℃回流6 h,冷却过夜,溶液中析出大量浅黄色沉淀,过滤、少量甲醇洗涤、自然干燥,得浅黄色固体为茶皂苷元缩氨基硫脲锌配合物。以产率为指标,对配料比、所用溶剂种类、反应温度和反应时间进行优化。
采用HPLC法测定皂苷元缩氨基硫脲及其锌配合物的纯度,色谱条件为:Agilent-1260高效液相色谱仪,色谱柱ODS-C18 (5 μm×250 mm),流动相:甲醇、水体积比为8:2,柱温30 ℃,进样量10 μL,检测波长280 nm。
2.3 茶皂苷元缩氨基硫脲及其锌配合物的结构表征取上述合成产物10 mg,用50 mL二甲基亚砜(DMSO)溶解,紫外-可见分光光度仪扫描200~800 nm吸收光谱。另取少量,用溴化钾压片制样,置于傅里叶变换红外光谱仪中扫描400~4 000 cm-1红外光谱。另取2~3 mg,置于元素分析仪中分析化合物中C、H、N、S元素的质量分数。另取5 mg,于500 ℃煅烧3 h得到氧化锌,精确称重并计算锌元素在配合物中的质量分数。用氘代DMSO溶解产物,进行核磁共振氢谱分析。
2.4 抗氧化活性测定 2.4.1 配合物对DPPH自由基的清除作用DPPH自由基(DPPH·)清除试验参照文献[20]方法。
2.4.2 配合物对ABTS阳离子自由基的清除作用ABTS阳离子自由基(ABTS+·)清除试验参照文献[21]方法。
2.4.3 配合物对羟基自由基的清除作用羟基自由基(·OH)清除试验参照文献[22]方法。
2.5 分子对接模拟从蛋白质数据库中下载人源全长重组蛋白(Keap1)的PDB文件(PDB ID:2FLU)。蛋白质分子预处理:在Discovery Studio 2016中打开PDB文件,删除受体蛋白中多余的水分子。对蛋白质分子进行补充氨基酸残基、加氢、去除蛋白多构像等处理,将蛋白质定义为受体,定义活性位点,并根据配体小分子的大小调整结合位点的半径。小分子配体的预处理:绘制出茶皂苷元、茶皂苷元缩氨基硫脲、茶皂苷元缩氨基硫脲锌配合物的分子结构,对小分子配体进行加氢、能量最小化等处理,对配体结构进行优化。分子对接:采用CDOCKER模块进行分子对接模拟,设定处理好的蛋白分子为受体,依次以茶皂苷元、茶皂苷元缩氨基硫脲及茶皂苷元缩氨基硫脲锌配合分子为配体,选择结合区域坐标,运行程序[1]。分析分子交互作用能和作用基团。
3 实验结果与讨论 3.1 茶皂苷元缩氨基硫脲及其锌配合物合成条件优化采用单因素实验对反应温度、反应时间、催化剂和茶皂苷元与硫代氨基脲的投料比n1: n2进行了筛选,如表 1所示,表中
|
|
表 1 茶皂苷元缩氨基硫脲反应条件优化 Table 1 Optimization of reaction conditions of sapogenin thiosemicarbazone |
用单因素实验对反应温度、反应时间、溶剂和茶皂苷元缩氨基硫脲与二水合醋酸锌投料比n3: n4进行筛选,结果见表 2。茶皂苷元缩氨基硫脲锌配合物的最优合成条件为:反应温度65 ℃,反应时间6 h,反应溶剂为纯甲醇,n3: n4=1:0.6,产率为72.1%。
|
|
表 2 茶皂苷元缩氨基硫脲锌配合物反应条件优化 Table 2 Optimization of reaction conditions of sapogenin thiosemicarbazone-zinc complex |
经HPLC检测,茶皂苷元缩氨基硫脲及其锌配合物纯度按面积归一法计算分别为92% 和90%。
3.2 茶皂苷元缩氨基硫脲及其锌配合物的结构表征结果 3.2.1 紫外光谱分析茶皂苷元缩氨基硫脲及其锌配合物紫外光谱如图 2所示,由图可见茶皂苷元缩氨基硫脲在279 nm处存在茶皂苷元的特征吸收峰。在317 nm处出现的弱吸收峰为C═S发生n→π*跃迁产生的吸收,349 nm处的弱吸收峰为C═N的n→π*跃迁吸收。茶皂苷元缩氨基硫脲锌配合物的茶皂苷元的特征吸收峰在278 nm处,323 nm处出现的弱而宽的吸收峰归属为C═S和C═N发生n→π*跃迁吸收,此外,茶皂苷元缩氨基硫脲锌配合物在389 nm处新增一个明显的峰,此处为配位场d→d*电子跃迁,说明锌离子与配体茶皂苷元缩氨基硫脲之间发生了配位作用。
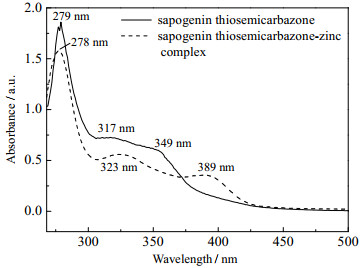
|
图 2 茶皂苷元缩氨基硫脲及其锌配合物紫外光谱图 Fig.2 UV spectra of sapogenin thiosemicarbazone and its zinc complex |
从红外光谱图可以看出(见图 3),茶皂苷元缩氨基硫脲在1 641 cm-1处出现强吸收峰,此处为C═N键的特征吸收峰,而在1 718 cm-1处的醛基特征吸收峰消失,说明茶皂苷元的醛基与硫代氨基脲的氨基发生了脱水缩合,醛基消失,生成了C═N键。1 037、802 cm-1为C═S键的特征吸收峰,而在2 450 ~2 650 cm-1无吸收峰,说明不存在C─S键,即氨基硫脲基团是以硫酮式而非硫醇式存在。茶皂苷元缩氨基硫脲锌配合物的红外谱图中,C═N键的特征吸收峰由1 718移动到1 638 cm-1处,C═S键的特征吸收峰移动到1 031、800 cm-1,此外,茶皂苷元缩氨基硫脲锌配合物在514 cm-1左右新增明显吸收峰,此处通常为金属配位键伸缩振动频率,这些变化是由于Zn与茶皂苷元缩氨基硫中的N、S发生了配位所导致,表明成功合成了茶皂苷元缩氨基硫脲锌配合物。
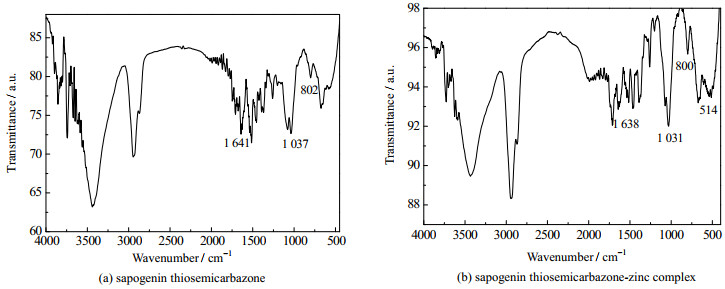
|
图 3 茶皂苷元缩氨基硫脲及其锌配合物红外光谱图 Fig.3 IR spectra of sapogenin thiosemicarbazone and its zinc complex |
采用元素分析仪测得C、H、N、S的质量分数wB如表 3所示,量比n(C): n(H): n(N): n (S)=31:52:3:1,与茶皂苷元缩氨基硫脲的理论值量比n(C): n (H): n (N): n (S) =31:51:3:1基本相符。根据茶皂苷元缩氨基硫脲-锌配合物的有机元素分析及金属的质量分数测定结果,计算可得配合物中C、H、N、S、Zn原子个数比为66:112:6:2:1,与理论值C、H、N、S、Zn为66:108:6:2:1在氢原子个数上存在差异,这可能是由于配合物结合了2个水分子引起的。
|
|
表 3 茶皂苷元缩氨基硫脲及其锌配合物的元素含量 Table 3 Element contents of sapogenin thiosemicarbazone and its zinc complex |
核磁共振氢谱图如图 4所示,其中茶皂苷元缩氨基硫脲数据为:1H NMR (500 MHz, DMSO-d6)化学位移δ 10.94 (s, 1H), 7.38 (s, 1H), 7.12 (s, 1H), 5.18 (s, 3H), 4.57 (s, 2H), 3.98 (d, J = 5.0 Hz, 2H), 3.81 (s, 1H), 3.61 (d, J = 13.9 Hz, 3H), 2.31 (d, J = 16.3 Hz, 4H), 1.82 (m, 12H), 1.24 (s, 3H), 0.93~0.82 (s, 15H);茶皂苷元缩氨基硫脲-锌配合物数据为:1H NMR (500 MHz, DMSO-d6) δ 11.04 (s, 1H), 8.08 (s, 1H), 7.29 (s, 1H), 5.32 (s, 3H), 4.29 (s, 2H), 4.08 (d, J = 4.5 Hz, 2H), 3.88 (s, 1H), 3.69 (d, J = 9.1 Hz, 3H), 2.38 (d, J = 13.2 Hz, 4H), 1.91 (m, 12H), 1.11 (s, 3H), 1.01~0.91 (s, 15H)。
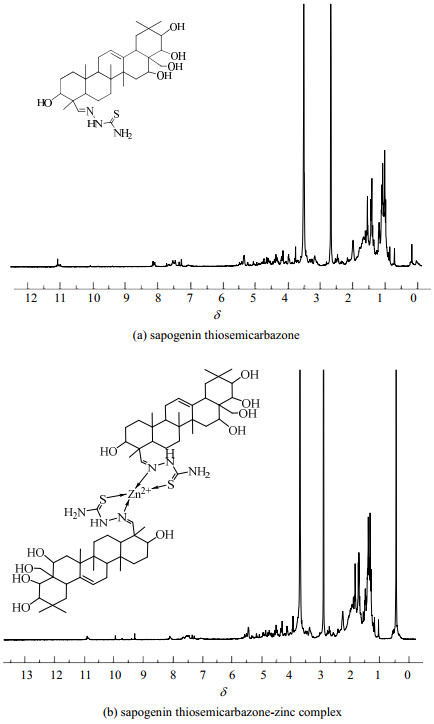
|
图 4 茶皂苷元缩氨基硫脲及其锌配合物的核磁共振氢谱 Fig.4 1H-NMR spectra of sapogenin thiosemicarbazone and its zinc complex |
对于配体茶皂苷元缩氨基硫脲,原本茶皂苷元δ=9.25处的醛基氢的峰消失,在10.94处出现了─NH2峰,7.38、7.12处出现了─NH峰,说明配体分子中的醛基参与了反应。对于茶皂苷元缩氨基硫脲锌配合物,─NH2和─NH峰分别移动到δ 为11.04和8.08、7.29,位移均向低场移动,且氢的个数没有变化,说明缩氨基硫脲基团与金属离子发生了配位反应。
3.3 茶皂苷元、茶皂苷元缩氨基硫脲及其锌配合物的抗氧化活性 3.3.1 对DPPH·的清除活性从图 5(a)可以看出,茶皂苷元、茶皂苷元缩氨基硫脲及茶皂苷元缩氨基硫脲锌配合物对DPPH·的半抑制浓度IC50值分别为2.36、0.66和1.19 mg·mL-1。其中茶皂苷元本身的清除活性明显不如另外2种衍生物,且茶皂苷元缩氨基硫脲对DPPH·的清除活性要强于其锌配合物,这可能是由于DPPH·清除反应为脂溶性反应,而茶皂苷元缩氨基硫脲锌配合物的脂溶性不如其配体,导致其清除活性降低。
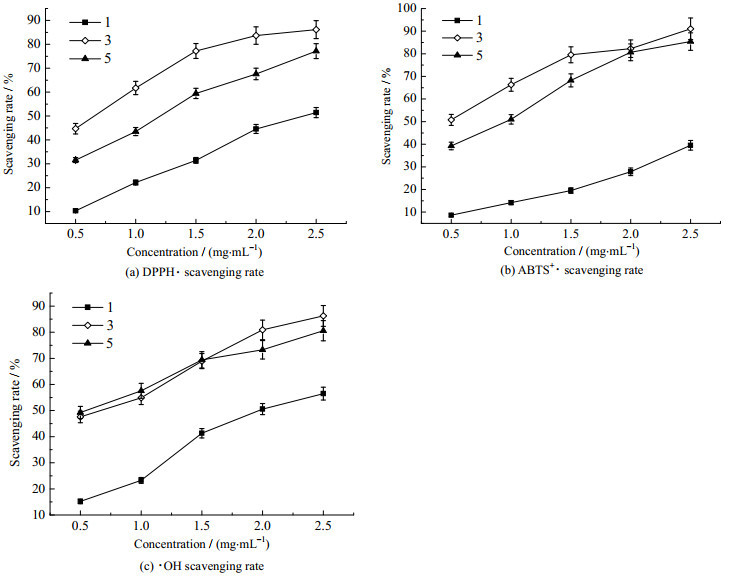
|
图 5 茶皂苷元、茶皂苷元缩氨基硫脲及茶皂苷元缩氨基硫脲锌配合物对各自由基的清除率(x+s, n=3)
Fig.5 Scavenging rates of different free radicals (x+s, n=3) by sapogenin, sapogenin thiosemicarbazone and sapogenin thiosemicarbazone-zinc complex
1. sapogenin 3. sapogenin thiosemicarbazone 5. sapogenin thiosemicarbazone-zinc complex |
从图 5(b)可以看出,茶皂苷元、茶皂苷元缩氨基硫脲及茶皂苷元缩氨基硫脲锌配合物对ABTS+·的IC50值分别为3.36、0.46和0.90 mg·mL-1,由此可见,茶皂苷元缩氨基硫脲衍生物及其锌配合物清除ABTS+·的效果要明显优于茶皂苷元本身。
3.3.3 对·OH的清除活性图 5(c)显示,茶皂苷元、茶皂苷元缩氨基硫脲及茶皂苷元缩氨基硫脲锌配合物对·OH的IC50值分别为2.08、0.68及0.57 mg·mL-1。茶皂苷元缩氨基硫脲及其锌配合物对·OH清除效果较为接近,在浓度为2.5 mg·mL-1时,清除率分别达到了86.24% 和80.59%。
茶皂苷元是茶皂素的水解产物,茶皂素对DPPH·和·OH清除的IC50分别为6和10 mg·mL-1[23],明显高于茶皂苷元,表明茶皂苷元是茶皂素的主要活性部分,这与本课题组前期研究结果相一致[8]。缩氨基硫脲和锌的加入,使衍生后的茶皂苷元分子结构具有更强的电子捕获能力,因而具有比衍生前的茶皂苷元更好的自由基的清除活性。
3.4 分子对接结果氧化应激是由细胞中活性反应物质和抗氧化应激防御系统之间的不平衡引起的,可能导致癌症[24]、心血管疾病[25]、神经退行性疾病[26]等多种疾病。Keap1-Nrf2-ARE信号通路是人体氧化应激防御机制的重要通路,Nrf2(核因子E2相关因子2)是抗氧化反应的主要调节因子,对改善氧化应激非常重要。本研究通过分子对接研究茶皂苷元、茶皂苷元缩氨基硫脲及其锌配合物与Keap1的相互作用,探讨其对机体抗氧化的作用机制。
分子对接主要根据配体与受体相互作用的能量(-Cdocker intereaction energy)以及相互作用的氨基酸位点等信息来确定其结合的程度。茶皂苷元、茶皂苷元缩氨基硫脲及其锌配合物与Keap1的对接结果见表 4和图 6。由表 4可知,三者与Keap1都可以在Keap1-Nrf2结合域内成功对接,且产生了10种对接姿态,从最优对接能看,茶皂苷元缩氨基硫脲锌配合物(16.49 × 104 J·mol-1)显示出比茶皂苷元(7.75 × 104 J ·mol-1)和茶皂苷元缩氨基硫脲(8.81 × 104 J·mol-1)与Keap1之间更强的相互作用,说明合成的茶皂苷元缩氨基硫脲锌配合物同Keap1具有更强的亲和力。由图 6可知,茶皂苷元分子与氨基酸残基Asn382之间产生了氢键作用,而Asn382正是Keap1与Nrf2产生结合作用的关键氨基酸残基。茶皂苷元缩氨基硫脲与Arg380、Asn382、Ser383之间产生了氢键作用,与Tyr334之间产生了疏水相互作用;茶皂苷元缩氨基硫脲锌配合物与Asn382、Ser602之间产生了氢键作用,与Try334、Ala556之间产生了疏水作用。由此可见,3种化合物均可以在Keap1-Nrf2结合域内与Keap1相互作用,从而占据Nrf2与Keap1的结合位点,诱导Nrf2的释放,增强机体抗氧化能力,且茶皂苷元缩氨基硫脲及其锌配合物与Keap1在Keap1-Nrf2结合域产生的氢键数目更多,结合作用更强。
|
|
表 4 茶皂苷元、茶皂苷元缩氨基硫脲和茶皂苷元缩氨基硫脲锌配合物与Keap1的交互作用能 Table 4 Interaction energy of sapogenin, sapogenin thiosemicarbazone and sapogenin thiosemicarbazone-zinc complex with Keap1 |
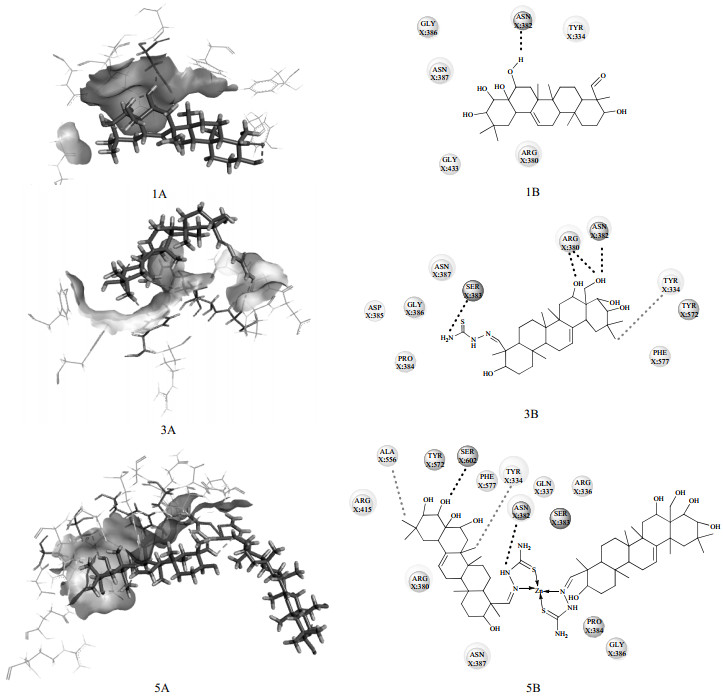
|
图 6 茶皂苷元、茶皂苷元缩氨基硫脲和茶皂苷元缩氨基硫脲-锌配合物与 Keap1 分子对接的三维立体图和二维平面图
Fig.6 Three dimensional stereogram and two dimensional plan of molecular docking of sapogenin, sapogenin thiosemicarbazone and sapogenin thiosemicarbazone-zinc complex with Keap1
1. sapogenin 3. sapogenin thiosemicarbazone 5. sapogenin thiosemicarbazone-zinc complex A. three dimensional stereogram B. two dimensional plan |
茶皂素无法与Keap1对接成功,表明其分子结构阻碍其与Keap1的作用,而茶皂苷元分子结构较小,易与Keap1作用。经缩氨基硫脲及锌衍生后的茶皂苷元具有更强的氢键结合能力,且靶点位于氧化应激的调节因子Nrf2,说明茶皂苷元缩氨基硫脲及其锌配合物是通过Keap1-Nrf2发挥抗氧化作用的。
4 结论(1) 对茶皂苷元进行结构修饰,制备了茶皂苷元缩氨基硫脲及其锌配合物,利用紫外光谱、红外光谱、元素分析、核磁共振氢谱等对其结构进行了表征,确定了3种化合物的组成。
(2) 茶皂苷元缩氨基硫脲最优反应条件为:反应温度75 ℃,反应时间8 h,催化剂为冰乙酸,茶皂苷元与硫代氨基脲的投料比n1: n2=1:1.2,产率为79.6%,纯度92%;茶皂苷元缩氨基硫脲-锌配合物最优反应条件为:反应温度65 ℃,反应时间6 h,反应溶剂为纯甲醇,茶皂苷元缩氨基硫脲与二水合醋酸锌的投料比n3: n4=1:0.6,产率为72.1%,纯度90%。
(3) 茶皂苷元缩氨基硫脲及其锌配合物清除DPPH、ABTS+、羟基自由基的能力比茶皂苷元均有较大提升,且茶皂苷元缩氨基硫脲对DPPH、ABTS+自由基的清除活性要强于茶皂苷元缩氨基硫脲锌配合物,两者对羟基自由基的清除效果相差不大。
(4) 3种化合物都能与Keap1成功地进行分子对接,茶皂苷元缩氨基硫脲锌配合物与Keap1在Keap1-Nrf 2结合域的结合作用最强,其对接交互作用能为16.49 × 104 J·mol-1,茶皂苷元缩氨基硫脲与Keap1在Keap1-Nrf2结合域产生的氢键数目最多,表明茶皂苷元缩氨基硫脲及其锌配合物能通过与Keap1作用增强机体的抗氧化能力。
| [1] |
李穗敏, 杨谦, 赵闯, 等. 光响应茶皂苷元纳米囊的制备及其抗耐药菌活性研究[J]. 高校化学工程学报, 2018, 32(1): 193-199. LI S M, YANG Q, ZHAO C, et al. Preparation of photo responsive sapogenin nanocapsules and their inhibiting activity on drug resistant bacteria[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(1): 193-199. |
| [2] |
魏婷婷, 崔晓芳, 文旭, 等. 油茶粕中茶皂素纯化方法与抗菌活性研究[J]. 中国油料作物学报, 2011, 33(6): 616-621. WEI T T, CUI X F, WEN X, et al. Purification technology and biological activity of theasaponin from Camellia cake[J]. Chinese Journal of Oil Crop Sciences, 2011, 33(6): 616-621. |
| [3] |
唐红枫, 孙茜, 张雨婷, 等. 油茶皂甙的提取及抑菌活性研究[J]. 中国油脂, 2012, 37(2): 69-71. TANG H F, SUN Q, ZHANG Y T, et al. Extraction and antibacterial activities of tea saponin[J]. China Oils and Fats, 2012, 37(2): 69-71. DOI:10.3969/j.issn.1003-7969.2012.02.018 |
| [4] |
CHATTOPADHYAY P, BESRA S E, GOMES A, et al. Anti-inflammatory activity of tea (Camellia sinensis) root extract[J]. Life Sciences, 2004, 74(15): 1839-1849. DOI:10.1016/j.lfs.2003.07.053 |
| [5] |
吕晓玲, 邱松山, 孙晓侠, 等. 油茶总皂苷的抗氧化及清除自由基能力初步研究[J]. 食品科学, 2005, 26(11): 66-70. LV X L, QIU S S, SUN X X, et al. Preliminary study on the capability of antioxidation and scavenging free radicals of sasanquasaponins[J]. Food Science, 2005, 26(11): 66-70. |
| [6] |
SYR P, CHANDHURI T, VEDASIROMONI J R, et al. Antiinflammatory and antioxidant property of saponins of tea Camellia sinensis (L) O. Kuntze root extract[J]. Phytotherapy Research, 2001, 15(2): 174-176. DOI:10.1002/ptr.696 |
| [7] |
YE Y, XING H, CHEN X. Anti-inflammatory and analgesic activities of the hydrolyzed sasanquasaponins from the defatted seeds of Camellia oleifera[J]. Archives of Pharmacal Research, 2013, 36(8): 941-951. DOI:10.1007/s12272-013-0138-y |
| [8] |
YE Y, FANG F, LI Y. Isolation of the sapogenin from defatted seeds of Camellia oleifera and its neuroprotective effects on dopaminergic neurons[J]. Journal of Agricultural & Food Chemistry, 2014, 62(26): 6175-6182. |
| [9] |
YE Y, CHEN X L, XING H T. Hypolipidemic and antioxidant activities of hydrolyzed saponins from defatted seeds of Camellia oleifera Abel[J]. Latin American Journal of Pharmacy, 2013, 32(3): 409-417. |
| [10] |
王延芳. 油茶皂素及其水解产物的分离及降血脂抗氧化活性研究[D]. 广州: 华南理工大学, 2012. WANG Y F. Studies on separation of sasanquasaponin and its hydrolyzed products and their hypolipidemic and antioxidant activities[D]. Guangzhou: South China University of Technology, 2012. |
| [11] |
陈雪兰. 油茶皂苷元的结构修饰及其抗神经退化活性研究[D]. 广州: 华南理工大学, 2015. CHEN X L. Studies on structural modifications of sapogenin and their anti-neurodegenerative activities[D]. Guangzhou: South China University of Technology, 2015. |
| [12] |
杨谦. 光响应茶皂苷元衍生物阳离子脂质体的制备及其抗菌活性研究[D]. 广州: 华南理工大学, 2018. YANG Q. Preparation of photoresponsive camelliagenin derivatives cationic liposome and its antibacterial activity[D]. Guangzhou: South China University of Technology, 2018. |
| [13] |
BAVIN E M, REES R J W, ROBSON J M, et al. The tuberculostatic activity of some thiosemicarbazones[J]. The Journal of Pharmacy and Pharmacology, 1950, 2(11): 764-772. |
| [14] |
BROCKMAN R W, THOMSON J R, BELL M J, et al. Observations on the antileukemic activity of pyridine-2-carboxaldehyde thiosemicarbazone and thiocarbohydrazone[J]. Cancer Research, 1956, 16(2): 167-170. |
| [15] |
LEVINSON W, FARAS A, WOODSON B, et al. Inhibition of RNA-dependent DNA polymerase of Rous sarcoma virus by thiosemicarbazones and several cations[J]. Proceedings of the National Academy of Sciences of the United States of America, 1973, 70(1): 164-171. DOI:10.1073/pnas.70.1.164 |
| [16] |
NUTTING C M, VAN HERPEN C M L, MIAH A B, et al. Phase Ⅱ study of 3-AP triapine in patients with recurrent or metastatic head and neck squamous cell carcinoma[J]. Annals of Oncology, 2009, 20(7): 1275-1279. DOI:10.1093/annonc/mdn775 |
| [17] |
ALCARAZ R, MUNIZ P, CAVIA M, et al. Thiosemicarbazone-metal complexes exhibiting cytotoxicity in colon cancer cell lines through oxidative stress[J]. Journal of Inorganic Biochemistry, 2020, 206: 110993-111003. DOI:10.1016/j.jinorgbio.2020.110993 |
| [18] |
ROSU T, GULEA A, NICOLAE A, et al. Complexes of 3dn metal ions with thiosemicarbazones: synthesis and antimicrobial activity[J]. Molecules, 2007, 12(4): 782-796. DOI:10.3390/12040782 |
| [19] |
PELOSI G, BISCEGLIE F, BIGNAMI F, et al. Antiretroviral activity of thiosemicarbazone metal complexes[J]. Journal of Medicinal Chemistry, 2010, 53(24): 8765-8769. DOI:10.1021/jm1007616 |
| [20] |
ZENG W C, ZHANG Z, GAO H, et al. Characterization of antioxidant polysaccharides from Auricularia auricular using microwave-assisted extraction[J]. Carbohydrate Polymers, 2012, 89(2): 694-700. DOI:10.1016/j.carbpol.2012.03.078 |
| [21] |
ZENG W C, ZHANG Z, GAO H, et al. Chemical composition, antioxidant, and antimicrobial activities of essential oil from pine needle (Cedrus deodara)[J]. Journal of Food Science, 2012, 77(7): 824-829. DOI:10.1111/j.1750-3841.2012.02767.x |
| [22] |
冯慧萍, 李亦聪. 羟自由基与水杨酸反应机理的初探[J]. 光谱实验室, 2009, 26(4): 931-938. FENG H P, LI Y C. A preliminary study on the reaction mechanism of hydroxyl radical with salicylic acid[J]. Chinese Journal of Spectroscopy Laboratory, 2009, 26(4): 931-938. DOI:10.3969/j.issn.1004-8138.2009.04.042 |
| [23] |
郭海阳, 莫林兰, 谭海生, 等. 茶皂素的美白功效及其抑菌和抗氧化活性研究[J]. 中国粮油学报, 2020, 35(6): 83-89. GUO H Y, MO L L, TAN H S, et al. Whitening effect, antibacterial and antioxidant activities of tea saponin[J]. Journal of Chinese Cereals and Oil Association, 2020, 35(6): 83-89. |
| [24] |
REUTER S, GUPTA S C, CHATURVEDI M M, et al. Oxidative stress, inflammation, and cancer: How are they linked?[J]. Free Radical Biology and Medicine, 2010, 49(11): 1603-1616. |
| [25] |
ANATOLIOTAKIS N, DEFTEREOS S, BOURAS G, et al. Myeloperoxidase: Expressing inflammation and oxidative stress in cardiovascular disease[J]. Current Topics in Medicinal Chemistry, 2013, 13(2): 115-138. |
| [26] |
EMERIT J, EDEAS A, BRICAIRE F. Neurodegenerative diseases and oxidative stress[J]. Biomedicine & Pharmacotherapy, 2004, 58(1): 39-46. |




