细胞因子诱导的杀伤细胞(Cytokine-induced killer cells,CIK cells)为主体的肿瘤过继免疫治疗已逐渐成为肿瘤生物治疗中最活跃的应用与研究领域之一。CIK细胞在临床上的应用是直接以细胞为治疗手段,输注给病人,其在剂量上有一定的要求。其中的CD3+CD56+细胞是CIK细胞的主要效应细胞,在肿瘤细胞的杀伤过程中起主要作用[1, 2]。CIK细胞培养的起始细胞通常来自肿瘤患者的血液单个核细胞,然而血液单个核细胞中的CD3+CD56+细胞的含量很低[3, 4],达不到临床治疗要求。因此,需要对单个核细胞进行体外诱导扩增,以获得足够数量的CIK细胞。在CIK细胞扩增过程中,以临床标准而言,不允许是异源血清,必须采用无血清培养才更符合临床及安全的要求。近些年来,无血清培养基开发应用领域飞速发展,无血清培养基因其化学组成的成分明确、批次差异小、外源感染风险低、易于统一规模化制备和管理等优越性能已成为生物制药以及细胞治疗领域的最佳选择。然而目前临床通常采用的无血清培养基大多是进口的商业培养基,客户以及科研工作者对其中成分及浓度可能一无所知,因此无法通过调整培养基里的组分种类及其浓度对细胞培养扩增的过程进行控制,这样往往使得扩增效果不可控、细胞质量不能保证。因此,自主开发一种成分明确的无血清培养基来培养CIK细胞就显得非常必要。
为此,本文在前期的研究初步筛选得到的血清替代物中发现,胰岛素、亚麻酸、胆固醇和乙醇胺对CIK细胞的体外扩增有重要作用,并且存在交互作用,然而其作用浓度并未得到优化。优化因子浓度的科学方法有很多,其中的中心组合设计(central composite design,CCD)和响应面分析(response surface analysis,RSA)广泛应用于因子数较少且存在交互作用时的浓度优化过程[5~7]。该方法将因子与目标响应值之间的复杂关系以及因子间的交互作用通过多元方程的形式拟合出来,进而绘制出更为直观的曲面图,将各因子最优值的求取转化成数学上有边界条件限制的多元函数最值的计算。该方法思路清晰,求解简单易行。本文以单个核细胞的扩增倍数为目标响应值,通过中心组合设计和响应面分析优化上述4种因子的浓度配比,以期获得可支持CIK细胞的体外扩增血清替代物组合。
2 材料与方法 2.1 材料 2.1.1 细胞本研究所使用的细胞为由健康妇女新鲜脐带血分离得到的单个核细胞。K562细胞来自中科院上海细胞库。
2.1.2 培养基无血清培养基SFM1,瑞士的Lonza公司;无血清培养基SFM2、基础培养基RPMI 1640、DMEM/F12和IMDM,Life Technonogy公司;血清,法国Biowest公司。
2.1.3 细胞因子重组人白细胞介素2(rIL-2)、重组人γ干扰素(IFN-γ)、重组人白细胞介素1(rIL-1α),美国Perotech公司;鼠抗人CD3单克隆抗体(OKT-3),美国eBioscience公司;植物血凝素(PHA),Sigma试剂公司。
2.1.4 试剂乙醇胺、亚麻酸、胆固醇,Sigma试剂公司;胰岛素,合作企业提供;CCK-8 kit,上海东仁(Dojindo)化学科技有限公司。
2.2 实验方法 2.2.1 单个核细胞的培养新鲜脐带血通过密度梯度离心(400 g,30 min)分离得到单个核细胞。以一定密度接种,并添加1000 U×mL-1的rIFN-γ。接种当天以第0天计,于接种24 h后补加500 U×mL-1的rIL-2、50 ng×mL-1的OKT-3、100 U×mL-1的rIL-1α。37℃,5%CO2培养一定时间后取样,台盘兰染色计取活细胞密度,并计算细胞扩增倍数。
2.2.2 细胞表型分析采用FITC-CD3、PerCP-CD8和PE-CD56流式抗体(均为美国BD Bioscience公司)标记细胞[8]。使用FASCCallibur (美国BD Bioscience公司)进行细胞表型检测,使用FlowJo 7.6软件进行细胞表型分析。
2.2.3 CIK细胞细胞杀伤肿瘤细胞实验分别以扩增后的总细胞为效应细胞(E)与靶细胞K562(T)比为3:1、5:1、7:1和9:1考察CIK细胞的细胞毒性,采用CCK-8试剂盒检测,以以下公式计算细胞毒性,即K562死亡率:
| $ {\rm{K}}562死亡率\% {\rm{ }} = {\rm{ }}1 - (ET - E)/T \times {\rm{ }}100\% $ |
第一次的浓度优化以胰岛素浓度、乙醇胺浓度、亚麻酸浓度、胆固醇浓度为考察因素,总细胞的扩增倍数为指标,采用中心组合设计,所有因素水平的设计为一个中心点,两个考察点(±1)和两个极点(±2)[5],见表 1。第二次的浓度优化以亚麻酸浓度、胆固醇浓度为考察因素,总细胞扩增倍数为指标,采用中心组合设计,所有因素水平的设计为一个中心点,两个考察点(±1)和两个极点(±1.414),见表 2。
| 表 1 实验因子水平 Table 1 Factors and levels used in the experiment design |
| 表 2 中心组合设计实验结果 Table 2 CCD results for CIK expansion |
用Design-Expert8.0.6对实验设计结果进行统计学分析。统计学分析采用T-test进行分析,以p < 0.05作为显著性的指标。
3 结果与讨论 3.1 四种组分浓度的优化查阅相关文献粗略估算细胞培养基中胰岛素浓度范围应为5~15 mg×L[7, 9~12],胆固醇为2~6 mg×L-1[7, 11],亚麻酸为0.5~1.5 mg×L[13],乙醇胺为0.61~1.83 mg×L[14~16]。以此为依据,进行中心组合设计,基础培养基为DMEM/F12和IMDM以1:1体积混合而成,如表 1所示。4种组分设计出30个组合,以培养6天的总细胞扩增倍数(y)为目标响应值,结果如表 2所示。
对表 2结果进行非线性回归分析,得到回归方程:
| $ y=\text{ }7.42000+0.63492{{x}_{2}}+0.14931{{x}_{3}}+5.11905\times {{10}^{-3}}{{x}_{1}}{{x}_{2}} $ | (1) |
采用线性数学模型模拟各组分浓度对细胞扩增倍数影响,显著性分析结果显示模型可用(p < 0.05),在所试验的4种组分的浓度范围内,只有组分亚麻酸和胆固醇的浓度对细胞扩增有显著性影响(p < 0.05),见表 3。根据表 2中的数据拟合出各组分浓度和总细胞扩增倍数之间的关系,见式(1)。结果显示,在所测试的浓度范围内,细胞扩增倍数与亚麻酸和胆固醇浓度几乎成单调递增的线性关系,说明最佳的亚麻酸和胆固醇浓度并不在上述设定浓度范围内。
| 表 3 各因子对总细胞扩增倍数的影响的显著性分析 Table 3 Significance analysis of the effects of factors on expansion fold of total cells |
为此,进一步扩大组分亚麻酸和胆固醇的试验浓度范围,在亚麻酸为0.76~9.24 mg×L-1,胆固醇为3.03~36.97 mg×L-1区间内各选取5个试验点,见表 4。
| 表 4 胆固醇和亚麻酸的浓度水平 Table 4 Concentration levels of cholesterol and linolenic acid |
采用中心组合设计出13个组合,以单细胞扩增倍数(7)为目标响应值,结果是表 5。
| 表 5 胆固醇和亚麻酸对CIK细胞扩增的影响 Table 5 Effects of cholesterol and linolenic acid on CIK cell expansion |
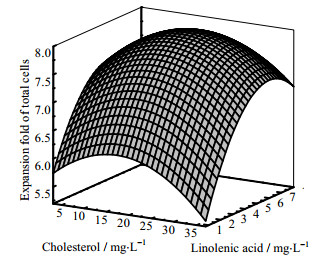
选用二次数学模型进行模拟,结果如表 6所示。显著性分析结果显示模型可用(p < 0.05)。根据实验设计结果拟合出各组分浓度和总细胞扩增倍数之间的关系,见式(2)和图 1。
| $ \begin{array}{l} y = {\rm{ }}4.95517 + 0.081137{x_2} + 0.79067{x_1} + 2.56944 \times {10^{ - 3}}{x_1}{x_2}\\ \;\;\;\;\;\;\;\; - 2.40799 \times {10^{ - 3}}{x_2}^2 - 0.074361{x_1}^2 \end{array} $ | (2) |
|
图 1 亚麻酸与胆固醇对总细胞扩增倍数的响应面曲面图 Fig.1 Response surface curve results of the effects of linolenic acid and cholesterol on expansion fold of total cells |
| 表 6 胆固醇和亚麻酸对总细胞扩增倍数的影响的显著性分析 Table 6 Significant analysis of the effects of cholesterol and linolenic acid on expansion fold of total cells |
在所测试的浓度范围内,表 6结果显示K组分浓度二次方项对细胞扩增倍数有显著影响,且式(2)显示亚麻酸组分浓度的二次项前面的系数为负值,即曲面向上凸起,再结合图 1中的曲面形状,说明其最适合浓度在所设定的浓度范围内,经计算机计算其最适值为5.66。M组分浓度二次方项对细胞扩增倍数有显著影响,且公式2显示胆固醇组分浓度的二次项前面的系数为负值,即曲面向上凸起,再结合图 1中的曲面形状,说明其最适合浓度在所设定的浓度范围内,经计算机计算其最适值为19.86。
胰岛素和乙醇胺虽然在上述实验设计优化过程中并未产生明显影响,本文并未优化它们的浓度。但是它们对淋巴细胞的生长增殖是非常重要的[17],而本文所培养的CIK细胞培养到最后有95%以上均为CD3+细胞,即T淋巴细胞(见3.2.3节中表 8),故而它们对CIK细胞的生长增殖也至关重要。于是本文仍然采用它们原来的浓度,胰岛素10 mg×L-1,乙醇胺1.22 mg×L-1。
至此,本文通过中心组合设计和响应面分析,得到了4种因子胰岛素、亚麻酸、胆固醇、乙醇胺的优化后浓度分别为10、5.66、19.86、1.22 mg×L-1。再结合本文前期的研究工作,本文获得了一组血清替代物组合的配方,将其命名为OSS。
3.2 验证实验将上述获得的血清替代物组合OSS配制成浓缩液,以1:1000的比例添加到基础培养基中配成新的培养基,将其命名为Optimizer。所使用的基础培养基由IMDM与DEME/F12以1:1的体积比混合而成。
以商业无血清培养基SFM1、SFM2以及含10%FBS的RPMI 1640为对照,单个核细胞分别以5×105cells×mL-1的密度接种于上述4种培养基中,培养过程中定期进行半量换液和分孔传代,共培养14天,以细胞形态、总细胞扩增倍数、各类细胞的比例、对K562细胞杀伤活性为指标,评价Optimizer培养基支持CIK细胞扩增的效果。
3.2.1 细胞形态培养过程中细胞形态变化如图 2所示。在第7天Optimizer和含10%FBS的RPMI 1640中细胞比SFM1和SFM2中略大,且含10% FBS的RPMI 1640中梭形细胞占据多数;第14天Optimizer和含10%FBS的RPMI 1640中的细胞大小和形态接近。
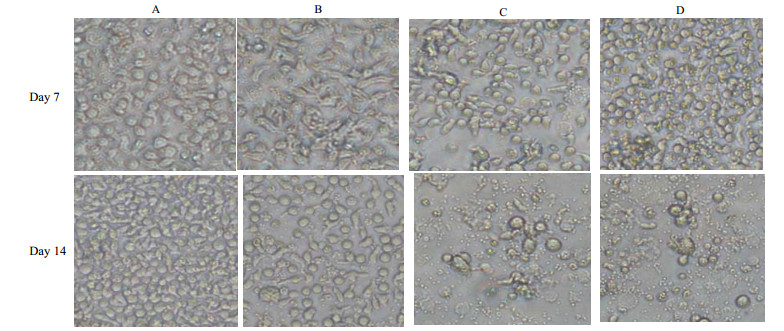
|
图 2 培养过程中细胞形态的变化 Fig.2 Cell morphology changes during the culture period A:Optimizer B:RPMI 1640+10%FBS C:SFM1 D:SFM2 |
表 7为单个核细胞在4种培养基中扩增14天后的总细胞扩增倍数。Optimizer的总细胞的扩增倍数为56.54±18.87,明显高于两种商业的无血清培养基的5.14±1.03和3.59±0.56(p < 0.05),而与含10% FBS的RPMI 1640的35.24±20.92相当(p > 0.05)。
| 表 7 培养14天后总细胞的扩增倍数 Table 7 Expansion fold of total cells cultured for 14 days |
CIK细胞是一类异质型细胞群,由多种表型的细胞组成,其中CD3+为T细胞表面特异性标记,以CD3+CD56+为特异性标记的细胞是CIK细胞主要的效应细胞,与其非MHC限制的肿瘤杀伤活性关系密切。这两类细胞的比例对评价扩增所获得的CIK细胞功能具有重要意义。为此,采用流式细胞仪检测单个核细胞在Optimizer、含10% FBS的RPMI 1640、SFM1和SFM2这4种培养基中扩增14天的培养物中CD3+和CD3+CD56+细胞的比例。
由于单个核细胞在两种商业无血清培养基SFM1和SFM2中培养14天后细胞倍数很低,因此,未对其表型进行分析。在Optimizer、含10%FBS的RPMI1640培养基中扩增14天的培养物中CD3+和CD3+CD56+细胞的比例。
表 8为4个样本扩增所获得的细胞中CD3+细胞的比例,CD3+细胞的比例均达到90%以上。Optimizer中扩增的细胞中CD3+细胞比例为97.98%±1.41%与含10%FBS的RPMI1640的94.34%±1.29%相当,二者之间无显著性差异(p > 0.05),说明Optimizer可支持CD3+细胞高效扩增。
| 表 8 CD3+细胞的比例 Table 8 Proportion of CD3+ cells |
表 9为4个样本扩增所获得细胞中CD3+CD56+细胞比例,其范围在10%~30%。Optimizer中扩增获得的CD3+CD56+细胞比例为18.17%±7.39%,含10% FBS的RPMI 1640中扩增获得的CD3+CD56+细胞比例的为25.49%±3.35%,采用Optimizer中扩增的细胞中CD3+CD56+细胞比例要低于含10% FBS的RPMI 1640,二者之间存在显著性差异(p < 0.05)。
| 表 9 CD3+CD56+细胞的比例 Table 9 Proportion of CD3+CD56+ cells |
表 10为扩增所获得的细胞中CD3+CD56+细胞的扩增倍数,其扩增倍数范围在200~700,样本之间存在差异,同一样本在两种培养基之间存在差异。Optimizer中扩增获得的CD3+CD56+细胞扩增倍数的平均值为440.86±222.89,与含10%FBS的RPMI1640的扩增倍数429.27±249.16之间不存在显著性差异(p > 0.05),说明采用Optimizer扩增CIK细胞的效果与含10% FBS的RPMI 1640相近。
| 表 10 CD3+CD56+细胞的扩增倍数 Table 10 Expansion fold of CD3+CD56+ cells |
分别以效靶比为3:1、5:1、7:1、9:1,检测在Optimizer和含10% FBS的RPMI 1640中扩增14天的CIK细胞对K562细胞的杀伤活性,结果见表 11。当效靶比为3:1时,Optimizer中扩增的CIK细胞对K562细胞的杀伤活性为11.59%,而在含10%FBS的RPMI1640扩增的细胞的杀伤活性为20.19%;而随着效靶比的升高,两种培养基中CIK细胞的杀伤活性均升高,且二者差异较小。当效靶比为9:1时,Optimizer中CIK细胞的杀伤活性为53.65%,接近含10%FBS的RPMI 1640的53.86%。说明,在所开发的Optimizer中扩增的CIK细胞具有与有血清培养的CIK细胞具有相似的肿瘤杀伤活性。
| 表 11 CIK细胞的杀死活性 Table 11 Killing activity of CIK cells |
本文考察了所开发的无血清培养基Optimizer支持CIK细胞体外高效扩增的效果,以细胞形态、总细胞扩增、CD3+、CD3+CD56+细胞的比例、CD3+CD56+细胞的扩增以及对K562细胞的杀伤活性为评价指标等方面均能达到与有血清培养基相似的效果。
| [1] | Sangiolo D . Cytokine induced killer cells as promising immunotherapy for solid tumors[J]. Journal of Cancer , 2011, 2 (1) : 363-368. |
| [2] | Lidia G, Loretta G, Michela C , et al. Cytokine-induced killer cells as immunotherapy for solid tumors:current evidences and perspectives[J]. Immunotherapy , 2015, 7 (9) : 999-1010. DOI:10.2217/imt.15.61. |
| [3] | Olioso P, Giancola R, Riti M D , et al. Immunotherapy with cytokine induced killer cells in solid and hematopoietic tumours:a pilot clinical trial[J]. Hematological Oncology , 2009, 27 (3) : 130-139. DOI:10.1002/hon.v27:3. |
| [4] | Jingting J, Changping W, Binfeng L . Cytokine-induced killer cells promote antitumor immunity[J]. Journal of Translational Medicine , 2013, 11 (1) : 230-235. DOI:10.1186/1479-5876-11-230. |
| [5] | YUAN Li-hong(袁丽红), SHAO Hui(邵辉), GU Yong-ming(顾永明) , et al. Simunaneous extraction and hydrolysis in situ for the recovery of diosgenin from Dioscorea zingiberensis(盾叶薯蓣中水解原位提取薯蓣皂甙元)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2007, 21 (3) : 538-544. |
| [6] | FAN Jie-ping(范杰平), CAO Jing(曹婧), KONG Tao(孔涛) , et al. Optimization of ultrasonic-assisted[Bmim]Br-K2HP04 aqueous two-phase system extraction of puerarin from pueraria([Bmim]BrK2HP04双水相萃取与超声耦合法提取葛根中的葛根素及其优化)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2011, 25 (6) : 955-961. |
| [7] | Jeon M K, Lim J B, Lee G M . Development of a serum-free medium for in vitro expansion of human cytotoxic T lymphocytes using a statistical design[J]. BMC Biotechnology , 2010, 10 (39) : 1-9. |
| [8] | Wei C, Wang W, Pang W , et al. The CIK cells stimulated with combination of IL-2 and IL-15 provide an improved cytotoxic capacity against human lung adenocarcinoma[J]. Tumour biology , 2014, 35 (3) : 1997-2007. DOI:10.1007/s13277-013-1265-2. |
| [9] | Darfler F J, Insel P A . Clonal growth of lymphoid cells in serum-free media requires elimination of H202 toxicity[J]. Journal of Cellular Physiology , 1983, 115 (1) : 31-36. DOI:10.1002/(ISSN)1097-4652. |
| [10] | Darfler F J, Murakami H, Insel P A . Growth of T-lymphoma cells in serum-free medium:lack of involvement of the cyclic AMP pathway in long-term cultures[J]. Proceedings of the National Academy of Sciences , 1980, 77 (10) : 5993-5997. DOI:10.1073/pnas.77.10.5993. |
| [11] | Yen A, Duigou R . Serum-free media for a human lymphocyte cell line and for PWM-stimulated peripheral blood lymphocytes:Requirements for insulin, transferrin and albumin[J]. Immunology Letters , 1983, 6 (3) : 169-174. DOI:10.1016/0165-2478(83)90100-1. |
| [12] | Hans Y, Jan E D V, Marcel K , et al. Serum free medium for generation and propagation of functional human cytotoxic and helper T cell clones[J]. Journal of lmmunological Methods , 1984, 72 (1) : 219-227. DOI:10.1016/0022-1759(84)90450-2. |
| [13] | Helga S P, Herman P . Requirement of a combination of a saturated and an unsaturated free fatty acid and a fatty acid carrier protein for in vitro growth of lymphocytes[J]. The Journal of Immunology , 1981, 126 (3) : 949-959. |
| [14] | Tamiko K S, Janice E E . Effects of phosphoethanolamine and ethonolamine on growth of mammary carcinoma cells in culture[J]. Experimental Cell Research , 1981, 136 (1) : 137-145. DOI:10.1016/0014-4827(81)90045-8. |
| [15] | Hiroki M, Hideo M, Gordon H S , et al. Growth of hybridoma cells in serum-free medium:Ethanolamine is an essential component[J]. Proceedings of the National Academy of Sciences of the United States of America , 1982, 79 (4) : 1158-1162. DOI:10.1073/pnas.79.4.1158. |
| [16] | Tamiko K S, Dorothy M C, Ziro Y , et al. Phosphoethanolamine as a growth factor of a mammary carcinoma cell line of rat[J]. Proceedings of the National Academy of Sciences , 1979, 76 (11) : 5741-5744. DOI:10.1073/pnas.76.11.5741. |
| [17] | Ulf B . Serum-free cultivation of lymphoid cells[J]. Advances in Biochemical Engineering/Biotechnology , 1987, 34 : 95-109. DOI:10.1007/BFb0000670. |