四唑类含能化合物分子中含有大量的N─C、N─N等化学键,具有氮含量高、生成热高、密度高和较好的热稳定性等特点,且燃烧产物多为环境友好的氮气[1-3],成为当前各国研究的热点之一,其中的典型代表有1, 1’-二羟基-5, 5’-联四唑二羟胺盐(HATO) [4]、偶氮四唑胍盐(GZT) [5]等。四唑含能化合物大多性能优越,在低特征信号推进剂、新型高能钝感炸药、气体发生剂和枪炮发射药等领域具有巨大的应用潜力。
1, 5-二氨基四唑(DAT)作为四唑化合物,氮含量高达84%,还具有较高的生成热和较好的热稳定性[6],但是其密度较小,氧平衡较低。2009年,G EBEL等[7]在DAT中引入2, 2, 2-三硝基乙醇(TNE),合成得到N1-(2, 2, 2-三硝基乙基)-1, 5-二氨基四唑(TTD),提高了其密度(1.831 g·cm-3)和氧平衡(-15.2%),生成热高达+1 443 kJ·kg-1,该化合物爆速、爆压与奥克托今(HMX)相当,具有良好的应用前景。G EBEL等以TNE、DAT为原料,经曼尼希反应(Mannich condensation)合成出TTD,但反应过程需在超声环境中发生,工艺复杂,且溶剂用量较大。本研究参考文献方法[7-8]制备得到TTD,并进行结构鉴定。为改进工艺,减少溶剂用量,采用复合溶媒为反应介质,进一步优化反应条件,产生废水量少,更具工业化前景。利用差示扫描量热法(DSC)、热失重法(TG)对TTD进行热分解研究。同时,并结合Kissinger法和Ozawa法及相关方程计算TTD的热动力学参数、热爆炸临界温度。
2 实验(材料与方法) 2.1 实验材料与仪器 2.1.1 实验材料二氨基胍盐酸盐,盐酸,工业级;乙醇,亚硝酸钠,多聚甲醛,四氯化碳,碳酸钠,均为分析纯;硝仿,自制。
2.1.2 仪器NEXUS 870型傅里叶变换红外光谱仪,美国热电尼高力公司;AV 500型(500 MHz)超导核磁功能共振仪,瑞士BRUKER公司;VARIO-EL-3型元素分析仪,德国EXEMENTAR公司;LC22010A型高效液相色谱仪,日本岛津公司。
2.2 实验过程 2.2.1 DAT的制备将15 g (0.12 mol)二氨基胍盐酸盐溶解在200 mL水和5 mL浓盐酸(37%)中,冷却到0 ℃,然后将50 mL (2.4 mol·L-1)亚硝酸钠溶液慢慢加入,温度要保持在0~5 ℃,加料完毕,反应30 min。然后用碳酸钠调节pH = 8,在40 ℃下搅拌反应20 min。反应结束,蒸除溶剂,所得固体用热乙醇(3×15 mL)提取,浓缩,所得固体用水重结晶后得到2.4 g DAT,收率为20%,纯度为97.5% (HPLC),熔点186~187 ℃[10]。1HNMR (CDCl3) δ:6.369(s,2H,NH2),6.405(s,2H,NH2)。IR光谱(KBr压片,cm-1):3 325,3 156,1 655,1 577,1 489,1 328,1 109,1 076,1 001,932,745,686。元素分析(%):CN6H4实测值(理论值):C,12.38 (12.00);N,85.02 (84.00);H,4.19 (4.00)。
2.2.2 TNE的制备将0.94 g (30 mmol) 95%多聚甲醛和4.24 g (28.0 mmol)硝仿加入到瓶中,倒入80 mL四氯化碳,搅拌条件下,升温至65~70 ℃,反应3~3.5 h,再加热至回流,反应0.5 h,冷却,过滤,浓缩至20 mL,在低温下析出固体,过滤,干燥,得到3.64 g TNE,收率为71.82%,纯度为98.83%。1H NMR(DMSO-d6) δ:5.19 (d,2H,CH2),6.31 (t,1H,OH);13C NMR(DMSO-d6) δ:128.4, 62.3。IR光谱(KBr压片,cm-1):3 431、2 898、1 595、1 310、1 092、1 061、714。元素分析(%):C2H3N3O7实测值(理论值):C,13.62(13.26);N,23.47 (23.20);H,1.58(1.66)。
2.2.3 TTD的制备将15 g蒸馏水和4.5 g无水乙醇加入到反应瓶中,加入1 g (0.01 mol) DAT并搅拌至溶解,再将1.81 g (0.01 mol) TNE缓慢加入到反应瓶中,加料完毕后,在温度25~30 ℃,反应1 h,反应结束,有固体析出,过滤,用冷水洗涤,干燥,得到2.27 g TTD,收率86.31%,纯度98.7%。IR光谱(KBr压片,cm-1):2 943,2 106,1 517,1 454,1 265,965,765。1HNMR (500 MHz, DMSO-d6)δ:7.985(2H, s, NH2),7.324 (2H, t, NH),5.215 (2H, d, CH2)。元素分析(%):C3H5N9O6实测值(理论值):C,13.75 (13.69);N,48.14(47.91);H,1.93(1.92)。
3 实验结果与讨论 3.1 TTD合成工艺优化常温条件下,由于DAT在水中溶解度较小,所以文献所述反应需在超声环境中反应20 min后再反应2 h,且溶剂量大,0.1 g DAT需溶于200 mL水。根据DAT和TNE的溶解特性,采用水/乙醇作为反应介质,对合成工艺进行了优化。
3.1.1 料比对反应的影响在温度30 ℃,反应时间1 h,水/乙醇质量比1:0.3作为反应介质条件下,考察了原料质量比对收率的影响,结果见表 1。结果表明,随着TNE投料量的增大,TTD收率也随着提高,即反应物浓度的增大有利于反应进行,但是当DAT与TNE的质量比超过1:2.00,二取代产物将生成,因此,选取DAT/TNE的质量比为1:2.00。
|
|
表 1 不同料比对TTD收率的影响 Table 1 Effects of feed ratios on TTD yields |
在温度30 ℃,反应时间1 h,DAT/TNE的质量比为1:2.00条件下,考察了不同水/乙醇质量比的反应溶剂对收率的影响,结果见表 2。
|
|
表 2 反应介质对TTD收率的影响 Table 2 Effects of solvents on TTD yields |
从表 2中看出,当乙醇比例较低时(水/乙醇= 1:0.1~0.2),由于DAT和TNE在水中的溶解性能较差,反应收率较低。当提高乙醇比例为水/乙醇质量比1:0.3,反应体系较为均一,TTD收率较高,达到86.31%。持续提高乙醇比例(水/乙醇= 1:0.5~1),TTD的收率没有明显升高。因此,选取水/乙醇质量比1:0.3作为反应介质。
3.1.3 反应温度的影响为研究反应温度对本反应的影响,在反应时间1 h,DAT/TNE的质量比为1:2.00,水/乙醇质量比1:0.3条件下,选取不同的反应温度进行实验。
从表 3中看出,当反应温度在30 ℃时,产物的收率最高,因为反应温度可以提高反应速率,缩短反应达到平衡的时间,提高转化率。继续提高反应温度,TTD的产率下降,这是因为温度过高时,会导致反应物TNE的缓慢分解发生,导致产物收率下降。
|
|
表 3 反应温度对TTD收率的影响 Table 3 Effects of reaction temperatures on TTD yields |
考察了反应温度为30 ℃,DAT/TNE的质量比为1:2.00,水/乙醇质量比1:0.3条件下,不同反应时间对TTD收率的影响,具体结果见表 4。
|
|
表 4 反应时间对TTD收率的影响 Table 4 Effects of reaction times on TTD yields |
从表 4中可以看出,当反应时间0.5 h时,反应不完全,收率为73%;当反应时间超过1 h,随着时间增长,反应收率趋于平衡,收率无明显变化。因此,最适宜反应时间为1 h。
3.1.5 改进方法与原方法的对比本文对比了改进方法和Göebel法,如表 5所示。2种方法所获得TTD的纯度均大98%,收率相当,发现改进方法拥有以下3个优点:① Göebel法需要使用超声催化,而改进方法不需要超声催化;② Göebel法反应时间为2 h,改进方法反应时间为1 h;③ Göebel法投料0.1 g DAT时,使用的溶剂水200 mL,改进方法投料0.1 g DAT时,使用的溶剂1.45 g水和0.45 g乙醇。
|
|
表 5 2种方法对比 Table 5 Comparison of the results of two different methods |
通过扫描电镜(SEM)对TTD的晶体形貌进行了分析,2种方法所获得TTD的晶体形貌基本一致,结果如图 1所示。从图中可以看出,TTD颗粒均匀不一,形貌呈不规则的棒状和片状,并且颗粒有团聚现象产生。

|
图 1 TTD的扫描电镜图 Fig.1 SEM micrograph of TTD |
DSC测试条件:铝样品池,参比物为空铝样品池,升温速率20 K·min-1,气氛为氮气,样品重约1.0 mg。热重-微分热重(TG-DTG)测试条件:样品重约1.0 mg,升温速率20 K·min-1。
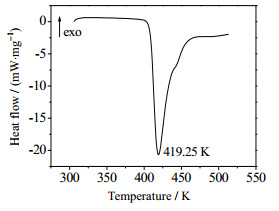
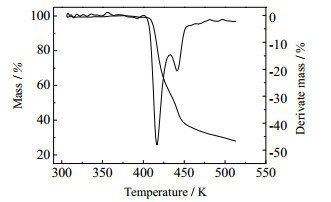
TTD的DSC和TG-DTG曲线如图 2和图 3所示。由图 2所知,TTD在419.25 K有一个向下的吸热峰,DSC的放热分解峰峰温Tp与DTG峰温基本一致。从DSC曲线可以看出,有2个放热峰,第1个较大分解峰始于411.65 K,峰温419.25 K,终于433.03 K,对应于TG-DTG曲线上的第一个最大失重台阶,失重达到44.83%。第2个较小的放热峰始于433.03 K,终于480.6 K,该阶段的质量损失为24.36%,最终残渣量为27.98%。
|
图 2 TTD的DSC图 Fig.2 DSC curve of TTD |
|
图 3 TTD的TG-DTG图 Fig.3 TG-DTG curve of TTD |
为了进一步研究TTD的热分解动力学,在不同升温速率下获得了DSC曲线,运用Kissinger法和Ozawa法[9-13],求得化合物的热动力学参数。
Kissinger法计算式为:
| $ \ln \left[\beta / T_{\mathrm{p}}^{2}\right]=\ln \left[A R / E_{\mathrm{a}}\right]-\left[E_{\mathrm{a}} / R T_{\mathrm{p}}\right] $ | (1) |
其中,Ea为表观活化能,A为指前因子,β为升温速率,R为气体常数,Tp为分解峰温。
Ozawa法计算式为:
| $ \lg \beta=C-0.4567\left[E_{\mathrm{a}} / R T\right] $ | (2) |
其中,
|
|
表 6 TTD的热动力学参数 Table 6 Thermodynamic parameters of TTD |
由表中数据可以看出,Kissinger法和Ozawa法得到E基本一致,线性相关系数为0.9976,0.9980,接近于1。
3.3 活化熵、活化焓和活化吉布斯自由能通过式(3)~(5)[9, 11],计算出TTD热分解反应的活化熵、活化焓和活化吉布斯自由能,并列于表 6中,分别为-79.47、70.43和100.88 J·K-1·mol-1。
| $ A{{\text{e}}^{\left( { - \frac{E}{{RT}}} \right)}} = \frac{{{\kappa _B}}}{h}{{\text{e}}^{\left( { - \frac{{\Delta {G^ \ne }}}{{RT}}} \right)}} $ | (3) |
| $ \Delta H=E-R T $ | (4) |
| $ \Delta {G^ \ne } = \Delta {H^ \ne } - T\Delta {S^ \ne } $ | (5) |
热爆炸临界温度Tb可以评价含能材料的热安定性和安全性,通过式(6)计算:
| $ {T_{{\text{be}}({\text{or}}\;{\text{bp}}0)}} = \frac{{{E_0} - \sqrt {E_0^2 - 4{E_0}R{T_{{\text{e}}0({\text{or}}\;{\text{p}}0)}}} }}{{2R}} $ | (6) |
式中当E0取Ep0 = 73.62 kJ·mol-1,Tp0 = 383.15 K时,得到热爆炸临界温度Tb = 401.34 K。
4 结论(1) 通过DAT与TNE的曼尼希缩合反应得到TTD,并通过红外光谱、核磁共振、元素分析等进行结构鉴定。
(2) 为了简化工艺,减少溶剂用量,对TTD的合成工艺进行了优化,确定了最适宜的反应条件为:选取质量比1:0.3水/乙醇作为反应介质,DAT/TNE的质量比为1:2.00,反应时间为1 h,反应温度为30 ℃。
(3) 利用DSC、TG对TTD进行了热分解研究,用Kissinger法和Ozawa法分别计算了热动力学参数,活化能和指前因子分别为:73.65 kJ·mol-1,21.15 s-1;并计算得到热爆炸临界温度为401.34 K。
| [1] |
阳世清, 徐松林, 黄亨健, 等. 高氮含能化合物及其含能材料[J]. 化学进展, 2008, 20(4): 526-537. YANG S Q, XU S L, HUANG H J, et al. High nitrogen compounds and their energy materials[J]. Progress in Chemistry, 2008, 20(4): 526-537. |
| [2] |
毕福强, 樊学忠, 许诚, 等. 不敏感四唑非金属含能离子化合物的研究进展[J]. 含能材料, 2012, 20(6): 805-811. BI F Q, FAN X Z, XU C, et al. Review on insensitive non-metallic energetic ionic compounds of tetrazolate anions[J]. Chinese Journal of Energetic Materials, 2012, 20(6): 805-811. DOI:10.3969/j.issn.1006-9941.2012.06.031 |
| [3] |
高福磊, 陈斌, 范红杰, 等. N, N-二(1(2)氢-5-四唑基)胺及其衍生物的研究进展[J]. 含能材料, 2014, 22(5): 709-715. GAO F L, CHEN B, FAN H J, et al. Progress of N, N'-bis(1(2)H-tetrazol-5-yl)amine and its derivatives[J]. Chinese Journal of Energetic Materials, 2014, 22(5): 709-715. |
| [4] |
葛忠学, 毕福强. 高能不敏感含能材料- HATO[J]. 含能材料, 2014, 22(4): 434-435. GE Z X, BI F Q. High energetic and insensitive materials HATO[J]. Chinese Journal of Energetic Materials, 2014, 22(4): 434-435. DOI:10.3969/j.issn.1006-9941.2014.04.001 |
| [5] |
王琼, 安亭, 潘清, 等. 偶氮四唑胍盐的热分解机理[J]. 含能材料, 2014, 22(1): 36-42. WANG Q, AN T, PAN Q, et al. Mechanism of thermal decomposition of guanidinium azotetrazolate[J]. Chinese Journal of Energetic Materials, 2014, 22(1): 36-42. |
| [6] |
齐书元, 张同来, 杨利, 等. 1, 5-二氨基四唑及其系列化合物研究进展[J]. 含能材料, 2009, 17(4): 486-496. QI S Y, ZHANG T L, YANG L, et al. Progress in 1, 5-Diamino-1H-tetrazole and its derivatives[J]. Chinese Journal of Energetic Materials, 2009, 17(4): 486-496. DOI:10.3969/j.issn.1006-9941.2009.04.027 |
| [7] |
Göebel M, Klapöetke T M. Development and testing of energetic materials:The concept of high densities based on the trinitroethyl functionality[J]. Advanced Functional Materials, 2009, 19(3): 347-365. DOI:10.1002/adfm.v19:3 |
| [8] |
管鸣宇, 杨红伟, 吕春绪, 等. 三硝基乙基四嗪化合物的合成与表征[J]. 含能材料, 2014, 22(6): 736-740. GUAN M Y, YANG H W, LV C X, et al. Synthesis and characterization of trinitroethyl compounds derived from tetrazine[J]. Chinese Journal of Energetic Materials, 2014, 22(6): 736-740. |
| [9] |
胡荣祖, 高胜利, 赵凤起, 等. 热分析动力学[M]. 北京: 科学出版社, 2008. HU R Z, GAO S L, ZHAO F Q, et al. ThermaI analysis kinetics[M]. Beijing: Science Press, 2008. |
| [10] |
SMITH L C. An approximate solution of the adiabatic explosion problem[J]. Thermochimica Acta, 1975, 13(1): 1-6. DOI:10.1016/0040-6031(75)80060-8 |
| [11] |
李彦峰, 王猛杰, 徐抗震, 等. 1-氨基-2-硝基胍(ANQ)的热行为[J]. 含能材料, 2016, 24(9): 848-852. LI Y F, WANG M J, XU K Z, et al. Thermal behaviors of 1-amino-2- nitroguanidine[J]. Chinese Journal of Energetic Materials, 2016, 24(9): 848-852. |
| [12] |
YANG R T, STEINBERG M. Reaction kinetics in differential thermalanalysis[J]. The Journal of Physical Chemistry, 1976, 80(9): 965-968. DOI:10.1021/j100550a009 |
| [13] |
OZAWA T. A new method of analyzing thermogravimetric data[J]. Bulletin of the Chemical Society of Japan, 1965, 38(12): 1881-1886. |




