谷胱甘肽(L-glutathione,简称GSH)是一种由谷氨酸、半胱氨酸和甘氨酸构成的具有重要生理功能的活性三肽,广泛存在于生物体内,是主要的抗氧化剂,参与细胞内的多种反应[1]。目前GSH的分离纯化方法仍存在样品预处理繁琐、特异性差、干扰大及灵敏度较差等问题,无论是GSH的生产合成和应用,还是GSH的生物学功能及临床应用方面的研究,都亟待优良的GSH分离纯化方法。
分子印迹是一种对模板分子具有特异性识别作用的新型技术[2, 3],分子印迹聚合物(MIPs)现通常由可控/“活性”自由基聚合进行制备,主要分为氮氧稳定自由基聚合(NMP)[4]、原子转移自由基聚合(ATRP)[5]、可逆-加成-断裂链转移自由基聚合(RAFT)[6]以及引发转移终止剂(Iniferter)法[7]。其机理的特点是快引发、慢增长和“无”终止,得到的聚合物分子量分布较窄,聚合物的端基、组成、结构等都可以控制。另外,可控/“活性”自由基聚合还可以实现低温光引发聚合,这种聚合方式对于生物活性较强的谷胱甘肽分子来说,更加利于其稳定性。因此采用可控/“活性”自由基聚合法是制备谷胱甘肽分子印迹聚合物有效且重要的方法。
本文采用Iniferter自由基聚合法,以4-乙烯基吡啶(4-VP)为功能单体制备得到了谷胱甘肽分子印迹聚合物(L-MIPs);同时研究了模板分子和功能单体的最佳配比,以及溶剂种类对L-MIPs在形貌和性能方面的影响;并通过实验对Iniferter自由基聚合和传统自由基聚合制备的分子印迹聚合物(L-MIPS和H-MIPs)进行了比较;详细研究了L-MIPs相比H-MIPs在静态吸附性能、动态吸附性能以及识别性能方面的优势。
2 实验部分 2.1 主要仪器与试剂傅立叶变换红外光谱仪(WQF-310,日本岛津公司);紫外可见光分光光度计(UV-2550,日本岛津公司);场发射扫描电子显微镜(Quanta 600FEG,美国TA公司);热分析系统(Q600SDT,美国TA);微波-紫外-超声三位一体合成萃取反应仪(UWave-1000,上海新仪微波化学科技有限公司);数显水浴恒温振荡器(SHZ-C,金坛市江南仪器厂);数控超声波清洗器(KQ-100DE,昆山市超声仪器有限公司)。
谷胱甘肽(GSH,BC,上海晶纯科技有限公司);氧化型谷胱甘肽(GSSG,BC,上海源叶生物科技有限公司);双甘氨肽(Gly-Gly,BC,上海晶纯科技有限公司);4-乙烯基吡啶(4-VP,AR,百灵威科技有限公司);乙二醇二甲基丙烯酸酯(EDMA,纯度为97%,烟台云开化工有限公司);对氯甲基苯乙烯(P-CMS,AR,TCI化学工业发展有限公司);二乙基二硫代氨基甲酸钠(DDTC,AR,天津市东海化工公司);二甲亚砜(DMSO,AR,广东省化学试剂工程技术研究开发中心);偶氮二异丁腈(AIBN,AR,上海青析化工科技有限公司);5,5-二硫代-2,2-二硝基苯甲酸(DTNB,AR,Sigma化学试剂有限公司);三羟甲基氨基甲烷(Tris,AR,中国医药集团上海化学有限公司);其余试剂均为分析纯。
2.2 合成与制备 2.2.1 光引发剂4-乙烯基苄基-N,N-二乙基二硫代氨基甲酸酯的合成以对氯甲基苯乙烯(p-CMS)和DDTC为原料,合成光引发剂4-乙烯基苄基-N,N-二乙基二硫代氨基甲酸酯(VBDC)[8]。
FT-IR(KBr)分析:914,985和1415 cm-1(CH=CH2),1210和1485 cm-1(CS-N);1H-NMR(CD3Cl)分析:7.322(4H,s,Ar-H),6.637 ~ 6.685(H,q,Ar-CH=),5.719~5.689和5.196~5.214(2H,d,CH2=),4.517(2H,s,Ar-CH2),3.637~3.675和3.982~4.0 17(4H,q,-N(CH2CH3)2),1.239~1.263和1.208 ~ 1.227(6H,t,-N(CH2CH3)2)。
2.2.2 谷胱甘肽分子印迹聚合物MIPs的制备称取6.5 mg的GSH加入石英烧瓶中,加入20 mL溶剂使其充分溶解,再向其中加入一定量的4-VP,静置2 h后,加入2 mL交联剂EDMA和10.6 mg引发剂VBDC,在紫外光照下反应10 h,期间一直保持N2氛围,用甲醇/水/乙酸(70/25/5,v/v)混合液洗脱GSH分子直至洗脱液中检测不到GSH为止,真空干燥后得到谷胱甘肽分子印迹聚合物(L-MIPs)。制备过程如图 1所示。
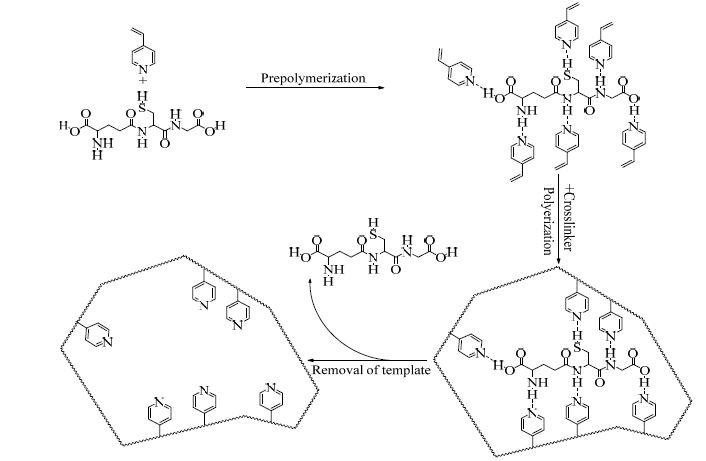
|
图 1 GSH 分子印迹聚合物制备过程示意图 Fig.1 Schematic diagram of the preparation route of GSH molecularly imprinted polymers |
空白分子印迹聚合物(L-NIPs)的制备方法同上,但在制备过程中不加入模板分子GSH。
普通自由基聚合法制备谷胱甘肽分子印迹聚合物(H-MIPs)的方法同上,但在制备过程中选用AIBN作为引发剂,并采用水浴加热65℃进行聚合。空白分子印迹聚合物(H-NIPs)制备过程不加入模板分子,其余方法同上。
2.3 谷胱甘肽分子印迹聚合物的吸附性能 2.3.1 静态平衡吸附准确称取多份一定量的MIPs和NIPs(每份约100 mg),各自置于50 mL锥形瓶中,然后依次加入10 mL浓度为0.02~0.3 mg⋅mL-1的GSH水溶液,于25℃下振荡吸附10 h,离心分离后,利用DTNB为显色剂,采用紫外分光光度计测定上清液中GSH的浓度[9],根据吸附前后溶液中GSH的浓度变化计算MIPs及NIPs的吸附量,如公式(1)所示。
| $Q=\left( {{C}_{0}}-{{C}_{e}} \right)V/m$ | (1) |
式中Q为吸附量(mg⋅g-1);C0为吸附前溶液中GSH的浓度(mg⋅mL-1);Ce为吸附后溶液中GSH的浓度(mg⋅mL-1);m为MIPs或NIPs的质量(g);V为吸附溶液的体积(mL)。平行测定三次,取平均值。
印迹因子β是表征印迹聚合物吸附特异性大小的物理量,β越大表明特异性吸附越强,印迹效果就越好。如公式(2)所示。
| $\beta ={{Q}_{MIPs}}/{{Q}_{NIPs}}$ | (2) |
式中QMIPs和QNIPs分别表示MIPs和NIPs的吸附量(mg⋅g-1)。
NIPs对GSH的吸附操作步骤同上。
2.3.2 吸附动力学研究为了研究MIPs/NIPs的吸附动力学,分别各自称取多份100 mg MIPs/NIPs置于锥形瓶中,加入10 mL浓度为0.2 mg⋅mL-1 GSH溶液,25℃振荡吸附,每隔10 min取样测定MIPs/NIPs对GSH的吸附量,以研究MIPs/NIPs对GSH的吸附速率。
2.4 谷胱甘肽分子印迹聚合物的识别性能称取1.05 g MIPs装入内径为10 mm的固相萃取柱中,其中填充柱的床体积(Bed Volume,BV)为2 mL,分别配制浓度为0.2 mg⋅mL-1 GSH,GSSG和Gly-Gly三种溶液,以2 BV⋅h-1的流速逆流通过固相萃取柱,并以1 BV的间隔收集流出液,测定流出液中待测物质的浓度,并绘制出动态结合曲线,利用流出液的浓度与床体积数,计算MIPs对三种待测物质的泄漏吸附量与饱和吸附量,研究MIPs的选择吸附性能。
3 结果与讨论 3.1 模板分子GSH与功能单体4-VP间的相互作用在预聚合过程中,功能单体-模板分子复合物的稳定性是制备高性能印迹聚合物的关键。当功能单体的用量较低时,聚合物无法形成完整的识别空穴,因而也无法实现功能单体与模板分子的多位点结合;相反,当功能单体用量较高时,会导致功能单体过剩,致使印迹聚合物的非特异性吸附增强,降低了印迹聚合物的特异识别性能[10]。优化模板分子与功能单体的摩尔配比,可以获得较高选择识别性能的印迹聚合物[11]。
利用Materials Studio 5.0软件对不同摩尔比的GSH和4-VP进行分子模拟。首先使用分子力学Forcite模块COMPASS的力场对GSH-4-VP复合物几何构型的进行了优化,并计算出GSH和4-VP之间的相互作用能。经Material Studio 5.0软件进行计算后结果如图 2所示。
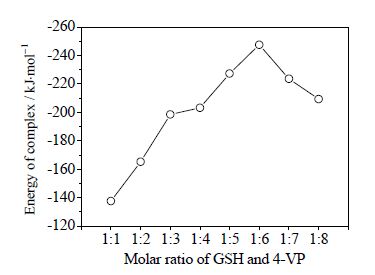
|
图 2 不同摩尔比的GSH 与4-VP 络合物的能量值 Fig.2 Energy of GHS-4-VP complexes prepared with different molar ratios |
由图 2可知,不同摩尔比的GSH和4-VP复合物的能量值随着摩尔比的增加呈现先增大后减小的趋势。这是由于GSH与4-VP形成的复合物中主要存在氢键、范德华力、静电力等相互作用力,其中最主要的为氢键作用。随着功能单体量的增加,这些作用力使得复合物的能量产生变化。当GSH与4-VP的摩尔比为1:6时,复合物最稳定,此时的能量最低。继续加入功能单体导致复合物的稳定结构被破坏,体系的能量升高。
计算机分子模拟是理论化计算的结果,为了验证结果的准确性,进一步采用紫外分光光度计法测定不同摩尔比的GSH和4-VP的紫外吸收光谱,实验发现随着4-VP使用量的增加,GSH-4-VP复合物的紫外吸收不断向长波方向移动,当两者的摩尔比为1:6时红移量最大,继续加入4-VP后反而开始向左移动。说明GSH与4-VP的摩尔比为1:6时,两者的氢键作用最大,为最佳摩尔比。这一结果与分子模拟结果一致。
3.2 溶剂的选择本研究采用DMSO,MeCN/DMSO(1/1,v/v)和EtOH/H2O(9/1,v/v)三种不同的溶液作为溶剂,分别制备了相应的L-MIPs和L-NIPs。其中L-MIPs1、L-NIPs 1、L-MIPs2和L-NIPs2均为块状聚合物,并且其MIPs表面比相应的NIPs表面更加粗糙,同时还可以看到MIPs表面存在大量的小孔,这有利于模板分子在识别过程中的传质,因此拥有较高的印迹因子(见表 1)。从图 3还可以看到L-MIPs3和L-NIPs3均为类球状聚合物,并且L-MIPs3的平均粒径明显高于L-NIPs3,这可能是由于模板分子在印迹过程中影响了聚合物链段的增长,其次GSH的模板作用可导致印迹聚合物内部有孔道存在,同样可以促使印迹聚合物的粒径增大。
| 表 1 不同溶剂对L-MIPs比表面积、孔体积、平均孔径及吸附性能的影响 Table 1 Effects of different solvents on surface areas (S), pore volume (Vp), pore size (dp) and adsorption properties of L-MIPs/NIPs |

|
图 3 不同溶剂制备的分子印迹聚合物SEM 图 Fig.3 SEM images of L-MIPs and L-NIPs prepared with different solvents (a) L-MIPs1 and (b) L-NIPs1, DMSO; (c) L-MIPs2 and (d) L-NIPs2, MeCN/DMSO (1/1, v/v); (e) L-MIPs3 and (f) L-NIPs3, EtOH/H2O (9/1, v/v) |
由表 1还可以看出,DMSO为溶剂时制备的L-MIPs1和L-NIPs1比表面积差值和孔体积差值较大,这主要是由于印迹聚合物的表面及内部存在大量的印迹孔穴,说明模板分子在印迹聚合物中起到了显著的印迹效果,且结合性能也最为优良。另外,L-MIPs3比表面积虽然较大,但其结合性能却最差,这可能是由于其类球状的形貌使得其比表面积相对较大,但L-MIPs3在印迹过程中存在大量的水,影响了模板分子与功能单体的相互作用,同时聚合物间相互团聚,减少了L-MIPs3中特异性识别位点,造成GSH的印迹因子较小,结合性能较差。综合分析表明,DMSO是制备识别性能优良L-MIPs的最佳溶剂。
3.3 L-MIPs和H-MIPs的识别性能 3.3.1 谷胱甘肽分子印迹聚合物的吸附等温线图 4为MIPs和NIPs对GSH的吸附等温线。由图 4可看出,随着GSH浓度的增加,L-MIPs和H-MIPs的吸附量均出现不同程度的增长,其饱和吸附量分别达到29.6和18.8 mg⋅g-1,明显高于L-NIPs和H-NIPs对GSH的吸附量。这种现象说明在印迹过程中,GSH与4-VP之间通过相互作用在MIPs上产生了印迹孔穴和结合位点,决定了MIPs对GSH的高度亲合力,而NIPs表面没有印迹孔穴和印迹位点,只限于微球表面产生的非特异性吸附,因此吸附能力较低[12]。另外,在相同浓度下,L-MIPs对GSH的吸附量明显高于H-MIPs,表明活性Iniferter自由基聚合法制备的印迹聚合物相比于普通自由基法可得到更多的印迹孔穴和识别位点,可有效改善对模板分子的识别性能。这可能是由于Iniferter自由基聚合法制备的L-MIPs拥有较为均匀的交联网状结构,可以形成结构稳定的印迹空穴和结合位点,因此对模板分子有较强的识别效果[13~15]。
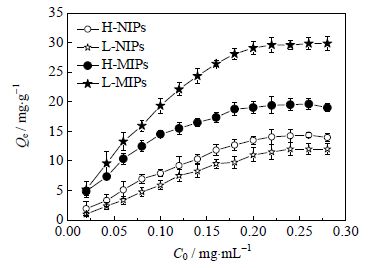
|
图 4 L-MIPs/NIPs 和H-MIPs/NIPs 的吸附等温线 Fig.4 Binding isotherms of L-MIPs/NIPs and H-MIPs/NIPs at 25℃ |
图 5为MIPs和NIPs对GSH吸附容量随时间的变化曲线。从图 5可知,L-MIPs 和H-MIPs对GSH吸附量随时间的延长而增加,并且呈现出前期增加迅速而后期增加缓慢的趋势。整个吸附现象表明印迹聚合物中由交联剂和功能单体构成的立体孔穴分布深浅不一,在开始阶段由于印迹聚合物外表面分布着大量印迹位点,因而对模板分子表现为快速结合;随着外表面结合逐渐达到饱和,GSH开始向深孔传质,此时会有一定的空间位阻效应,导致吸附速率显著下降,最终直至饱和[16]。 另外,L-MIPs在前30 min吸附量可达到吸附总量的50%,并且在75 min内可达到吸附饱和,体现了对GSH的快速响应能力;H-MIPs达到吸附饱和至少需要100 min,并且饱和吸附量较低。这充分说明Iniferter活性自由基聚合是一种可行有效的制备方法,同时L-MIPs具有较高的传质速率。从图中还可以看出,L-NIPs和H-NIPs吸附容量随时间的延长而增加,之后达到吸附平衡,其饱和吸附量分别为16.2 和13.4 mg⋅g-1。 这种吸附过程可能是由于模板分子扩散到NIPs表面,模板分子与NIPs表面功能基团通过疏水作用,范德华力及氢键相互作用而造成非特异性吸附。
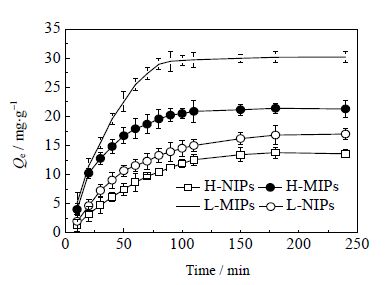
|
图 5 L-MIPs/NIPs 和H-MIPs/NIPs 对GSH 的吸附动力学曲线 Fig.5 GSH binding dynamic curves of L-MIPs/NIPs and H-MIPs/NIPs |
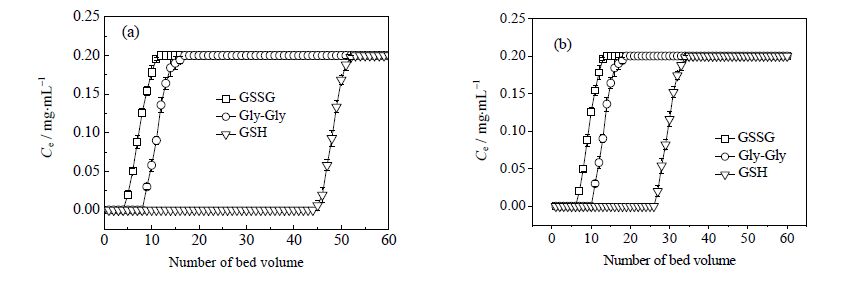
图 7为L-MIPs和H-MIPs对GSH,GSSG和Gly-Gly的动态结合曲线。从图 7(a)可以看到GSSG,Gly-Gly溶液的泄漏体积分别是5和9 BV,而GSH溶液的泄露体积表现出较高数值(45 BV)经计算发现,L-MIPs对GSSG的泄漏吸附量与饱和吸附量仅为1.91和4.95 mg⋅g-1,对Gly-Gly的泄漏吸附量与饱和吸附量为3.43和6.78 mg⋅g-1,而对GSH的泄漏吸附量与饱和吸附量则高达18.0和20.8 mg⋅g-1。由这些数据可以看出L-MIPs对Gly-Gly和GSSG的吸附量明显小于对GSH的吸附量。这是由于L-MIPs上具有和GSH尺寸及空间构型一致的孔穴,因而模板分子GSH能够进入孔穴之中而表现出较强的保留,但对其他两种竞争物质,由于结构十分相似,主要为物理吸附,因此差别很小,基本不选择、不识别、不结合,该结果表明L-MIPs对GSH有较好的特异性识别能力。
|
图 6 GSH、GSSG 和Gly-Gly 的化学结构式 Fig.6 Chemical structures of GSH, GSSG and Gly-Gly |
|
图 7 L-MIPs (a) 和H-MIPs (b) 对GSH, GSSG 和Gly-Gly 的动态结合曲线 Fig.7 Dynamic binding curves of L-MIPs (a) and H-MIPs (b) for GSH, GSSG and Gly-Gly Bed volume: 2 mL; temperature: 25℃; initial concentration: 0.20 mg⋅mL-1; flow rate: 2 BV⋅h-1 |
从图 7(b)中可以看出,H-MIPs作为填充柱时,对GSH、GSSG和Gly-Gly三种多肽溶液的泄漏体积分别为27、7和11 BV。这是由于普通自由基聚合法制备的印迹聚合物网络结构不均匀,多分散性无法控制,因而其有效的识别位点少,相较于L-MIPs对GSH的选择性较差。
4 结 论采用Iniferter自由基聚合法,以GSH为模板分子,4-VP为功能单体,DMSO为溶剂,制备了L-MIPs。研究发现,由于Iniferter自由基聚合可以控制聚合物分子量和交联网络结构,使得L-MIPs比传统自由基聚合制备的H-MIPs对GSH具有更好的结合性能和更快的响应能力,饱和吸附量分别为29.6和18.8 mg·g-1,饱和时间分别为75和100 min。在GSH以及与其结构相似的GSSG、Gly-Gly作为竞争底物的体系中,L-MIPs对GSH具有更好的选择识别性。说明采用Iniferter自由基聚合法制备L-MIPs具有明显的优势。
符号说明:
| C0 | - 吸附前GSH的浓度,mg⋅mL-1 | QNIPs | - 非印迹聚合物的吸附量,mg⋅g-1 |
| Ce | - 吸附后溶液中GSH的浓度,mg⋅mL-1 | S | - 比表面积,m2⋅g-1 |
| dp | - 平均孔径,nm | V | - 吸附溶液体积,mL |
| m | - 聚合物质量,g | Vp | - 孔体积,mL⋅g-1 |
| Q | - 吸附量,mg⋅g-1 | β | - 印迹因子 |
| QMIPs | - 印迹聚合物的吸附量,mg⋅g-1 |
| [1] | LIN Jian-ping(林建平), YOU Jian-feng(游建锋), SHENG Xiao-xia(盛晓霞) . Study on the batch fermentation for the production of glutathione with spent brewer's yeast(利用啤酒酵母间歇发酵合成谷胱甘肽的研究)[J]. Journal Chemical Engineering of Chinese Universities(高校化学工程学报) , 2003, 17 (6) : 689-694 |
| [2] | Qian L W, Hu X L, Guan P . Preparation of bovine serum albumin imprinting sensitive hydrogels using ionic liquid as co-monomer and stabilizer[J]. Talanta , 2014, 121 (4) : 56-64 |
| [3] | ZHAO Na(赵娜), HU Xiao-ling(胡小玲), GUAN Ping(管萍) . Preparation of erythromycin-imprinted polymeric microspheres by emulsion polymerization and their adsorption properties(乳液聚合法制备红霉素分子印迹聚合物微球及其吸附性能)[J]. Acta Physico-Chimica Sinica(物理化学学报) , 2014, 30 (1) : 121-128 |
| [4] | WANG Mei-yu(王美玉), XU Xiao-mei(徐晓梅), LIU Jia-nan(刘佳楠) . Reaction behavior in preparation of comb-like branched polystyrene by combination of nitroxide-mediated radical polymerization and atom transfer radical polymerization(氮氧稳定自由基聚合与原子转移自由基聚合结合制备梳形支化聚苯乙烯的反应行为)[J]. Journal Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28 (1) : 98-103 |
| [5] | LIU Ke-yong(刘克勇), BAO Yong-zhong(包永忠) . Preparation of PVC-g-BA copolymers by atom transfer radical polymerization in aqueous phase(水相原子转移自由基聚合制备PVC-g-BA聚合物)[J]. Journal Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27 (3) : 476-481 |
| [6] | Yang H, Guo T Y, Zhou D Z . Surface hydrophilic modification with well-defined glycopolymer for protein imprinting matrix[J]. International Journal of Biological Macromolecules , 2011, 48 (3) : 432-438 DOI:10.1016/j.ijbiomac.2011.01.002 |
| [7] | Chen R R, Qin L, Jia M . Novel surface-modified molecularly imprinted membrane prepared with iniferter for permselective separation of lysozyme[J]. Journal of Membrane Science , 2010, 363 (1-2) : 212-220 DOI:10.1016/j.memsci.2010.07.026 |
| [8] | Otsu T, Yamashita K, Tsuda K . Synthesis, reactivity, and role of 4-vinylbenzyl N,N-diethyldithiocarbamate as a monomer-iniferter in radical polymerization[J]. Macromolecules , 1986, 19 (2) : 287-290 DOI:10.1021/ma00156a007 |
| [9] | ZHU Ya-ling(朱亚玲), ZHANG Xiao-yong(张小勇), CUI Sheng-yun(崔胜云) . Determination of GSH in lycium barbarum L fruits by derivatizing agent(利用衍生化试剂DTNB测定枸杞中谷胱甘肽)[J]. Food Science(食品科学) , 2011, 32 (6) : 250-255 |
| [10] | Baggiani C, Anfossi L, Giovannoli C . Binding properties of 2,4,5-trichlorophenoxyacetic acid-imprinted polymers prepared with different molar ratios between template and functional monomer[J]. Talanta , 2004, 62 (5) : 1029-1034 DOI:10.1016/j.talanta.2003.10.027 |
| [11] | Gao F X, Ma X T, He X W . Smart surface imprinting polymer nanospheres for selective recognition and separation of glycoprotein[J]. Colloids and Surface A:Physicochemical and Engineering Aspects , 2013, 433 (35) : 191-199 |
| [12] | Sun Z, Schüssler W, Sengl M . Selective trace analysis of diclofenac in surface and wastewater samples using solid-phase extraction with a new molecularly imprinted polymer[J]. Analytica Chimica Acta , 2008, 620 (1-2) : 73-81 DOI:10.1016/j.aca.2008.05.020 |
| [13] | HE Jian-feng(何建峰), YANG Wan-li(杨万里), HUANG Shao-mei(黄少梅) . Study on the preparation for quinine imprinted polymeric microsphere by living/controlled radical polymerization and its recognition properties(活性/可控自由基聚合制备奎宁分子印迹微球及识别性能研究)[J]. Chemical Research and Application(化学研究与应用) , 2014, 26 (1) : 55-59 |
| [14] | Song R Y, Hu X L, Guan P . Synthesis of glutathione imprinted polymer particles via controlled living radical precipitation polymerization[J]. Chinese Journal of Polymer Science , 2015, 33 (3) : 404-415 DOI:10.1007/s10118-015-1590-6 |
| [15] | Ma Y, Pan G Q, Zhang H Q . Comparative study of the molecularly imprinted polymers prepared by reversible addition-fragmentation chain transfer "bulk" polymerization and traditional radical "bulk" polymerization[J]. Journal of Molecular Recognition , 2013, 26 (5) : 240-251 DOI:10.1002/jmr.v26.5 |
| [16] | Qin L, He X W, Li W Y . Molecularly imprinted polymer prepared with bonded β-cyclodextrin and acrylamide on functionalized silica gel for selective recognition of tryptophan in aqueous media[J]. Journal of Chromatography A , 2008, 1187 (1-2) : 94-102 DOI:10.1016/j.chroma.2008.02.004 |




