2. 浙江昂利康制药股份有限公司, 浙江 绍兴 312000
2. Zhejiang Anglikang Pharmaceutical Co. Ltd., Shaoxing 312000, China
硫化氢(H2S)是人体内仅次于一氧化氮(NO)和一氧化碳(CO)的第3种内源性气体信号递质分子[1-4],同时,硫化氢也是环境有毒气体之一,生理水平与毒理水平之间的H2S浓度范围小于两个数量级[5-7],因此,实现生物体内H2S高效检测具有重要意义。荧光分析方法具有选择性好、灵敏度高、检测速度快和适于细胞和活体成像等特点,在内源性H2S检测方面得到广泛应用[8-10]。比率计量型荧光探针与活性分子反应前后,表现出比率型特点,可有效减少激发光源和光漂白效应引起的成像干扰,适合生物活性分子的定量检测[11]。因此,开发出具有良好荧光性能的比率型H2S荧光探针是当前的主要需求[12-17]。
基于叠氮还原的反应型H2S荧光探针具有反应稳定性好、设计简单等优势,已成为H2S荧光探针设计的重要策略之一。但是受叠氮基团荧光淬灭效应的影响,基于叠氮还原设计的H2S探针大多是荧光增强型探针[18-21]。2018年,朱勍教授团队基于喹啉母环设计了一例增强型H2S探针,成功用于活细胞H2S成像[22]。进一步提高该类探针的检测灵敏度和准确性,结合比率型荧光探针设计的前期基础[23-24],本研究以炔基替代三氮唑基团,改善探针分子的共轭特征,提高探针荧光量子产率,制备了新型具有良好比率型特点的H2S荧光探针,并对探针的荧光检测性能和细胞成像效果进行了研究。
2 实验部分 2.1 仪器与试剂合成过程中所使用的所有原料和试剂均属于国产分析纯或者化学纯试剂,没有经过进一步处理;无水试剂按照常规方法进行处理。8-氨基喹啉、N-碘代丁二酰亚胺、苯甲酰氯、双三苯基磷二氯化钯、碘化亚铜、苯乙炔、叠氮三甲基硅烷和亚硝酸叔丁酯均购自萨恩化学技术(上海)有限公司;四氢呋喃、乙酸乙酯等试剂购自国药集团化学试剂有限公司。
Hitachi F-4500型荧光光谱仪(Hitachi公司,日本);UV-2700型分光光度计(岛津公司,日本);Brucker核磁共振仪400 MHz (Brucker公司,瑞士);X-5型显微熔点测定仪(北京泰克仪器有限公司);共聚焦荧光显微镜(CLSM,Nikon A1R系统,日本)。
2.2 探针QL-N3的合成及表征探针QL-N3的合成路线如图 1所示。称取质量为0.497 g (1.33 mmol)化合物1,质量为0.271 g (2.66 mmol) 苯乙炔,质量为0.5 g (0.71 mmol)双三苯基磷二氯化钯和质量为0.1 g (0.52 mmol)的碘化亚铜于50 mL三口烧瓶中,加入10 mL三乙胺和1 mL四氢呋喃,50 ℃温度且氮气保护下,磁力搅拌反应1 h后停止反应并降温;溶剂减压旋干;加入乙酸乙酯和饱和食盐水,萃取,有机层用无水硫酸钠干燥后过滤。滤液减压旋干,加入乙酸乙酯和环己烷重结晶,过滤后得化合物2,为灰色固体,质量为0.23 g。化合物2产率49.5%。氢谱1H NMR (400 MHz,CDCl3) 化学位移δ: 10.83 (单峰s,1H),8.93 (双峰d,耦合常数J = 8.1 Hz,1H),8.89 (双重双峰dd,J = 4.2, 1.6 Hz,1H),8.73 (dd,J = 8.4,1.6 Hz,1H),8.09 (dd,J = 8.0,1.4 Hz,2H),7.86 (d,J = 8.1 Hz,1H),7.65~7.61 (m,2H),7.61~7.53 (m,4H),7.41~7.37 (m,3H)。碳谱13C NMR (101 MHz, CDCl3, TMS) δ: 165.47、148.68、138.43、135.18、135.09、134.89、132.06、131.88、131.62、128.88、128.52、128.27、127.35、123.12、122.32、116.04、114.94、94.16、86.38。
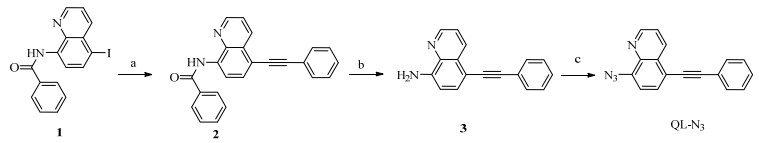
|
图 1 探针QL-N3合成路线 Fig.1 Synthesis of probe QL-N3 |
称取质量为0.46 g (1.32 mmol)化合物2,氢氧化钠4.0 g(0.1 mol)于100 mL三口烧瓶中,加入13 mL甲醇、15 mL水和10 mL四氢呋喃,搅拌升温至回流,反应18 h。薄层层析法(thin layer chromatography,TLC)检测反应完全,冷却至室温后,加入20 mL四氢呋喃,适量饱和食盐水洗涤,有机层用无水硫酸钠干燥后过滤,滤液旋干,粗品柱层析分离(体积比V(乙酸乙酯): V(正己烷) =1:10),得黄色固体化合物3,质量为0.29 g。化合物3产率为89.5%。氢谱1H NMR (400 MHz,CDCl3) 化学位移δ: 8.78 (双重双峰dd,耦合常数J = 4.1,1.7 Hz,1H),8.63 (dd,J = 8.4,1.7 Hz,1H),7.65~7.56 (m,3H),7.48 (dd,J = 8.4,4.2 Hz,1H),7.40~7.30 (m,3H),6.85 (双峰d,J = 7.9 Hz,1H),5.23 (s,2H)。碳谱13C NMR (101 MHz,CDCl3,TMS) δ: 147.74、144.92、137.79、134.76、132.22、131.38、129.21、128.44、127.93、123.80、122.12、109.31、108.33、92.18、87.47。
将质量为0.40 g (1.64 mmol)化合物3溶解于30 mL乙腈中,加入叠氮三甲基硅烷质量为0.38 g (3.28 mmol) 和亚硝酸叔丁酯0.34 mL (3.28 mmol),室温搅拌反应20 h。反应结束后,旋干溶剂,粗品柱层析分离(体积比V(乙酸乙酯): V(正己烷) =1:20),得0.13 g黄色固体,为荧光探针QL-N3,收率为29.4%,熔点为103~105 ℃。氢谱1H NMR (400 MHz,CDCl3) 化学位移δ: 8.99 (双重双峰dd,耦合常数J = 4.1,1.6 Hz,1H),8.75 (dd,J = 8.5、1.7 Hz,1H),7.78 (d, J = 7.9 Hz,1H),7.65 (dd,J = 6.5、3.2 Hz,2H),7.60 (dd,J = 8.5、4.2 Hz,1H),7.47~7.41 (m,3H),7.38 (双峰d,J = 7.9 Hz,1H)。碳谱13C NMR (101 MHz,CDCl3) δ: 149.76、141.16、137.68、135.03、131.64、130.71、129.56、128.77、128.55、122.81、122.58、117.84、117.47、95.07、85.89。高分辨质谱HRMS: C17H11N4理论值271.098 4,实测值271.100 4。
3 结果与讨论 3.1 荧光性能首先考察荧光探针QL-N3对H2S荧光响应的比率型特点,如图 2所示。向探针浓度为5 μmol·L−1的磷酸缓冲盐溶液(PBS)(1.0×10−2 mol·L−1,pH 7.4,质量分数40% 的二甲基亚砜(DMSO))加入120 μmol·L−1 H2S,利用UV-2700型分光光度计获得加入H2S前后的紫外吸收光谱,如图 2(a);利用Hitachi F-4500型荧光光谱仪获得加入H2S前后的荧光发射光谱变化,如图 2(b)。结果表明,在加入H2S前,探针QL-N3的紫外最大吸收峰位于345 nm,溶液表现出明显的蓝色荧光,最大荧光发射峰位于435 nm;与H2S反应后,发生明显红移,最大吸收峰红移至390 nm,最大荧光发射峰红移至525 nm,表现出明显比率型特点。
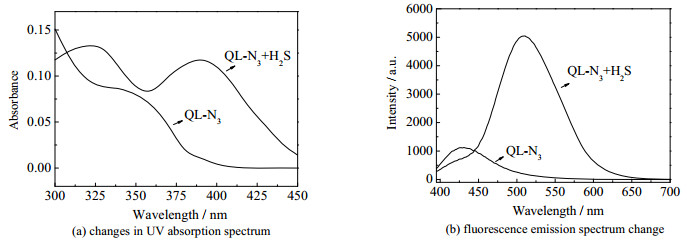
|
图 2 探针QL-N3(5 μmol·L−1)对H2S(0 μmol·L−1和120 μmol·L−1)的荧光响应 Fig.2 Fluorescence response of QL-N3 (5 μmol·L−1) to different concentrations of H2S (0 μmol·L−1 and 120 μmol·L−1) |
为了了解QL-N3对H2S的荧光识别过程,采用高效液相色谱和质谱对样品溶液进行了分析。QL-N3 (浓度5 μmol·L−1)与H2S(浓度60 μmol·L−1)反应5 min后,有2个明显的峰值,分别对应于QL-N3和QL-NH2。同时,高分辨质谱结果显示,[QL-N3+H]的质荷比峰值出现在m/z =271.100 4处。[QL-NH2+H]的质荷比峰值出现在m/z =245.109 5处。这些结果表明,紫外吸收光谱和荧光发射光谱显示的荧光响应是由H2S还原QL-N3生成QL-NH2引起的。
进一步研究了荧光探针QL-N3对不同离子和活性分子的荧光响应能力(1:GSH、2:Cys、3:Na+、4:Ca2+、5:Zn2+、6:Cl−、7:Br−、8:F−、9:CO32−、10:SO42−、11:N3−、12:NO32−、13:SO32−、14:Hcy、15:Gly、16:Lys、17:Glu、18:H2S),如图 3所示,向探针浓度为5 μmol·L−1的PBS溶液(浓度为1.0×10−2 mol·L−1,pH 7.4,质量分数为40%的DMSO)中加入120 μmol·L−1常见金属离子(Na+、Ca2+、Zn2+),阴离子(Cl−、Br−、F−、CO32−、SO42−、N3−、NO32−、SO32−),活性分子(Hcy、Cys、GSH、Gly、Lys、Glu、H2S),如图 3(a)。I525nm/I435nm表示在荧光发射光谱525和435 nm处的强度比值,如图 3(b)。结果表明,与其他离子或者活性分子相比,仅有H2S能够使荧光探针发生荧光强度变化和荧光光谱红移,表现出对H2S的较高选择性。
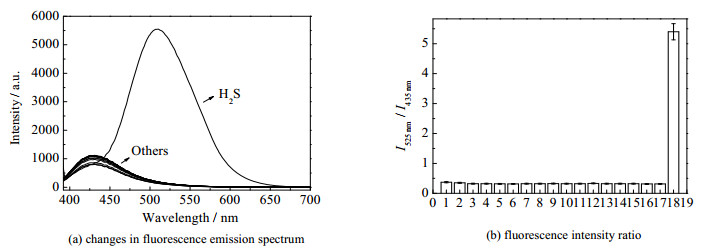
|
图 3 探针QL-N3 (5 μmol·L−1)对不同离子和活性分子(120 μmol·L−1) 的选择性 Fig.3 Selectivity of probe QL-N3 (5 μmol·L−1) to different ions or active molecules (120 μmol·L−1) |
研究探针QL-N3在不同H2S浓度下的荧光性能,向探针浓度为5 μmol·L−1的PBS溶液(浓度为1.0×10−2 mol·L−1,pH 7.4,质量分数40% DMSO)中分别加入浓度为0、20、40、60、80、100、120、140 μmol·L−1的H2S溶液,其荧光发射光谱如图 4所示。随着H2S浓度的增大,探针溶液的在525 nm处荧光强度不断增强,且I525 nm / I435nm在0~120 μmol·L−1呈现良好的线性关系(相关系数R2=0.990 86)。计算得到探针的检测极限为1.8×10−8 mol·L−1。同时,以罗丹明B(荧光量子产量为0.69)作为标准参考物质[25-26],探针在PBS溶液中与H2S反应前后的荧光量子产率分别为0.12和0.48。结果表明,探针QL-N3对H2S检测灵敏度较高。
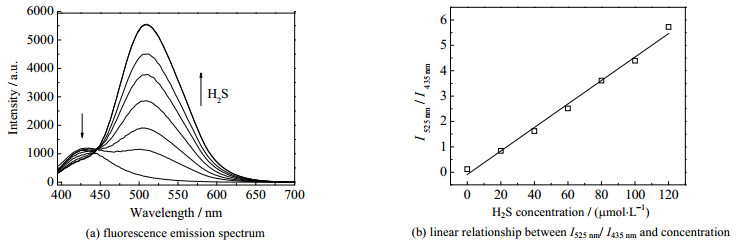
|
图 4 探针QL-N3(5 μmol·L−1)对不同H2S浓度(0~120 μmol·L−1)的荧光响应 Fig.4 Fluorescence response of probe QL-N3 (5 μmol·L−1) to different concentrations of H2S (0-120 μmol·L−1) |
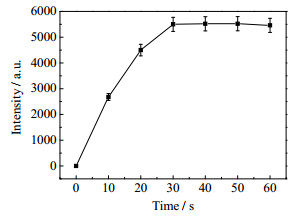
研究探针QL-N3对H2S的荧光响应速度,向探针浓度为5 μmol·L−1的PBS溶液(浓度为1.0×10−2 mol·L−1,pH 7.4,质量分数为40% 的DMSO)中加入浓度为120 μmol·L−1的H2S,检测在不同时间下525 nm处的荧光发射强度变化,如图 5所示。结果表明,探针QL-N3与H2S反应迅速,在30 s内即可完成检测,具有H2S快速响应的特点。
|
图 5 探针QL-N3(5 μmol·L−1)对H2S (120 μmol·L−1)响应时间 Fig.5 Response times of probe QL-N3 (5 μmol·L−1) to H2S (120 μmol·L−1) |
在探针QL-N3用于人宫颈癌细胞(HeLa cell) H2S荧光成像之前,研究探针的细胞毒性。分别选取浓度为0、10、20、50 μmol·L−1的探针溶液与HeLa细胞孵化48 h,采用3-(4,5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐比色法(MTT法),获得HeLa细胞的存活率数据。结果表明,探针QL-N3对HeLa细胞毒性较弱,适合进行细胞内H2S荧光成像。
研究了QL-N3用于HeLa细胞H2S共聚焦荧光成像效果。首先,向HeLa细胞中加入探针QL-N3 (浓度为5 μmol·L−1),孵育10 min后,仅观察到探针本身的蓝色荧光(如图 6(a)所示)。接着,使用PBS缓冲液对上述细胞洗涤3次,最后,加入外源性H2S (60 μmol·L−1)继续孵育10 min,观察到明显的绿色荧光(如图 6(b)所示)。从荧光成像效果来看,荧光探针QL-N3可以有效减少激发光源和光漂白效应引起的干扰,表现出较好的比率型H2S荧光成像特点(如图 6(c)所示)。

|
图 6 探针QL-N3用于HeLa细胞H2S共聚焦荧光成像 Fig.6 Confocal imaging of H2S in HeLa cells using probe QL-N3 |
设计合成了一种新型快速响应的比率型H2S荧光探针QL-N3,具有选择性好、检测灵敏度高(检测极限为1.8×10−8 mol·L−1)、检测速度快(30 s)和生物相容性好等特点。该荧光探针表现出良好的荧光发射比率型特点,有效减少激发光源和光漂白效应引起的成像干扰,为进一步进行生物体内H2S的定量检测及荧光成像提供了有力工具,具有潜在的应用价值。
| [1] |
FARO M L L, FOX B, WHATMORE J L, et al. Hydrogen sulfide and nitric oxide interactions in inflammation[J]. Nitric Oxide-Biology and Chemistry, 2014, 41: 38-47. DOI:10.1016/j.niox.2014.05.014 |
| [2] |
SZABO C. Gasotransmitters in cancer: From pathophysiology to experimental therapy[J]. Nature Reviews Drug Discovery, 2016, 15(3): 185-203. DOI:10.1038/nrd.2015.1 |
| [3] |
SZABO C, PAPAPETROPOULOS A. International union of basic and clinical pharmacology. CⅡ: Pharmacological modulation of H2S levels: H2S donors and H2S biosynthesis inhibitors[J]. Pharmacological Reviews, 2017, 69(4): 497-564. |
| [4] |
MÓDIS K, BOS E M, CALZIA E, et al. Regulation of mitochondrial bioenergetic function by hydrogen sulfide. Part Ⅱ: Pathophysiological and therapeutic aspects[J]. British Journal of Pharmacology, 2014, 171(8): 2123-2146. |
| [5] |
CARFORA A, CAMPOBASSO C P, CASSANDRO P, et al. Fatal inhalation of volcanic gases in three tourists of a geothermal area[J]. Forensic Science International, 2019, 297: 1-7. DOI:10.1016/j.forsciint.2019.01.004 |
| [6] |
MARTINS I, COLACO A, SANTOS R S, et al. Relationship between the occurrence of filamentous bacteria on Bathymodiolus azoricus shell and the physiological and toxicological status of the vent mussel[J]. Journal of Experimental Marine Biology & Ecology, 2011, 376(1): 1-6. |
| [7] |
OLSON K R. The therapeutic potential of hydrogen sulfide: Separating hype from hope[J]. American Journal of Physiology- Regulatory, Integrative and Comparative Physiology, 2011, 301(2): 297-312. DOI:10.1152/ajpregu.00045.2011 |
| [8] |
KOLANOWSKI J L, LIU F, NEW E J. Fluorescent probes for the simultaneous detection of multiple analytes in biology[J]. Chemical Society Reviews, 2018, 47(1): 195-208. DOI:10.1039/C7CS00528H |
| [9] |
LIN V S, CHEN W, XIAN M, et al. Chemical probes for molecular imaging and detection of hydrogen sulfide and reactive sulfur species in biological systems[J]. Chemical Society Reviews, 2015, 44(14): 4596-4618. DOI:10.1039/C4CS00298A |
| [10] |
解畅, 马趁, 贾旭, 等. 一种响应速率匹配的双反应探针用于荧光识别硫化氢[J]. 有机化学, 2019, 39(11): 3277-3282. XIE C, MA C, JIA X, et al. A response rate matching dual-reactable probe for fluorescent recognition of hydrogen sulfide[J]. Chinese Journal of Organic Chemistry, 2019, 39(11): 3277-3282. |
| [11] |
LEE M H, KIM J S, SESSLER J L. Small molecule-based ratiometric fluorescence probes for cations, anions, and biomolecules[J]. Chemical Society Reviews, 2015, 44(13): 4185-4191. DOI:10.1039/C4CS00280F |
| [12] |
BAE S K, HEO C H, CHOI D J, et al. A ratiometric two-photon fluorescent probe reveals reduction in mitochondrial H2S production in Parkinson's disease gene knockout astrocytes[J]. Journal of the American Chemical Society, 2013, 135(26): 9915-9923. DOI:10.1021/ja404004v |
| [13] |
CHEN Y C, ZHU C C, YANG Z H, et al. A ratiometric fluorescent probe for rapid detection of hydrogen sulfide in mitochondria[J]. Angewandte Chemie-International Edition, 2013, 125(6): 1732-1735. |
| [14] |
FENG X, ZHANG T, LIU J T, et al. A new ratiometric fluorescent probe for rapid, sensitive and selective detection of endogenous hydrogen sulfide in mitochondria[J]. Chemical Communications, 2016, 52(15): 3131-3134. DOI:10.1039/C5CC09267A |
| [15] |
WANG X, SUN J, ZHANG W H, et al. A near-infrared ratiometric fluorescent probe for rapid and highly sensitive imaging of endogenous hydrogen sulfide in living cells[J]. Chemical Science, 2013, 4(6): 2551-2556. DOI:10.1039/c3sc50369k |
| [16] |
YU F B, LI P, SONG P, et al. An ICT-based strategy to a colorimetric and ratiometric fluorescence probe for hydrogen sulfide in living cells[J]. Chemical Communications, 2012, 48(23): 2852-2854. DOI:10.1039/c2cc17658k |
| [17] |
ZHAO C C, ZHANG X L, LI K B, et al. Forster resonance energy transfer switchable self-assembled micellar nanoprobe: Ratiometric fluorescent trapping of endogenous H2S generation via fluvastatin-stimulated upregulation[J]. Journal of the American Chemical Society, 2015, 137(26): 8490-8498. DOI:10.1021/jacs.5b03248 |
| [18] |
JI A, FAN Y C, REN W, et al. A sensitive near-infrared fluorescent sensor for mitochondrial hydrogen sulfide[J]. ACS Sensors, 2018, 3(5): 992-997. DOI:10.1021/acssensors.8b00142 |
| [19] |
QI F P, ZHANG Y, WANG B, et al. A fluorescent probe for the dicriminatory detecion of Cys/Hcy, GSH and H2S in living cells and zebrafish[J]. Sensors and Actuators B: Chemical, 2019, 296: 126533. |
| [20] |
QIAO Z, ZHANG H, WANG K W, et al. A highly sensitive and responsive fluorescent probe based on 6-azide-chroman dye for detection and imaging of hydrogen sulfide in cells[J]. Talanta, 2019, 195: 850-856. |
| [21] |
ZHAO Q, YIN C X, KANG J, et al. A viscosity sensitive azide-pyridine BODIPY-based fluorescent dye for imaging of hydrogen sulfide in living cells[J]. Dyes and Pigments, 2018, 159: 166-172. |
| [22] |
DOU Y, GU X, YING S, et al. A novel lysosome-targeted fluorogenic probe based on 5-triazole-quinoline for the rapid detection of hydrogen sulfide in living cells[J]. Organic & Biomolecular Chemistry, 2018, 16(5): 712-716. |
| [23] |
DU K, NIU S, QIAO L, et al. A highly selective ratiometric fluorescent probe for the cascade detection of Zn2+ and H2PO4- and its application in living cell imaging[J]. RSC Advances, 2017, 7(64): 40615-40620. |
| [24] |
DU K, NIU S, CHEN X, et al. A novel highly selective ratiometric fluorescent sensor for relay recognition of Zn2+ and H2PO4-[J]. Tetrahedron Letters, 2018, 59(4): 356-360. |
| [25] |
BAI X L, XU S Y, WANG L Y. Full-range pH stable Au-clusters in nanogel for confinement-enhanced emission and improved sulfide sensing in living cells[J]. Analytical Chemistry, 2018, 90(5): 3270-3275. |
| [26] |
ZHU X Y, WU H, GUO X F, et al. Novel BODIPY-based fluorescent probes with large Stokes shift for imaging hydrogen sulfide[J]. Dyes and Pigments, 2019, 165: 400-407. |




