2. 矿产资源化学四川省高校重点实验室,四川 成都 610059
2. Mineral Resources Chemistry Key Laboratory of Sichuan Higher Education Institutions, Chengdu 610059, China
我国的地下卤水资源丰富,其中四川盆地是一个巨型自流盆地,产层众多,地下卤水的总储量达6万亿m3,含有丰富的钾锶资源[1]。其中位于四川龙门山山前的平落坝,其富锶富钾地下卤水就是含矿质元素最丰厚的卤水之一[2],该富钾卤水的深度为4 600多米,平均矿化度为377.27 g·L-1,其中K+的质量浓度达到53.27 g·L-1,且溶液中还富含Br-、I-、Li+和Rb+等许多具有高利用价值的组分,这些元素的浓度都达到甚至超过了工业指标,适合综合开发利用。而位于四川盆地龙女寺的深层地下卤水中Sr2+的质量浓度达到3.08 g·L-1,同时富含钾溴锂等资源,其中Br-的质量浓度达到1.9 g·L-1,是重要的液态矿产资源[3-4]。我国的固态钾矿较少,依靠进口才能满足本国需要,而四川盆地地下卤水中富含高品位的液态钾,钾的平均质量浓度为18.86 g·L-1,部分达到25~53 g·L-1 [5]。锶是人体中必不可少的一种微量元素,且由于锶的独特化学性能,锶的应用非常广泛[6]。可见四川盆地的富锶钾溴卤水品质上乘,具有极高的开发利用价值。
对于含钾或锶水盐体系的相平衡研究,国内外学者做出了很多的贡献。早在20世纪50年代,瑞典的Assarsson等[7-10]开展了一系列含锶水盐体系的相平衡研究,其研究的体系均为含氯化锶体系,具体为Na+,K+,Ca2+,Mg2+,Sr2+//Cl-–H2O体系的部分子体系。近年我国学者也对其进行不同温度的相平衡研究,如对温度为298 K下三元体系K+,Sr2+//Cl-–H2O [11],Li+,Sr2+//Cl-–H2O [12]和Ca2+,Sr2+//Cl-–H2O [13]以及288、298、348 K下三元体系Na+,Sr2+//Cl-–H2O [14-16]溶解度数据的研究。尤其是川西富钾溴锶卤水,为了实现对四川盆地地下卤水的开采利用,课题组前期也对含锶体系开展了有关多温相平衡研究工作,完成了三元体系Mg2+,Sr2+//Cl-–H2O [17]、K+,Sr2+//Br-–H2O [18]、Na+,Sr2+//Br-–H2O [18]和四元体系Na+,K+,Sr2+//Cl-–H2O [19-20]、Na+,K+,Sr2+//Br-–H2O [18, 21]在323和348 K的相平衡研究。此外,孟令宗等[22]还开展了288 K下三元体系K+,Sr2+//Br-–H2O和Na+,Sr2+//Br-–H2O的相平衡研究。本文研究的四元体系Na+,K+,Sr2+//Br-–H2O为川西盆地富硼钾卤水子体系,且在温度308 K下的相平衡研究未见报道,所需的三元子体系共饱点数据,作者前期已经完成,故在此基础上开展了308 K下四元体系Na+,K+,Sr2+//Br-–H2O的相平衡研究,为卤水资源的开发提供基础相平衡数据。
2 实验部分 2.1 实验试剂与实验仪器实验试剂:实验过程中用到的试剂NaBr和KBr都是源自成都市科龙化工试剂厂,纯度:质量分数≥99.0%;试剂SrBr2·6H2O源自上海阿拉丁生化科技股份有限公司,纯度:质量分数≥99.0%,且它们都是分析纯试剂。配制样品料液和实验过程分析所用到的水均为去离子水,其pH约为6.6、电导率 < 1×10-5 S·m-1,并在使用前先煮沸去除CO2。
实验仪器:电子天平(AL104型,美国Mettler-Toledo公司,精度值0.000 1 g);超纯水机(UPT-II-20T,四川优普超纯科技有限公司);电热鼓风干燥箱(101-0AB型,北京中兴伟业仪器有限公司);恒温水浴振荡器(HZS-H型,哈尔滨东联电子技术有限公司,精度值± 0.1 ℃);X-ray粉末衍射仪(XRD)(DX-2700,丹东方圆仪器有限公司)。
2.2 实验方法本文采用等温溶解平衡法研究四元体系Na+,K+,Sr2+//Br-–H2O的溶解度数据,首先准备些许容量为50 mL的磨砂口的玻璃瓶,然后根据已经研究出的3个三元体系共饱点的溶解度数据和每个单盐的溶解度数据,从各个三元共饱点处开始逐步加入另一种新盐,将混合盐分别放置于50 mL玻璃瓶内,再分别向其中加入适量的去离子水,密封后置于恒温水浴振荡器中(处于震荡状态),温度控制在(308 ± 0.1) K,进行等温溶解平衡,一段时间后,定期用移液枪快速取其上层清液到100 mL容量瓶中,称重并记录质量,然后进行化学分析,直至各化学组分含量保持不变时为达到平衡的标准。平衡后对上层清液进行化学分析,然后用药勺取适量平衡湿固相做化学分析,在此基础上平衡固相用X-射线粉末衍射仪(XRD)进行鉴定。
2.3 分析方法[23]K+:四苯硼钠-季胺盐返滴定法(STPB法,相对误差 < 0.005);Sr2+:EDTA络合滴定法测定(相对误差 < 0.005);Br-:银量法测定(相对误差 < 0.003);Na+:差减法(相对误差 < 0.005)。平衡固相分析方法:采用化学分析并辅以X-射线粉末衍射仪进行鉴定(扫描方式为步进扫描,扫描角度为10°~80°,扫描速度为10°·min-1,步长0.05°·step-1,扫描时间管电压40 kV,管电流30 mA)。
3 结果与讨论 3.1 实验结果在经过对温度308 K下四元体系Na+,K+,Sr2+//Br-–H2O液相的化学分析后,得到其平衡液相的溶解度数据,用质量分数wB表示,并由此以m(NaBr) + m(KBr) + m(SrBr2) = 100 g(m为质量)为基准计算相应的耶涅克干盐指数J(Jänecke index),即各单盐占总干盐的质量比,还计算了相应的水指数JA,即水占总干盐的质量比,数据如表 1所示。在此基础上绘制了该四元体系在308 K时的等温溶解度图和相应的水图(如图 1和2所示)。
|
|
表 1 四元体系Na+,K+,Sr2+//Br−–H2O在308 K时溶解度数据 Table 1 Solubilities of salts in the Na+, K+, Sr2+//Br−–H2O quaternary system at 308 K |
|
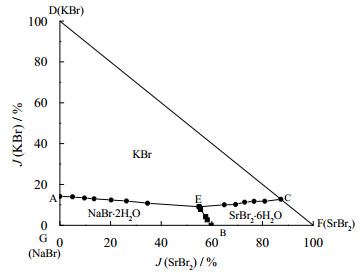
图 1 四元体系Na+,K+,Sr2+//Br−–H2O 308 K时相图 Fig.1 Phase diagram of the Na+, K+, Sr2+//Br−–H2O quaternary system at 308 K |
|
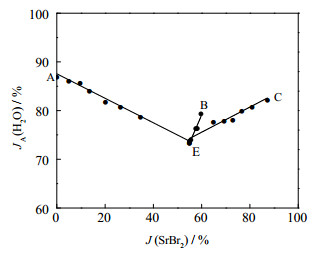
图 2 四元体系Na+,K+,Sr2+//Br−–H2O 308 K时水含量图 Fig.2 Water contents of saturated solutions in the Na+, K+, Sr2+//Br−–H2O quaternary system at 308 K |
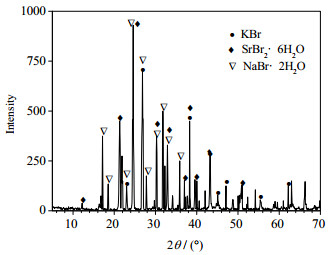
从表 1和图 1的结果看,在308 K时四元体系Na+,K+,Sr2+//Br-–H2O是一个简单的共饱和类型,体系中没有形成固溶体和复盐,其相图有一个共饱点E,此时的平衡液相组成以质量分数表示为w(NaBr)=20.70%,w(KBr)=5.22%,w(SrBr2)=31.67%,对应的平衡固相分别为KBr、NaBr·2H2O和SrBr2·6H2O,并对该共饱点的平衡固相做了鉴定,其X-射线粉末衍射图见图 3,图中特征峰的位置和标准卡片上的峰相对应;相图还包含3条溶解度曲线AE、BE和CE(其中AE是NaBr和KBr的共饱和溶解度曲线,BE是SrBr2·6H2O和NaBr的共饱和溶解度曲线,CE是KBr和SrBr2·6H2O的共饱和溶解度曲线)。以及3个平衡固相结晶区AECD、AEBG和CEBF,分别对应平衡固相KBr、NaBr·2H2O和SrBr2·6H2O。其中平衡固相结晶区AECD最大,表明KBr溶解度最小,易从饱和溶液中结晶析出而实现分离。由相图可知,溴化钠和溴化钾共饱和情况下加入六水溴化锶,随着六水溴化锶增多,液相中溴化钠和溴化钾的浓度都一直在减小,这说明溴化锶对溴化钠和溴化钾有明显的盐析作用。相图中液相组成点A、B和C分别是四元体系Na+,K+,Sr2+//Br-–H2O三个子体系的共饱点,其中A为Na+,K+//Br-–H2O的共饱点,其平衡液相组成以质量分数表示为w(NaBr)=45.91%,w(KBr)=7.56%,对应的平衡固相为NaBr·2H2O + KBr;B为Na+,Sr2+//Br-–H2O的共饱点,其平衡液相组成以质量分数表示w(NaBr)=22.45%,w(SrBr2)=33.32%,对应的平衡固相为NaBr·2H2O + SrBr2·6H2O;C为K+,Sr2+//Br-–H2O的共饱点,其平衡液相组成以质量分数表示w(KBr)=6.99%,w(SrBr2)=47.85%,对应的平衡固相为SrBr2·6H2O + KBr。
|
图 3 308 K时四元体系Na+,K+,Sr2+//Br−–H2O共饱点E处X-射线粉末衍射图 Fig.3 X-ray diffraction pattern of the invariant point E in the Na+, K+, Sr2+//Br−–H2O quaternary system at 308 K |
本文根据质量分数计算出耶涅克干盐指数J,以J(SrBr2)为横坐标,JA(H2O)为纵坐标,绘制了308 K下该四元体系的水图 2,图 2反映了3条溶解度曲线上饱和溶液的水含量JA(H2O)随J(SrBr2)的变化规律。在等温溶解度曲线AE上,饱和溶液中水含量JA(H2O)随J(SrBr2)的增大而减小,在等温溶解度曲线CE上,饱和溶液中水含量JA(H2O)随J(SrBr2)的增大而增大,而在溶解度曲线BE上,饱和溶液中水含量JA(H2O)随J(SrBr2)的增大变化不明显。因此,混合溶液中水含量值在E点达到最小值(JA(H2O)=73.65%),说明溶液的总盐浓度在E点达到最大值。
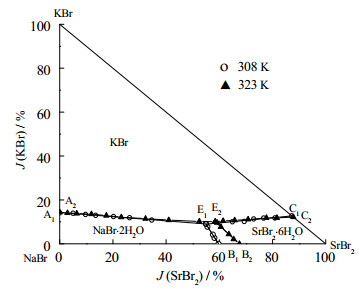
3.2 实验讨论在四元体系Na+,K+,Sr2+//Br-–H2O 308 K固液相平衡研究基础上,该体系与之前曾经报道的323 K[18]和348 K[21]时共饱点的溶解度数据进行比较。该体系在各温度共饱点处的平衡液相组成和平衡固相列于表 2,由表 2可知该四元体系Na+,K+,Sr2+//Br-–H2O在3个温度下均为简单共饱体系,只有一个共饱点,且没有形成复盐和固溶体。当温度为308和323 K时共饱点处的平衡固相均为KBr、NaBr·2H2O和SrBr2·6H2O,而在348 K时为KBr、NaBr和SrBr2·6H2O,说明随着温度的升高,平衡固相NaBr·2H2O会脱水转化为无水NaBr。3个温度下SrBr2的液相组成均随温度的升高而增大,NaBr的液相组成均随温度的升高而减小。由于平衡固相不同,故只对该四元体系Na+,K+,Sr2+//Br-–H2O在308和323 K的相图进行比较,结果如图 4所示,发现温度由308升到323 K时,KBr的结晶区没有明显变化,NaBr·2H2O的结晶区变大,SrBr2·6H2O的结晶区变小,相对于KBr、NaBr·2H2O和SrBr2·6H2O的结晶区对温度变化较为明显些。
|
|
表 2 四元体系Na+,K+,Sr2+//Br−–H2O在308、323和348 K下的共饱点溶解度数据对比 Table 2 Comparison of solubility at invariant points of the Na+, K+, Sr2+//Br−–H2O quaternary system at 308, 323 and 348 K |
|
图 4 308 K和323 K温度下四元体系Na+,K+,Sr2+//Br−–H2O平衡相图的对比 Fig.4 Comparison of equilibrium phase diagrams of the Na+, K+, Sr2+//Br−–H2O quaternary system at 308 and 323 K [18] |
(1) 采用等温溶解平衡法在308 K条件下对四元体系Na+,K+,Sr2+//Br-–H2O的稳定相平衡关系开展研究,测定了相应的溶解度数据,鉴定了平衡固相并根据实验结果绘制了相应的相图和水图。
(2) 该四元体系在308 K时为简单共饱和体系,没有形成复盐及固溶体,相图由一个共饱点,3条单变量曲线和3个固相结晶区构成。共饱点处液相组成为w(NaBr)=20.70%,w(KBr)=5.22%,w(SrBr2)=31.67%,对应的平衡固相为SrBr2·6H2O、NaBr·2H2O和KBr。
(3) 由相图可知KBr的固相结晶区面积最大,因此KBr的溶解度最小,易从饱和溶液中结晶析出而实现分离。从水图中可以发现,溶液的总盐浓度在共饱点处达到最大值。
(4) 通过对该体系多温相平衡研究结果对比发现,该体系均为简单共饱体系,308和323 K时共饱点处的平衡固相都同为NaBr·2H2O + KBr + SrBr2·6H2O,而348 K时平衡固相为NaBr + KBr + SrBr2·6H2O。
| [1] |
纪律, 刘呈君, 郑宁, 等. 四川盆地地下富钾、硼、溴卤水加工工艺研究[J]. 矿业快报, 2003, 19(10): 16-18. JI L, LIU C J, ZHENG N, et al. The processing research on the underground potassium, boron and bromine bittern of the Sichuan Basin[J]. Express Information of Mining Industry, 2003, 19(10): 16-18. |
| [2] |
林耀庭, 潘尊仁. 四川盆地气田卤水浓度分布及成因分类研究[J]. 盐湖研究, 2001, 9(3): 1-7. LIN Y T, PAN Z R. Study on density and torming dassification of gas field brine[J]. Journal of Salt Lake Research, 2001, 9(3): 1-7. |
| [3] |
周训. 四川盆地龙女寺储卤构造深层地下卤水的水文地球化学特征及成因[J]. 现代地质, 1993, 7(1): 83-92. ZHOU X. Hydrogeochemical characteristics and formation of subsurface brines of deep aquifers in longnu temple brine-bearing structure, Sichuan Basin[J]. Geoscience, 1993, 7(1): 83-92. |
| [4] |
林耀庭, 陈绍兰. 四川盆地地下卤水勘探开发前景展望[J]. 盐湖研究, 2008, 16(4): 1-7. LIN Y T, CHEN S L. Exploration and development prospect of underground brine in Sichuan Basin[J]. Journal of Salt Lake Research, 2008, 16(4): 1-7. |
| [5] |
林耀庭. 四川盆地卤水钾资源分布类型及其品质的研究[J]. 化工矿产地质, 2002, 24(4): 216-217. LIN Y T. Distribution types of characters of potassium Bearing brine resources in Sichuan Basin[J]. Geology of Chemical Minerals, 2002, 24(4): 216-217. |
| [6] |
高延林. 锶的利用与开发[M]. 西宁: 青海人民出版社, 1995. GAO Y L. Utilization and development of strontium[M]. Xining: Qinghai People's Publishing House, 1995. |
| [7] |
ASSARSSON G O. Equilibria in aqueous systems containing Na+, K+, Sr2+ and Cl-[J]. The Journal of Physical Chemistry, 1953, 57(7): 207-210. |
| [8] |
ASSARSSON G O, BALDER A. Equilibria between 18 and 100 ℃ in the aqueous systems containing Sr2+, Mg2+ and Cl-[J]. The Journal of Physical Chemistry, 1954, 58(5): 416. |
| [9] |
ASSARSSON G O, BALDER A. Equilibria in aqueous systems containing Ca2+, Sr2+, K+, Na+ and Cl- between 18 and 114 ℃[J]. The Journal of Physical Chemistry, 1954, 58(3): 253-255. |
| [10] |
ASSARSSON G O, BALDER A. The poly-component aqueous systems containing the chlorides of Ca2+, Mg2+, Sr2+, K+ and Na+ between 18 and 93 ℃[J]. The Journal of Physical Chemistry, 1955, 59(7): 631-633. |
| [11] |
时历杰, 孙柏, 丁秀萍, 等. 三元体系KCl–SrCl2–H2O 25℃相平衡研究[J]. 无机化学学报, 2010, 26(2): 333-338. SHI L J, SUN B, DING X P, et al. Phase equilibria in ternary system KCl–SrCl2–H2O at 25 ℃[J]. Chinese Journal of Inorganic Chemistry, 2010, 26(2): 333-338. |
| [12] |
GUO L J, SUN B, ZENG D W, et al. Isopiestic measurement and solubility evaluation of the ternary system LiCl-SrCl2-H2O at 298.15 K[J]. Journal of Chemical and Engineering Data, 2012, 57(3): 817-827. |
| [13] |
毕玉敬, 孙柏, 赵静, 等. 25 ℃时三元体系SrCl2–CaCl2–H2O相平衡研究[J]. 无机化学学报, 2011, 27(9): 1765-1771. BI Y J, SUN B, ZHAO J, et al. Phase equilibrium in ternary system SrCl2–CaCl2–H2O at 25 ℃[J]. Chinese Journal of Inorganic Chemistry, 2011, 27(9): 1765-1771. |
| [14] |
LI D C, FAN R, YANG S N, et al. Solid-liquid equilibria in the ternary systems (NaCl+SrCl2+H2O) and (KCl+SrCl2+H2O) at 288.15 K and 0.1 MPa[J]. Chemical Research in Chinese Universities, 2018, 34(5): 803-807. |
| [15] |
丁秀萍, 孙柏, 时历杰, 等. 氯化钠-氯化锶-水三元体系25 ℃相平衡研究[J]. 无机盐工业, 2010, 42(6): 9-10. DING X P, SUN B, SHI L J, et al. Study on phase equilibria in NaCl-SrCl2-H2O ternary system at 25 ℃[J]. Inorganic Chemicals Industry, 2010, 42(6): 9-10. |
| [16] |
LI D W, SANG S H, CUI R Z. Solid-liquid equilibria in the ternary systems NaCl-SrCl2-H2O and KCl-SrCl2-H2O at 348 K[J]. Journal of Chemical and Engineering Data, 2015, 60(5): 1227-1232. |
| [17] |
李大伟, 桑世华, 崔瑞芝, 等. 三元体系MgCl2–SrCl2–H2O 323 K及348 K相平衡[J]. 四川大学学报(自然科学版), 2015, 52(3): 638-644. LI D W, SANG S H, CUI R Z, et al. Phase equilibria in the ternary system MgCl2–SrCl2–H2O at 323 K and 348 K[J]. Journal of Sichuan University (Natural Science Edition), 2015, 52(3): 638-644. |
| [18] |
CUI R Z, NIE G L, SANG S H. Measurements of (solid + liquid) phase equilibria in the quaternary system NaBr-KBr-SrBr2-H2O and two subsystems NaBr-SrBr2-H2O and KBr-SrBr2-H2O at 323 K[J]. Journal of Chemical and Engineering Data, 2017, 62(10): 3187-3192. |
| [19] |
ZHANG X, SANG S H, ZHONG S Y, et al. Equilibria in the ternary system SrCl2-KCl-H2O and the quaternary system SrCl2-KCl-NaCl-H2O at 323 K[J]. Russian Journal of Physical Chemistry, 2015, 89(12): 2322-2326. |
| [20] |
李大伟. Na+, K+, Mg2+, Sr2+//Cl-–H2O及子体系348 K相平衡研究[D].成都: 成都理工大学, 2015. LI D W. Solid-liquid equilibria in the quinary system Na+, K+, Mg2+, Sr2+//Cl-–H2O at 348 K /[D]. Chengdu: Chengdu University of Technology, 2015. |
| [21] |
HU J X, SANG S H, ZHANG T T, et al. Solid-liquid equilibria in the systems CaBr2-MgBr2-H2O and NaBr-KBr-SrBr2 at 348 K[J]. Journal of Chemical and Engineering Data, 2015, 60(11): 993-998. |
| [22] |
LI D, MENG L Z, DENG T L. Experimental and thermodynamic modeling study of solid-liquid equilibrium in ternary systems NaBr-SrBr2-H2O and KBr-SrBr2-H2O at 288.15 K and 0.1 MPa[J]. Journal of Molecular Liquids, 2018, 252: 362-367. |
| [23] |
中国科学院青海盐湖研究所. 卤水和盐的分析方法[M]. 北京: 科学技术出版社, 1984. Qinghai Institute of Salt Lakes, Chinese Academy of Sciences. Analysis method of brine and salt[M]. Beijing: Science and Technology Press, 1984. |




