2. 天津大学 化工学院, 天津 300072
2. School of Chemical Engineering and Technology, Tianjin University, Nankai distict, Tianjin 300072, China
乙酸仲丁酯(SBAC)属于乙酸丁酯的四种同分异构体之一,为无色,易燃,带有水果香味的液体,并且可以溶解多种树脂和有机物。乙酸仲丁酯广泛应用于医药、涂料、油墨、胶黏剂、固化剂、清洗剂、稀释剂、树脂生产和乙酸脱水等行业中[1]。此外醋酸仲丁酯还具有较高的辛烷值,可以作为汽油添加剂。N,N—二甲基甲酰胺(N,N-Dimethylformamide,简称DMF)是一种高沸点、强极性、非质子化有机溶剂,具有溶解能力强、稳定性好、不易挥发、不易水解、腐蚀性低等特点,可广泛用于石油加工和有机合成领域[2, 3]。乙腈在化工和制药中广泛地作为溶剂或者重要的化学品,在色谱分离和分析中也常常作为流动相而被广泛使用。并且在C4分离中也常常作为萃取剂而被广泛的运用[4]。
本文测定了在101.3 kPa下醋酸仲丁酯—N,N-二甲基甲酰胺、醋酸仲丁酯—乙腈二元体系的汽液平衡数据,文献[5]虽然在101.3 kPa下对仲丁醇—醋酸仲丁酯—N,N二甲基甲酰胺的三元汽液平衡进行测定,而对于醋酸仲丁酯—N,N二甲基甲酰胺、醋酸仲丁酯—乙腈二元体系的汽液平衡并未报道。本论文的汽液平衡数据通过了热力学一致性检验,并用NRTL[6],UNIQUAC[7],Wilson[8]进行关联,从而验证了汽液平衡数据,进而为醋酸仲丁酯—N,N-二甲基甲酰胺、醋酸仲丁酯—乙腈二元体系的精馏分离提供了依据。
2 实验部分 2.1 实验试剂实验试剂为醋酸仲丁酯、N,N—二甲基甲酰胺和乙腈。所有试剂的来源、分子式、纯度等如表 1。试剂的纯度用气相色谱仪进行检测,试剂密度用比重瓶进行测定。
| 表 1 试剂来源、纯度、性质 Table 1 Chemicals used in the study and their physical properties |
汽相与液相组成采用浙江福立9790型汽相色谱仪分析,分析条件如下:使用热导检测器和N型多孔性聚合微球填充柱(0.3 mmx2 m,杭州科晓化学仪器公司,中国)采用40 mL⋅min-1氢气作为载气,进样口不分流。进样口和检测器的温度为393.15 K,柱箱温度为343.15 K。采用重量分析法作标准曲线并进行数据校正。
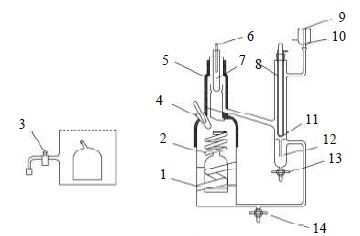
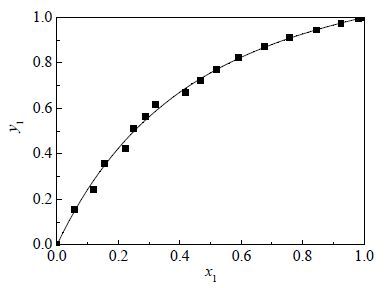
2.3 实验装置该体系的汽液平衡数据采用改进的 Ellis平衡釜[10, 11]测定,在此汽液平衡釜(图 1)中,汽液两相能够直接接触,从而保证汽液平衡的快速建立。在测得的每一组数据中,当温度计稳定并保持至少30 min不变时则汽相与液相已达到平衡。平衡温度由已校正的精密水银温度计测定,精密温度为0.01 K,通过带有2个缓冲瓶的压力控制装置将压力控制在101.3 kPa,采用数显真空测压仪testo-511进行测定。通过测定乙醇-叔丁醇体系的汽液平衡数据并与文献值[12]进行比较,实验结果如表 2和图 2,可见数据与文献值一致,验证了该装置的可靠性。
|
图 1 Ellis 汽液平衡釜 Fig.1 Schematic diagram of the Ellis still 1. heater 2. tube delivering mixture 3. liquid phase sampling valve 4. equilibrium temperature thermometer 5. heater for overheating vapor stream 6. vapor temperature thermometer 7. separator for liquid and vapor phases 8. vapor condenser 9. cooler 10. to pressure-stabilising system 11. flow meter (drop counter) 12. vapor condensate container 13. vapor condensate sampling valve 14. valve for drainage of still |
|
图 2 乙醇—叔丁醇的x1-y1曲线图 Fig.2 The x1-y1 diagram of ethanol(1)–isobutanol (2) at 101.3 kPa ■ experimental data - literature data[12] |
| 表 2 乙醇-叔丁醇的汽液平衡数据 Table 2 Isobaric VLE data of the ethanol (1) + isobutanol (2) binary system at 101.3 kPaa |
纯物质的饱和蒸汽压用改进的安托尼方程进行计算(公式1),其安托尼参数从ASPEN V8.0 中获得,其数于表 3。
| $\ln {P_i}^s = A + \frac{B}{T} + E\ln T + F{T^G}$ | (1) |
| 表 3 纯物质的安托尼系数 Table 3 Antoine constants of pure substancesa |
二元体系的汽液平衡数据与相应的活度系数如表 4表 5,该体系的汽相与液相[13]的平衡关系可用一下方程表示:
| $P{y_i}\phi _i^{\rm{V}} = P_i^{\rm{s}}{x_i}{\gamma _i}\phi _i^{\rm{s}}\exp \left( {\frac{{V_i^{\rm{L}}\left( {P - P_i^{\rm{s}}} \right)}}{{RT}}} \right)$ | (2) |
| 表 4 在101.3 kPa下醋酸仲丁酯—N,N二甲基甲酰胺的气液平衡数据与活度系数 Table 4 Experimental VLE data and acitivity confficients of the sec-butyl acetate- N,N-dimethylformamid binary system at 101.3 kPaa |
| 表 5 在101.3 kPa下 醋酸仲丁酯—乙腈的汽液平衡数据与活度系数 Table 5 Experimental VLE data and acitivity confficients of the sec-butyl acetate- acetonitrile binary system at 101.3 kPaa |
方程(2)中的指数在低压下,汽相假设为理想气体且液相由于逸度所产生的压力不计则方程(2)可简化为以下公式并计算活度系数(γi)。P和T分别表示达到平衡时的压力和温度;为纯组分的饱和蒸汽压(由安托尼方程所得);yi为汽相的摩尔分数,xi为液相的摩尔分数。所有的二元体系的实验数据与理想的相比都显示出正偏差。表 4表 5列出了醋酸仲丁酯—N,N-二甲基甲酰胺与醋酸仲丁酯—乙腈二元体系的汽液平衡数据与活度系数。
| ${\gamma _i} = \frac{{{y_i}P}}{{{x_i}P_{\rm{i}}^{\rm{s}}}}$ | (3) |
为了验证该汽液平衡数据的真实性,利用Herington[14]热力学一致性检验,该验证可以用以下公式来验证。
Tmax、Tmin 为最大泡点值与最小泡点值温度,γ1为在温度T下关联的活度系数。Herington方法介绍如果(D-J)<10,那么该实验所测得点就符合热力学的一致性检验。检验的结果在表 6,其结果符合热力学一致性检验。
| $D = 100 \times \frac{{\left| {\int_0^1 {{\rm{ln}}({\gamma _1}/{\gamma _2})d{x_1}} } \right|}}{{\int_0^1 {\left| {{\rm{ln}}({\gamma _1}/{\gamma _2})} \right|} d{x_1}}}$ | (4) |
| $J = 150 \times \frac{{{T_{{\rm{max}}}} - {T_{{\rm{min}}}}}}{{{T_{\min }}}}$ | (5) |
| 表 6 汽液平衡数据热力学一致性检验 Table 6 Thermodynamic consistency test results of the VLE data |
根据活度系数法,使用Aspen PlusV8.0中Wilson、NRTL和UNIQUAC活度系数模型对两组二元体系汽液平衡实验数据进行关联[15, 16],aij,bij列于表 7中。
| 表 7 二元系统在101.3 kPa下关于Wilson,NRTL和UNIQUAC模型方程的相关参数与均方根偏差 Table 7 Correlation parameters and root mean square deviations(RMSD) of Wilson,NRTL and UNIQUAC models for the binary system at 101.3 kPa |
醋酸仲丁酯-N,N-二甲基甲酰胺、醋酸仲丁酯-乙腈二元体系的数据通过Aspen V8.0中的NRTL,Wilson,UNIQAC活度系数模型进行回归。通过优化物理参数和建立适合的模型,使最大目标函数的值最小。最大目标函数的公式[17]:
| $Q = \sum\limits_{i = 1}^n {\left( {{{\left( {\frac{{T_I^{\exp } - T_i^{est}}}{{{\sigma _T}}}} \right)}^2} + {{\left( {\frac{{p_i^{\exp } - p_i^{est}}}{{{\sigma _p}}}} \right)}^2} + {{\left( {\frac{{x_i^{\exp } - x_i^{est}}}{{{\sigma _x}}}} \right)}^2} + {{\left( {\frac{{y_i^{\exp } - y_i^{est}}}{{{\sigma _y}}}} \right)}^2}} \right)} $ | (6) |
n表示实验所测的点数,T、P、x、y分别表示平衡的温度、压力、液相的摩尔分数和汽相的摩尔分数。exp、est分别表示实验值和回归值。用Wilson,NRTL和UNIQUAC活度系数模型回归的数值如下表。同时温度和汽相组成的相对误差与绝对误差也在表中列出。
4 结 论采用改进Ellis汽液平衡釜测定了醋酸仲丁酯—N,N-二甲基甲酰胺,醋酸仲丁酯—乙腈在101.3 kPa下的汽液平衡数据,实验数据的热力学一致性行通过了Herington半经验公式的验证,并且利用Wilson、NRTL和UNIQUAC活度系数模型对于数据进行关联。模型的相互作用参数通过最大似然法获得,体系温度与气液组成的均方根偏差(RMSD)显示了各个模型对于实验结果的关联度,尤其是NRTL模型对于该两组体系关联度最好。该数据可以作为精馏设计的可靠依据。
符号说明:
| 表 Table |
| [1] | LI Ling(李玲), GUO Chuan(郭川), WU Yan-xiang(吴燕翔) . Liquid-liquid equilibrium of the water+sec-butyl alcohol+sec-butyl acetate ternary system(水-仲丁醇-乙酸仲丁酯三元体系的液液相平衡研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27 (2) : 183-186 |
| [2] | ZHOU Ya-ting (周亚婷). Process optimization of preparing N,N-dimethylacetamid via reaction distillation (反应精馏法合成高纯度N,N-二甲基乙酰胺的研究) [D]. Shaihai (上海):East China University of Science and Technology (华东理工大学), 2013. http://cdmd.cnki.com.cn/article/cdmd-10251-1013210283.htm |
| [3] | ZENG Hong(曾红), YAO Shun(姚舜), LIU Qi-song(刘其松) . Isobaric vapor-liquid equilibria of acetonitrile-propan-1-ol-N, N-dimethyl formamide systems(乙腈-正丙醇-N,N-二甲基甲酰胺体系的等压汽液平衡)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2011, 25 (3) : 365-369 |
| [4] | WANG Zhuo-duan(王卓端), ZHU Tang-feng(朱堂峰), QIAN Guo-fei(钱国飞) . Study on isobaric vapor-liquid equilibria of acetonitrile 1-propanol 3-methyl-1-butanol systems(乙腈-1-丙醇-3-甲基丁醇体系的等压汽液平衡的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28 (2) : 407-411 |
| [5] | Zhang X M, Liu Y X, He J . Isobaric vapor-liquid equilibrium for ternary system of sec-butyl alcohol+sec-butyl acetate+N,N-dimethyl acetamid at 101.3 kPa[J]. Fluid Phase Equilibrium , 2015, 394 : 83-87 DOI:10.1016/j.fluid.2015.03.013 |
| [6] | Renon H, Prausnitz J M . Local composition in thermodynamic excess functions for liquid mixtures[J]. AIChE Journal , 1968, 14 (1) : 135-144 DOI:10.1002/(ISSN)1547-5905 |
| [7] | Abrams D S, Prausnitz J M . Statistical thermodynamics of liquid mixtures:a new expression for the excess gibbs energy of partly or completely miscible systems[J]. AIChE Journal , 1975, 21 (1) : 116-128 DOI:10.1002/(ISSN)1547-5905 |
| [8] | Wilson G M. Vapor-liquid equilibrium XI. A new expression for the excess free energy of mixing[J]. Journal of the American Chemical Society, 1964, 86(2):127-130. |
| [9] | CHENG Neng-lin(程能林), HU Sheng-wen(胡声闻) . A handbook of solvent(溶剂手册)[M]. Beijing(北京): Chemical Industry Press(化学工业出版社), 2006 . |
| [10] | Luo M J, Ma P S, Xia S Q . A modification of α in SRK equation of state and vapor-liquid equilibria prediction[J]. Chinese Journal of Chemical Engineering , 2007, 15 (1) : 102-109 DOI:10.1016/S1004-9541(07)60041-X |
| [11] | Huang X J, Xia S Q, Ma P S . Vapor-liquid equilibrium of N-formylmorpholine with toluene and xylene at 101.33 kPa[J]. Journal of Chemical & Engineering Data , 2007, 53 (1) : 252-255 |
| [12] | Resa J M, González C, Goenaga J M . Density refractive index and speed of sound at 298.15 K and vapor-liquid equilibria at 101.3 kPa for binary mixtures of ethyl acetate+1-pentanol and ethanol+2-methyl-1-propanol[J]. Journal of Chemical & Engineering Data , 2004, 49 (4) : 804-808 |
| [13] | Smith J M, Van N H C, Abbott M M . Introduction to chemical engineering thermodynamics[M]. New York: McGraw-Hill, 2001 . |
| [14] | Herington E . A method for testing thermodynamic consistency[J]. Journal of Institute of Chemists , 1951, 37 : 457-459 |
| [15] | Wang S J, David S H, Yu S . Effect of entrainer loss on plant-wide design and control of an isopropanol dehydration process[J]. Industrial & Engineering Chemistry Research , 2008, 47 (17) : 6672-6684 |
| [16] | Burger J, Strofer E, Hasse H . Chemical equilibrium and reaction kinetics of the heterogeneously catalyzed formation of poly (oxymethylene) dimethyl ethers from methylal and trioxane[J]. Industrial & Engineering Chemistry Research , 2012, 51 (39) : 12751-12761 |
| [17] | SONG Yu-he(宋玉鹤), LI Qing-song(李青松) . The vapor-liquid equilibrium of formaldehyde-Methylal-polyoxymethylene dimethyl ether system(甲醛-甲缩醛-聚甲醛二甲基醚体系气液平衡)[J]. Chemical Engineering(化学工程) , 2015, 43 (2) : 30-34 |




