由芳烃硝化物还原制芳胺及其衍生物是重要的有机合成过程,具有极大的工业应用价值[1]。目前,还原芳烃硝化物的方法主要包括催化加氢[2, 3]、铁粉还原[4]以及电化学还原[5]等。然而,催化加氢法反应体系复杂且装置投资高;铁粉还原法产物分离困难,特别是会产生大量的废渣污染环境;电化学还原法存在着能耗高、电极腐蚀快、电极植被复杂等问题,以上这些不足极大地限制了还原反应的工业应用。近年来,研究人员倾向于采用更环保、更安全的操作路线催化还原硝基化合物,硼氢化钠作为一种温和而且可以在水溶液中操作的还原剂,越来越多地受到人们关注。2002年,Pal等[6]首先报道在Ag纳米粒子的存在下使用NaBH4催化还原对硝基苯酚(4-NP),随后人们发现了更多金属催化剂,如Au[7]、Ag[8]、Pt[9]和Pd[10]等贵金属纳米粒子均可用于硝基酚类的还原,但是这些金属由于价格昂贵、来源稀缺并且回收困难导致了它们的实际应用受到了限制。出于降低成本的考虑,2010年,Patra等[11]报道使用廉价的Cu纳米球和Cu纳米棒催化还原4-NP,反应1 h后反应转化率分别达到94 %和76 %。然而不论是贵金属还是Cu纳米粒子均具有明显的缺点,它们在反应过程中极易团聚,并且使用后很难回收再利用。
最新发现二维碳材料石墨烯,在化学催化领域具有广阔的应用前景,是一种理想的载体材料[12~15]。将磁性金属氧化物如Fe3O4负载在石墨烯上,可以充分利用石墨烯大的比表面积、较强的吸附能力和良好的电输运性能,从而提高催化反应效率,同时解决纳米粒子容易团聚和难以回收的问题[16],另外,褶皱的石墨烯还可以作为缓冲以减少催化剂中有效成分的流失及催化剂组份价态的改变,这对催化剂的循环使用大有益处。Li等[17]选择性地将粒径3~5 nm的贵金属(Pt、Pd、Pt@Pd)纳米粒子负载到Fe3O4@GE复合载体上,获得多功能的纳米催化材料。作者前期研究表明,将纳米材料与Fe3O4@GE复合后,兼顾了磁性和催化性能[18, 19],在此基础上,将Cu纳米粒子与Fe3O4/石墨烯(GE)复合,用于催化NaBH4还原4-NP[20],具有极佳的催化效果。然而,由于催化还原反应历程非常复杂,反应效率受到多种因素的制约,如反应物的浓度、温度、催化剂用量、反应pH等[21],正确地描述该反应的过程是目前研究的一个难点,也是将理论过渡到工业实际所需要解决的问题。因此需要一种方法能够分析研究各项参数条件对该反应的具体影响,从而能够将该研究从实验阶段引入具体的工业化进程。而科研工作者为此也经常从动力学方面着手,通过使用不同的动力学方程来了解各个反应条件对反应的影响[22, 23], 从而使之工业化应用更近一步。Zhang等[24]对Fe-TiO2光催化剂还原4-NP进行了动力学研究,讨论了Fe的掺杂量、催化剂的投入量、4-NP的初始浓度、pH、催化时间等多种因素对反应的影响。上述文献说明对4-NP还原反应进行动力学研究是将其工业化必不可少的步骤。而目前并未有对Cu-Fe3O4@GE复合材料的催化还原性能以及反应动力学方面的研究报道,因此本文从表观反应动力学方面下手,来研究影响4-NP效率的具体数据,从而为其工业化打下基础。
2 实验部分 2.1 实验材料石墨粉、K2S2O8、P2O5、NaNO3、KMnO4、Cu(NO3)2·3H2O、FeSO4·7H2O、NaOH、NaBH4和4-NP等原料均购自中国国药集团化学试剂有限公司,所有试剂均为分析纯。
2.2 氧化石墨的制备氧化石墨根据改进的Hummers法制备[25, 26]。具体步骤如下:
2.2.1 石墨的预氧化将2.4 g(0.0089 mol)K2S2O8和2.5 g(0.0176 mol)P2O5加到100 mL的四口烧瓶里同时开启搅拌,再缓慢的加入50 g的浓硫酸,水浴加热到80℃,在80℃温度下慢慢的加入5 g石墨粉。然后,撤去水浴加热装置,在室温下反应6 h;将反应液倒入1 L的烧杯中,加800 mL蒸馏水稀释,抽滤,用蒸馏水冲洗几次。最后将过滤得到的固体放入真空干燥箱里,60℃干燥12 h。
2.2.2 制备氧化石墨5 g的预氧化处理石墨和2.5 g(0.03 mol)NaNO3加到500 mL的四口烧瓶里,恒速搅拌,分批次加入浓硫酸,记下加入的量。
在冰盐浴条件下(0~5℃)缓慢加入15 g(0.095 mol) KMnO4,添加完毕后在室温(约25℃)下保温30 min。后水浴加热到35℃,保温反应3.5 h。撤去水浴加热装置,用恒压滴液漏斗慢慢滴加230 mL蒸馏水。后改用加热套加热,96~98℃温度下反应30 min。后撤去加热套,冷却至50~60℃,向烧瓶中加入5 mL的5%(wt) HCl溶液和10 mL的双氧水,搅拌一段时间。将反应液移至1 L的烧杯中,加适量蒸馏水稀释至800 mL,放置过夜分层。把上层倒掉再用蒸馏水稀释至800 mL,重复2~3次。取下层沉淀倒入渗析袋中渗析,得到氧化石墨胶体并测固含量。
2.3 Cu-Fe3O4@GE复合材料的制备称取30 mg氧化石墨于60 mL乙醇中超声分散45 min;称取0.3025 g FeSO4·7H2O(1.088 mmol)溶解于5 mL水中,缓慢滴加至氧化石墨烯悬浮液中,搅拌30 min;称取0.2473 g Cu(NO3)2·3H2O(1.0243 mmol)溶解于水中,用NaOH溶液调节pH至10~11,抽滤沉淀物,滤饼经洗涤后置于乙醇中重新超声分散60 min,再将其滴加至氧化石墨烯与FeSO4混合液中,调节pH至10~11,搅拌30 min,置于水热釜200℃下反应10 h,水热后得到的产物进行磁分离。分离出的固体产物用去离子水洗涤3次,得到磁性纳米Cu-Fe3O4@GE复合材料。
2.4 Cu-Fe3O4@GE催化还原4-NP以Cu-Fe3O4@GE复合材料为催化剂,在不同条件下催化NaBH4催化还原4-NP。将10 mL的4-NP水溶液(1 mmol·L-1)和10 mL NaBH4水溶液(10 mmol·L-1)混合加入到50 mL的烧杯中,加入一定量的催化剂,恒温反应,使用机械搅拌使催化剂与4-NP及NaBH4充分接触,每隔2 min取1 mL反应液于离心管中,离心除去催化剂。由于取样放入离心机的时间不足10 s,所以就将取样时间提早了5 s,例如2 min测得的数据实际上是1 min 55 s时取样得到的,可以用UV-Vis分光光度计检测清液在400 nm处的吸光度来确定催化反应速率的变化。
2.5 Cu-Fe3O4@GE催化剂的表征及催化反应的检测本实验采用X射线粉末衍射(XRD, D/max 2000 PC, Rigaku)对制备的材料进行相结构分析,使用Cu Ka射线(λ= 1.5418 )在40 kV和300 mA下检测,扫描范围从5°至80°。本实验采用TEM (JEM-2100, JEOL, Japan)在200 kV的加速电压下对制备的材料进行结构分析,并使用该仪器测试其选区电子衍射(SAED)。
使用配备有积分球的UV-vis分光光度计(UV-2700,Shimazu,Japan)对4-NP的还原进行定时监测。具体步骤已在2.4节中给出。通过在室温(25℃)下使用该设备在不同的时间间下隔测量反应液的吸光度值记录反应的进行程度。检测范围为200~800 nm。
3 结果与讨论 3.1 样品的形貌与结构从图 1(a)中可以看出,纳米级球状的Fe3O4[27]密集的分布在薄纱状石墨烯上,在此基础上制备了具有纳米Cu的Fe3O4@GE三元复合材料如图 1(b)所示,石墨烯片表面均匀负载了很多直径为20~50 nm Fe3O4纳米颗粒和直径范围在100~200 nm的针状纳米团簇,与文献报道的纳米Cu针状团簇一致[28]。图 1(c)为Cu-Fe3O4@GE复合材料的选区电子衍射图(SAED),图中衍射环由里至外分别对应于311(Fe3O4)晶面、111(Cu)晶面、200(Cu)晶面、440(Fe3O4)晶面和220(Cu)晶面。进一步对本文制备的三元复合材料进行XRD检测如图 1(d)所示,从图上可以明显看出复合材料具有Cu和Fe3O4特征衍射峰,未出现GE峰归因于被负载的Cu和Fe3O4纳米粒子所剥离破坏了其有序的堆叠。

|
图 1 Cu-Fe3O4@GE相关的TEM和XRD表征图 Fig.1 TEM micrographs and XRD patterns of the Cu-Fe3O4@GE composite (a)Fe3O4@GE (b) Cu-Fe3O4@GE composite (c) selected area electron diffraction (SAED) pattern (d) XRD pattern |
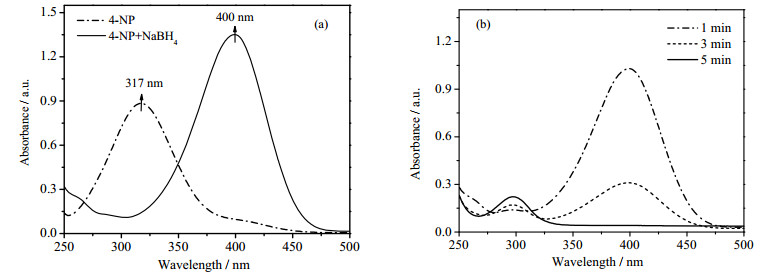
如图 2(a)所示,4-NP的紫外最大吸收波长在317 nm处,加入NaBH4溶液后将混合液用紫外检测其吸收波长,发现峰红移至400 nm处,说明两者发生反应生成了对硝基苯酚钠。前期研究表明,在不加催化剂时,即使加入过量的NaBH4 4-NP的吸收峰强度也不会发生改变。而当加入微量的催化剂后,在295 nm处出现了一个新的吸收峰(图 2(b)),并且随着反应时间的增加,400 nm处出现的对硝基苯酚钠峰值不断降低,而295 nm处的吸收峰强度不断增加,表明催化剂的加入促使对硝基苯酚被还原。
|
图 2 催化反应的紫外分光光谱图的变化 Fig.2 UV spectra of samples in catalytic reaction (a) visible absorption spectra of 4-NP solution before and after NaBH4 addition (b) UV-Vis spectra of reaction samples at different reaction times |
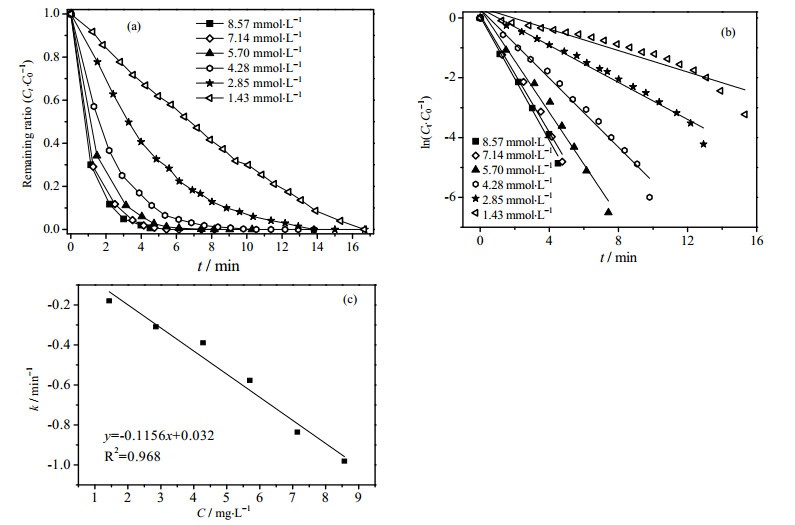
作为催化还原4-NP反应的还原剂,NaBH4溶液的浓度对Cu-Fe3O4@GE复合材料催化还原4-NP的效率有很大影响。如图 3(a)所示,随着NaBH4浓度增加,4-NP的转化效率显著提高,当NaBH4的浓度为1.43 mmol·L-1时,需要15 min才能将4-NP完全转化。当NaBH4的浓度增加到7.14 mmol·L-1时,只需5 min即可将4-NP完全还原。从图 3(b)可以观察到良好的线性关系,表明Cu-Fe3O4@GE复合材料催化还原4-NP的反应符合赝一级动力学。从图上可以直观地看出,随着NaBH4浓度增大,斜率增大,说明随着NaBH4浓度的增大,反应速率不断加快,这与图 3(a)结果相一致。当NaBH4浓度为1.43 mmol·L-1时,该反应的动力学常数k为0.18 min-1,浓度提高至7.14 mmol·L-1时k增加到0.98 min-1,继续提高NaBH4浓度到8.57 mmol·L-1时,速率常数k仅增加到1.03 min-1。
|
图 3 NaBH4浓度对反应动力学的影响 Fig.3 Effect of NaBH4 concentration on reaction kinetics (a) effect of different NaBH4 concentration on reduction efficiency (b) relation between reaction rate and NaBH4 concentration; (c) c to k plot |
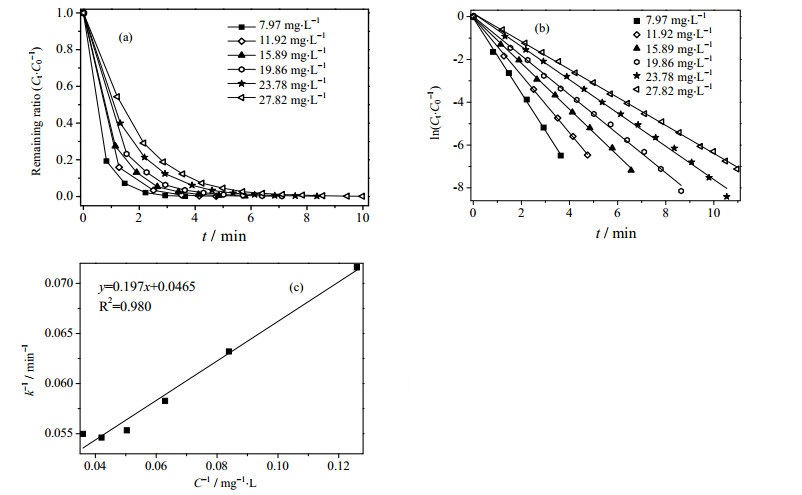
进一步研究了初始4-NP浓度对催化还原效率的影响。如图 4(a)所示,初始4-NP浓度在7.94~27.82 mg·L-1时,11 min内4-NP均完全反应。该反应的动力学常数k随着4-NP浓度从7.94 mg·L-1增加至27.82 mg·L-1,常数k也从1.76 min-1渐降至0.65 min-1,说明随着4-NP浓度的增加,催化效率会降低。硼氢化物吸附到金属催化剂上是一个快速且可逆的过程,其中决速步骤是水解过程中水分子中OH键的分裂[29]。研究表明,催化去除有机物的反应动力学遵循表面介质过程,反应物的初始速率与反应物在金属表面的吸附有关,而且反应速率常数随着反应物初始浓度的增加而降低[30, 31]。这是由于Cu-Fe3O4@GE复合材料上只有有限的活性位点用于吸附4-NP,所以提高4-NP初始浓度会增加吸附和催化的时间,从而催化的动力学常数k随之降低。可以用Langmuir-Hinshelwood动力学模型来描述4-NP浓度和反应速率之间的关系:
| $ {r_0} = \frac{{{\rm{d}}c}}{{{\rm{d}}t}} = {k_r}\frac{{{K_a}c}}{{1 + {K_a}c}} $ | (1) |
| $ \frac{1}{{{r_0}}} = \frac{1}{{{k_r}{K_a}}} \times \frac{1}{c} + \frac{1}{{{k_r}}} $ | (2) |
|
图 4 初始4-NP浓度对动力学的影响 Fig.4 Effect of initial 4-NP concentration on reaction kinetics (a) effects of different initial 4-NP concentrations on reduction efficiency (b) relation between initial 4-NP concentration and reaction rate (c) 1/c~1/k plot |
r0是4-NP还原反应的反应速率,c是4-NP的浓度,kr是反应速率常数,Ka是Langmuir吸附平衡系数。初始浓度的倒数与速率的倒数之间具有一个良好的线性关系(如图 4(c)所示),线性回归方程为1/r0 = 0.197·1/c+0.0465,R2 = 0.980,其中反应速率常数kr = 1.25 mg·min·L-1,Ka = 4.06 L·mg-1。这说明了4-NP还原反应符合Langmuir-Hinshelwood动力学模型,R2 > 0.95表明了Cu-Fe3O4@GE催化剂催化还原4-NP反应速率由反应物在催化剂表面的吸附所控制。
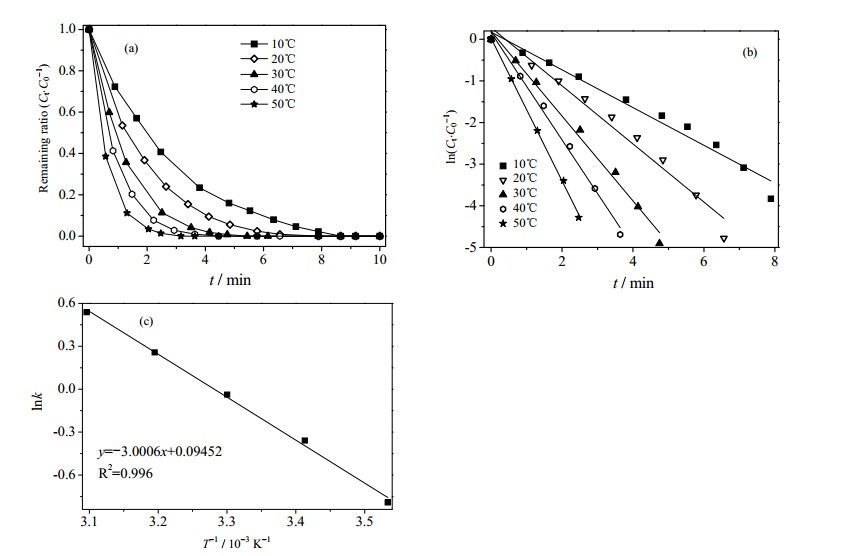
3.5 反应温度对催化还原反应的影响图 5(a)显示的是以Cu-Fe3O4@GE复合材料为催化剂,不同还原温度对4-NP还原效率的影响。还原温度从10℃提高到50℃时,该反应的化学反应速率常数k从0.45 min-1上升到1.23 min-1,说明4-NP还原效率随温度提高而提高。该反应的常数k与温度T的关系可以用阿伦尼乌斯公式(3)来描述,由此可以计算出4-NP还原反应的活化能公式:
| $ {\rm{ln}}k = - \frac{E}{{RT}} + {\rm{ln}}A $ | (3) |
|
图 5 反应温度对动力学的影响 Fig.5 Effect of reaction temperature on reaction kinetics (a) effects of reaction temperature on reduction efficiency; (b) relation between reaction temperature and reaction rate (c) 1000/T~lnk plot |
通常溶液中受分散控制的反应活化能低于20 kJ·mol-1,受传质控制的则对温度变化感应不明显,而受化学反应控制的则随着温度变化而变化。如图 5(b)所示,lnk与1/T有良好的线性关系,根据阿仑尼乌斯方程可以计算出Cu-Fe3O4@GE复合材料催化还原4-NP的活化能为24.95 kJ·mol-1,说明4-NP还原反应的反应速率由化学反应所控制,受控于4-NP、NaBH4和Cu-Fe3O4@GE催化剂三者之间发生的电子转移现象。值得关注的是本实验中活化能低于大多数文献数据,Wunder等[32]检测了Au/SPB在10~35℃范围内催化还原4-NP反应的活化能为40 kJ·mol-1。Wu等[33]研究了胶原纤维负载Au纳米粒子作为催化剂还原4-NP,计算出的活化能为37.3 kJ·mol-1。以上这些文献报道的活化能均高于本次所制备的催化剂,本文制备的催化剂用于催化还原4-NP所需的活化能较低的原因可能是由于表面电子从Cu上转移到Fe3O4上后,在石墨烯上得到了有效的分散,提高了催化接触面积,使得4-NP能够更加容易的与电子相结合从而发生还原反应。较低的活化能使得该反应能够在几分钟之内就完成,说明了Cu-Fe3O4@GE复合材料是一种催化4-NP还原反应的优异催化剂。
3.6 pH对催化还原反应的影响通过0.1 mol·L-1的HCl溶液或0.1 mol·L-1的NaCl溶液来调节pH,考察了不同pH值下(5、7、9、11)催化剂对4-NP还原反应的影响。结果如图 6(a)所示,随着pH的增加,催化性能逐渐降低。在pH = 5时,仅需要4 min即可完全反应。而pH = 7~9时,反应需要约7 min才可完成,pH = 11时则几乎不能观察到催化还原反应的进行。另外随着pH从5升高至9,该反应的动力学常数k值也从1.27降至0.70 min-1,表明碱性条件不利于反应的进行。
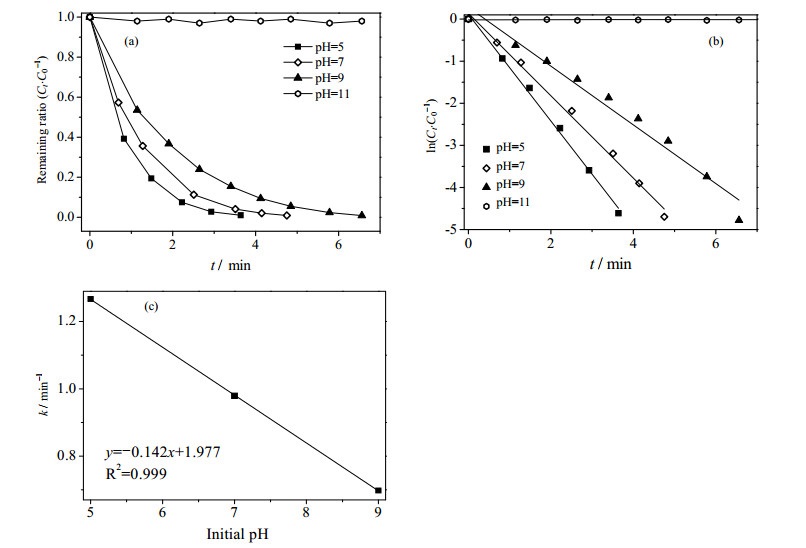
|
图 6 反应pH对动力学的影响 Fig.6 Effect of pH on reaction kinetics (a) effect of initial pH on reduction efficiency (b) relation between initial pH and reaction rate (c) inital pH~K plot (The slope k is not added when pH = 11) |
究其原因是由于H+在催化还原4-NP时参与了反应[34]式(4)、(5)所示:
| $ {{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons {{\text{H}}^{\text{+}}}\text{+O}{{\text{H}}^{\text{-}}} $ | (4) |
| $ {{\text{H}}^{\text{+}}}\text{+BH}_{\text{4}}^{\text{-}}\text{+3}{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons {{\text{H}}_{\text{3}}}\text{B}{{\text{O}}_{\text{3}}}\text{+4}{{\text{H}}_{\text{2}}} $ | (5) |
方程式(4)和(5)分别是水分子电离和硼氢根离子水解。硼氢根离子水解速率低于水电离速率,是决速步骤。在pH较低时,溶液中游离的质子(H+)多,容易与BH4-结合形成氢气提供电子,通过硝基基团吸附到Cu表面的硝基酚接受了电子从而生成了氨基酚。而pH过高时(如pH=11),无法使H+与BH4-结合生成H3BO3和H2从而提供电子,反应也就不能进行,所以pH较低时反应速率较快。
4 结论研究了在不同反应条件下使用Cu-Fe3O4@GE催化NaBH4还原4-NP的表观动力学,发现催化反应效率与NaBH4浓度、初始4-NP浓度、反应温度和溶液pH密切相关。反应可以用Langmuir-Hinshelwood动力学模型来描述,反应速率由反应物在催化剂表面的吸附所控制。催化剂在[NaBH4]/[4-NP]的比值范围为10~50、pH范围为5~9时均具有优异的催化性能且均符合动力学曲线。通过计算可知该反应的活化能为24.95 kJ·mol-1,低于大多数文献报道的催化剂。石墨烯的引入更好的分散金属粒子,抑制了纳米粒子的团聚,提高了催化效率,使得在催化还原4-NP的反应中显示出较高的催化活性。同时,由于磁性Fe3O4的存在,使得回收也较为简便,提高了催化剂的使用效益。这些研究结果表明Cu-Fe3O4@GE复合材料是一种优异的催化剂,具有极大的应用价值。
符号说明:
|
|
| [1] | Gupta V K, Atar N, Yola M L, et al. A novel magnetic Fe@Au core-shell nanoparticles anchored graphene oxide recyclable nanocatalyst for the reduction of nitrophenol compounds[J]. Water Research , 2014, 48(1): 210-217. |
| [2] | Deshpande A, Figueras F, Kantam M L, et al. Environmentally friendly hydrogenation of nitrobenzene to p-aminophenol using heterogeneous catalysts[J]. Journal of Catalysis , 2010, 275(2): 250-256. DOI:10.1016/j.jcat.2010.08.005. |
| [3] | Wang S F, He B B, Wang Y J, et al. MgAPO-5-supported Pt-Pb-based novel catalyst for the hydrogenation of nitrobenzene to p-aminophenol[J]. Catalysis Communications , 2012, 24(24): 109-113. |
| [4] | Rode C V, Vaidya M J, Chaudhari R V. Synthesis of p-aminophenol by catalytic hydrogenation of nitrobenzene[J]. Organic Process Research & Development , 1999, 3(6): 465-470. |
| [5] | ZHENG Hua-jun(郑华均), HUANG Jian-guo(黄建国), WANG Wei(王伟), et al. Electrocatalytic properties of nanocrystalline tungsten carbide thin film as cathode electrode for p-nitrophenol electro-reduction(碳化钨纳米晶薄膜电极在对硝基苯酚电化学还原中的催化性能)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2006, 20(1): 57-62. |
| [6] | Pradhan N, Pal A, Pal T. Silver nanoparticle catalyzed reduction of aromatic nitro compounds[J]. Colloids & Surfaces A:Physicochemical & Engineering Aspects , 2002, 196(2): 247-257. |
| [7] | Fountoulaki S, Daikopoulou V, Gkizis P L, et al. Mechanistic studies of the reduction of nitroarenes by NaBH4 or hydrosilanes catalyzed by supported gold nanoparticles[J]. ACS Catalysis , 2014, 4(10): 3504-3511. DOI:10.1021/cs500379u. |
| [8] | Tian Y, Cao Y, Pang F, et al. Ag nanoparticles supported on N-doped graphene hybrids for catalytic reduction of 4-nitrophenol[J]. RSC Advances , 2014, 4(81): 43204-43211. DOI:10.1039/C4RA06089J. |
| [9] | Pandey S, Mishra S B. Catalytic reduction of p-nitrophenol by using platinum nanoparticles stabilised by guar gum[J]. Carbohydrate Polymers , 2014, 113: 525-531. DOI:10.1016/j.carbpol.2014.07.047. |
| [10] | Coccia F, Tonucci L, Bosco D, et al. One-pot synthesis of lignin-stabilised platinum and palladium nanoparticles and their catalytic behaviour in oxidation and reduction reactions[J]. Green Chemistry , 2012, 14(4): 1073-1078. DOI:10.1039/c2gc16524d. |
| [11] | Patra A K, Dutta A, Bhaumik A. Cu nanorods and nanospheres and their excellent catalytic activity in chemoselective reduction of nitrobenzenes[J]. Catalysis Communications , 2010, 11(7): 651-655. DOI:10.1016/j.catcom.2010.01.015. |
| [12] | Geim A K, Novoselov K S. The rise of graphene[J]. Nature materials , 2007, 6(3): 183-191. DOI:10.1038/nmat1849. |
| [13] | Novoselov K S, Geim A K, Morozov S V, et al. Electric field effect in atomically thin carbon films[J]. Science , 2004, 306(5696): 666-669. DOI:10.1126/science.1102896. |
| [14] | Wang W, Xiao K, Zhu L, et al. Graphene oxide supported titanium dioxide & ferroferric oxide hybrid, a magnetically separable photocatalyst with enhanced photocatalytic activity for tetracycline hydrochloride degradation[J]. RSC Advances , 2017, 7(34): 21287-21297. DOI:10.1039/C6RA28224E. |
| [15] | Li X, Wang X, Song S Y, et al. Selectively deposited noble metal nanoparticles on Fe3O4/graphene composites:stable, recyclable, and magnetically separable catalysts[J]. Chemistry -A European Journal , 2012, 18(24): 7601-7607. DOI:10.1002/chem.201103726. |
| [16] | Yang X, Zhu J, Qiu L, et al. Bioinspired effective prevention of restacking in multilayered graphene films:towards the next generation of high-performance supercapacitors[J]. Advanced Materials , 2011, 23(25): 2833-2838. DOI:10.1002/adma.201100261. |
| [17] | Stoller M D, Park S, Zhu Y, et al. Graphene-based ultracapacitors[J]. Nano Letters , 2008, 8(10): 3498-3502. DOI:10.1021/nl802558y. |
| [18] | Zhu Y, Xue J, Xu T, et al. Enhanced photocatalytic activity of magnetic core-shell Fe3O4@Bi2O3-RGO heterojunctions for quinolone antibiotics degradation under visible light[J]. Journal of Materials Science:Materials in Electronics , 2017, 28(12): 8519-8528. DOI:10.1007/s10854-017-6574-6. |
| [19] | HE Guang-yu(何光裕), ZHANG Yan(张艳), QIAN Mao-gong(钱茂公), et al. Preparation and catalytic properties of Fe3O4/graphene magnetically separable photo-fenton catalyst(磁性Fe3O4/石墨烯光-Fenton催化剂的制备及其催化活性)[J]. Chinese Journal of Inorganic Chemistry(无机化学学报) , 2012, 28(11): 2306-2312. |
| [20] | Xu R, Bi H P, He G Y, et al. Synthesis of Cu-Fe3O4@graphene composite:A magnetically separable and efficient catalyst for the reduction of 4-nitrophenol[J]. Materials Research Bulletin , 2015, 57: 190-196. |
| [21] | PENG Shao-hong(彭少洪), HUANG Yun-feng(黄运凤). Kinetic study on photocatalytic degradation of o-nitrophenol by solid superacid SO42-/TiO2-WO3(固体超强酸SO42-/TiO2-WO3光催化降解邻硝基苯酚动力学研究)[J]. Chemistry & Bioengineering(化学与生物工程) , 2009, 26(6): 32-35. |
| [22] | ZHOU Ying-mei(周颖梅), XU Yang(徐阳), ZHOU Hui-min(周慧敏), et al. Bi/Fe-catalyzed reduction of 4-nitrophenol with sodium borohydride in water(Bi/Fe催化硼氢化钠还原水中对硝基苯酚)[J]. Science Technology and Engineering(科学技术与工程) , 2016, 16(11): 1-4. DOI:10.3969/j.issn.1671-1815.2016.11.001. |
| [23] | QING Feng-xiang(秦凤祥), LI Ping-li(李凭力), HUANG Yi-ping(黄益平), et al. Kinetic analysis of catalytic reduction of 4-nitrophenol by Ag/MIL-101(Ag/MIL-101催化剂还原对硝基苯酚反应动力学)[J]. Chemical Industry and Engineering Progress(化工进展) , 2016, 35(s2): 168-173. |
| [24] | ZHANG Yi-bing(张一兵), FU Hong-jin(付红金). Study on the photocatalytic kinetics of p-nitrophenol degraded by iron-doping A-TiO2(铁掺杂A-TiO2光催化降解对硝基苯酚的动力学研究)[J]. The Journal of Light Scattering(光散射学报) , 2014, 26(3): 302-306. |
| [25] | Hummers W S, Offeman R E. Preparation of graphitic oxide[J]. Journal of the American Chemical Society , 1958, 80(6): 1339. DOI:10.1021/ja01539a017. |
| [26] | Kovtyukhova N I, Ollivier P J, Martin B R, et al. Layer-by-layer assembly of ultrathin composite films from micron-sized graphite oxide sheets and Polycations[J]. Chemistry of Materials , 1999, 11(3): 771-778. DOI:10.1021/cm981085u. |
| [27] | Heidarizadeh M, Doustkhah E, Rostamnia S, et al. Dithiocarbamate to modify magnetic graphene oxide nanocomposite (Fe3O4-GO):a new strategy for covalent enzyme (lipase) immobilization to fabrication a new nanobiocatalyst for enzymatic hydrolysis of PNPD[J]. International Journal of Biological Macromolecules , 2017, 101: 696-702. DOI:10.1016/j.ijbiomac.2017.03.152. |
| [28] | Zhang X, Cheng X, Yin H, et al. Preparation of needle shaped nano-copper by microwave-assisted water system and study on its application of enhanced epoxy resin coating electrical conductivity[J]. Applied Surface Science , 2008, 254(18): 5757-5759. DOI:10.1016/j.apsusc.2008.03.078. |
| [29] | Wu H, Huang X, Gao M, et al. Polyphenol-grafted collagen fiber as reductant and stabilizer for one-step synthesis of size-controlled gold nanoparticles and their catalytic application to 4-nitrophenol reduction[J]. Green Chemistry , 2011, 13(3): 651-658. DOI:10.1039/c0gc00843e. |
| [30] | Wunder S, Polzer F, Lu Y, et al. Kinetic analysis of catalytic reduction of 4-nitrophenol by metallic nanoparticles immobilized in spherical polyelectrolyte brushes[J]. The Journal of Physical Chemistry C , 2010, 114(19): 8814-8820. DOI:10.1021/jp101125j. |
| [31] | Lee C, Doong R. Dechlorination of tetrachloroethylene in aqueous solutions using metal-modified zerovalent silicon[J]. Environmental Science & Technology , 2008, 42(13): 4752-4757. |
| [32] | Parshetti G K, Doong R. Dechlorination of chlorinated hydrocarbons by bimetallic Ni/Fe immobilized on polyethylene glycol-grafted microfiltration membranes under anoxic conditions[J]. Chemosphere , 2012, 86(4): 392-399. DOI:10.1016/j.chemosphere.2011.10.028. |
| [33] | Wu H, Huang X, Gao M, et al. Polyphenol-grafted collagen fiber as reductant and stabilizer for one-step synthesis of size-controlled gold nanoparticles and their catalytic application to 4-nitrophenol reduction[J]. Green Chemistry , 2011, 13(3): 651-658. DOI:10.1039/c0gc00843e. |
| [34] | Churikov A V, Gamayunova I M, Zapsis K V, et al. Influence of temperature and alkalinity on the hydrolysis rate of borohydride ions in aqueous solution[J]. International Journal of Hydrogen Energy , 2012, 37(1): 335-344. DOI:10.1016/j.ijhydene.2011.09.066. |




