随着现代工业的迅猛发展,CO2排放量不断增加[1]。由此引发的温室效应日益严重,带来一系列不利影响,如海平面上升、生物多样性减少、极端天气事件增加等,给自然生态及人类生活带来巨大挑战[2]。化石燃料的燃烧利用是CO2的主要来源,对此采取CO2捕集技术,是缓解气候变暖的重要手段[3]。
目前,工业上普遍使用的CO2捕集技术是化学吸收法,主要使用一乙醇胺(monoethanolamine,MEA)水溶液作为吸收剂[4]。MEA水溶液可快速吸收CO2,但是在解吸时,需要对溶液中的大量水分进行加热,热量消耗较大,再生能耗较高。据研究,MEA水溶液的再生能耗占总捕集费用(包括设备费、操作费、维护费等)的56%[5]。
相变吸收剂,相较于MEA水溶液,具有再生能耗低的优势,在碳捕集领域有极大的应用前景。相变吸收剂,在吸收过程中,可由均匀的液相转化为分明的贫、富两相,富相聚集了95% 以上的CO2吸收产物;解吸时,只需对富相进行加热,可有效降低加热的溶液量,从而降低再生能耗[6]。Zhang等[7-9]对二丙胺/N, N-二甲基环己胺水溶液进行了深入的研究,发现其在吸收CO2后,可分成有机相与水相,水相富集了大量的氨基甲酸酯、碳酸氢盐。Ye等[10]筛选了近50种相变吸收剂,发现三乙烯四胺/ N, N-二乙基乙醇胺水溶液是最合适的复配体系,其吸收负荷为0.92 mol·mol−1,且总能耗比MEA水溶液降低了30%以上。Machida等[11]研究发现N-乙基乙醇胺/乙醇水溶液在吸收CO2后,可转化为液-液两相,其吸收负荷为0.315 mol·mol−1,能耗仅为1.6 GJ·t−1。Wang等[12]探究了二乙烯三胺/环丁砜水溶液,发现此混合溶液的吸收负荷为0.89 mol·mol−1,再生能耗为3.23 GJ·t−1,较MEA水溶液降低19%。
可见,相变吸收剂可有效降低再生能耗。本研究提出一种新型相变吸收剂,N-氨乙基哌嗪(1-(2, 3 aminoethyl)piperazine,AEP)/正丙醇水溶液。AEP含有3个氨基基团,伯氨、仲氨与叔氨,伯氨与仲氨可快速吸收CO2,叔氨可提高吸收负荷。正丙醇与CO2吸收产物不互溶,可作为分相剂,促进贫、富相的形成。水为溶剂,可溶解CO2吸收产物。本研究将探究AEP/正丙醇水溶液的吸收-解吸性能、物性参数及动力学特性,从而为其工业应用提供理论依据。
2 实验部分 2.1 实验试剂实验所用试剂为N-氨乙基哌嗪(质量分数≥99.99%,阿拉丁)、正丙醇(分析纯,国药)、一乙醇胺(分析纯,阿拉丁)、二氧化碳(体积分数≥99.99%)、氮气(体积分数≥99.99%),气体均购自杭州今工特种气体有限公司。
2.2 吸收实验实验所用吸收装置为25 mL吸收瓶。实验时,配制20 g AEP/正丙醇水溶液,AEP质量分数为20%,正丙醇质量分数为40%。将溶液倒入吸收瓶中,置于303.15~333.15 K的水浴中。待溶液升至所需温度后,开始向吸收瓶中进气,进气流速为240 L·moL−1,进气组成为CO2、N2体积分数分别为15%、85%。使用皂膜流量计测量吸收瓶的进气速度与出气速度,从而计算AEP/正丙醇水溶液的吸收负荷,公式如下:
| $ {r_{{\text{ab}}}}{\text{ = }}\frac{{{Q_{{\text{in}}}} - {Q_{{\text{out}}}}}}{{{n_{{\text{AEP}}}}{{ \times }}{V_{\text{0}}}}}\left( {\frac{{{p_{{\text{act}}}}{T_{\text{0}}}}}{{{p_{\text{0}}}{T_{{\text{act}}}}}}} \right) $ $ {r_{{\text{ab}}}}{\text{ = }}\frac{{{Q_{{\text{in}}}} - {Q_{{\text{out}}}}}}{{{n_{{\text{AEP}}}}{{ \times }}{V_{\text{0}}}}}\left( {\frac{{{p_{{\text{act}}}}{T_{\text{0}}}}}{{{p_{\text{0}}}{T_{{\text{act}}}}}}} \right) $ | (1) |
| $ \alpha = \int\limits_0^t {{r_{{\rm{ab}}}}{\rm{d}}t} $ | (2) |
式中:rab为吸收速率,mol·mol−1·min−1;Qin为进气流速,L·min−1;Qout为出气流速,L·min−1;nAEP为AEP的量,mol;V0为标准状况下的气体摩尔体积,22.4 L·mol−1;pact为实验气体压力,Pa;p0为1×105 Pa;Tact为实验气体温度,K;T0为273.15 K;t为吸收时间,min;α为吸收负荷,mol·mol−1。
2.3 解吸实验实验所用解吸装置为25 mL解吸瓶。将富相置于解吸瓶中,同时添加2 mL贫相以促进解吸,在393.15 K下搅拌加热30 min。使用皂膜流量计测量解吸瓶的出气速度,计算解吸负荷。
2.4 物性参数测试实验实验分别使用电子液体密度计(MDJ-300G,上海力辰邦西仪器)、数显黏度计(NDJ-8S,上海邦西仪器科技)测试AEP/正丙醇水溶液的密度和黏度。
2.5 动力学实验实验所用动力学装置为500 mL双搅拌釜装置。双搅拌釜是一个带有水浴夹套的玻璃圆筒,反应器半径约为3 cm,横截面积约为28.27 cm2。双搅拌釜平均分为上、下2层,上层为气相,下层为液相,均带有搅拌装置。在双搅拌釜中,反应主要在气液接触界面上进行,所以可用双搅拌釜模拟气液界面实验。
实验时,向反应釜中加入250 mL AEP/正丙醇水溶液,设置水浴温度为303.15~333.15 K,气相搅拌速度为1 000 r·min−1,液相搅拌速度为250 r·min−1,进气流速为1 000 mL·min−1,进气组成为CO2、N2体积分数分别为15%、85%。使用皂膜流量计测量双搅拌釜的进气速度与出气速度,从而计算吸收速率与吸收负荷。
3 实验结果与讨论本研究提出新型相变吸收剂AEP/正丙醇水溶液,对吸收-解吸性能进行考察,测试吸收负荷、解吸负荷等重要参数;随后,测试不同温度、不同吸收负荷下的物性参数;最后,进一步探究AEP/正丙醇水溶液的动力学特性。研究将为AEP/正丙醇水溶液的工业应用提供重要的理论参考。
3.1 AEP/正丙醇水溶液的吸收性能工业上,在碳捕集工序中,烟道气的温度会受到前段脱硫工序的影响,在318.15~328.15 K波动[13]。探究AEP/正丙醇水溶液在303.15~333.15 K下的吸收性能,结果如图 1所示。可发现,AEP/正丙醇水溶液的吸收负荷随着温度的降低而升高。当温度为333.15 K时,AEP/正丙醇水溶液的吸收负荷为1.09 mol·mol−1。当温度降低至303.15 K时,AEP/正丙醇水溶液的吸收负荷为1.35 mol·mol−1。整体而言,在303.15~333.15 K,AEP/正丙醇水溶液可保持较好的吸收性能,吸收负荷均大于1 mol·mol−1,为MEA水溶液的2倍以上(0.50 mol·mol−1),优势较大。
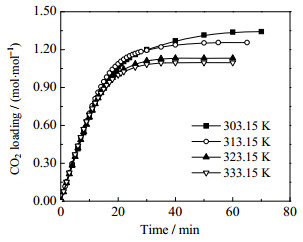
|
图 1 AEP/正丙醇水溶液的吸收性能 Fig.1 Absorption performance of AEP/1-propanol aqueous solution |
同时,探究AEP/正丙醇水溶液在303.15~333.15 K下的分相情况,结果如表 1所示。可发现,当温度为303.15~333.15 K时,富相体积分数为56.5%~58.6%,富相产物质量分数为97.1%~99.0%,表明AEP/正丙醇水溶液在此温度范围可维持较低的富相体积分数与较高的富相产物质量分数,分相情况较为稳定。由于相变吸收剂在解吸时,只需对富相进行加热,较低的富相体积分数可降低解吸过程中溶液的加热量,有利于降低再生能耗。
|
|
表 1 AEP/正丙醇水溶液的分相情况 Table 1 Phase separation performance of AEP/1-propanol aqueous solution |
图 2展示了AEP/正丙醇水溶液的解吸性能。可发现,随着解吸时间的延长,解吸负荷逐渐增加。当解吸时间趋于30 min时,解吸速率趋近于0,解吸负荷趋于平缓。解吸完成后,AEP/正丙醇水溶液的解吸负荷为0.93 mol·mol−1。解吸后的溶液由液-液两相恢复为均一液相,溶液中仅残留少量CO2吸收产物。AEP/正丙醇水溶液的解吸负荷为MEA水溶液的2.8倍(0.33 mol·mol−1),表明AEP/正丙醇水溶液具有较好的解吸性能。
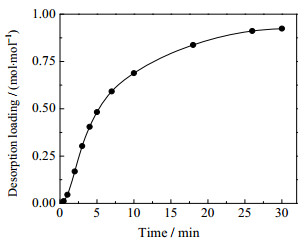
|
图 2 AEP/正丙醇水溶液的解吸性能 Fig.2 Desorption performance of AEP/1-propanol aqueous solution |
图 3(a)展示了AEP/正丙醇水溶液在不同温度、不同吸收负荷下的密度。可发现,随着温度的升高,AEP/正丙醇水溶液的密度逐渐降低。对于新鲜AEP/正丙醇水溶液,当温度为303.15 K时,密度为0.933 g·mL−1,当温度为333.15 K时,密度降低至0.915 g·mL−1。同时,随着吸收负荷的升高,AEP/正丙醇水溶液的密度逐渐升高。当温度为303.15 K时,新鲜AEP/正丙醇水溶液的密度为0.933 g·mL−1,接近饱和时AEP/正丙醇水溶液的密度为0.990 g·mL−1。整体而言,AEP/正丙醇水溶液在吸收过程中的密度范围为0.915~0.990 g·mL−1,略低于水。
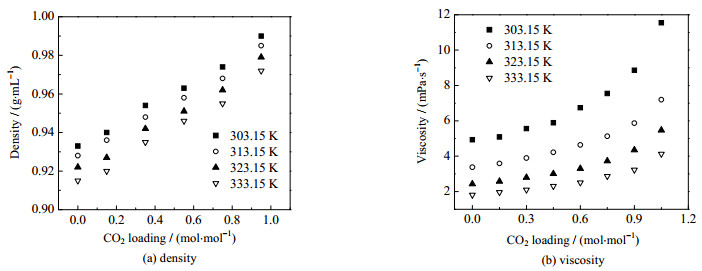
|
图 3 AEP/正丙醇水溶液的密度和黏度 Fig.3 Density and viscosity profiles of AEP/1-propanol aqueous solution |
图 3(b)展示了AEP/正丙醇水溶液在不同温度、不同吸收负荷下的黏度。可发现,AEP/正丙醇水溶液的黏度随着温度的升高而降低,随着吸收负荷的增大而增大。新鲜AEP/正丙醇水溶液的黏度较小。当吸收负荷为0,温度在303.15~333.15 K时,溶液的黏度范围为1.81~4.93 mPa·s−1。接近饱和时AEP/正丙醇水溶液的黏度较大。当吸收负荷为1.05 mol·mol−1,温度为303.15~333.15 K时,溶液的黏度范围为4.13~11.55 mPa·s−1。整体而言,AEP/正丙醇水溶液在吸收过程中的黏度范围为1.81~11.55 mPa·s−1。
3.4 AEP/正丙醇水溶液的动力学 3.4.1 反应理论分析在AEP/正丙醇水溶液中,AEP为主吸收剂。AEP含有3个氨基基团,伯氨、仲氨和叔氨,皆可与CO2发生反应。因此,得出反应速率如下:
| $ r=k_{1} c_{\mathrm{AH}} c_{\mathrm{CO}_{2}}+k_{2} c_{\mathrm{AHF}} c_{\mathrm{CO}_{2}}+k_{3} c_{\mathrm{AHF}} c_{\mathrm{CO}_{2}}=k_{{\rm{mix}}} c_{\mathrm{AFF}} c_{\mathrm{CO}_{2}}=k_{{\rm{o v}}} c_{\mathrm{CO}_{2}} $ | (3) |
式中:r为反应速率,kmol·m−3·s−1;k1、k2、k3分别为伯氨、仲氨、叔氨与CO2的反应速率常数,m3·kmol−1·s−1;cAEP为AEP的浓度,kmol·m−3;
在双搅拌釜中,AEP/正丙醇水溶液与CO2发生界面反应,可使用双膜理论分析传质过程,得出传质通量如下:
| $N=k_{\mathrm{G}}\left(p_{\mathrm{G}}-p_{\mathrm{i}}\right) $ | (4) |
| $ N=E k_{\mathrm{L}}\left(c_{\mathrm{i}}-c_{\mathrm{L}}\right) $ | (5) |
式中:N为传质通量,kmol·m−2·s−1;kG为气相分传质系数,kmol·m−2·s−1·kPa−1;pG为气相CO2分压,kPa;pi为界面CO2分压,kPa;kL为液相分传质系数,m·s−1;ci为界面CO2的浓度,kmol·m−3;cL为液相CO2的浓度,kmol·m−3;E为化学反应增强因子。
由于AEP可快速吸收CO2,液相主体中CO2浓度几乎为0,故式(4)、(5)可转化为
| $ c_{\mathrm{i}}=\frac{N}{E k_{\mathrm{L}}}=\left(p_{\mathrm{G}}-\frac{N}{k_{\mathrm{G}}}\right) \times \frac{1}{H} $ | (6) |
式中:H为CO2的亨利常数,kPa·m3·kmol−1。
式(6)又可转化为
| $N=\frac{p_{\mathrm{G}}}{\frac{H}{E k_{\mathrm{L}}}+\frac{1}{k_{\mathrm{G}}}} $ | (7) |
kG和kL可通过实验测得。使用NaOH水溶液吸收SO2,液相传质阻力忽略不计,得出kG为10.25×10−6 kmol·m−2·s−1·kPa−1;使用蒸馏水吸收CO2,传质阻力主要集中在液相中,得出kL为4.44×10−5 m·s−1。通过对比发现,1/kG远小于H/(EkL),故式(7)可化简为
| $ N=\frac{E k_{\mathrm{L}} p_{\mathrm{G}}}{H} $ | (8) |
对于快速拟一级反应,E≥3,可用如下公式计算:
| $E \approx \frac{\sqrt{D k_{\mathrm{ov}}}}{k_{\mathrm{L}}} $ | (9) |
式中:D为CO2的扩散系数,m2·s−1。
结合式(3)、(9),式(8)可化为
| $ N=\frac{p_{\mathrm{G}}}{H} \sqrt{D k_{\text {mix }} c_{\text {AEP }}}$ | (10) |
使用双搅拌釜确定AEP/正丙醇水溶液与CO2反应的动力学区域。发现当液相搅拌速度为100~250 r·min−1时,吸收速率不变,排除瞬时反应、界面瞬时反应和快速反应;发现当液相体积为150~250 mL时,吸收速率不变,排除中速反应、中速拟n级反应、慢速反应和液相主体的极慢反应。因此,确定AEP/正丙醇水溶液与CO2的反应为快速拟一级反应。
使用双搅拌釜测试AEP/正丙醇水溶液在不同温度、不同吸收负荷下的吸收速率,并通过式(3)~(10)计算得出动力学参数,结果如表 2所示。可发现,AEP/正丙醇水溶液的化学反应速率常数随着温度的升
|
|
表 2 AEP/正丙醇水溶液的动力学参数 Table 2 Kinetics parameters of AEP/1-propanol aqueous solution |
高而升高,随着吸收负荷的升高而降低。使用阿伦尼乌斯公式对化学反应速率常数进行拟合,拟合结果如图 4所示,得出拟合公式如下:
| $k_{\text {mix }}=1.20 \times 10^{8} \exp \left(\frac{-3531}{T}\right) \quad R^{2}=0.99$ | (11) |
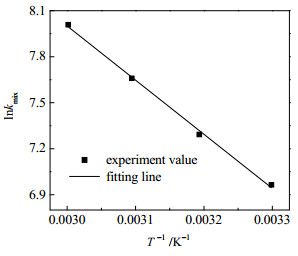
|
图 4 AEP/正丙醇水溶液的化学反应速率常数 Fig.4 Reaction rate constants of AEP/1-propanol aqueous solution |
拟合公式的R2值接近1,表明线性相关度较高,可使用此公式对化学反应速率常数作较为准确的预测。
化学反应增强因子E,可反映化学反应对传质过程的增强作用。E随着温度的升高而升高,随着吸收负荷的增大而减小。当温度为333.15 K、吸收负荷为0时,E有最大值为73.8,在温度为303.15 K、吸收负荷为0.9 mol·mol−1时,E有最小值为4.6。E值均大于3,表明AEP/正丙醇水溶液与CO2的反应为快速拟一级反应。AEP/正丙醇水溶液可快速吸收CO2,有利于工业应用。
4 结论研究提出新型相变吸收剂AEP/正丙醇水溶液,对其CO2捕集性能进行研究。在303.15~333.15 K,AEP/正丙醇水溶液可保持较好的吸收性能与稳定的分相情况,吸收负荷为1.09~1.35 mol·mol−1,为MEA的2倍以上;富相体积分数为56.5%~58.6%,富相产物质量分数为97.1%~99.0%,较低的富相体积分数与较高的富相产物质量分数有利于再生能耗的降低。AEP/正丙醇水溶液在吸收饱和后,可通过解吸恢复为均一液相,解吸负荷为0.93 mol·mol−1,为MEA水溶液的2.8倍,表明AEP/正丙醇水溶液具有较好的解吸性能。通过物性测试,得出AEP/正丙醇水溶液在吸收过程中的密度范围为0.915~0.990 g·mL−1,黏度范围为1.81~11.55 mPa·s−1。最后,进一步探究AEP/正丙醇水溶液的动力学特性,发现AEP/正丙醇水溶液可与CO2发生快速拟一级反应,有利于工业应用。
| [1] |
KHAN A A, HALDER G N, SAHA A K. Carbon dioxide capture characteristics from flue gas using aqueous 2-amino-2-methyl-1- propanol (AMP) and monoethanolamine (MEA) solutions in packed bed absorption and regeneration columns[J]. International Journal of Greenhouse Gas Control, 2015, 32: 15-23. DOI:10.1016/j.ijggc.2014.10.009 |
| [2] |
XIAO M, LIU H, IDEM R, et al. A study of structure–activity relationships of commercial tertiary amines for post-combustion CO2 capture[J]. Applied Energy, 2016, 184: 219-229. DOI:10.1016/j.apenergy.2016.10.006 |
| [3] |
徐海涛, 廖建华, 梁红波, 等. 新型聚离子液体的制备及其捕获CO2性能研究[J]. 高校化学工程学报, 2015, 29(1): 226-231. XU H T, LIAO J H, LIANG H B, et al. Synthesis and CO2 capture properties of a novel poly(ionic liquid)[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(1): 226-231. DOI:10.3969/j.issn.1003-9015.2015.01.034 |
| [4] |
PAPADOPOULOS A I, TZIRAKIS F, TSIVINTZELIS I, et al. Phase-change solvents and processes for postcombustion CO2 capture: A detailed review[J]. Industrial & Engineering Chemistry Research, 2019, 58(13): 5088-5111. |
| [5] |
ROCHELLE G T. Amine scrubbing for CO2 capture[J]. Science, 2009, 325(5948): 1652-1654. DOI:10.1126/science.1176731 |
| [6] |
XU M M, WANG S J, XU L Z. Screening of physical-chemical biphasic solvents for CO2 absorption[J]. International Journal of Greenhouse Gas Control, 2019, 85: 199-205. DOI:10.1016/j.ijggc.2019.03.015 |
| [7] |
ZHANG J F, MISCH R, TAN Y, et al. Novel thermomorphic biphasic amine solvents for CO2 absorption and low-temperature extractive regeneration[J]. Chemical Engineering & Technology, 2011, 34(9): 1481-1489. |
| [8] |
ZHANG J F, AGAR D W, ZHANG X H, et al. CO2 absorption in biphasic solvents with enhanced low temperature solvent regeneration[J]. Energy Procedia, 2011, 4: 67-74. DOI:10.1016/j.egypro.2011.01.024 |
| [9] |
ZHANG J F, NWANI O, TAN Y, et al. Carbon dioxide absorption into biphasic amine solvent with solvent loss reduction[J]. Chemical Engineering Research and Design, 2011, 89(8): 1190-1196. DOI:10.1016/j.cherd.2011.02.005 |
| [10] |
YE Q, WANG X L, LU Y Q. Screening and evaluation of novel biphasic solvents for energy-efficient post-combustion CO2 capture[J]. International Journal of Greenhouse Gas Control, 2015, 39: 205-214. DOI:10.1016/j.ijggc.2015.05.025 |
| [11] |
MACHIDAA H, ANDOA R, ESAKIA T, et al. Low temperature swing process for CO2 absorption-desorption using phase separation CO2 capture solvent[J]. International Journal of Greenhouse Gas Control, 2018, 75: 1-7. DOI:10.1016/j.ijggc.2018.05.010 |
| [12] |
WANG L D, YU S H, LI Q W, et al. Performance of sulfolane/DETA hybrids for CO2 absorption: Phase splitting behavior, kinetics and thermodynamics[J]. Applied Energy, 2018, 228: 568-576. DOI:10.1016/j.apenergy.2018.06.077 |
| [13] |
ZHOU X B, JING G H, LV B H, et al. Low-viscosity and efficient regeneration of carbon dioxide capture using a biphasic solvent regulated by 2-amino-2-methyl-1-propanol[J]. Applied Energy, 2019, 235: 379-390. DOI:10.1016/j.apenergy.2018.10.118 |




