2. 浙江大学衢州研究院, 浙江 衢州 324000
2. Institute of Zhejiang University-Quzhou, Quzhou 324000, China
锂离子电池(lithium-ion batteries,LIB)中的钴、锂等金属成分含量较高,具有较高的回收价值。目前对LIB的回收方法主要为:火法冶金[1]、生物冶金[2]和湿法冶金[3]。其中,湿法冶金常选用无机酸(如硫酸[4-5]、磷酸[6])和有机酸[7-10](如柠檬酸[11-13]、甘氨酸[14])浸取LIB中的金属成分。近年来,低共熔溶剂(deep eutectic solvents,DES)[15-19]也被研究用于回收废弃LIB[20]。目前对LIB的回收主要针对正极材料的浸出和回收[21-22],而工业上的LIB废料一般还含有作为集流体的铜箔、铝箔。但这些金属会部分溶解在浸出剂中,例如,约20% 的铜箔、铝箔会溶解在硫酸、柠檬酸溶液中,约90% 的铜粉和30% 的铝溶解在氯化胆碱-柠檬酸DES[23]中,导致浸出液中金属离子种类较多,后续分离纯化步骤繁杂。
为解决这些问题,本研究以去除铝箔的正极-集流体混合材料为背景,设计出一种绿色环保的DES,能高效地选择性浸出钴酸锂,降低湿法回收对预处理的要求,减少后续分离纯化的步骤。已有研究表明,柠檬酸对钴酸锂-铜具有一定的选择性浸出的效果。因此,本研究以柠檬酸为氢键受体,以价格低廉、不含卤族元素的绿色溶剂聚乙二醇为氢键供体,合成DES,并考察对钴酸锂-铜混合材料的浸出效果。研究有望促进钴酸锂电池回收的产业化开发,具有较好的参考价值。
2 实验 2.1 实验材料与仪器聚乙二醇200(polyethylene glycol,平均相对分子质量为200,PEG200,上海麦克林生化科技有限公司);柠檬酸(citric acid,CA,分析纯,纯度99%,上海麦克林生化科技有限公司);铜粉(分析纯,99%,上海麦克林生化科技有限公司);钴酸锂粉末(分析纯,99%,上海麦克林生化科技有限公司);锂、钴、铜标准溶液1 000 µg·mL−1,中国坛墨科技股份有限公司;硝酸(质量分数:65%,中国西陇科技有限公司);去离子水。集热式恒温加热磁力搅拌器(DF-101S,上海越众仪器设备有限公司);石墨电加热板(力辰科技公司);分析天平(梅特勒-托利多国际贸易(上海)有限公司);火焰原子吸收分光光度计T3000型(FAAS,美国赛默飞公司);核磁共振氢谱(600兆,瑞士Bruker公司)。
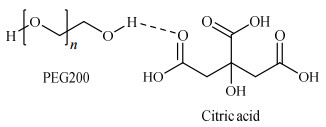
2.2 分析方法 2.2.1 聚乙二醇200-柠檬酸DES的合成采用PEG200充当氢键供体,与氢键受体CA结合,形成DES,结构如图 1所示。具体合成方法如下:将等物质的量的PEG200和CA缓慢加入500 mL圆底烧瓶中,反应温度为80 ℃,缓慢搅拌30 min。PEG200和CA经过固液两相通过氢键的相互作用,生成DES,溶液变为澄清透明均相体系。
|
图 1 聚乙二醇200与柠檬酸形成DES的结构示意图 Fig.1 DES formation from PEG200 and citric acid |
通过碱浸法去除锂电池破碎废料中铝片后的主要成分为钴酸锂-铜二元混合材料(LiCoO2-Cu)。本研究使用PEG200-CA为浸出剂,浸出钴酸锂-铜二元混合材料中锂、钴的同时分离铜。具体步骤为:向100 mL圆底烧瓶中加入20 g的PEG200-CA,在80 ℃水浴条件下,以600 r·min−1进行搅拌,并按照所需的固液比,在预热后的DES中加入钴酸锂-铜二元混合粉末(质量比m(Cu): m(LiCoO2)= 1:2)。充分混合后,依照等时间间隔通过一次性2 mL注射器吸取浸出液0.3~0.5 g,并用针筒过滤头过滤,样品称重后置于50 mL三角烧杯中,以备表征。
由于表征所用的火焰原子吸收光谱仪分析是基于火焰燃烧获得待测元素蒸气,进以吸收特征辐射,计算待测元素含量。而PEG200-CA中的有机烃结构会出现高温炭化现象,堵塞分析仪器,影响测试结果。因此在分析之前,需要通过湿法消解法除去有机物成分[24]。具体步骤为:在50 mL三角烧杯中,向待测溶液加入15 mL的硝酸溶液(体积比V(HNO3): V(H2O) = 1:3),充分振荡混合,置于180 ℃的石墨电热板上加热消解2 h。所有的测试溶液均由体积分数为2% 的硝酸稀释。
2.3 测试与表征 2.3.1 傅里叶变换红外光谱(FTIR)采用傅里叶变换红外光谱仪对PEG200-CA进行结构表征。ATR模式分析,测试温度为室温,扫描范围为4 000~650 cm−1,扫描速率为32 s−1,分辨率为4 cm−1。
2.3.2 核磁共振氢谱(1H-NMR)采用Bruker公司的600兆超导核磁共振仪进行测试,溶剂为二甲基亚砜(dimethyl sulfoxide,DMSO),质量浓度约为30 mg·mL−1。
2.3.3 火焰原子吸收光谱(FAAS)利用火焰原子吸收光谱测定浸出液中钴、锂、铜离子质量浓度。分别测定一定梯度质量浓度的标准金属离子溶液,绘制各种金属离子的标准曲线,得到吸光度和质量浓度之间的关系,从而测定金属离子的质量浓度。
随着金属离子质量浓度的升高,浸出液的黏度增大,如果通过测量体积的方式评估浸出液中金属离子质量浓度,误差较大,因此通过称重浸出液的质量计算浸出率η,如式(1):
| $ \eta {\rm{ = }}\frac{{{w_{i, {\rm{aq}}}}{m_0}}}{{{w_{i, {\rm{s}}}}{m_i}}} \times 100\% $ | (1) |
式中:
浸出液中锂离子与钴离子物质的量比
| $ {R_{{\rm{Li/Co}}}}{\rm{ = }}\frac{{{w_{{\rm{Li, aq}}}}/{M_{{\rm{Li}}}}}}{{{w_{{\rm{Co, aq}}}}/{M_{{\rm{Co}}}}}} \times 100\% $ | (2) |
式中:
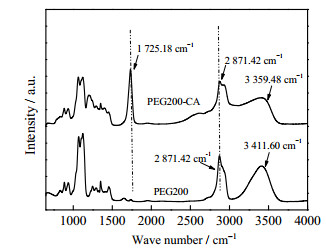
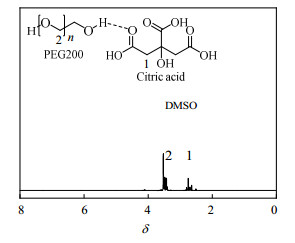
为了探究混合物内部氢键的相互作用,对制备的DES进行了FTIR表征,如图 2所示,PEG200纯组分的O─H伸缩振动峰出现在3 411.60 cm−1处,乙基的C─H伸缩振动峰出现在2 871.42 cm−1处。形成DES后,羟基的伸缩振动吸收峰位于3 359.48 cm−1处,与PEG200纯组分中的羟基吸收峰相比,发生了红移,且吸收峰变宽,表明DES的氢键作用强于PEG200自身纯组分。而形成的氢键作用会间接影响C═O的键力常数,形成DES后,C═O的伸缩振动峰增大到1 725.18 cm−1处,进一步说明PEG200中的氢原子与柠檬酸中的羰基氧原子之间发生相互作用,形成氢键。为进一步证明PEG200与CA之间的相互作用,对制备的PEG200-CA DES进行了核磁氢谱(1H-NMR)的表征,如图 3所示,纯PEG200在化学位移δ=4.48处有1个峰,在3.42和3.52处有2个多重峰,分别对应于─OH和─CH2基团。当PEG200与CA形成DES后,分别在3.4和2.74处存在2个多重峰,分别对应于PEG 200和CA的─CH2基团,积分面积比为1:1,证明PEG 200与CA的物质的量比为1:1。形成DES后,─OH基团消失,可能是质子转移造成的。
|
图 2 PEG200-CA及PEG200的红外谱图 Fig.2 FTIR spectra of PEG200-CA DES and PEG200 |
|
图 3 PEG200-CA DES的核磁氢谱 Fig.3 1H-NMR spectrum of PEG200-CA DES |
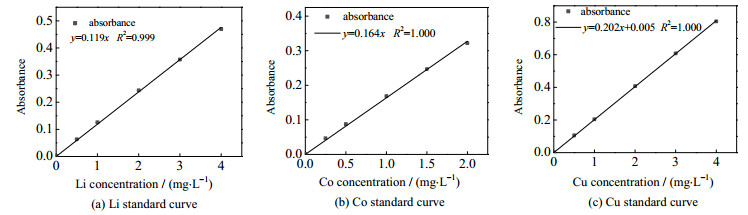
将1 000 µg·mL−1的金属离子标准溶液置于100 mL容量瓶中,用体积分数为2% 的HNO3稀释至0~4×10−6 mg·L−1质量浓度梯度。实验测定FAAS的吸光度,并绘制标准曲线,如图 4所示,标准曲线的线性相关度较好,R2均大于0.995。
|
图 4 原子吸收光谱标准曲线 Fig.4 Standard FAAS curves of different metal ions |
在PEG200与柠檬酸物质的量比n(PEG200): n(CA)=1:1、固液(固体材料与浸出剂DES)质量比为1:50、温度为100 ℃的条件下,考察浸出时间对钴、锂、铜浸出率及浸出液中锂、钴物质的量比的影响。如图 5(a)所示,随着时间的推移,3种金属的浸出率逐步增加,当浸出时间为1 h时,锂、钴和铜的浸出率分别为50%、89%、0;当浸出时间为5 h时,钴、锂的浸出率为71%、96%,铜开始浸出,浸出率为2%;浸出时间为5~8 h,钴、锂的浸出率趋于稳定。当浸出时间从1h增加至5h,锂离子的浸出率趋于稳定,而钴离子的浸出率逐渐上升,RLi/Co逐渐从1.8降低至1.35,5h后趋于稳定,如图 5(b)所示。因此,当浸出时间为5h,铜浸出率维持较低,对铜选择性较好;RLi/Co比更接近于1,更适合后续钴酸锂的再生。
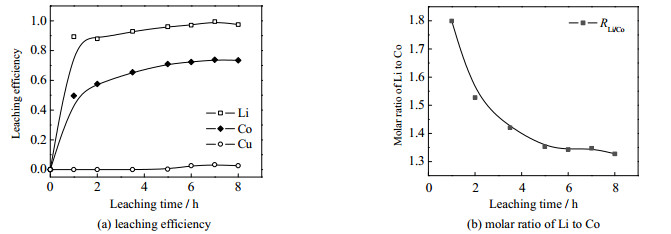
|
图 5 金属浸出率和锂/钴摩尔比随浸出时间的变化 Fig.5 Leaching performances at different leaching times |
在n(PEG200): n(CA)=1:1、固液质量比为1:100、浸出时间为5 h的条件下,考察浸出温度对钴、锂、铜浸出率及对铜选择性浸出效果的影响。如图 6所示,当温度为100 ℃时,锂、钴的浸出率最高,分别为96%、71%。该DES在较宽的温度范围内(90~120 ℃)对铜的浸出率始终低于5%,对铜具有较好的选择性浸出效果。当温度从90 ℃升至100 ℃时,锂的浸出率从93% 升至96%,钴的浸出率维持在71%。温度的升高能显著降低PEG200-CA的黏度,促进固液相之间的传质、提高固液接触效率。由于柠檬酸的电离为吸热过程,温度的升高促进质子的形成,从而促进钴酸锂的浸出。当温度升高至110 ℃时,锂、钴的浸出率均显著降低,锂、钴的浸出率分别为74%、45%。可能是由于柠檬酸开始挥发,导致柠檬酸质量浓度降低,浸出率下降。
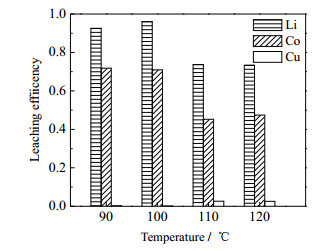
|
图 6 温度对浸出率的影响 Fig.6 Effect of temperature on leaching efficiency |
在n(PEG200): n(CA)=1:1、浸出温度为100 ℃、浸出时间为5 h的浸出条件下,考察固液质量比对钴、锂、铜浸出率的影响。如图 7所示,当固液质量比从1:1 000增至1:50时,锂和钴的浸出率均逐渐降低,锂的浸出率从99%降低至82%,钴的浸出率从94% 降低至61%。这是因为固液比增大,反应体系中固液接触面减小,且固体质量占比高,反应体系黏度上升,不利于传质,钴、锂的浸出率降低。当固液质量比为1:1 000、1:500时,锂与钴浸出率虽高,但所消耗的浸出剂量大,不适宜工业化应用。当固液质量比为1:100时,锂和钴的浸出率分别为96%、71%,固液比适中,浸出效果较好,为合适的固液比。
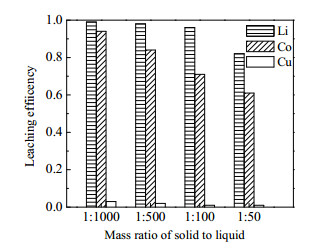
|
图 7 固液比对浸出率的影响 Fig.7 Effect of solid-liquid ratio on leaching efficiency |
由于CA的特殊结构导致制备的二元PEG200-CA的黏度较大、流动性低,与钴酸锂-铜混合粉末传质困难,而加入水组分后,三元DES的黏度降低,且大多数DES的氢键网络结构能保持至水质量分数约为42%[25-26]。因此本研究合成了具有不同的水质量分数w(H2O)(0、10%、20%、30%)的PEG200-CA (物质的量比为1:1),并分析其对钴酸锂-铜混合粉末浸出效果的影响。为比较不同的水质量分数的三元DES与二元DES对钴酸锂-铜混合粉末的浸出效果,表 1列出了在100 ℃、固液质量比为1:100、浸出时间为5 h下,不同的DES对钴酸锂-铜混合粉末的浸出效果。由表 1可知,二元PEG200-CA (1:1)对铜的浸出率较低,为2%,而对锂、钴的浸出率分别为96%、71%。当水质量分数为10% 的PEG200-CA (物质的量比为1:1)浸取钴酸锂-铜粉末时,铜的浸出率显著增加至24%。虽然加入少量去离子水能够有效降低DES黏度,但对锂、钴的浸出率没有起到显著提升的效果。这是由于在水合作用时,DES的结构会受到轻微的破坏,分子间配位数降低至纯DES的90%,其中的水分子在DES中充当了二级氢键供体分子,对钴、锂的浸出没有明显的浸出作用[27]。在不存在还原剂的情况下,柠檬酸能够与铜反应结合形成柠檬酸铜及氢气[11],而去离子水的加入能促进柠檬酸的电离,显著促进铜的溶解。而当水质量分数增加至30% 时,柠檬酸的浓度显著下降,导致铜的浸出率显著降低。当水的质量分数达到20%~30% 时,钴离子逐渐与溶剂中的柠檬酸根与水分子形成水合结晶物,生成红棕色沉淀,导致传质困难,使得浸出剂的浓度下降,当水的质量分数为30% 时,锂的浸出率降低至82%,铜的浸出率为25%。
|
|
表 1 浸出剂对锂、钴、铜浸出率的影响 Table 1 Leaching efficiency of lithium, cobalt and copper by different leaching agents |
根据2.2节的研究结果,浸出的合适条件为100 ℃、固液质量比1:100、浸出时间为5 h、n(PEF200): n(CA)=1:1)钴、锂、铜的浸出率分别为71%、95%、2%。作为比较,本研究列出了一些DES对废弃LIBs中金属的浸出效果,如表 2所示。相比于其他的DES,n(PEG200): n(CA)=1:1在相对温和的条件下,对钴酸锂-铜混合材料具有更好的选择性浸出的能力。此外,这些DES无需额外加入还原剂,却能在较温和的条件下对LiCoO2具有较高浸出率,一般是通过还原络合的机制实现的。如尿素(urea)、乙醇(ethanol)、乙二醇(ethylene glycol,EG)、硫脲(thiourea)等均具有一定的还原性[28],将LiCoO2中的Co3+还原为Co2+,氯化胆碱(ChCl)中的电负性较强的Cl−能与Co2+/Li+等发生络合作用,从而能够更高效地浸出钴酸锂[23]。而聚乙二醇200-硫脲(PEG200-thiourea)中长链聚乙二醇的─O─,距离两端的吸电子基团─OH较远,具有较强的电负性,与─N─,─S─,─O─相比,长链聚乙二醇的─O─与缺电子基团Co3+/Li+结合能力更强,最有可能是Co2+、Li+的结合位点[31]。
|
|
表 2 聚乙二醇-柠檬酸与一些报道的低共熔溶剂对正极材料的浸出效果比较 Table 2 Comparison of leaching results of positive electrode materials by PEG200-CA and some reported eutectic solvents for spent lithium-ion batteries recycling |
大多数研究的DES仅针对几乎纯化后的LiCoO2的浸出,对集流体铜片等杂质的浸出并未考虑。而Peeter等[23]发现,相对于ChCl、CA、HCl溶液,ChCl-CA (1:1)+H2O(w(H2O)=30%)对单质铜、铝及钴酸锂都具有更强的溶解能力。可能是铜在此过程中具有一定的还原剂的作用,Cl−将LiCoO2的晶体结构破坏,Cu将Co3+还原为Co2+,而自身形成Cu2+与Cu+,并与Cl−络合,形成[CuCl2] −。与该DES体系相比,PEG200-CA (物质的量比为1:1)中CA的─OH将Co3+还原成Co2+,与浸出液呈粉色的现象一致。而DES中PEG200长链上的─O─与缺电子基团Li+与Co2+结合,从而促进浸出。而在水分子含量较低时,柠檬酸较难电离,因此对Cu具有较低的浸出率。
浸出后的Li+和Co2+会与失去质子的有机酸分子发生络合反应,以有机金属络合物的形式存在于浸出液中。一般来说,浸出液中的金属元素通过过滤、萃取除杂、沉淀(如加入与金属离子结合能力更强的阴离子CO32−、OH−、C2O42−等)后焙烧合成氧化钴或溶胶凝胶法(如加入螯合剂CA、PEG200等)再合成正极材料钴酸锂,实现金属元素的提纯和进一步回收。本研究中过滤得到的浸出液中CA和PEG200含量较高,在加热搅拌下螯合锂离子和钴离子形成凝胶前驱体的可行性较大,具有在浸出液中再生钴酸锂的潜力。
4 结论本研究采用一种新型的聚乙二醇-柠檬酸低共熔溶剂,用于选择性浸出含铜的钴酸锂粉末中的钴、锂,考察了不同含水量的三元低共熔溶剂及浸出条件对浸出效果的影响。结果表明,加入去离子水后的三元低共熔溶剂黏度降低,但对浸出没有明显的促进作用,且水量的增大会导致钴离子的沉淀,影响浸出效果。优化后的浸出条件为:温度为100 ℃,浸出时间为5 h,固液质量比为1:100,此时锂、钴和铜的浸出率分别为96%、71%、2%。说明该溶剂可同时浸取锂、钴离子和分离铜。与已报道的DES体系相比,该溶剂可能以还原络合的机制浸出钴酸锂,可以在相对短时间、温和的反应温度、不添加额外的还原剂的情况下,表现出较好的选择性浸出性能,为直接对含铜杂质的钴酸锂正极材料的回收利用提供了技术参照。
| [1] |
MAKUZA B, TIAN Q H, GUO X Y, et al. Pyrometallurgical options for recycling spent lithium-ion batteries: A comprehensive review[J]. Journal of Power Sources, 2021, 491: 229622. DOI:10.1016/j.jpowsour.2021.229622 |
| [2] |
ROY J J, CAO B, MADHAVI S. A review on the recycling of spent lithium-ion batteries (LIBs) by the bioleaching approach[J]. Chemosphere, 2021, 282: 130944. DOI:10.1016/j.chemosphere.2021.130944 |
| [3] |
YAO Y L, ZHU M Y, ZHAO Z, et al. Hydrometallurgical processes for recycling spent lithium-ion batteries: A critical review[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(11): 13611-13627. |
| [4] |
MESHRAM P, PANDEY B D, MANKHAND T R. Hydrometallurgical processing of spent lithium ion batteries (LIBs) in the presence of a reducing agent with emphasis on kinetics of leaching[J]. Chemical Engineering Journal, 2015, 281: 418-427. DOI:10.1016/j.cej.2015.06.071 |
| [5] |
YANG Y, XU S M, HE Y H. Lithium recycling and cathode material regeneration from acid leach liquor of spent lithium-ion battery via facile co-extraction and co-precipitation processes[J]. Waste Management, 2017, 64: 219-227. DOI:10.1016/j.wasman.2017.03.018 |
| [6] |
祝宏帅, 孙金峰, 胡启阳, 等. 磷酸体系应用于失效磷酸铁锂电池正极材料回收的研究[J]. 高校化学工程学报, 2017, 31(5): 1238-1244. ZHU H S, SUN J F, HU Q Y, et al. Application of phosphoric acid system in positive electrode material recovery from invalid lithium iron phosphate batteries[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(5): 1238-1244. |
| [7] |
LI L, DUNN J B, ZHANG X X, et al. Recovery of metals from spent lithium-ion batteries with organic acids as leaching reagents and environmental assessment[J]. Journal of Power Sources, 2013, 233: 180-189. DOI:10.1016/j.jpowsour.2012.12.089 |
| [8] |
LI L, GE J, CHEN R J, et al. Environmental friendly leaching reagent for cobalt and lithium recovery from spent lithium-ion batteries[J]. Waste Management, 2010, 30(12): 2615-2621. DOI:10.1016/j.wasman.2010.08.008 |
| [9] |
FAN E, YANG J B, HUANG Y X, et al. Leaching mechanisms of recycling valuable metals from spent lithium-ion batteries by a malonic acid-based leaching system[J]. ACS Applied Energy Materials, 2020, 3(9): 8532-8542. DOI:10.1021/acsaem.0c01166 |
| [10] |
LI L, FAN E, GUAN Y B, et al. Sustainable recovery of cathode materials from spent lithium-ion batteries using lactic acid leaching system[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(6): 5224-5233. |
| [11] |
MENG F, LIU Q C, KIM R, et al. Selective recovery of valuable metals from industrial waste lithium-ion batteries using citric acid under reductive conditions: Leaching optimization and kinetic analysis[J]. Hydrometallurgy, 2020, 191: 105160. DOI:10.1016/j.hydromet.2019.105160 |
| [12] |
LI L, GE J, WU F, et al. Recovery of cobalt and lithium from spent lithium ion batteries using organic citric acid as leachant[J]. Journal of Hazardous Materials, 2010, 176(1/2/3): 288-293. |
| [13] |
YAO L, FENG Y, XI G X. A new method for the synthesis of LiNi1/3Co1/3Mn1/3O2 from waste lithium ion batteries[J]. RSC Advances, 2015, 5(55): 44107-44114. DOI:10.1039/C4RA16390G |
| [14] |
NAYAKA G P, PAI K V, SANTHOSH G, et al. Recovery of cobalt as cobalt oxalate from spent lithium ion batteries by using glycine as leaching agent[J]. Journal of Environmental Chemical Engineering, 2016, 4(2): 2378-2383. DOI:10.1016/j.jece.2016.04.016 |
| [15] |
ABBOTT A P, CAPPER G, DAVIES D L, et al. Solubility of metal oxides in deep eutectic solvents based on choline chloride[J]. Journal of Chemical & Engineering Data, 2006, 51(4): 1280-1282. |
| [16] |
JIANG J Y, BAI X Y, ZHAO X H, et al. Poly-quasi-eutectic solvents (PQESs): Versatile solvents for dissolving metal oxides[J]. Green Chemistry, 2019, 21(20): 5571-5578. DOI:10.1039/C9GC02604E |
| [17] |
RODRIGUEZ R N, MACHIELS L, BINNEMANS K. p-Toluenesulfonic acid-based deep-eutectic solvents for solubilizing metal oxides[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(4): 3940-3948. |
| [18] |
RICHTER J, RUCK M. Synthesis and dissolution of metal oxides in ionic liquids and deep eutectic solvents[J]. Molecules, 2020, 25(1): 78. |
| [19] |
DAMILANO G, LAITINEN A, WILLBERG-KEYRILÄINEN P, et al. Effects of thiol substitution in deep-eutectic solvents (DESs) as solvents for metal oxides[J]. RSC Advances, 2020, 10(39): 23484-23490. DOI:10.1039/D0RA03696J |
| [20] |
JENKIN G R T, AL-BASSAM A Z M, HARRIS R C, et al. The application of deep eutectic solvent ionic liquids for environmentally-friendly dissolution and recovery of precious metals[J]. Minerals Engineering, 2016, 87: 18-24. DOI:10.1016/j.mineng.2015.09.026 |
| [21] |
TRAN M K, RODRIGUES M T F, KATO K, et al. Deep eutectic solvents for cathode recycling of Li-ion batteries[J]. Nature Energy, 2019, 4(4): 339-345. DOI:10.1038/s41560-019-0368-4 |
| [22] |
SCHIAVI P G, ALTIMARI P, BRANCHI M, et al. Selective recovery of cobalt from mixed lithium ion battery wastes using deep eutectic solvent[J]. Chemical Engineering Journal, 2021, 417: 129249. DOI:10.1016/j.cej.2021.129249 |
| [23] |
PEETERS N, BINNEMANS K, RIAÑO S. Solvometallurgical recovery of cobalt from lithium-ion battery cathode materials using deep-eutectic solvents[J]. Green Chemistry, 2020, 22(13): 4210-4221. DOI:10.1039/D0GC00940G |
| [24] |
刘明家, 周志强, 祖元刚, 等. 湿法消解-火焰原子吸收法测定动物样品中六种金属元素[J]. 光谱学与光谱分析, 2012, 32(7): 1961-1964. LIU M J, ZHOU Z Q, ZU Y G, et al. Determination of six metal elements in animal samples by flame absorption spectrometry with wet digestion[J]. Spectroscopy and Spectral Analysis, 2012, 32(7): 1961-1964. |
| [25] |
QUINLAN F T, VIDU R, PREDOANA L, et al. Lithium Cobalt Oxide (LiCoO2) Nanocoatings by sol−gel methods[J]. Industrial & Engineering Chemistry Research, 2004, 43(10): 2468-2477. |
| [26] |
HAMMOND O S, BOWRON D T, JACKSON A J, et al. Resilience of malic acid natural deep eutectic solvent nanostructure to solidification and hydration[J]. The Journal of Physical Chemistry B, 2017, 121(31): 7473-7483. DOI:10.1021/acs.jpcb.7b05454 |
| [27] |
SINGH A, WALVEKAR R, KHALID M, et al. Thermophysical properties of glycerol and polyethylene glycol (PEG 600) based DES[J]. Journal of Molecular Liquids, 2018, 252: 439-444. DOI:10.1016/j.molliq.2017.10.030 |
| [28] |
WANG S B, ZHANG Z T, LU Z G, et al. A novel method for screening deep eutectic solvent to recycle the cathode of Li-ion batteries[J]. Green Chemistry, 2020, 22(14): 4473-4482. DOI:10.1039/D0GC00701C |
| [29] |
ROLDÁN-RUIZ M J, FERRER M L, GUTIÉRREZ M C, et al. Highly efficient p-toluenesulfonic acid-based deep-eutectic solvents for cathode recycling of Li-ion batteries[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(14): 5437-5445. |
| [30] |
巩珊珊, 吴彤, 王官格, 等. 基于高效回收废旧锂离子电池正极材料的低共熔溶剂的筛选[J]. 高等学校化学学报, 2021, 42(10): 3151-3159. GONG S S, WU T, WANG G G, et al. Screening of deep eutectic solvent based on efficient recovery of spent lithium-ion battery cathode materials[J]. Chemical Journal of Chinese Universities, 2021, 42(10): 3151-3159. |
| [31] |
CHEN Y, LU Y H, LIU Z H, et al. Efficient dissolution of lithium-ion batteries cathode LiCoO2 by polyethylene glycol-based deep eutectic solvents at mild temperature[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(31): 11713-11720. |




