2. 西安交通大学 动力工程多相流国家重点实验室, 陕西 西安 710049
2. State Key Laboratory of Multiphase Flow in Power Engineering, Xi'an Jiaotong University, Xi'an 710049, China
1, 4-丁二醇(1, 4-butanediol,BDO)是一种含有4个碳原子的二元伯醇,主要用于生产包括四氢呋喃(tetrahydrofuran,THF)[1]、γ-丁内酯(gamma-butyrolactone,GBL)[2]、聚对苯二甲酸丁二醇酯(polybutylene terephthalate,PBT)[3]、聚氨基甲酸酯(polyurethane,PU)[4]等在内的一系列精细化学品,是十分重要的化工原料。然而,随着近年来BDO产业的迅速扩张,整个行业步入供过于求的时代[5]。探索更多的BDO下游产品生产工艺,扩展BDO产业链,缓解产能过剩所带来的风险是目前急需解决的问题。3-丁烯-1-醇(3-butene-1-ol,BTO)是一种高价值的不饱和醇类化合物,常用作医药、农化产品以及食品添加剂等产品的中间体,尤其在新型杂环类药物、抗肿瘤药物、抗艾滋药物的合成中具有不可替代的地位[6-7]。从BDO脱水制备BTO不但为BTO规模化生产提供了新工艺,同时对BDO下游产业链的扩展也具有重要的意义。然而,BDO脱水是一个较为复杂的反应网络,能够发生包括脱水、脱氢、异构化和加氢等多种反应[8],各反应或相互竞争,或相互促进,共同决定了BDO脱水反应的产物分布。然而,目前的BDO脱水反应研究主要集中于催化剂的开发,对于反应机理的研究却很少[9-12]。
反应体系的热力学分析、微观反应动力学研究对于催化剂的设计、反应器的选型、工艺流程的优化乃至反应过程的强化具有十分重要的意义。王丽苹等[13]采用Benson和Joback基团贡献法对碳酸二甲酯与BDO合成聚碳酸酯二醇的反应体系进行了热力学分析,计算了BDO在不同温度下的生成焓、摩尔等压热容以及标准熵。Qian等[14]研究了BDO与环己酮的缩酮反应,并对体系的热力学性质进行了分析。Ermelinda等[15]通过实验的方法报道了BDO不同异构体之间的蒸发焓。Zorebski等[16]测量了不同温度下BDO的摩尔热容。这些研究虽然涉及了BDO部分热力学性质的计算和测量,但本反应体系中所涉及的3-丁烯-1-醇、反-2-丁烯-1-醇、顺-2-丁烯-1-醇、γ-丁内酯等物质的热力学数据却未见报道,无法直接进行BDO脱水反应网络热力学分析,可采用量子化学的方法对反应的热力学及其微观机理进行理论研究。Alexopoulos等[17]采用密度泛函理论研究了乙醇脱水反应网络,不仅分析了乙醇脱水生成乙烯和乙醚的反应路径,还提出了乙醚进一步分解生成乙烯和乙醇的反应机理,并计算了相应的动力学数据。John等[18]采用第一性原理对丁醇脱水反应进行了研究,提出了反应网络中各反应的反应机理,并通过过渡态理论对相应的动力学参数进行了计算。同时,John等还发现,提高反应温度并降低丁醇分压有利于其脱水生成丁烯。反之,则有利于分子间脱水产物二丁醚的生成。
基此,本文将通过量子化学的方法,对反应体系中各反应物和产物进行结构优化和频率计算,得到BDO脱水反应网络中各反应在不同温度下的热力学参数,并以此对反应体系进行热力学分析。同时,对各反应的过渡态及反应路径进行搜索,确定反应的微观机理。以变分过渡态理论为基础,对反应体系中各反应的动力学性质进行研究,以期为该反应体系催化剂的设计以及工艺参数的优化提供理论依据。
2 计算方法BDO脱水反应网络如图 1所示,主要包括7个反应,即BDO脱水生成BTO的主反应(反应1),BDO环化脱水生成THF(反应2)和BDO脱氢生成GBL(反应3)的2个平行副反应,BTO发生双键异构化生成反-2-丁烯-1-醇(trans-2-buten-1-ol, T-2BT1O,反应4)和同分异构体顺-2-丁烯-1-醇(cis-2-buten-1-ol, C-2BT1O,反应5),以及BTO脱水生成1, 3-丁二烯(1, 3-butadiene, BDE,反应6)和BTO加氢生成丁醇(butanol,BuOH,反应7) 4个串联副反应[3, 5-6, 8]。
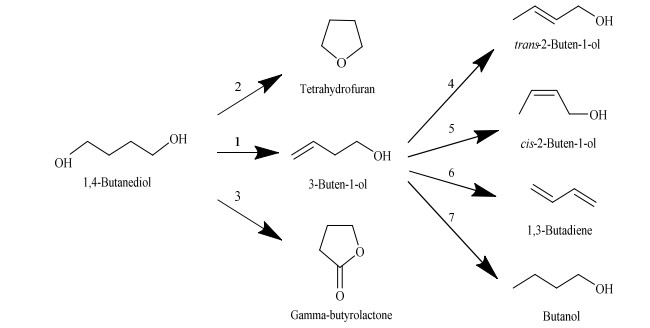
|
图 1 BDO脱水反应网络 Fig.1 Reaction network of BDO dehydration |
本研究利用密度泛函理论通过Gaussian 09软件包对上述反应进行量子化学计算[19-20]。采用m06-2x泛函,6-311g+(d, p)基组对反应体系中各物质进行几何结构优化和频率分析,以得到各物质的零点能、焓和熵。同时采用更高级别的def2-TZVPP基组对优化后的构型进行单点能计算,得到优化构型的电子能量E。这一组合方法具有较高的性价比既能保证计算精度又能节约计算成本[21-22]。各物质的Gibbs自由能可由式(1)计算得到
| $G = E + Z{\rm{PE}} + \Delta H - T \times S$ | (1) |
式中:ΔH为该物质目标温度及绝对零度下焓值的差值(H(T)-H(0))。同时,采用Alecu等[23]拟合的谐振频率校正因子对各物质的热力学性质进行校正。并通过式(2)~(4)计算各反应的热力学参数:
| ${\Delta _{\rm{r}}}{H_{\rm{m}}} = \sum\limits_{i = 1}^n {{\nu _i}{H_{\rm{P}}} - } \sum\limits_{j = 1}^s {{\nu _j}{H_{\rm{R}}}} $ | (2) |
| ${\Delta _{\rm{r}}}{G_{\rm{m}}} = \sum\limits_{i = 1}^n {{\nu _i}{G_{\rm{P}}} - } \sum\limits_{j = 1}^s {{\nu _j}{G_{\rm{R}}}} $ | (3) |
| ${\Delta _{\rm{r}}}G_{\rm{m}}^\Theta = - RT\ln {K^\Theta }$ | (4) |
通过对反应物和产物的几何结构进行分析,猜测初始的过渡态结构并通过TS(Transition State)方法对各反应可能的过渡态进行搜索。对所得过渡态的结构进行频率计算,验证其虚频的个数,并进行自然键轨道(natural bond orbital,NBO)分析。随后,通过内禀反应坐标(intrinsic reaction coordinate,IRC)的计算获取反应过程中的最小能量路径(minimum energy path,MEP),并以此来判断过渡态结构的合理性[24]。
基于反应路径的计算,利用KiSThelP开源软件(Kinetic and Statistical Thermodynamical Package)[25],以变分过渡态理论为基础计算各反应的反应速率常数:
| $k(s, T) = \frac{\sigma }{{h\beta }} \times \frac{{{Q^ \ne }(T)}}{{{Q^{\rm{R}}}(T)}}{\exp _{}}\left[ { - \beta \Delta V({s^ \ne })} \right]$ | (5) |
此外,通过Wigner方法计算隧道校正因子κ,并对反应速率常数进行隧道效应校正。其中Wigner方法计算如式(6):
| $\kappa (T) = 1 + \frac{1}{{24}}{\left| {{\omega ^ \ne }\beta } \right|^2}$ | (6) |
考虑隧道效应后的反应速率常数表达式如下:
| ${k_{{\rm{tunnel}}}}(T) = \kappa (T)k(s, T)$ | (7) |
本文在m06-2x/6-311g+(d, p)水平上对反应物和产物进行结构优化,优化后各物质的构型如图 2所示,其吉布斯自由能可以由式(1)计算得到。采用Alecu等[23]报道的谐振频率校正因子对反应物及产物进行校正,并通过式(2)~(4)计算不同反应温度下各反应的热力学数据。其中,部分物质热力学参数、结构的计算值与文献报道的实验值如表 1所示,从表中可见其相对误差最大不超过2%,表明本文的计算方法较为可靠,可以用来对BDO脱水反应体系进行理论计算。
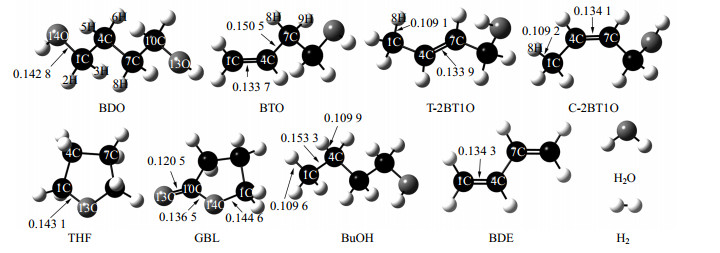
|
图 2 BDO反应网络中各物质的优化几何结构(键长单位为nm) Fig.2 Optimized geometries of chemicals in BDO reaction network |
|
|
表 1 计算结果验证 Table 1 Verification of calculated results |
不同温度下各反应的摩尔反应焓如图 3所示。从图中可以看出反应1、反应6以及反应3的摩尔反应焓都大于0,均属于吸热反应,但是各摩尔反应焓随温度的变化趋势和程度有所不同。反应3的吸热量最大,且随着反应温度的升高,摩尔反应焓迅速增加。反应1、反应6也是吸热反应,但是其吸热量低于反应3,且随着反应温度的升高,摩尔反应焓的变化并不明显。反应2、反应4、反应5以及反应7的摩尔反应焓都小于0,属于放热反应。其中,在T = 298 K时,反应7的反应放热量最大,反应2放热量最小;随着反应温度的增加,反应2摩尔焓变的绝对值迅速增加,在T = 800 K时成为放热量最大的反应。反应4和反应5也均为放热反应,其摩尔反应焓的绝对值也随着反应温度的升高而增加。总之,反应1、反应3和反应6为吸热反应,反应2、4、5和7为放热反应。
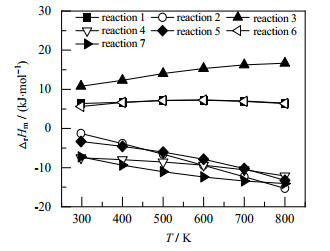
|
图 3 不同温度下各反应的摩尔反应焓 Fig.3 Molar enthalpy of reactions at different temperatures |
不同温度下各反应的摩尔反应Gibbs自由能变如图 4所示。在T = 298~800 K时,所有反应的摩尔Gibbs自由能变均小于零,说明其在热力学上都是能够自发进行的[33]。
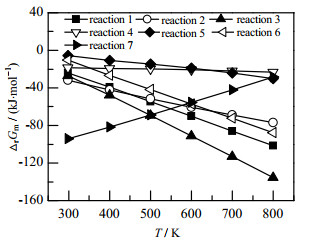
|
图 4 不同温度下各反应的摩尔反应Gibbs自由能 Fig.4 Molar Gibbs free energy of reactions at different temperatures |
BDO脱水反应网络中各反应平衡常数KΘ与反应温度的关系如图 5所示。在T = 298~800 K时,反应1、3、6的反应平衡常数较大,且随着温度的升高,平衡常数进一步增加。因此,温度升高有利于其正反应的进行[34]。反应2、4、7的平衡常数随温度的升高不断下降,说明高温不利于其正反应的进行。值得注意的是,反应5虽然是放热反应,但由于有摩尔反应熵及反应温度的影响,其平衡常数随着温度的升高而略有增加,表明高温对其反应的正向进行有利。此外,从图 4和5中可以看出,反应2的摩尔反应Gibbs自由能随着反应温度的增加逐渐减小,其平衡常数也是逐渐减小的。这是因为反应平衡常数是通过式(4)计算得到的,当摩尔反应Gibbs自由能的绝对值增加速率小于反应温度T的增加速率时,反应平衡常数便呈现出逐渐减小的趋势。

|
图 5 不同温度下各反应的反应平衡常数 Fig.5 Reaction equilibrium constants of reactions at different temperatures |
对于BDO脱水反应网络来说,反应1、2、3的平衡常数都在较高的水平上,三者都可以达到很高的反应程度。同时,由于反应6和7的平衡常数也非常大,在反应达到平衡时,通过反应1生成的BTO会继续脱水转化为BDE等串联副反应产物,从而导致平衡产物中BTO的含量降低。在低温下,由于生成BuOH的反应平衡常数远大于其他反应的平衡常数,反应体系中会生成大量的BuOH。随着反应温度的提高,BTO脱水生成BDE的反应平衡常数迅速增大,平衡产物中的BTO进一步反应生成大量的BDE。可以看出,由于各反应的平衡常数都较高,反应程度较大,热力学平衡有利于完全脱水产物BDE的生成。
尽管各反应的平衡常数随着温度的升高有不同的变化趋势,但是基本上所有反应的平衡常数都非常大,当反应温度大于500 K时,除BTO异构化反应之外,所有反应的对数ln KΘ都大于9.2。一般认为,当平衡常数K大于105(ln KΘ > 9.2)时,反应即认为是不可逆反应[35]。对于复杂反应网络来说,若产物的分布是根据热力学平衡得到,则可称该反应为热力学控制(thermodynamic control);若产物的分布取决于反应速率,则可称为动力学控制(kinetic control),而不可逆反应的主要产物通常是动力学控制的产物[36]。因此,对于BDO脱水反应网络来说,在研究的温度范围,产物分布主要受动力学控制。要想提高产物中BTO含量,必须对各反应速率进行控制。因此,对反应网络中各反应路径及其动力学特性的研究是十分必要的。
3.2 1, 4-丁二醇脱水反应体系分析上述分析发现,BDO脱水反应体系为动力学控制,必须通过提高BTO生成速率,同时降低平行副反应及串联副反应的速率来实现脱水产物中BTO含量的提高。为此,有必要对各反应机理及动力学进行分析,以此为催化剂的设计、反应条件的优化等研究内容提供理论支撑。
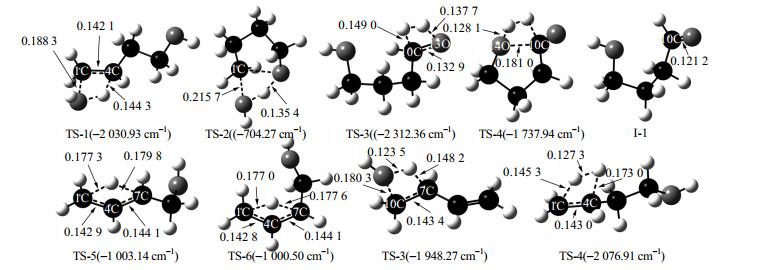
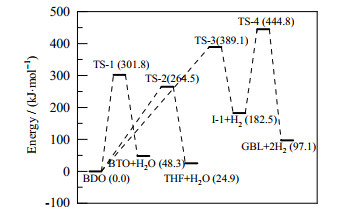
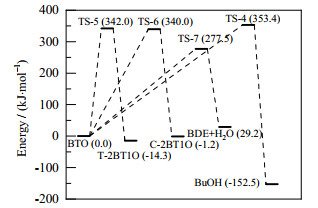
在优化反应物和产物构型基础上,对各反应进行过渡态搜索和IRC计算,可以得到各反应过渡态及中间产物的优化结构,如图 6所示。反应过程中的能量变化如图 7、8所示。
|
图 6 反应过程中各驻点的结构(键长单位为nm;括号内为驻点虚频) Fig.6 Optimized geometries of stationary points in the reaction processes (the bond length unit is nm; imaginary frequency of stationary points is in the brackets) |
|
图 7 反应1、2、3的势能剖面图 Fig.7 Relative potential energy profiles of reaction 1, 2 and 3 (the potential energy of BDO equals to 0) |
|
图 8 反应4、5、6、7的势能剖面图 Fig.8 Relative potential energy profiles of reaction 4, 5, 6 and 7 (the potential energy of BTO equals to 0) |
结合图 2及6可以发现,反应1是BDO经由过渡态TS-1生成BTO和H2O的一步反应,该过程需要克服301.8 kJ·mol-1的势垒。反应开始时,5H向14O方向移动,5H-4C和1C-14O键长因此逐渐伸长,而1C-4C键长逐渐变短,形成了一个含有1C-4C-5H-14O四元环的过渡态结构。在此过程中,5H-4C键长从0.110 1 nm逐渐伸长到0.144 3 nm;同时,1C-14O键从0.142 9伸长到0.188 3 nm,而1C-4C键长则从0.153 0减小到0.142 1 nm,并逐渐从单键向双键过渡。14O-5H距离则缩短到0.126 0 nm,有进一步缩短形成新化学键的趋势。5H原子上的电子向邻近C原子及O原子上转移,本身正电荷增加0.209 6。1C上的负电荷增加了0.069 7,4C上的负电荷增加了0.095 3,电子密度的增加使得C-C逐渐过渡为C=C。同时,5H上的电子向14O转移,使得14O负电荷增加了0.118 2,进而有利于14O和5H的化学键的形成。随着反应越过过渡态TS-1,1C-14O及5H-4C键长继续伸长,单键逐渐减弱并断裂。同时,1C=4C双键逐渐生成,5H也继续向14O方向移动,并最终成键,生成产物BTO及H2O。
3.2.2 1, 4-丁二醇脱水生成四氢呋喃对反应2而言,BDO克服了264.5 kJ·mol-1的势垒形成过渡态TS-2,并进一步生成环化产物THF和H2O。首先,BDO分子需要进行构型扭转使得碳链两端的1C和10C相互接近。随后,15H也逐渐向14O移动,二者距离则缩短到0.108 7 nm,1C-14O因此逐渐伸长到0.215 7 nm。13O则逐渐向1C靠近,距离缩短到0.225 8 nm。同时13O-15H逐渐伸长到0.135 4 nm,形成了一个1C-14O-15H-13O的四元环过渡态。C-O键的逐渐断裂以及13O的靠近导致14O及1C上负电荷分别从-0.745 9和-0.088 0增加到-0.893 7和-0.118 5。在14O和13O的共同作用下,15H上的电荷从0.464 3增加到0.516 1。随着反应越过过渡态TS-2,1C-14O以及13O-15H键断裂,新的1C-13O及14O-15H键形成,生成了产物THF和H2O。新的1C-13O键长为0.143 1 nm,14O-15H键长为0.096 5 nm。
3.2.3 1, 4-丁二醇脱氢生成γ-丁内酯从图 6和7中可以看出,反应3是一个典型的2步反应,可分别标记为反应3-1和反应3-2。在反应3-1中,BDO首先克服了389.1 kJ·mol-1的势垒形成过渡态TS-3,并脱氢生成中间体I-1;在反应3-2中,I-1则通过过渡态TS-4继续脱氢生成产物GBL,过程中克服了262.3 kJ·mol-1的势垒。
反应过程中,11H首先向15H方向移动,键长缩短为0.101 4 nm;10C-11H及13O-15H键也随之逐渐伸长,10C-11H键长从原来的0.110 1伸长到0.149 0 nm,13O-15H从原来的0.096 5伸长到0.137 7 nm;10C-13O从原来的0.143 0缩短到0.132 9 nm,其C-O逐渐由单键向双键转变,进而形成了过渡态TS-3。当反应越过过渡态TS-3后,10C-11H及13O-15H键逐渐断裂,10C-13O由单键转化为双键,形成中间体I-1。同时,11H-15H也形成单键,实现了H2的脱除。
随后,中间体I-1中14O逐渐靠近10C,二者距离在过渡态时缩短到0.180 8 nm;10C及14O上的电子转移至12H与16H上,12H及16H上的电荷因此分别从0.146 3和0.478 5降低到-0.097 4和0.312 2。同时,10C-12H以及14O-16H分别从原来的0.111 0及0.096 9 nm伸长到0.160 2及0.128 1 nm。12H逐渐靠近16H,二者之间的距离逐渐缩短到0.098 0 nm,形成过渡态TS-4。随着反应越过过渡态,10C-14O新键生成,键长为0.136 5 nm,得到产物GBL;同时14O-16H和10C-12H键断裂,12H-16H单键生成,脱除了另一份H2。
3.2.4 3-丁烯-1-醇异构化生成反-2-丁烯-1-醇反应4为BTO经过过渡态TS-5异构生成T-2BT1O的反应。反应开始时,7C-8H键长从0.109 9伸长到0.179 8 nm,8H向1C方向移动;H原子上电子主要向4C上转移,8H上的正电荷由原来的0.248 6增加到0.428 7;同时,1C-4C键也随着8H原子的移动开始从双键向单键的转变;4C-7C单键也在逐渐缩短,键长从原来的0.150 5减小到0.144 1 nm。8H原子的移动使得分子上形成了一个1C-4C-7C-8H的四元环,也标志着过渡态TS-5的生成。当反应越过过渡态后,随着8H向1C方向的移动,7C-8H键断裂,1C-8H键逐渐形成。此时也伴随着双键从1C-4C上移动至4C-7C上。随着1C-8H的键长缩短到0.109 4 nm,1C-4C键长伸长到0.150 2 nm,4C-7C键长缩短至0.133 9 nm,TS-5转化为T-2BT1O。
3.2.5 3-丁烯-1-醇异构化生成顺-2-丁烯-1-醇反应5与反应4的过程非常相似,是由BTO经过过渡态TS-6异构生成C-2BT1O的反应,过程需要克服340.0 kJ·mol-1的势垒。反应开始时,9H向1C方向移动,同时1C-4C键长逐渐增加而4C-7C单键逐渐缩短,形成过渡态TS-6。当反应越过过渡态后,9H与1C成键,7C-9H键断裂,双键从1C-4C上转移到4C-6C上,生成了C-2BT1O。
3.2.6 3-丁烯-1-醇脱水生成1, 3-丁二烯反应6的机理与反应1非常相近,BTO克服277.5 kJ·mol-1势垒形成过渡态TS-7,随后脱水生成BDE。13O原子首先向9H原子靠近;H原子上的电子主要向邻近的O原子和C原子上转移,9H上的正电荷由原来的0.248 6增加到0.443 6;同时,7C原子上的负电荷由原来的-0.507 6增加到-0.596 7。10C-13O键以及7C-9H键随着13O向9H方向的移动,其键长分别从0.143 0以及0.109 9增加到0.180 3和0.148 2 nm。9H原子的移动使得分子上形成了一个7C-10C-13O-9H的四元环过渡态。当反应越过过渡态后,7C上的电子继续向10C上移动,同时9H上的部分电子转移到13O上形成新的化学键。7C上的负电荷从-0.596 7减少到-0.248 3,10C上的负电荷也从-0.154 3增加到-0.408 3。同时,随着9H与13O的成键,10C-13O以及7C-9H键分别断裂,形成了H2O。7C与10C的键长由过渡态的0.143 4 nm进一步缩短到0.134 3 nm,形成了C=C。至此,BTO经过TS-7脱水生成BDE。
3.2.7 3-丁烯-1-醇加氢生成丁醇反应7中,BTO与H2克服353.4 kJ·mol-1的势垒形成过渡态TS-8并进一步生成BuOH。反应开始时,17H、18H原子彼此远离并分别向1C、4C靠近;1C-4C双键由原来的0.133 6逐渐伸长到0.143 0 nm,并与17H和18H形成了一个四元环过渡态。其中17H上的电荷为-0.225 9,而18H上的电荷为0.392 6,可以认为反应的过程中,氢键先发生断裂,随后由18H进攻1C,逐渐形成1C-18H键;随即17H与4C结合,形成过渡态TS-8。随后,17H-18H断裂,1C-4C由双键转变为单键,键长由0.143 0增加到0.153 3 nm,最终生成产物BuOH,完成反应。
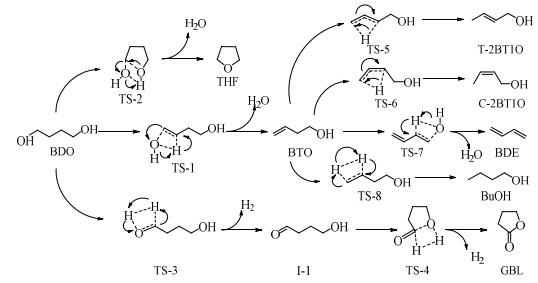
基于上述讨论的结果,BDO反应网络中各基元反应的反应机理可以概括如图 9所示。
|
图 9 BDO反应网络中各反应的反应机理 Fig.9 Mechanism of each elementary reaction in BDO reaction network |
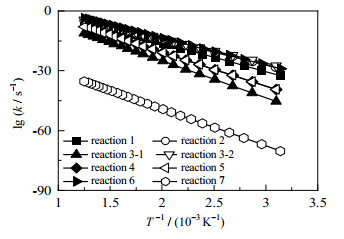
在得到各反应过渡态及相应的反应路径后,可以通过变分过渡态理论计算各反应经过隧道效应校正后的反应动力学常数,其结果如表 2所示。各反应的反应速率常数与反应温度的关系如图 10所示,通过双参数Arrhenius方程进行拟合,可以得到各反应的指前因子和活化能[37],结果列于表 2。
|
|
表 2 过渡态热力学参数及各反应的动力学参数 Table 2 Thermodynamic parameters of transition state and kinetic parameters of reactions |
|
图 10 不同温度下各反应的反应速率常数 Fig.10 Rate constant of reactions at different temperatures |
对BDO脱水生成BTO及两个平行副反应来说,反应1的过渡态TS-1势垒为301.8 kJ·mol-1,反应2中过渡态TS-2的势垒为264.5 kJ·mol-1。BDO脱氢反应为两步反应,其中过渡态TS-3的势垒为389.1 kJ·mol-1,过渡态TS-4的势垒为444.8 kJ·mol-1。由于存在较高的势垒和较长的反应路径,BDO脱氢反应显然比脱水反应更难发生。而从2种BDO脱水方式来看,BDO脱水生成THF反应的势垒相对较低,BDO更容易环化脱水生成THF,其反应速率比反应1高出4个数量级。对于BTO的串联副反应,则存在4条平行的反应途径。BTO异构生成T-2BT1O和C-2BT1O的反应较为相似,反应能垒分别为342.0和340.0 kJ·mol-1。反应生成BuOH的势垒较高,为353.4 kJ·mol-1,该过程较难进行。而BTO脱水生成BDE的势垒只有277.5 kJ·mol-1,反应容易进行。从各反应的反应路径中可以看出,脱氢和加氢反应所需的势垒最高,为反应网络中最难以进行的反应。BTO双键异构化反应所需的势垒同样较高。而脱水反应所需的势垒则相对较低。其中,BDO脱水生成THF的反应以及BTO脱水生成BDE的反应势垒最低,对BTO选择性的影响最大。
通过上述分析可以发现,对于目标产物BTO选择性影响最大的反应分别是BDO脱水生成THF的平行副反应2以及BTO进一步脱水生成BDE的串联副反应6。分析反应1和反应2的反应机理可以发现,在脱水的过程中均首先涉及BDO端羟基中14O原子与相连1C原子间C─O键的断裂。在反应2中,端羟基C─O断裂后,羟基会进一步吸引另一个端羟基中的15H原子,同时1C原子也会进攻羟基中的13O原子,从而形成THF。反应2的上述进程与Madduluri等[38]的报道是一致的,这也说明本文中有关反应机理的计算分析结果是可靠的。
基于以上分析,在设计催化剂时,使用酸性催化剂对其羟基进行活化,使1C-14O键更容易断裂,形成的碳正离子进攻另一端羟基中的O原子,即可促使BDO脱水环化生成THF。对于反应1而言,在14O-1C键断裂后,还需要断开β-H原子与4C原子之间的C─H键,才能进一步脱水生成烯烃。通过对各原子上的电荷密度进行分析后可以发现,TS-1中14O上的负电荷为-0.745 9,5H原子则带正电,其上电荷为0.218 1。基于此,应该设计一种酸碱双功能催化剂,以能够接受电子的酸性位点来活化羟基,同时采用可以给出电子的碱性位点对氢原子进行活化,二者协同作用才能使BDO脱水生成BTO。
对于同样势垒较低的反应6而言,其反应机理与反应1非常相近,很难通过控制催化剂表面的活性位点来降低BDE的生成。因此,可以采取提高反应空速,降低BTO在催化剂床层中的停留时间来降低串联副反应的选择性,以提高目标产物BTO的收率。
4 结论(1) 热力学研究表明:BDO脱水反应网络中反应1、3、6为吸热反应,其余反应为放热反应。升高温度有利于BTO的生成。所有反应的Gibbs自由能变均小于零,说明其在热力学上都是能够自发进行的。同时,当反应温度大于500 K时,几乎所有反应的平衡常数ln KΘ都大于9.2,表明各个反应中逆反应发生的几率非常低,产物的分布主要取决于各反应的速率,过程为动力学控制。
(2) 通过对各反应进行过渡态搜索和IRC计算,研究了各反应的过渡态结构、反应中键长及电荷的变化情况,提出了相应的反应机理。其中BDO脱氢生成GBL的反应为两步连续反应,其余反应均为一步反应。进一步的动力学研究表明,脱氢和加氢反应所需的势垒最高,反应最难进行。脱水反应所需的势垒则相对较低。其中反应2和反应6的反应势垒最低,对目标产物BTO选择性的影响最大。
(3) 通过分析反应1和反应2的反应机理可以发现,两者均涉及BDO端羟基C─O键的断裂。而对于反应1,还需要经过β-H原子与4C原子之间的C─H键断裂才能生成BTO。因此,可以通过设计酸碱双功能催化剂,以能够接受电子的酸性位点和可以给出电子的碱性位点分别对羟基和氢原子进行活化,促进BDO脱水生成BTO。对于同样势垒较低的反应6,由于其反应机理与反应1相似,难以通过控制催化剂活性位点来抑制BDE的生成。因此,可以采取提高反应空速,降低BTO在催化剂床层中的停留时间来提高目标产物BTO的选择性。
|
|
| [1] |
TAKAGAKI A. Kinetic analysis of aqueous-phase cyclodehydration of 1, 4-butanediol and erythritol over a layered niobium molybdate solid acid[J]. Catalysis Science & Technology, 2016, 6(3): 791-799. |
| [2] |
BHANUSHALI J T, PRASAD D, PATIL K N, et al. Simultaneous dehydrogenation of 1, 4- butanediol to γ-butyrolactone and hydrogenation of benzaldehyde to benzyl alcohol mediated over competent CeO2-Al2O3 supported Cu as catalyst[J]. International Journal of Hydrogen Energy, 2020, 45(23): 12874-12888. DOI:10.1016/j.ijhydene.2020.03.021 |
| [3] |
DUAN H, HIROTA T, OHTSUKA S, et al. Vapor-phase catalytic dehydration of 1, 4-butanediol to 3-buten-1-ol over modified ZrO2 catalysts[J]. Applied Catalysis A: General, 2017, 535: 9-16. DOI:10.1016/j.apcata.2017.01.024 |
| [4] |
尚如静, 穆仕芳, 牛刚, 等. 煤基1, 4-丁二醇及其衍生精细化学品市场分析[J]. 现代化工, 2019, 38(2): 11-13. SHANG R J, MU S F, NIU G, et al. Market analysis of coal based 1, 4-butanediol and its derivative fine chemicals[J]. Modern Chemical Industry, 2019, 38(2): 11-13. |
| [5] |
MI R, HU Z, YANG B. In situ DRIFTS for the mechanistic studies of 1, 4-butanediol dehydration over Yb/Zr catalysts[J]. Journal of Catalysis, 2019, 370: 138-151. DOI:10.1016/j.jcat.2018.12.013 |
| [6] |
SATO S, SATO F, GOTOH H, et al. Selective dehydration of alkanediols into unsaturated alcohols over rare earth oxide catalysts[J]. ACS Catalysis, 2013, 3(4): 721-734. DOI:10.1021/cs300781v |
| [7] |
MICHALAK O, GRUZA M, WITKOWSKA A, et al. Synthesis and physicochemical characterization of the impurities of pemetrexed disodium, an anticancer drug[J]. Molecules, 2015, 20(6): 10004-10031. DOI:10.3390/molecules200610004 |
| [8] |
ZHANG Q, ZHANG Y, LI H, et al. Heterogeneous CaO-ZrO2 acid-base bifunctional catalysts for vapor-phase selective dehydration of 1, 4-butanediol to 3-buten-1-ol[J]. Applied Catalysis A: General, 2013, 466: 233-239. DOI:10.1016/j.apcata.2013.06.020 |
| [9] |
ZHANG Q, ZHANG Y, LI H, et al. Vapor-phase selective dehydration of 1, 4-butanediol to 3-buten-1-ol over ZrO2 catalysts modified with alkaline earth metal oxides[J]. Chinese Journal of Catalysis, 2013, 34(6): 1159-1166. DOI:10.1016/S1872-2067(12)60525-7 |
| [10] |
SATO F, SATO S, YAMADA Y. Acid-base concerted mechanism in the dehydration of 1, 4-butanediol over bixbyite rare earth oxide catalysts[J]. Catalysis Today, 2014, 226: 124-133. DOI:10.1016/j.cattod.2013.08.005 |
| [11] |
TAKAHASHI R, YAMADA I, IWATA A, et al. Synthesis of 3-buten-1-ol from 1, 4-butanediol over indium oxide[J]. Applied Catalysis A: General, 2010, 383(1/2): 134-140. |
| [12] |
INOUE H, SATO S, TAKAHASHI R, et al. Dehydration of 1, 4-butanediol over supported rare earth oxide catalysts[J]. Applied Catalysis A: General, 2009, 352(1/2): 66-73. |
| [13] |
王丽苹, 萧斌, 王公应. 碳酸酯与1, 4-丁二醇酯交换合成聚碳酸酯二醇的热力学分析[J]. 石油化工, 2009, 38(9): 961-965. WANG L P, XIAO B, WANG G Y. Thermodynamic analysis for synthesis of polycarbonate diols by transesterification of carbonate and 1, 4-butanediol[J]. Petrochemical Technology, 2009, 38(9): 961-965. DOI:10.3321/j.issn:1000-8144.2009.09.008 |
| [14] |
QIAN J, QIU M, ZENG Z, et al. Cation-exchange resin catalyzed ketalization reaction of cyclohexanone with 1, 4-butanediol: Thermodynamics and kinetics[J]. Industrial & Engineering Chemistry Research, 2018, 57(14): 4841-4847. |
| [15] |
ERMELINDA EUSÉBIO M, LOPES JESUS A J, CRUZ M S C, et al. Enthalpy of vaporisation of butanediol isomers[J]. The Journal of Chemical Thermodynamics, 2003, 35(1): 123-129. DOI:10.1016/S0021-9614(02)00306-3 |
| [16] |
ZORĘBSKI E, GÓRALSKI P. Molar heat capacities for (1-butanol+1, 4-butanediol, 2, 3-butanediol, 1, 2-butanediol, and 2-methyl-2, 4-pentanediol) as function of temperature[J]. The Journal of Chemical Thermodynamics, 2007, 39(12): 1601-1607. DOI:10.1016/j.jct.2007.04.011 |
| [17] |
ALEXOPOULOS K, JOHN M, Van der BORGHT K, et al. DFT-based microkinetic modeling of ethanol dehydration in H-ZSM-5[J]. Journal of Catalysis, 2016, 339: 173-185. DOI:10.1016/j.jcat.2016.04.020 |
| [18] |
JOHN M, ALEXOPOULOS K, REYNIERS M, et al. First-principles kinetic study on the effect of the zeolite framework on 1-butanol dehydration[J]. ACS Catalysis, 2016, 6(7): 4081-4094. DOI:10.1021/acscatal.6b00708 |
| [19] |
FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09, revision A. 02[CP]. Wallingford: Gaussian Inc, 2009.
|
| [20] |
LIU Y, YANG B L, YI C H. Density functional theory investigation for catalytic mechanism of gasoline alkylation desulfurization over nkc-9 ion-exchange resin[J]. Industrial & Engineering Chemistry Research, 2013, 52(21): 6933-6940. |
| [21] |
WALKER M, HARVEY A J A, SEN A, et al. Performance of m06, m06-2x, and m06-hf density functionals for conformationally flexible anionic clusters: m06 functionals perform better than b3lyp for a model system with dispersion and ionic hydrogen-bonding interactions[J]. The Journal of Physical Chemistry A, 2013, 117(47): 12590-12600. DOI:10.1021/jp408166m |
| [22] |
ZHAO Y, TRUHLAR D G. The M06 suite of density functionals for main group thermochemistry, thermochemical kinetics, noncovalent interactions, excited states, and transition elements: two new functionals and systematic testing of four M06-class functionals and 12 other functionals[J]. Theoretical Chemistry Accounts, 2008, 120(1): 215-241. |
| [23] |
ALECU I M, ZHENG J, ZHAO Y, et al. Computational thermochemistry: Scale factor databases and scale factors for vibrational frequencies obtained from electronic model chemistries[J]. Journal of Chemical Theory and Computation, 2010, 6(9): 2872-2887. DOI:10.1021/ct100326h |
| [24] |
尹红, 王刚, 戴思远, 等. 六氟环氧丙烷的合成及主副反应机理研究[J]. 高校化学工程学报, 2015, 29(4): 830-836. YIN H, WANG G, DAI S Y, et al. Synthesis of hexafluoropropylene oxide and its reaction mechanism[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(4): 830-836. DOI:10.3969/j.issn.1003-9015.2015.04.009 |
| [25] |
CANNEAUX S, BOHR F, HENON E. KiSThelP: A program to predict thermodynamic properties and rate constants from quantum chemistry results[J]. Journal of Computational Chemistry, 2014, 35(1): 82-93. DOI:10.1002/jcc.23470 |
| [26] |
ENGERHOLM G, LUNTZ A C, GWINN W, et al. The microwave spectrum, dipole moment, and barrier to pseudo rotation in tetrahydrofuran[J]. The Journal of Chemical Physics, 1969, 50(6): 2446-2457. DOI:10.1063/1.1671401 |
| [27] |
HERZBERG G. Molecular spectra and molecular structure[M]. Boston: Springer, 1966.
|
| [28] |
HOY A R, BUNKER P R. A precise solution of the rotation bending Schrödinger equation for a triatomic molecule with application to the water molecule[J]. Journal of Molecular Spectroscopy, 1979, 74(1): 1-8. DOI:10.1016/0022-2852(79)90019-5 |
| [29] |
HUBER K P, HERZBERG G. Constants of diatomic molecules[M]. Boston: Springer, 1979.
|
| [30] |
WILHOIT R C, CHAO J. Thermodynamic properties of key organic oxygen compounds in the carbon range C1 to C4[J]. Journal of Physical and Chemical Reference Data, 1985, 14(1): 1-175. DOI:10.1063/1.555747 |
| [31] |
LEBEDEV B V. Thermodynamic properties of tetrahydrofuran from 8 to 322 K[J]. The Journal of Chemical Thermodynamics, 1978, 10(4): 321-329. DOI:10.1016/0021-9614(78)90064-2 |
| [32] |
SHENYAVSKAYA E A, YUNGMAN V S. NIST-JANAF thermochemical tables[J]. Journal of Physical and Chemical Reference Data, 2004, 33: 923-957. DOI:10.1063/1.1638781 |
| [33] |
陈立宇, 雷鹏, 师博辉, 等. 甲烷在发烟硫酸体系中部分氧化反应的热力学研究[J]. 高校化学工程学报, 2012, 26(3): 365-369. CHEN L Y, LEI P, SHI B H, et al. Study on the thermodynamics of methane partial oxidation in oleum[J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(3): 365-369. DOI:10.3969/j.issn.1003-9015.2012.03.001 |
| [34] |
李银, 夏举佩, 刘海浪, 等. 硅石、钾长石助熔磷矿碳热还原反应机理研究[J]. 高校化学工程学报, 2017, 31(5): 1120-1126. LI Y, XIA J P, LIU H L, et al. Mechanism of silica and k-feldspar as flux agents in phosphate ore carbothermic reduction[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(5): 1120-1126. DOI:10.3969/j.issn.1003-9015.2017.05.014 |
| [35] |
余岳溪, 高正阳, 季鹏, 等. 煤焦异相还原N2O的反应机理[J]. 化工学报, 2017, 68(1): 369-374. YU Y X, GAO Z Y, JI P, et al. Heterogeneous reduction reaction of N2O by char[J]. CIESC Journal, 2017, 68(1): 369-374. |
| [36] |
张丹维, 黎占亭. 分子内氢键促进的大环合成: 动力学和热力学控制途径[J]. 有机化学, 2012, 32(11): 2009-2017. ZHANG D W, LI Z T. Intramolecular hydrogen bonding-promoted formation of macrocycles: Dynamical and thermodynamic control approaches[J]. Chinese Journal of Organic Chemistry, 2012, 32(11): 2009-2017. |
| [37] |
周彩荣, 郄晶伟, 吕忠闯, 等. 改性USY分子筛催化愈创木酚乙酰化反应及动力学研究[J]. 高校化学工程学报, 2017, 31(2): 485-491. ZHOU C R, QIE J W, LV Z C, et al. Study on guaiacol acetylation catalyzed by modified USY zeolite and reaction dynamics[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(2): 485-491. DOI:10.3969/j.issn.1003-9015.2017.02.031 |
| [38] |
MADDULURI V R, NEELI C K P, KATARI N K, et al. Vapor phase selective tetrahydrofuran production from dehydration of biomass derived 1, 4-butanediol using ecofriendly red brick catalyst[J]. Catalysis Communications, 2018, 110: 38-41. DOI:10.1016/j.catcom.2018.03.007 |




