2. 中国科学院大学,北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
硫酸钾(K2SO4)是一种重要的无氯钾肥,同时也是重要的化工原料。目前从自然界中提取钾,就世界范围而言主要来自于固体钾矿和含钾卤水[1~4]。我国的钾资源占世界总储量较少,探明储量约占世界的2.2%[5, 6]。其中以卤水状态赋存的盐湖钾盐资源占我国总储量的92%,固体状态赋存的钾资源仅占2.6%且品位较低[7]。因此,研究卤水中钾资源的开发利用对我国经济发展至关重要。
当前世界上K2SO4的生产方法大致可划分为三大类:第一类是利用硫酸或硫酸盐与氯化钾(KCl)转化制取K2SO4[6, 8~10];第二类是利用硫酸盐矿或多组分的钾盐矿制取K2SO4[6, 10~12];第三类是利用盐湖卤水及地下卤水制取K2SO4[9, 13]。利用盐湖卤水资源和地下卤水生产K2SO4的方法,大多以软钾镁矾(K2SO4·MgSO4·6H2O,Pic)和KCl为原料转化制得[14~17]。目前,国内外对K2SO4·MgSO4·6H2O与KCl转化结晶K2SO4过程的研究报道较少,为对其转化结晶提供更充分的理论控制依据,研究复盐K2SO4·MgSO4·6H2O和单盐KCl转化生产K2SO4的结晶过程很有必要。
实际工业运用此体系转化K2SO4温度在40~55℃,本文在前期常温条件下对此体系探索的基础上[18],参考实际生产温度范围,研究对比分析系列变温条件下,K2SO4·MgSO4·6H2O和KCl转化结晶K2SO4过程,探究在不同温度下两者的溶解速率以及K2SO4结晶速率;采用非线性拟合K2SO4结晶量以及K2SO4·MgSO4·6H2O和KCl溶解量与时间的关系;结合动力学模型、计算机编程模拟计算,得到溶解、结晶动力学方程、获得其过程反应级数,计算溶解和结晶的活化能;提出溶解及结晶转化机理;对K2SO4·MgSO4·6H2O和KCl转化结晶生产K2SO4的工程设计、工艺优化、过程控制具有指导意义。
2 实验部分 2.1 试剂与仪器设备主要化学试剂:实验所用试剂均为市售分析纯及基准纯试剂。主要仪器设备:IKA®数显恒速搅拌器(EUROSTAR 40 digital,德国IKA);恒温恒速搅拌装置(PCD-C5000系列,上海双舜实业有限公司)快速分离装置(D-3400,德国赛多利斯集团);循环水式真空抽滤泵(SHZ-DⅢ,巩义市矛华仪器有限责任公司);电子分析天平(AE240S,梅特勒-托利多仪器有限公司);全自动X-射线衍射仪(X′ Pert Pro,荷兰帕纳科公司);实验室纯水系统(Spring-R10,厦门锐思捷水纯化技术有限公司)智能PID温控仪(XMT806,香港慧能自动化设备有限公司);除湿器(C500B,北京亚都空气污染治理技术有限公司)。
2.2 实验方法依据K+,Mg2+// SO42--H2O水盐体系相图,实验室自制获得软钾镁矾[19]。KCl由重结晶获得,通过筛分选取粒度为10~20目晶体作为试验原料。
以K+,Mg2+//Cl-,SO42--H2O四元水盐交互体系相图为理论依据,计算物料比例(H2O: K2SO4·MgSO4·6H2O:KCl = 160.25:137.68:75.59)。按比例称取10~20目K2SO4·MgSO4·6H2O 20.6520 g和KCl 11.3385 g,使其充分混合;于直径52 mm、高度72 mm密闭容器中,称取结晶所需H2O 24.0375 g置于恒温水浴中,待转化结晶所需H2O温度恒定后,启动搅拌装置,转速为360 r·min-1,一次性快速加入混合均匀的K2SO4·MgSO4·6H2O和KCl;控制温度、搅拌速率,进行溶解转化,选取不同时间点,将转化浆液于快速分离装置进行分离,取液样进行化学分析,固样做X-射线衍射(XRD)测试。
2.3 分析与表征各离子含量的测定方法如下[20]:K+,四苯硼钠-季胺盐返滴定法;Mg2+,铬黑T指示剂EDTA络合滴定法;Cl-,硝酸汞络合容量滴定法。固样采用荷兰帕纳科公司生产的X’pert Pro衍射进行物相鉴定。
3 实验结果和讨论 3.1 系列温度下软钾镁矾和氯化钾溶解转化实验40℃条件下,K2SO4·MgSO4·6H2O和KCl转化结晶K2SO4液样进行化学分析,结果如表 1。
| 表 1 40℃时K2SO4·MgSO4·6H2O和KCl转化结晶K2SO4实验数据 Table 1 Experimental data of K2SO4 crystallization from K2SO4·MgSO4·6H2O and KCl reaction at 40℃ |
55℃条件下,K2SO4·MgSO4·6H2O和KCl转化结晶K2SO4液样进行化学分析,结果如表 2。
| 表 2 55℃时K2SO4·MgSO4·6H2O和KCl转化结晶K2SO4实验数据 Table 2 Experimental data of K2SO4 crystallizing from K2SO4·MgSO4·6H2O and KCl reaction at 55℃ |
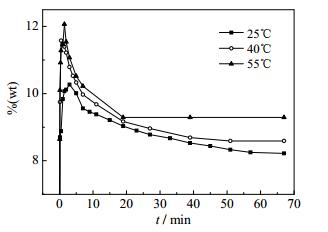
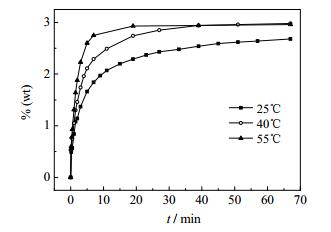
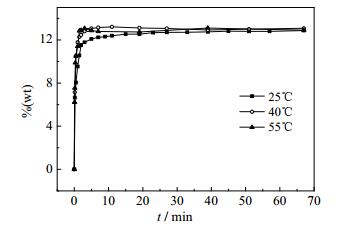
引用常温条件下此体系转化结晶K2SO4实验数据[18],结合以上40和55℃实验数据;绘制系列温度下此体系转化结晶K2SO4过程中K+ %(wt)-t曲线、Mg2+ %(wt)-t曲线、C1- %(wt)-t曲线分别如图 1、图 2、图 3。
|
图 1 系列温度下K2SO4·MgSO4·6H2O和KCl转化结晶K2SO4过程中K+ %(wt)-t曲线 Fig.1 %(wt) -t curves of K+ during K2SO4 crystallization from K2SO4·MgSO4·6H2O and KCl reaction under different temperatures |
|
图 2 系列温度下K2SO4·MgSO4·6H2O和KCl转化结晶K2SO4过程中Mg2+ %(wt)--t曲线 Fig.2 %(wt) -t curves of Mg2+ during K2SO4 crystallization from K2SO4·MgSO4·6H2O and KCl reaction under different temperatures |
|
图 3 系列温度下K2SO4·MgSO4·6H2O和KCl转化结晶K2SO4过程中C1- %(wt) -t曲线 Fig.3 %(wt)-t curves of C1- during K2SO4 crystallization from K2SO4·MgSO4·6H2O and KCl reaction under different temperatures |
|
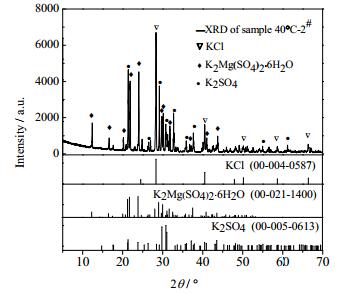
图 4 40℃转化结晶2#样品X射线衍射图谱 Fig.4 XRD patterns of sample 2# at 40℃ |

|
图 5 55℃转化结晶2#样品X射线衍射图谱 Fig.5 XRD patterns of sample 2# at 55℃ |
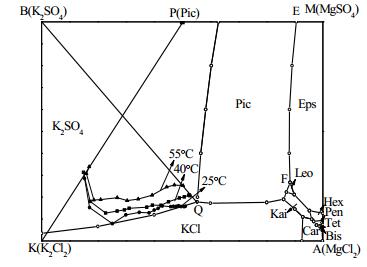
通过换算耶涅克指数(J),标注出不同温度、不同时间条件下液相组成在25℃ K+,Mg2+//Cl-,SO42--H2O四元水盐交互体系中的移动轨迹,如图 6。
|
图 6 25℃ K+, Mg2+//Cl-, SO42--H2O四元水盐交互体系相图 Fig.6 Solubility phase diagram of the K+, Mg2+//Cl-, SO42--H2O system at 25℃ |
根据25℃[18]、40℃、55℃三组温度条件下,K+、Mg2+、C1-、SO42-化学分析结果(表 1和2)及%(wt)-t变化曲线,可以得到如下结论:在三组温度条件下的转化过程中,K+、Mg2+、C1-、SO42的C-t变化趋势均一致,在三组条件下Cl-浓度升高速率均大于Mg2+升高速率,该现象表明KCl的溶解速率大于K2SO4·MgSO4·6H2O。SO42-浓度迅速升高后急剧下降,然后浓度基本持平,表明K2SO4在溶解过程初期快速结晶,其后结晶速率与K2SO4·MgSO4·6H2O溶解速率基本一致。K+浓度随着时间变化,均是先迅速升高达到一个极值,然后逐渐降低,最后趋于平衡;K+浓度从极值到平衡的过程,必然是一个结晶过程,但并不是K+达到极值之后才开始结晶。通过分析不同时间固相的XRD测试结果,可以看出K2SO4的结晶析出非常迅速,结合衍射图谱结果图 4、图 5发现在溶解转化30 s时,已经有固体K2SO4结晶析出;25℃在转化30 s时也已经有K2SO4结晶析出[18]。
图 1、图 2、图 3表明,此体系下Mg2+的溶解速率和溶解度随着温度的增高而增大,25~40℃内Mg2+溶解度受温度的影响相比于40~55℃溶解度受温度的影响更明显。Cl-在此体系下的溶解速率和溶解度随着温度的变化所受影响均不明显;说明在本实验条件下,此体系温度的变化对KCl的溶解速率和溶解度变化不大,但对Pic的溶解速率和溶解度影响较大。
在此体系下K+的溶解度和溶解速率随着温度的升高增加,其结晶推动力ΔC也随着温度的升高而增大。结合不同温度、不同时间条件下液相组成在25℃ K+,Mg2+//Cl-,SO42--H2O四元水盐交互体系中的移动轨迹(图 6)可以得出结论,随温度的升高,K2SO4的收率降低;K2SO4的结晶速率以及KCl、K2SO4·MgSO4·6H2O的溶解速率均由大变小;KCl的溶解速率大于K2SO4·MgSO4·6H2O的溶解速率;反应初期K2SO4大量结晶,同时KCl大量溶解;转化2 min以后,是K2SO4·MgSO4·6H2O溶解与K2SO4结晶速率基本等值的过程。
3.2 转化母液量、K2SO4·MgSO4·6H2O、KCl溶解速率以及K2SO4的结晶速率在工业生产中,如果能根据反应时间来判断反应物的溶解量及生成物的结晶量,将会对实际生产具有指导意义,更有利于实现过程控制。
利用经过化学分析的液相组成和投入的物料量,通过物料平衡方程,计算出转化过程各时段母液量、反应物的溶解量、生成物的结晶量以及溶解速率和结晶速率(表 3和表 4)。
| 表 3 40℃反应物的溶解速率以及生成物的结晶速率 Table 3 Dissolution rates of reactants and crystallization rates of the product at 40℃ |
| 表 4 55℃反应物的溶解速率以及生成物的结晶速率 Table 4 Dissolution rates of reactants and crystallization rates of the product at 55℃ |
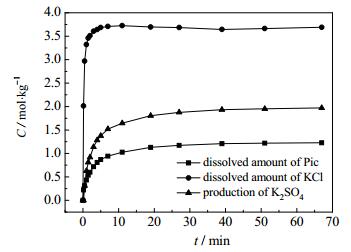
40℃-------通过非线性拟合计算,拟合K2SO4·MgSO4·6H2O、KCl的溶解量以及K2SO4的结晶量和转化时间t的关系(图 7);得出:
|
图 7 40℃ Pic和KCl的溶解量以及K2SO4的结晶量 Fig.7 Profiles of dissolved reactants (Pic and KCl) and crystallized product (K2SO4) at 40℃ |
| $ {W_1} = 0.39847-0.00602t + \frac{{0.05605}}{t} + 0.28834\ln t({R^2} = 0.9979) $ | (1) |
| $ {W_2} = 3.58313-0.00436t-\frac{{0.24086}}{t} + 0.08153\ln t({R^2} = 0.9908) $ | (2) |
| $ {W_3} = 0.60961-0.01051t + \frac{{0.04025}}{t} + 0.48128\ln t({R^2} = 0.9972) $ | (3) |
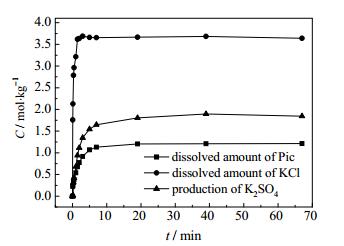
55℃-------通过非线性拟合计算,拟合K2SO4·MgSO4·6H2O、KCl的溶解量以及K2SO4的结晶量和转化时间t的关系(图 8);得出:
|
图 8 55℃ Pic和KCl的溶解量以及K2SO4的结晶量 Fig.8 Profiles of dissolved reactants (Pic and KCl) and crystallized product (K2SO4) at 55℃ |
| $ {W_1} = 0.55881-0.01001t + \frac{{0.0353}}{t} + 0.30339\ln t({R^2} = 0.9832) $ | (4) |
| $ {W_2} = 3.37932-0.00937t-\frac{{0.10511}}{t} + 0.19928\ln t({R^2} = 0.9257) $ | (5) |
| $ {W_3} = 0.73298-0.01604t + \frac{{0.04138}}{t} + 0.5058\ln t({R^2} = 0.9889) $ | (6) |
可以看出,K2SO4的结晶速率以及KCl、K2SO4·MgSO4·6H2O的溶解速率均由大变小,KCl的溶解速率大于K2SO4·MgSO4·6H2O的溶解速率,进一步佐证了与前面的结论。
由以上方程可预测,本试验时间段内的任意时间,反应物K2SO4·MgSO4·6H2O、KCl的溶解量、溶解速率以及生成物K2SO4的结晶量、结晶速率,为化工生产过程控制提供依据。
3.3 动力学模型的建立转化结晶是一个比较复杂的过程,通常包括溶质由液相本体向晶格表面的扩散过程和溶质在固液界面上的表面化学反应过程。结晶速率取决于这两步中最慢的一个过程[21]。溶解和结晶动力学方程的数学模型以及用计算机编程拟合动力学方程参数k,n的方法参见文献[22]。
3.3.1 溶解动力学模型的建立采用Mg2+浓度变化,通过计算机编程拟合计算25[18]、40和55℃溶解动力学方程分别得出25~55℃溶解过程均符合stumm模型:
| $ {25^ \circ }{\rm{C}}\;\;\;\frac{{{\rm{d}}c}}{{{\rm{d}}t}} = 0.1221 \times {(1.3563-c)^{1.54}} $ | (7) |
| $ {40^ \circ }{\rm{C}}\;\;\;\;\frac{{dc}}{{dt}} = 0.2047 \times {(1.2272-c)^{0.99}} $ | (8) |
| $ {55^ \circ }{\rm{C}}\;\;\;\;\frac{{dc}}{{dt}} = 0.3869 \times {(1.2126-c)^{0.99}} $ | (9) |
|
图 9 40℃溶解动力学模型曲线与实验数据对比 Fig.9 Comparison of results from dissolution kinetic model and experimental data at 40℃ |
|
图 10 55℃解动力学模型曲线与实验数据对比 Fig.10 Comparison of results from dissolution kinetic model and experimental data at 55℃ |
运用Arrhenius公式:
估算在此体系下25~40℃活化能为26.7392 kJ·mol-1;估算40~55℃活化能为36.2597 kJ·mol-1。
综上所述,此体系在25℃时溶解属于表面反应控制;随着温度的升高(25~55℃)溶解属于表面反应控制和扩散控制混合控制。
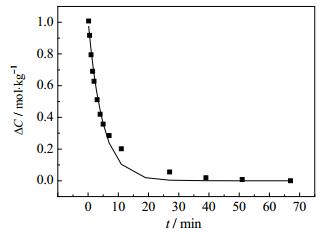
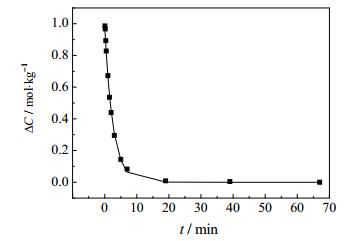
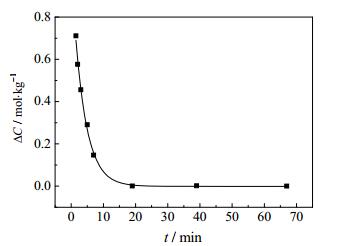
3.3.2 结晶动力学模型的建立根据K+浓度变化,通过计算机编程拟合,计算得出25℃[18]和40℃此体系条件下的结晶动力学方程符合stumm模型;55℃结晶动力学方程没有找到合适的溶解结晶模型;非线性拟合结晶ΔC与t的关系符合单指数衰减函数;方程式如下:
| $ 25{}^ \circ {\rm{C}}\;\;\;\;-\frac{{dc}}{{dt}} = 0.0218 \times {(c-2.1035)^{0.38}} $ | (10) |
| $ 40{}^ \circ {\rm{C}}\;\;\;\;-\frac{{dc}}{{dt}} = 0.12 \times {(c-2.1972)^{1.24}} $ | (11) |
| $ 40{}^ \circ \rm{C}\;\;\;\;\Delta C = 1.03496{e^{(\frac{{-t}}{{3.72061}})}}-0.00109 $ | (12) |

|
图 11 40℃结晶动力学模型曲线与实验数据对比图 Fig.11 Comparison of results from crystallization kinetic model and experimental data at 40℃ |
|
图 12 55℃结晶动力学模型曲线与实验数据对比图 Fig.12 Comparison of results from crystallization kinetic model and experimental data at 55℃ |
25~40℃结晶速率和反应级数随着温度的升高快速增大;运用Arrhenius公式:
| $ \ln k = \ln A-\frac{{{E_a}}}{{R{T^2}}};推导出:\ln \frac{{{k_2}}}{{{k_1}}} = \frac{{{E_a}}}{R}\frac{{{T_2}-{T_1}}}{{{T_1}{T_2}}} $ |
估算在此体系条件下,25~40℃活化能为88.263 kJ·mol-1;综上所述,此体系在25~40℃结晶属于表面反应控制控制。
4 结论通过探究系列温度下复盐K2SO4·MgSO4·6H2O和单盐KCl转化结晶K2SO4的过程;得出以下结论:
(1) 在此系列温度条件下KCl的溶解速率均大于K2SO4·MgSO4·6H2O的溶解速率;K2SO4的结晶是一个很迅速的过程,在30 s时已经有K2SO4的生成。
(2) Mg2+的溶解速率和溶解度随着温度的升高而增大;而Cl-在此体系下的溶解速率和溶解度随着温度的变化不明显;说明此体系温度的变化对KCl的溶解速率和溶解度影响不大;但对Pic的溶解速率和溶解度影响较大。
(3) K+在此体系下的溶解度和溶解速率随着温度的升高增加;并且结晶推动力ΔC也随着温度的升高而增大;随着温度的升高,K2SO4的收率降低;K2SO4的结晶速率以及KCl、K2SO4·MgSO4·6H2O的溶解速率随时间变化均由大变小;反应初期K2SO4大量结晶,同时KCl大量溶解;转化2 min以后,是K2SO4·MgSO4·6H2O溶解与K2SO4结晶速率基本一致的过程。
(4) 计算出母液量、K2SO4·MgSO4·6H2O、KCl的溶解量以及K2SO4的结晶量,并进行非线性拟合,得到溶解量以及结晶量随时间的变化关系;通过非线性拟合的方程可以计算出试验涉及时间段内的任意时间K2SO4·MgSO4·6H2O、KCl的溶解量、溶解速率以及K2SO4的结晶量、结晶速率。
(5) 运用溶解和转化结晶动力学方程的数学模型;计算机编程模拟计算25~55℃溶解结晶动力学方程,得到溶解结晶动力学方程,获得其过程反应级数,利用Arrhenius方程计算其活化能,提出溶解及结晶转化机理。
参考实际生产温度,通过对系列温度条件下复盐K2SO4·MgSO4·6H2O和单盐KCl转化结晶K2SO4过程的研究,对K2SO4·MgSO4·6H2O和KCl转化结晶生产K2SO4的工程设计、工艺优化、过程控制具有指导意义;提出了溶解和结晶转化机理,对复盐和单盐转化结晶过程的研究方法提供了一种新的思路。
符号说明:
A —指前因子
C —瞬时浓度,mol·kg-1
ΔC —瞬时浓度与平衡浓度之差,mol·kg-1
Ea —表观活化能
k —速率常数
R —摩尔气体常量
T —热力学温度,K
t —转化结晶时间,min
W1 —反应物K2SO4·MgSO4·6H2O的溶解量,mol·kg-1
W2 —反应物KCl的溶解量,mol·kg-1
W3 —生成物K2SO4的结晶量,mol·kg-11
| [1] | ZHENG Mian-ping(郑绵平), QI Wen(齐文). Saline Resources and its Development in China(我国盐湖资源及其开发利用)[J]. Conservation and Utilization of Minerales Ources(矿产保护与利用), 2006(5): 45-50. |
| [2] | SONG Peng-sheng(宋彭生). Comprehensive utilization of salt lake and related resources (continuation l)(盐湖及相关资源开发利用进展(续一))[J]. Journal of Salt Lake Research(盐湖研究), 2000, 8(2): 33-58. |
| [3] | Bader M S. Precipitation and separation of salts, scale salts, and norm contaminant salts from saline waters and saline water and saline solutions: US, 5468394A[P]. 1995-11-21. https://es.scribd.com/document/56659681/Microbiologia-Ambiental |
| [4] | CHEN Yong(陈勇), SHAO Man-jun(邵曼君), CHEN Hui-ping(陈慧萍). Crystal growth kinetics grom aqueous solution of potassium sulfate(水溶液中硫酸钾晶体生长动力学)[J]. Journal of Chemical Industry and Engineering (China)(化工学报), 2003, 54(12): 1766-1769.DOI:10.3321/j.issn:0438-1157.2003.12.011. |
| [5] | ZHENG Mian-ping(郑绵平), ZHANG Zhen(张震), ZHANG Yong-sheng(张永生), et al. Potash exploration characteristics in China: new understanding and research progress(我国钾盐找矿规律新认识和进展)[J]. Acta Geoscientica Sinica(地球学报), 2012, 33(3): 280-294. |
| [6] | WANG Li(王丽), WANG Ying-bin(王英滨), MA Hong-wen(马鸿文), et al. Preparation of potassium sulphate from separation of potassium and sodium by amine extraction(有机胺萃取分离钾钠制备硫酸钾)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2012, 26(1): 151-154. |
| [7] | WANG Chun-ning(王春宁), YU Jun-qing(余俊清), CHEN Liang(陈良), et al. A review on the exploration of global potash resources with an emphasis on the past and present status of China with a methodological perspective(钾盐资源全球分布和我国找钾实践及方法探究)[J]. Journal of Salt Lake Research(盐湖研究), 2007, 15(3): 56-72. |
| [8] | TU Min-duan(涂敏端), YU Geng-zhi(禹耕之), LUO Cai-ping(骆彩萍), et al. Solubility of K+, NH4+//Cl-, SO42--H2O system(K+、NH4+//Cl-、SO42--H2O体系的溶解度)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 1997, 11(4): 86-89. |
| [9] | FENG Xin(冯新), LIU Chang(刘畅), JI Xiao-yan(吉晓燕), et al. The simulation and analysis for the process of potassium sulfate production by glauber salt method(芒硝法生产硫酸钾工艺的模拟与分析)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2000, 14(6): 583-587. |
| [10] | HE Kai(何凯), WANG Xiang-rong(王向荣). Conversion of gypsum and potassium chloride to potassium sulphate in aqueous ammonia(石膏转化法由氯化钾制取硫酸钾)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 1996, 10(4): 83-86. |
| [11] | QIU Long-hui(邱龙会), WANG Li-sheng(王励生), JIN Zuo-Mei(金作美). Leaching process of potassium sulfate from roasts of potash feldspar, gypsum and calcium carbonate(钾长石-石膏-碳酸钙热分解烧成物中硫酸钾的浸取过程)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2000, 14(5): 465-469. |
| [12] | YANG Lin-jun(杨林军), QI Jia-hui(漆嘉惠), ZHANG Yun-xiang(张允湘), et al. Study on K2SO4 crystallization in potassium sulfate production by two-step conversion of gypsum(石膏两步法制硫酸钾中K2SO4结晶工艺条件研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2004, 18(1): 89-93. |
| [13] | CHEN Dai-wei(陈代伟), GUO Ya-fei(郭亚飞), DENG Tian-long(邓天龙). Current research status of production technology of potassium sulfate(硫酸钾生产工艺研究现状)[J]. Inorganic Chemicals Industry(无机盐工业), 2010, 42(4): 4-7. |
| [14] | Dave R H, Ghosh P K. Efficient recovery of potassium chloride from liquid effluent generated during preparation of schoenite from kainite mixed salt and its reuse in production of potassium sulfate[J]. Industrial & Engineering Chemistry Research, 2006, 45(5): 1551-1556. |
| [15] | Gerlandp M, Dante C, Michele M, et al. Process for producing potassium sulfate from kainite through the intermediate formation of schoenite and langbeinite: US, 3207576[P]. 1965-9-21. |
| [16] | Rathore S S, Chaudhary D R, Vaisya L K, et al. Schoenite and potassium sulphate: indigenous potassic fertilizer for rainfed groundnut[J]. Indian Journal of Traditional Knowledge, 2014, 13(1): 222-226. |
| [17] | Hancer M, Miller J D. The flotation chemistry of potassium double salts: schoenite, kainite, and carnallite[J]. Minerals Engineering, 2000, 13(14-15): 1483-1493.DOI:10.1016/S0892-6875(00)00132-1. |
| [18] | HU Tian-qi(胡天琦), ZHANG Zhi-hong(张志宏), DONG Ou-yang(董欧阳), et al. Study on the kinetics and mechanism of K2SO4 crystallizing from K2SO4·MgSO4·6H2O and KCl at 25℃(25℃ K2SO4·MgSO4·6H2O与KCl转化结晶K2SO4动力学与机理研究)[J]. Journal of Synthetic Crystals(人工晶体学报), 2016, 45(02): 309-315. |
| [19] | FU Zhen-hai(付振海), ZHANG Zhi-hong(张志宏), AN Dong(安东), et al. Preparation of schoenite by evaporating the system of K2SO4-MgSO4-H2O and its physical property(K2SO4-MgSO4-H2O三元体系蒸发制备软钾镁矾及其物理性质)[J]. Transactions of Materials and Heat Treatment(材料热处理学报), 2014, 35(S2): 5-9. |
| [20] | The Analysis Centre of Chinese Academy of Sciences Qinghai Institute of Salt Lakes (中国科学院青海盐湖研究所分析室). The analysis method of the brine and salt(卤水和盐的分析方法)[M].Beijing(北京): Science Press(科学出版社), 1998. |
| [21] | GAO Shi-yang(高世扬), CHEN Xue-an(陈学安), XIA Shu-ping(夏树屏). Chemistry of borate in salt lake brine ⅩⅢ. crystallization kinetics study of 2MgO·2B2O3·MgCl2·14H2O(盐卤硼酸盐化学ⅩⅢ. 2MgO·2B2O3·MgCl2·14H2O结晶动力学研究)[J]. Acta Chimica Sinica(化学学报), 1990, 48(11): 1049-1056. |
| [22] | XIA Shu-ping(夏树屏), LIU Zhi-hong(刘志宏), GAO Shi-yang(高世扬). Chemistry of borate in salt lake brine ⅩⅤ. Study on kinetics of dissolution and transformation process of 2MgO·2B2O3·MgCl2·14H2O in water at 30℃(盐卤硼酸盐化学——ⅩⅤ.氯柱硼镁石在30℃水中的溶解和相转化过程)[J]. Journal of Inorganic Chemistry(无机化学学报), 1993, 9(3): 279-285. |




