苯乙烯是一种重要的化工单体,被广泛用于塑料和合成橡胶的生产,例如聚苯乙烯、丙烯腈-丁二烯-苯乙烯树脂以及苯乙烯-丁二烯橡胶。截至2022年,全球苯乙烯产能约为4 310.1×104 t⋅a−1,同比增长6.6%,中国苯乙烯产能增至1 763.6×104 t⋅a−1[1]。苯乙烯的生产主要采用乙苯脱氢、苯乙烯-环氧丙烷联产和裂解汽油(石脑油蒸汽裂解副产物)抽提的方法[2-4],其中乙苯脱氢法是主要生产工艺。然而,随着乙烯工业的发展和装置规模大型化,从裂解汽油中回收苯乙烯备受关注。
从裂解汽油中回收苯乙烯的工艺包括精馏、选择性加氢和萃取抽提3个单元[5],其中选择性加氢单元至关重要,其目的是脱除苯乙炔。苯乙炔的存在会增加苯乙烯聚合时的催化剂消耗量,影响碳链长度和聚合速度,同时导致聚苯乙烯性能下降[6]。然而,原料进入加氢反应器时含有大量苯乙烯,易造成加氢损失。因此,在转化苯乙炔的同时尽量减少苯乙烯的加氢损失成为从裂解汽油中回收苯乙烯的关键。
目前,工业上广泛采用气-液-固三相固定床绝热反应器进行炔基和烯基芳烃的选择性加氢反应,影响加氢反应效果的主要因素是催化剂性能和反应器操作[7]。苯乙炔选择性加氢反应主要使用Pd基催化剂[8-18],其具有高活性、低起活温度的优点,但往往很难同时兼顾高苯乙炔转化率和高苯乙烯选择性,且随温度升高,Pd基催化剂的苯乙烯选择性呈显著下降趋势[19]。此外,Pd金属价格昂贵,催化剂制备成本较高。在这些不利因素的影响下,人们致力于研发高效且经济的催化剂替代Pd基催化剂[20-26]。本课题组成功开发Ni(质量分数为20%)负载的Ni3CuSn0.3/SiO2三金属催化剂[27],在苯乙炔选择性加氢反应中表现优异(苯乙炔完全转化时苯乙烯选择性达到93.3%)[28],是一种有潜力的裂解汽油C8芳烃选择性加氢催化剂。
为探索Ni3CuSn0.3/SiO2催化剂的工业应用潜力,并为后续的反应器设计和操作条件优化奠定基础,本研究首先采用搅拌釜式反应器,开展裂解汽油C8芳烃选择性加氢反应的本征动力学研究,建立相应的反应动力学模型;然后在固定床反应器中考察反应温度、压力、H2/苯乙炔摩尔比、原料苯乙炔含量等因素对裂解汽油C8芳烃选择性加氢反应的影响,建立固定床反应器数学模型。本研究旨在分析固定床反应器中裂解汽油C8芳烃选择性加氢的反应过程,为裂解汽油中的苯乙烯回收技术提供一定的理论指导。
2 实验部分采用浸渍法制备Ni3CuSn0.3/SiO2催化剂,具体方法见文献[28]。反应原料为裂解汽油C8芳烃馏分模型化合物[29],若无特殊说明,其组成为苯乙炔(PA,2%)、苯乙烯(ST,28%)、乙苯(EB,30%)、间二甲苯(MX,40%)。通过气相色谱仪(PEG-20M色谱柱,30 m×0.32 mm×0.5 μm)和氢火焰离子化检测器,采用面积校正归一化法分析加氢产物组成。色谱进样器和检测器温度分别设定为160 ℃和200 ℃,色谱柱的升温程序:初始温度为80 ℃,恒温3 min,以5 ℃⋅min−1的速率升温至120 ℃,恒温5 min。
鉴于加氢催化剂普遍表现出初始活性高且不稳定的特点,本研究有意采用苛刻的反应条件先对Ni3CuSn0.3/SiO2进行前期处理,使其处于稳定状态,然后再进行反应动力学和固定床反应器的相关研究。催化剂前期处理在固定床反应器中进行,平均颗粒粒径为640 μm (20~40目)。首先对催化剂进行氢气还原处理(在30% H2/N2气氛中于500 ℃下还原2 h),然后在苛刻条件下(90 ℃、1.0 MPa、H2/苯乙炔摩尔比为8、液时空速为16 h−1)开展催化剂稳定性测试。待催化剂处于稳定状态后,停止反应,于室温下将催化剂颗粒快速移出,置于手套箱中(N2气氛),以供后续使用。
2.1 本征反应动力学实验采用搅拌釜式反应器开展本征反应动力学实验研究。首先,通过改变Ni3CuSn0.3/SiO2粒径和搅拌转速来消除催化剂颗粒内、外扩散的影响。然后,在60~90 ℃和0.2~1.0 MPa的条件下,进行裂解汽油C8芳烃选择性加氢反应的本征动力学实验。液体原料为100 mL,催化剂用量为0.3 g,二者均一次性加入,H2连续通入并维持系统压力。液相产物定时取出并分析其组成。
2.2 固定床反应器实验固定床反应器为夹套式不锈钢反应器(内径为1 cm,高为25 cm),将催化剂颗粒(640 μm,1 g)置于反应器中央(催化剂床层高度为2 cm),其余部分填充石英砂(640 μm)。通过外置的循环水浴来控制反应温度。反应条件:50~90 ℃、0.4~1.4 MPa、H2/苯乙炔摩尔比为4~14、原料苯乙炔质量分数为0~4%、液时空速为10 h−1。在实验过程中,通入N2以保持气体总流量为73 mL⋅min−1。具体的实验装置和流程见文献[24]。
3 模型部分 3.1 本征反应动力学模型苯乙炔加氢反应体系主要包括苯乙炔→苯乙烯的选择性加氢和苯乙烯→乙苯的过度加氢[30-31]。根据文献报道,对该反应的动力学模型主要可分为幂函数型[30]和Langmuir-Hinshelwood型[19]两类。为了便于后续固定床反应器的建模和求解,本研究采用幂函数型动力学模型:
| $ {R_{{\text{PA}} \to {\text{ST}}}} = {k_1}c_{{\text{PA}}}^{{a_1}}c_{\text{H}}^{{b_1}} $ | (1) |
| $ {R_{{\text{ST}} \to {\text{EB}}}} = {k_2}c_{{\text{ST}}}^{{a_2}}c_{\text{H}}^{{b_2}} $ | (2) |
式中:
| $ {k_i} = {k_{i,0}}\exp \left( { - \frac{{{E_i}}}{{RT}}} \right),i = 1,2 $ | (3) |
式中:ki, 0(i = 1, 2)为各步骤的反应速率常数指前因子,i = 1时单位为m3⋅g−1⋅s−1,i = 2时单位为m4.5⋅mol0.5⋅g−1⋅s−1;Ei为反应活化能,J⋅mol−1;R为气体常量,8.314 J⋅mol−1⋅K−1;T为反应温度,K。
在反应釜内,苯乙炔和苯乙烯的浓度随反应时间的变化可分别表示为:
| $ \frac{{d{c_{{\text{PA}}}}}}{{dt}} = - \frac{m}{{{V_{\text{L}}}}}{R_{{\text{PA}} \to {\text{ST}}}} $ | (4) |
| $ \frac{{d{c_{{\text{ST}}}}}}{{dt}} = \frac{m}{{{V_{\text{L}}}}}\left( {{R_{{\text{PA}} \to {\text{ST}}}} - {R_{{\text{ST}} \to {\text{EB}}}}} \right) $ | (5) |
式中:m为催化剂质量,0.3 g;VL为原料液体积,100 mL。式(4)、(5)的初始边界条件为:
| $ t = 0:{c_{{\text{PA}}}} = c_{{\text{PA}}}^0,{c_{{\text{ST}}}} = c_{{\text{ST}}}^0 $ | (6) |
利用实验数据,通过Levenberg-Marquardt算法对动力学模型参数进行估值,目标函数为苯乙炔和苯乙烯浓度的实验值与动力学模型计算值之间的残差平方和最小值。
3.2 固定床反应器数学模型在建立固定床反应器数学模型时,作以下几点假设:(1) 催化剂床层处于等温状态;(2) 忽略床层内的轴向返混和径向分布;(3) 气-液两相间充分混合,溶液中的氢气浓度与其溶解度相等;(4) 催化剂颗粒完全润湿。
液体体相的质量平衡方程为:
| $ {u}_{\text{L}}\frac{d{c}_{\text{L,}j}}{dz}+{k}_{\text{LS}}{a}_{\text{LS}}\left({c}_{\text{L,}j}-{c}_{\text{S,}j|r={r}_{\text{P}}}\right)=0,j={\text{PA,}}^{{}_{\text{ }}}{\text{ST,}}^{\text{ }}\text{EB} $ | (7) |
式中:uL为液体流速,m⋅s−1;kLS为液-固传质系数,m⋅s−1;aLS为单位反应器体积的液固界面面积,m−1;z为反应器轴向位置,m;
| $ {\varepsilon _{\text{B}}}\left( {\frac{{{k_{{\text{LS}}}}{d_{\text{P}}}}}{{{D_{\text{L}}}}}} \right) = 0.8{\left( {\frac{{{d_{\text{P}}}{u_{\text{L}}}{\rho _{\text{L}}}}}{{{\mu _{\text{L}}}}}} \right)^{0.5}}{\left( {\frac{{{\mu _{\text{L}}}}}{{{D_{\text{L}}}{\rho _{\text{L}}}}}} \right)^{0.33}} $ | (8) |
式中:εB为催化剂床层空隙率,取0.43;dp为催化剂颗粒直径,m;DL为液体分子扩散系数,m2⋅s−1;ρL为液体密度,kg⋅m−3;μL为液体黏度,Pa⋅s。式(7)的边界条件为:
| $ z = 0:{c_{{\text{L,}}j}} = c_{{\text{L,}}j}^0,j = {\text{PA,ST,EB}} $ | (9) |
催化剂颗粒相的质量平衡方程为:
| $ \frac{{{D_{{\text{e,H}}}}}}{{{r^2}}}\frac{{\text{d}}}{{{\text{d}}r}}\left( {{r^2}\frac{{{\text{d}}{c_{{\text{S,H}}}}}}{{{\text{d}}r}}} \right) = {R_{{\text{PA}} \to {\text{ST}}}} + {R_{{\text{ST}} \to {\text{EB}}}} $ | (10) |
| $ \frac{{{D_{{\text{e,PA}}}}}}{{{r^2}}}\frac{{\text{d}}}{{{\text{d}}r}}\left( {{r^2}\frac{{{\text{d}}{c_{{\text{S,PA}}}}}}{{{\text{d}}r}}} \right) = {R_{{\text{PA}} \to {\text{ST}}}} $ | (11) |
| $ \frac{{{D_{{\text{e,ST}}}}}}{{{r^2}}}\frac{{\text{d}}}{{{\text{d}}r}}\left( {{r^2}\frac{{{\text{d}}{c_{{\text{S,ST}}}}}}{{{\text{d}}r}}} \right) = {R_{{\text{ST}} \to {\text{EB}}}} - {R_{{\text{PA}} \to {\text{ST}}}} $ | (12) |
| $ \frac{{{D_{{\text{e,EB}}}}}}{{{r^2}}}\frac{{\text{d}}}{{{\text{d}}r}}\left( {{r^2}\frac{{{\text{d}}{c_{{\text{S,EB}}}}}}{{{\text{d}}r}}} \right) = - {R_{{\text{ST}} \to {\text{EB}}}} $ | (13) |
式中:cS, j表示催化剂颗粒中组分j的物质的量浓度,mol⋅L−1;组分j的有效扩散系数De, j可由式(14)计算得出[24]:
| $ {D_{{\text{e,}}j}} = \frac{{{\varepsilon _{\text{P}}}}}{{{\tau _{\text{P}}}}}{D_j},j = {{\text{H}}_{\text{2}}}{\text{,PA,ST,EB}} $ | (14) |
式中:εP为催化剂孔隙率,取0.4;τP为催化剂曲折因子,取4.0;Dj为组分j的分子扩散系数,可由式(15)计算得到[32]:
| $ {D_j} = \frac{{7.4 \times {{10}^{ - 8}}\sqrt {\phi {M_{\text{L}}}} T}}{{{\mu _{\text{L}}}V_j^{0.6}}} $ | (15) |
式中:ϕ为相关因子;ML为液体摩尔质量,kg⋅mol−1;Vj为组分j的摩尔体积,cm3⋅mol−1。
式(10)~(13)的边界条件为:
| $ r = 0:\frac{{d{c_{{\text{S,}}j}}}}{{dr}} = 0,j = {{\text{H}}_{\text{2}}}{\text{,PA,ST,EB}} $ | (16) |
| $ r={r}_{\rm{P}}:{D}_{\text{e,}j}\frac{d{c}_{\text{S,}j}}{dr}={k}_{\text{LS,}j}\left({c}_{\text{L,}j}-{c}_{\text{S,}j|r={r}_{\rm{P}}}\right),j={\text{H}}_{\text{2}}{\text{,PA,}}^{{}_{\text{ }}}{\text{ST,}}^{\text{ }}\text{EB} $ | (17) |
H2在液相中的物质的量浓度cH可通过式(18)计算:
| $ {c_{\text{H}}} = \left( { - 7.096 + 0.112T} \right){P_{\text{H}}} $ | (18) |
式中:PH为氢气压力,MPa。
采用有限元正交配置法对催化剂颗粒相的扩散-反应方程组进行求解,沿颗粒径向进行离散化处理,将其分为10个单元,每个单元配置5个节点。对于液相主体的浓度分布微分方程组,采用四阶龙格-库塔法进行求解。上述模型涉及的物性参数见文献[33-34]。
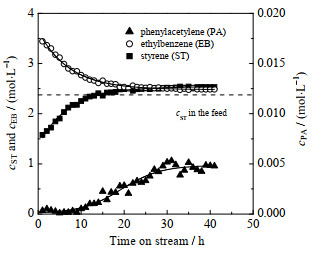
4 结果与讨论 4.1 催化剂的稳定性图 1给出了在苛刻的反应条件下,反应器出口处苯乙炔、苯乙烯和乙苯浓度随反应时间的变化趋势(其中LHSV为液时空速)。反应器进口原料中苯乙炔、苯乙烯、乙苯浓度分别为0.173、2.370、2.487 mol⋅L−1。由图可知,在反应初期(≤ 10 h),催化剂表现出非常高的加氢活性,苯乙炔几乎完全转化,同时苯乙烯被大量消耗,使得反应产物中的苯乙烯浓度低于原料中的浓度。随着反应的进行,催化剂活性逐渐降低,未反应的苯乙炔逐渐增加。苯乙炔的存在抑制了苯乙烯的过度加氢[28],导致苯乙烯浓度增加,而乙苯浓度则减小。当反应进行到30 h后,3种物质的浓度保持不变,表明催化剂的活性趋于稳定。此时,产品苯乙烯的浓度大于原料苯乙烯浓度,凸显了Ni3CuSn0.3/SiO2催化剂优异的苯乙炔→苯乙烯选择性。在后续的研究中,均采用活性稳定的催化剂进行相关实验。
|
图 1 反应产物中各组分浓度随反应时间的变化规律 Fig.1 Variation of component concentrations in the product as a function of reaction time (Conditions: 90 ℃, 1.0 MPa, H2/PA molar ratio = 8, LHSV = 16 h−1) |
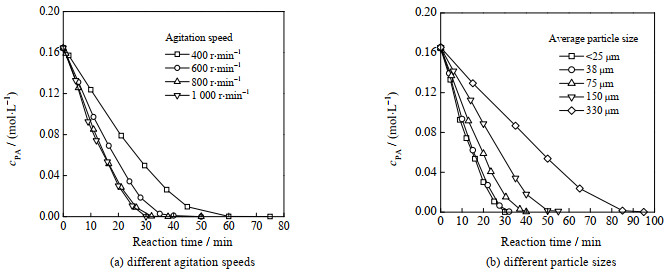
由图 2可知,当催化剂平均粒径小于38 μm且搅拌转速大于800 r⋅min−1时,可以消除催化剂内、外扩散的影响。鉴于此,本研究采用粒径小于25 μm的催化剂颗粒,在1 000 r⋅min−1的转速下,开展本征反应动力学的研究。
|
图 2 苯乙炔浓度随反应时间的变化规律 Fig.2 Variation of phenacetylene concentration as a function of reaction time (90 ℃, 1.0 MPa, 0.3 g catalyst, (a) dp < 25 μm, (b) 1 000 r⋅min−1) |
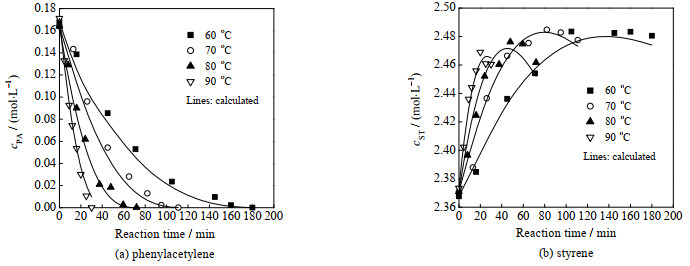
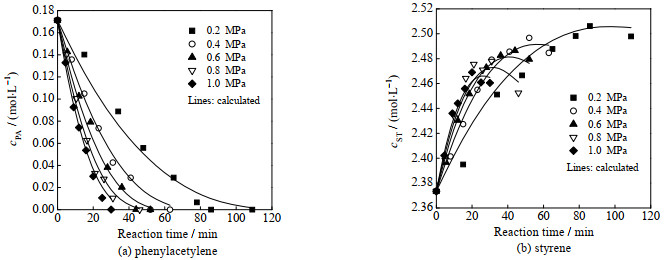
图 3显示了苯乙炔和苯乙烯浓度随反应温度变化的典型规律。随着反应温度的升高,苯乙炔和苯乙烯的反应速率均增加,导致苯乙炔完全转化所需时间缩短。同时,苯乙烯浓度的最大值呈总体下降趋势。图 4展示了苯乙炔和苯乙烯浓度随反应压力变化的规律。随着压力增大,溶液中的氢气浓度增加,导致苯乙炔和苯乙烯的加氢反应加快,使苯乙炔完全转化所需时间缩短、苯乙烯浓度的最大值减小,这与温度的影响趋势相似。
|
图 3 不同反应温度下物质浓度随反应时间的变化 Fig.3 Variation of substance concentrations as a function of reaction time at different temperatures (1.0 MPa; symbols: experimental data; lines: calculated from the kinetic model) |
|
图 4 不同反应压力下物质浓度随反应时间的变化 Fig.4 Variation of substance concentrations as a function of reaction time at different pressures (90 ºC; symbols: experimental data; lines: calculated from the kinetic model) |
基于本征动力学实验数据,通过非线性最小二乘拟合,获得了苯乙炔和苯乙烯加氢反应的活化能和反应级数,其加氢反应速率方程分别为:
| $ {R_{{\text{PA}} \to {\text{ST}}}} = 1.02\exp \left( { - \frac{{{{46}_{}}330}}{{RT}}} \right)c_{{\text{PA}}}^{0.628}c_{\text{H}}^{0.655} $ | (19) |
| $ {R_{{\text{ST}} \to {\text{EB}}}} = 2.77\exp \left( { - \frac{{{{68}_{}}950}}{{RT}}} \right)c_{{\text{ST}}}^{0.822}c_{\text{H}}^{1.185} $ | (20) |
苯乙烯→乙苯加氢反应的表观活化能(68.95 kJ⋅mol−1)大于苯乙炔→苯乙烯(46.33 kJ⋅mol−1),因此反应温度升高对于苯乙烯加氢更为有利,这与实验观察到的温度影响相符(图 3(b))。此外,苯乙烯→乙苯反应的氢气级数(1.185)大于苯乙炔→苯乙烯(0.655),导致升高氢压对苯乙烯生成不利,这也符合实验现象(图 4(b))。
由图 3和图 4可知,苯乙炔和苯乙烯浓度的实验值与动力学模型计算值较为接近,二者的平均相对误差绝对值分别为9.5% (苯乙炔)和0.2% (苯乙烯)。上述结果表明,本研究所建立的裂解汽油C8芳烃选择性加氢反应的动力学模型是合理和可靠的。需要说明的是,相比于苯乙烯,苯乙炔的平均相对误差较大,这可能是因为苯乙炔浓度较低,实验分析误差相对较大。
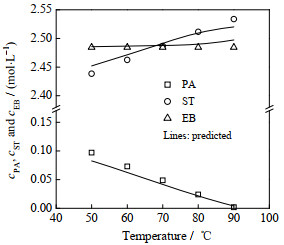
4.3 固定床反应器分析在固定床反应器中,研究了反应温度(图 5)、压力(图 6)、进料H2/苯乙炔的摩尔比(图 7)和苯乙炔浓度(图 8)对裂解汽油C8芳烃选择性加氢反应的影响。当反应温度由50 ℃提高至90 ℃时,产物中苯乙炔浓度由0.097 mol⋅L−1下降至0,苯乙烯浓度则由2.438 mol⋅L−1增加至2.533 mol⋅L−1,而乙苯浓度保持不变,与进料浓度相同。这表明在此条件下,仅发生了苯乙炔→苯乙烯的加氢反应。
|
图 5 反应温度对反应器出口处各组分浓度的影响 Fig.5 Effect of reaction temperature on the outlet concentration of each component (1.0 MPa, H2/PA molar ratio = 8, LHSV = 10 h−1, symbols: experimental data; lines: model prediction) |
|
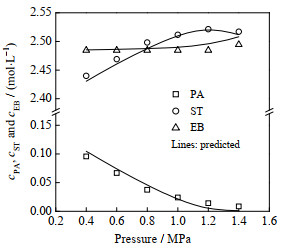
图 6 反应压力对反应器出口处各组分浓度的影响 Fig.6 Effect of reaction pressure on the outlet concentration of each component (80 ℃, H2/PA molar ratio = 8, LHSV = 10 h−1, symbols: experimental data; lines: model prediction) |

|
图 7 H2/苯乙炔摩尔比对反应器出口处各组分浓度的影响 Fig.7 Effect of H2/PA molar ratio on the outlet concentration of each component (80 ºC, 1.0 MPa, LHSV = 10 h−1, symbols: experimental data; lines: model prediction) |
|
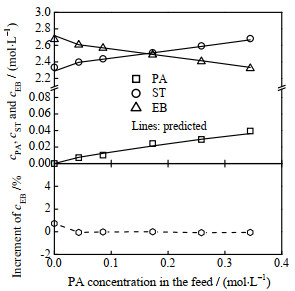
图 8 原料苯乙炔浓度对反应器出口处各组分浓度的影响 Fig.8 Effect of phenylacetylene concentration in the feed on the outlet concentration of each component (80 ºC, 1.0 MPa, H2/PA molar ratio = 8, LHSV = 10 h−1; symbols: experimental data; lines: model prediction) |
随着压力从0.4 MPa升至1.2 MPa,苯乙炔浓度迅速下降,苯乙烯浓度增加,而乙苯浓度保持不变。当压力进一步增至1.4 MPa时,虽然苯乙炔浓度继续降低,但是苯乙烯浓度略有下降,而乙苯浓度则有所增加。上述结果说明,增加压力有利于苯乙炔的转化,适当提高压力亦可提高苯乙烯的收率,但是过高的压力会加速苯乙烯→乙苯的反应,从而对苯乙烯的收率不利,这与前文的动力学研究结果相符。
随着进料H2/苯乙炔摩尔比在4~14内增加,产物中苯乙炔浓度逐渐降至0,而苯乙烯浓度先增加后减小,在H2/苯乙炔摩尔比为8~12时达到最大值。与此相对应,在H2/苯乙炔摩尔比≤ 8时,乙苯浓度与进料浓度保持相等,当H2/苯乙炔摩尔比 > 8之后,其值开始增加。H2/苯乙炔摩尔比的影响规律与压力的影响规律相似,这是合理的,因为二者在本质上都改变了H2在液相的溶解度。
鉴于在工业生产中,裂解汽油C8芳烃馏分中苯乙炔质量分数通常在0.2%~2.0% 变化[29],因此,研究了进料苯乙炔质量分数(0~4%)对裂解汽油C8芳烃选择性加氢反应的影响。在改变进料苯乙炔含量时,苯乙烯质量分数(28%)和间二甲苯质量分数(40%)保持不变,而乙苯含量作相应调整。
随着进料苯乙炔浓度的增加,产品中苯乙炔和苯乙烯的浓度均增大,而乙苯浓度则减小。考虑到原料中乙苯浓度随着苯乙炔浓度的改变而发生了变化,本研究引入了乙苯浓度增量(产物中乙苯浓度相对于原料中乙苯浓度的增加百分比)这一变量,用以分析原料苯乙炔浓度对反应的影响。由图 8可见,随着原料苯乙炔浓度的增加,乙苯浓度增量几乎保持为0(除了苯乙炔浓度为0的情况),这表明苯乙炔的存在的确抑制了苯乙烯的进一步加氢。需要强调的是,当原料中不含苯乙炔时,经过固定床反应器,苯乙烯浓度仅从原料中的2.365 mol⋅L−1稍微降至产物中的2.334 mol⋅L−1,损失率约为1.3%。与之相对应,乙苯浓度增量约为0.73%。这说明该催化剂对苯乙烯→乙苯的加氢反应作用不明显。
上述反应器的研究结果充分证明了Ni3CuSn0.3/SiO2催化剂在裂解汽油C8芳烃选择性加氢反应过程中的优异性能。此外,采用反应器数学模型对固定床反应器内的裂解汽油C8芳烃选择性加氢反应进行了模拟。由图 5~8可见,模型的预测结果与实验结果较为一致。苯乙炔、苯乙烯和乙苯的浓度实验值与模型预测值之间的平均相对误差绝对值分别为9.8%、0.3% 和0.3%。这说明本研究所建立的反应器数学模型能够准确描述固定床反应器内的裂解汽油C8芳烃选择性加氢反应过程。
利用反应器数学模型可进一步求取各反应组分的效率因子(ƞj),计算如式(21):
| $ {\eta _j} = \frac{{3{D_{{\text{e,}}j}}}}{{{r_{\text{p}}}}}{\left( {\frac{1}{{{R_j}}} \times \frac{{{\text{d}}{c_{{\text{S,}}j}}}}{{{\text{d}}r}}} \right)_{r = {r_{\text{p}}}}},j = {{\text{H}}_{\text{2}}}{\text{,PA,ST,EB}} $ | (21) |
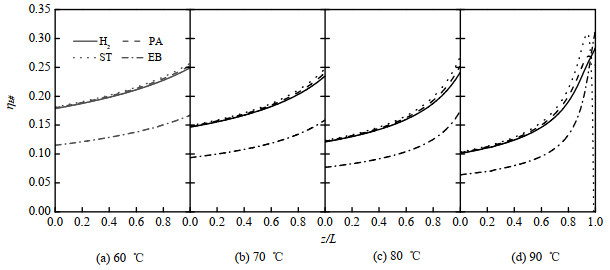
图 9显示了在60~90 ℃,H2、苯乙炔、苯乙烯和乙苯的效率因子随反应器轴向的变化趋势。所有反应组分的效率因子均介于0.05~0.35,表明加氢反应受到催化剂颗粒内扩散的影响。随着反应温度由60 ℃升至90 ℃,在反应器进口处(z/L = 0,z/L表示固定床反应器无因次轴向位置)各组分的效率因子减小,这是由于反应速率(Rj)随温度升高而增大。在给定的反应温度下,随着z/L的增加,各组分的效率因子基本上逐渐增大,这是因为随着反应进行,反应物浓度降低,反应速率减小。
|
图 9 各反应组分的效率因子沿固定床反应器轴向的变化 Fig.9 Variation of effectiveness factors for each component along the axial direction of the fixed-bed reactor (1.0 MPa, LHSV =10 h−1, H2/PA molar ratio = 8) |
然而,在90 ℃的反应温度下,苯乙烯的效率因子呈先增大后快速下降的趋势,在z/L = 0.940处达到最大值,在z/L = 0.986时趋于0。根据前文的分析可知,当苯乙炔大量存在时,苯乙烯加氢反应受到抑制,苯乙烯基本上可视为产物而非反应物,此时在反应中苯乙烯大量生成,催化剂颗粒表面的苯乙烯浓度梯度(
本研究对Ni3CuSn0.3/SiO2催化剂上的裂解汽油C8芳烃选择性加氢反应进行了实验和理论研究,建立了相应的本征反应动力学模型和固定床反应器数学模型,可以准确描述上述反应过程。苯乙炔→苯乙烯和苯乙烯→乙苯的本征反应活化能分别为46.33 kJ⋅mol−1和68.95 kJ⋅mol−1,氢气反应级数分别为0.655和1.185。在固定床反应器中,适当提高反应温度、压力和H2/苯乙炔的摩尔比,不仅可以加快苯乙炔加氢反应,还能提高苯乙烯的收率。随着反应温度升高,催化剂颗粒内扩散的影响增强,各组分的初始效率因子相应降低。利用本研究建立的固定床反应器数学模型,可以指导后续的Ni3CuSn0.3/SiO2催化剂上的裂解汽油C8芳烃选择性加氢反应器的设计和优化操作。
| [1] |
刘玲, 刘宏吉, 张春阳, 等. 国内外苯乙烯生产及市场分析预测[J]. 化学工业, 2023, 41(3): 45-51. LIU L, LIU H J, ZHANG C Y, et al. Production, market analysis and prediction of styrene in China and overseas[J]. Chemical Industry, 2023, 41(3): 45-51. |
| [2] |
GHASEMZADEH K, ZEYNALI R, BAHADORI F, et al. CFD analysis of Pd-Ag membrane reactor performance during ethylbenzene dehydrogenation process[J]. International Journal of Hydrogen Energy, 2018, 43(15): 7675-7683. DOI:10.1016/j.ijhydene.2017.09.112 |
| [3] |
NIJHUIS T A, MAKKEE M, MOULIJN J A, et al. The production of propene oxide: Catalytic processes and recent developments[J]. Industrial & Engineering Chemistry Research, 2006, 45(10): 3447-3459. |
| [4] |
LEE F M, GENTRY J C, WYTCHERLEY R W. Recovery of styrene from pyrolysis gasoline by extractive distillation: US, 5849982A [P]. 1998-12-15.
|
| [5] |
于婷婷, 安晓冬, 吴兴松, 等. 应用GT-Styrene®苯乙烯回收技术对裂解汽油的改质分析[J]. 乙烯工业, 2011, 23(2): 26-29. YU T T, AN X D, WU X S, et al. Pyrolysis gasoline upgrading by using GT-Styrene recovery process[J]. Ethylene Industry, 2011, 23(2): 26-29. |
| [6] |
肖剑, 杨伟, 陈祎华, 等. 苯乙烯存在下苯乙炔选择性加氢过程的研究[J]. 工业催化, 2004, 12(7): 7-11. XIAO J, YANG W, CHEN Y H, et al. Selective hydrogenation of phenylacetylene in the presence of styrene[J]. Industrial Catalysis, 2004, 12(7): 7-11. |
| [7] |
ARNOLD H, DöBERT F, GAUBE J. Selective hydrogenation of hydrocarbons [M]//ERTL G, KNÖZINGER H, SCHÜTH F, et al. Handbook of Heterogeneous Catalysis. 2nd ed. Weinheim: Wiley-VCH, 2008: 3266-3284.
|
| [8] |
HU J W, ZHOU Z M, ZHANG R, et al. Selective hydrogenation of phenylacetylene over a nano-Pd/α-Al2O3 catalyst[J]. Journal of Molecular Catalysis A: Chemical, 2014, 381: 61-69. DOI:10.1016/j.molcata.2013.10.008 |
| [9] |
王沾祺, 周志明, 张锐, 等. Pd-Cu/γ-Al2O3催化苯乙炔选择性加氢反应[J]. 物理化学学报, 2014, 30(12): 2315-2322. WANG Z Q, ZHOU Z M, ZHANG R, et al. Selective hydrogenation of phenylacetylene over Pd-Cu/γ-Al2O3 catalysts[J]. Acta Physico-Chimica Sinica, 2014, 30(12): 2315-2322. |
| [10] |
WANG Z Q, YANG L, ZHANG R, et al. Selective hydrogenation of phenylacetylene over bimetallic Pd–Cu/Al2O3 and Pd–Zn/Al2O3 catalysts[J]. Catalysis Today, 2016, 264: 37-43. DOI:10.1016/j.cattod.2015.08.018 |
| [11] |
YANG L, CHEN X L, ZHOU Z M, et al. Magnetic Fe3O4@SiO2/Pd and Fe3O4@SiO2/Pd-M (M=Ag, Cu and Zn) catalysts for selective hydrogenation of phenylacetylene[J]. ChemistrySelect, 2016, 1(18): 5599-5606. DOI:10.1002/slct.201601422 |
| [12] |
YANG L, JIN Y Z, FANG X C, et al. Magnetically recyclable core-shell structured Pd-based catalysts for semihydrogenation of phenylacetylene[J]. Industrial & Engineering Chemistry Research, 2017, 56(48): 14182-14191. |
| [13] |
SHEN Y L, YIN K J, AN C H, et al. Design of a difunctional Zn-Ti LDHs supported PdAu catalyst for selective hydrogenation of phenylacetylene[J]. Applied Surface Science, 2018, 456: 1-6. DOI:10.1016/j.apsusc.2018.06.091 |
| [14] |
MIYAZAKI M, FURUKAWA S, TAKAYAMA T, et al. Surface modification of PdZn nanoparticles via galvanic replacement for the selective hydrogenation of terminal alkynes[J]. ACS Applied Nano Materials, 2019, 2(5): 3307-3314. DOI:10.1021/acsanm.9b00761 |
| [15] |
YANG F, DING S P, SONG H B, et al. Single-atom Pd dispersed on nanoscale anatase TiO2 for the selective hydrogenation of phenylacetylene[J]. Science China Materials, 2020, 63(6): 982-992. DOI:10.1007/s40843-020-1271-x |
| [16] |
LIU Y, GUO W, LI X J, et al. Copper single-atom-covered Pt nanoparticles for selective hydrogenation of phenylacetylene[J]. ACS Applied Nano Materials, 2021, 4(5): 5292-5300. DOI:10.1021/acsanm.1c00646 |
| [17] |
SONG X, SHAO F J, ZHAO Z J, et al. Single-atom Ni-modified Al2O3-supported Pd for mild-temperature semi-hydrogenation of alkynes[J]. ACS Catalysis, 2022, 12(24): 14846-14855. DOI:10.1021/acscatal.2c04883 |
| [18] |
LV J G, WANG D, GUO X F, et al. Selective hydrogenation of phenylacetylene over high-energy facets exposed nanotubular alumina supported palladium catalysts[J]. Catalysis Communications, 2023, 181: 106715. DOI:10.1016/j.catcom.2023.106715 |
| [19] |
ZHOU Z M, HU J W, ZHANG R, et al. Revisiting the reaction kinetics of selective hydrogenation of phenylacetylene over an egg-shell catalyst in excess styrene[J]. Chemical Engineering Science, 2015, 138: 663-672. DOI:10.1016/j.ces.2015.08.040 |
| [20] |
程远琳, 朱俊华, 李斯琴, 等. 裂解C8馏分选择性加氢脱除苯乙炔[J]. 化学反应工程与工艺, 2013, 29(4): 301-306. CHENG Y L, ZHU J H, LI S Q, et al. Selective hydrogenation of phenylacetylene in C8 fraction of pyrolysis gasoline[J]. Chemical Reaction Engineering and Technology, 2013, 29(4): 301-306. |
| [21] |
LI C M, CHEN Y D, ZHANG S T, et al. Nickel-gallium intermetallic nanocrystal catalysts in the semihydrogenation of phenylacetylene[J]. ChemCatChem, 2014, 6(3): 824-831. DOI:10.1002/cctc.201300813 |
| [22] |
YANG K X, CHEN X, WANG L, et al. SBA-15-supported metal silicides prepared by chemical vapor deposition as efficient catalysts towards the semihydrogenation of phenylacetylene[J]. ChemCatChem, 2017, 9(7): 1337-1342. DOI:10.1002/cctc.201601653 |
| [23] |
YANG L, YU S Y, PENG C, et al. Semihydrogenation of phenylacetylene over nonprecious Ni-based catalysts supported on AlSBA-15[J]. Journal of Catalysis, 2019, 370: 310-320. DOI:10.1016/j.jcat.2019.01.012 |
| [24] |
BAO Z C, YANG L, CHENG Z M, et al. Selective hydrogenation of the C8 aromatic fraction of pyrolysis gasoline over NiZn3/α-Al2O3: Experimental and modeling studies[J]. Industrial & Engineering Chemistry Research, 2020, 59(10): 4322-4332. |
| [25] |
CHEN W, BAO Z C, ZHOU Z M. Selective hydrogenation of phenylacetylene over non-precious bimetallic Ni–Zn/SiO2 and Ni–Co/SiO2 catalysts prepared by glucose pyrolysis[J]. Reaction Kinetics, Mechanisms and Catalysis, 2022, 135(5): 2533-2550. DOI:10.1007/s11144-022-02276-w |
| [26] |
WANG X X, SONG T, FU G Y, et al. Electronic and steric modification of Ni nanoparticle surface via N-doped carbon layers enables highly selective semihydrogenation of alkynes[J]. ACS Catalysis, 2023, 13(17): 11634-11643. DOI:10.1021/acscatal.3c02450 |
| [27] |
周志明, 季国争, 陈伟. 二氧化硅负载镍基三金属催化剂及其制备方法以及在苯乙炔选择性加氢中的应用: CN, 114849720A [P]. 2022-08-05. ZHOU Z M, JI G Z, CHEN W. Silica-loaded nickel-based trimetal catalyst, preparation method thereof and application of silica-loaded nickel-based trimetal catalyst in selective hydrogenation of phenylacetylene: CN, 114849720A [P]. 2022-08-05. |
| [28] |
CHEN W, XU H W, MA X L, et al. Synergistic trimetallic Ni-Cu-Sn catalysts for efficient selective hydrogenation of phenylacetylene[J]. Chemical Engineering Journal, 2023, 455: 140565. DOI:10.1016/j.cej.2022.140565 |
| [29] |
LI S Q, LIU J T, ZHU Z Y, et al. Method for selective hydrogenation of phenylacetylene using composite bed in the presence of styrene: US, 8916736B2 [P]. 2014-12-23.
|
| [30] |
JACKSON S D, SHAW L A. The liquid-phase hydrogenation of phenyl acetylene and styrene on a palladium/carbon catalyst[J]. Applied Catalysis A: General, 1996, 134(1): 91-99. DOI:10.1016/0926-860X(95)00194-8 |
| [31] |
HARDACRE C, MULLAN E A, ROONEY D W, et al. Comparison of mass transfer effects in the heterogeneously catalysed hydrogenation of phenyl acetylene in heptane and an ionic liquid[J]. Chemical Engineering Science, 2006, 61(21): 6995-7006. DOI:10.1016/j.ces.2006.07.020 |
| [32] |
AUMO J, WäRNå J, SALMI T, et al. Interaction of kinetics and internal diffusion in complex catalytic three-phase reactions: Activity and selectivity in citral hydrogenation[J]. Chemical Engineering Science, 2006, 61(2): 814-822. DOI:10.1016/j.ces.2005.07.036 |
| [33] |
REID R C, PRAUSNITZ J M, POLING B E. The properties of gases and liquids[M]. 4th ed. New York: McGraw-Hill, 1987.
|
| [34] |
YAWS C L. Chemical properties handbook: Physical, thermodynamic, environmental, transport, safety, and health related properties for organic and inorganic chemicals[M]. New York: McGraw-Hill, 1999.
|




