2. 北部湾大学 海洋学院, 广西 钦州 535011
2. College of Marine Sciences, Beibu Gulf University, Qinzhou 535011, China
化学-酶法环氧化是在Prileshajev环氧化反应基础上建立起来的催化方式,Björkling等[1]在1990年第一次以脂肪酶为催化剂实现烯烃环氧化,即以有机酸和过氧化氢为底物在酶的催化下原位合成过氧酸,当体系中存在烯烃,过氧有机酸可立即将氧传递给C═C双键而形成环氧化物。脂肪酶[2]介导的化学-酶法环氧化不需辅助因子参与,且有较好的有机溶剂耐受性,已有多种烯烃环氧化成功的报道[3-4]。α-蒎烯环氧化物即2, 3-环氧蒎烷是一类重要的中间体,是香精香料如龙脑烯醛、反式香芹醇等高价值化合物的前体[5-6],由α-蒎烯的环氧化反应形成[7-9]。
然而脂肪酶的稳定性仍是其工业化应用的瓶颈制约,提高其稳定性也是研究的热点[10-11]。目前研究主要认为化学-酶法环氧化体系中存在高浓度H2O2引起脂肪酶失活[12],熊阳等[13]发现过氧有机酸和H2O2的协同作用对酶稳定性的影响要高于单一因素。过氧有机酸对脂肪酶稳定性的影响少有报道。为提高脂肪酶稳定性,常需要对脂肪酶进行固定化,如商品固定化酶Novozym435[14-17],以及将酶嵌入其中的金属有机骨架(MOFs)固定化法[18-19]。全细胞脂肪酶,相当于酶以天然固定化的方式保护于细胞中,可以免去酶的提纯与纯化工序,有望提高脂肪酶稳定性。前期研究发现米根霉(Rhizopus oryzae CGMCC 3.5040)产生的脂肪酶(Rhizopus oryzae lipase)可以催化有机酸和过氧化氢原位合成过氧酸,即具有“过水解”(perhydrolysis)反应的功能[20],但是目前对于全细胞催化剂在该反应体系中的稳定性影响因素的探究尚未见报道。
全细胞生物催化剂用于催化底物完全转化为产物的催化效率和稳定性等由细胞的总体功能决定,如脂肪酶在微生物全细胞中的定位及各组分之间的传质等[21-22]。碱性缓冲盐常作为束酸剂加入反应体系中,用来调节体系的酸度,从而抑制产物开环反应,提高反应的选择性[3-4, 23]。而柠檬酸三钠(Na3C6H5O7)是否能通过维持反应体系氢离子的浓度在相对较低的水平,从而减缓过氧有机酸对脂肪酶的影响,这方面工作未见报道。戊二醛(GA)常用作细胞固定化交联剂,通过对细胞的支持和固定作用来加强整个细胞的稳定性[24-25]。本研究以α-蒎烯为模式底物,通过考察反应体系中不同pH的戊二醛交联固定化细胞,柠檬酸三钠用量,过氧化氢(H2O2)用量及回用方式等对全细胞脂肪酶稳定性的影响,寻求保持全细胞脂肪酶酶活的方法,这对于该全细胞催化剂实现工业化应用有重要意义。
2 实验(材料与方法) 2.1 实验材料实验菌种:米根霉(Rhizopus oryzae CGMCC 3.5040)购自中国微生物菌种保藏中心(CGMCC;北京);(±)-α-蒎烯,(±)-α-环氧蒎烷(气相色谱标准品)、辛酸、柠檬酸三钠二水合物(Na3C6H5O7 ·2H2O)、大豆油购自阿拉丁化学有限公司(上海);过氧化氢(质量分数为30%)、甲苯购自天津大茂化学试剂厂;戊二醛溶液(质量分数为50%)购自Macklin公司(上海)。所有试剂均为分析纯。
2.2 细胞培养固体培养基:马铃薯蔗糖培养基(PDA)。接种斜面于30 ℃生化培养箱培养5 d。液体培养基:大豆油30 g⋅L−1,蛋白胨70 g⋅L−1,NaNO3 1 g⋅L−1,KH2PO4 1 g⋅L−1,MgSO4·7H2O 0.5 g⋅L−1,调节pH为5.5。将斜面孢子接入液体培养基中,接种量为106孢子数每100 mL培养基。接种后于30 ℃,150 r⋅min−1摇床培养48 h。细胞培养完后,水洗、过滤、干燥至恒重后作为未交联细胞备用。
2.3 全细胞戊二醛交联与表征采用不同pH值(6.7、6.8、6.9、7.0、7.2、7.4、7.6、7.8)的0.01 mol⋅L−1磷酸盐缓冲液(PB)配制体积分数为0.1% 戊二醛溶液,用水配制0.1% 戊二醛溶液作对照。细胞培养结束后,洗涤后的全细胞在不同pH值戊二醛溶液于25 ℃下浸泡1 h,再用缓冲溶液洗涤抽滤3次收集全细胞;全细胞需先在−80 ℃下冰冻1 h,再进行真空冷冻干燥20 h。
扫描电镜(SEM):对戊二醛交联处理前后的菌丝及在环氧化反应的细胞再次冷冻干燥后进行使用Tescan MIRA LMS场发射扫描电镜(捷克布鲁诺)观察。
傅里叶红外光谱(FT-IR):取少量戊二醛交联处理前后的冻干菌丝,与溴化钾以质量分数为1:100的比例混合后研磨、压片,采用傅里叶红外光谱仪对上述圆片试样进行测试(每个样品扫描32次,分辨率设置为4 cm−1),扫描范围为400~4 000 cm−1。
2.4 全细胞催化α-蒎烯环氧化反应α-蒎烯环氧化反应:30 mL反应瓶中加入1 mmol α-蒎烯,再加入1 mmol辛酸,用溶剂甲苯定容至1.5 mL作为有机相溶液,再加入0.5 mL 30% 的H2O2溶液,加入3.5 mmol柠檬酸钠震荡3 min混匀,在30 ℃预热15 min,再加入200 mg全细胞启动反应,于30 ℃,180 r⋅min−1摇床反应8 h后取上层有机相,用气相色谱仪测定。不加柠檬酸钠做对照。
三相过氧化氢浓度的测定:α-蒎烯环氧化反应8 h结束后取反应体系有机相、水相、细胞相用铈量法测定过氧化氢浓度。细胞回用:全细胞催化剂在第一次反应结束后采用甲苯溶剂洗涤,抽滤回收,将回收的全细胞投入新的反应体系。
2.5 戊二醛交联的影响α-蒎烯环氧化反应参照2.4节。全细胞热稳定性:将戊二醛交联及未交联的全细胞在水浴(100 ℃)中加热不同时间,再将进行过热处理后的全细胞进行α-蒎烯环氧化反应。全细胞储存稳定性:将同一批戊二醛交联及未交联的全细胞放置不同时间,再取不同储存时间的全细胞进行α-蒎烯环氧化反应。
2.6 柠檬酸三钠用量的影响α-蒎烯环氧化反应参照2.4节,分别加入0、1、2.5、3.5、5 mmol不同用量柠檬酸钠,分别于30 min和8 h取上层有机相,用气相色谱仪测定。过水解反应:30 mL反应瓶中加入1 mmol辛酸,用溶剂甲苯定容至1.5 mL作为有机相溶液,再加入0.5 mL的30% 的H2O2,加入不同用量柠檬酸钠震荡3 min混匀,在30 ℃预热15 min,再加入200 mg戊二醛交联全细胞启动反应,于30 ℃,180 r⋅min−1摇床反应4 h。取上层有机相分析过酸浓度。
2.7 不同H2O2用量的影响α-蒎烯环氧化反应参照2.4节,分别加入1、2.5、5、7.5、10 mmol不同用量H2O2,于8 h取上层有机相,用气相色谱仪测定。全细胞催化剂在第一次反应结束后采用甲苯洗涤,抽滤回收,将回收的全细胞投入新的反应体系。
2.8 回用方式的影响参照2.4节α-蒎烯环氧化反应结束后,采用水-甲苯洗、乙腈-甲苯洗,丙酮-甲苯洗、甲苯溶剂洗涤,抽滤回收,将回收的全细胞投入新的反应体系。同时考察直接吸取上层有机相后,重新加入含1 mmol α-蒎烯、1 mmol辛酸的1.5 mL甲苯新鲜有机相进行新一轮的反应。
2.9 全细胞催化蒎烯环氧化的回用稳定性30 mL反应瓶中加入1 mmol α-蒎烯,再加入1 mmol辛酸,用溶剂甲苯定容至1.5 mL作为有机相溶液,再加入0.75 mL的30% 的H2O2,加入3.5 mmol柠檬酸钠震荡3 min混匀,在30 ℃预热15 min,再加入200 mg戊二醛交联全细胞,于30 ℃,180 r⋅min−1摇床反应8 h。反应结束后,将上层有机相分离取出,并在原体系中加入新的有机相进行反应,如此重复4次。再取出细胞加入新的反应体系,按上述方式重复3次。
2.10 α-蒎烯环氧化反应转化率、收率及过酸浓度的分析方法α-蒎烯及其环氧化物采用气相色谱外标法分析:气相色谱仪(GC-2010 Plus,日本岛津),FID检测器,Rxi-5Sil毛细血管柱(Shimadzu,30 m×0.32 mm (ID) × 0.25 µm);载气为N2;进样量:1 µL,进样口温度为250 ℃,检测器温度为280 ℃;进样方式:分流;分流比:20:1;柱温:80 ℃,保留3 min,以20 ℃⋅min−1升温到160 ℃,保留1 min。待测样品经孔径为0.22 µm的有机滤头过滤到进样瓶后用自动进样器进行检测。
| $\text { Conversion }=\frac{n_0-n_{\mathrm{f}}}{n_0} \times 100 \%$ | (1) |
式中:n0为加入α-蒎烯物质的量,mmoL;nf为反应后剩余α-蒎烯物质的量,mmol。
| $ \text { Yield }=\frac{n}{n_0} \times 100 \% $ | (2) |
式中:n为生成环氧蒎烷物质的量,mmol。
| $ v_0=\frac{c_0}{t} $ | (3) |
式中:
活性氧原子的浓度用碘量法测量,剩余H2O2浓度用铈量法测定,过酸浓度便是两者的差值[26-27]。
2.11 数据统计每个实验设立3个平行样,实验数据采用“平均值±标准差”(mean±SD)表示,采用SPSS 23.0软件进行数据处理分析,利用Duncan′s检验方法进行组间差异性分析,显著性p < 0.05表示数据间存在显著差异。
3 实验结果与讨论 3.1 全细胞催化蒎烯环氧化反应体系实验采用由有机相-固相-水相构成的三相体系,蒎烯和辛酸在有机相,30% H2O2溶液构成水相,固相为全细胞Rhizopus oryzae CGMCC 3.5040,辛酸和H2O2在全细胞脂肪酶的催化下原位合成过氧酸,过氧有机酸可立即将氧传递给蒎烯中C═C双键而形成环氧蒎烷(图 1)。由于细胞中存在半透膜,将全细胞加入用脂肪酶催化过水解反应的甲苯-30% H2O2溶液中时,在渗透压的作用下,反应体系中的H2O2水溶液渗透到细胞中,从而使细胞膨胀,下沉。
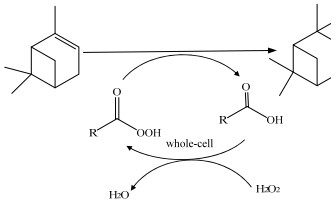
|
图 1 全细胞脂肪酶基于化学-酶法催化α-蒎烯环氧化反应 Fig.1 Chemo-enzymatic epoxidation of α-pinene catalyzed with whole-cell lipase |
反应通过加入缓冲盐,使水相形成高渗液,当细胞加入该反应体系后,在高渗液中平衡后悬浮于上层有机相中。测定反应体系加入3.5 mmol柠檬酸三钠前后三相中H2O2的浓度(图 2(a)),发现加入3.5 mmol柠檬酸三钠有机相中H2O2浓度能达到0.15 mol⋅L−1,而不加入缓冲盐,有机相最高浓度只能达到0.079 mol⋅L−1,说明柠檬酸三钠能有效提高有机相中的H2O2浓度。值得注意的是在水相中,加入3.5 mmol柠檬酸三钠水相中的H2O2初始浓度为16.61 mol⋅L−1,而30% H2O2原始浓度为8.9 mol⋅L−1,说明柠檬酸三钠的加入与H2O2中的水形成了饱和盐溶液,进而起到浓缩H2O2的作用,而高浓度的H2O2溶液更有利于H2O2从水相屮向有机相屮传质,同时说明该全细胞脂肪酶能耐受较高浓度的H2O2。从图 2(b)可以看出无柠檬酸三钠加入时,蒎烯的转化率仅为16.1%,加入3.5 mmol柠檬酸三钠后蒎烯转化率为81.6%,提升显著。
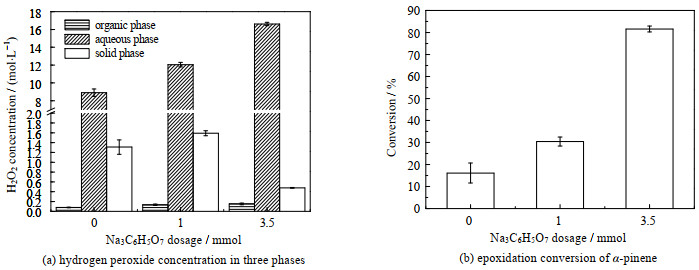
|
图 2 不同柠檬酸三钠添加量对全细胞催化α-蒎烯环氧化反应的影响 Fig.2 Effects of trisodium citrate additions on whole-cell catalyzed α-pinene epoxidation |
进一步考察该反应体系中全细胞催化剂的回用稳定性,从图 3可以看出,当直接采用米根霉全细胞催化α-蒎烯环氧化反应时,环氧蒎烷的首次收率为56.1%,第2次回用收率为32.2%,第3次回用时收率仅为2.3%,说明全细胞脂肪酶催化剂在该反应体系中回用稳定性较差。
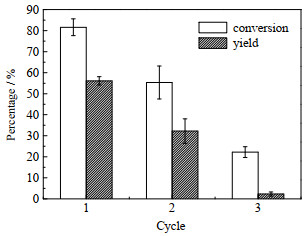
|
图 3 未交联全细胞催化α-蒎烯环氧化反应的回用稳定性 Fig.3 Reusage stability of uncrosslinked whole-cell for α-pinene epoxidation |
实验采用戊二醛交联的方式对全细胞进行固定化以提高其稳定性,从图 4(a)可以看出,直接使用水配制戊二醛溶液(对照组)与不同pH值磷酸盐缓冲液配制的戊二醛溶液交联细胞后其催化效率及回用稳定性都显著提高(p < 0.05)。
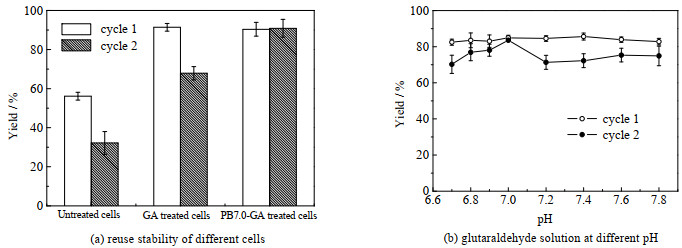
|
图 4 戊二醛交联对全细胞催化α-蒎烯环氧化反应稳定性的影响 Fig.4 Effects of GA crosslinking on the stability of whole-cell for α-pinene epoxidation |
同时发现不同pH值PB配制的戊二醛溶液交联细胞与对照组的回用稳定性不同(图 4(a)、(b)),对照组首次环氧化收率为91.4%,第2次收率却只有67.9%,不同pH值PB缓冲液配制的戊二醛溶液交联细胞后,其首次环氧化收率相近,都接近90% (p>0.05),但是pH为7.0的PB缓冲液配制的戊二醛溶液交联细胞回用收率最好,为90.9% (p<0.05)。由于首次收率相近,回收稳定性却不同,考虑是中性PB缓冲盐能减轻反应过程产生的有机酸对细胞的损害。从扫描电镜图(图 5)可以看出,戊二醛交联细胞在反应前后菌丝体形态相近,未交联的细胞反应后形态发生变化,细胞壁被分解并聚集成固体簇。

|
图 5 未交联细胞与戊二醛交联细胞的扫描电镜图 Fig.5 SEM micrographs of GA-crosslinked whole cells and untreated cells for epoxidation |
考察戊二醛对细胞交联前后红外光谱图,由图 6所示,细胞交联后在1 650 cm−1和1 539 cm−1处均显示出更高的特征峰强度,该两处吸收峰归属于酰胺Ⅰ带和酰胺Ⅱ带[28],戊二醛分子结构中2个醛基不仅可与羟基发生羟醛缩合反应,还可与蛋白质的氨基在室温下发生席夫碱反应,生成的席夫碱键在1 640 cm−1存在C═N拉伸振动的特征峰[29],本实验中猜测该峰与酰胺Ⅰ带(1 650 cm−1)重合,这与其他文献的结果一致[30]。
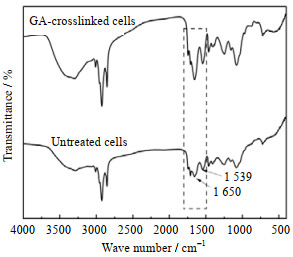
|
图 6 戊二醛交联细胞与未交联细胞的红外光谱图 Fig.6 FTIR spectra of GA-crosslinked whole cells and untreated cells GA-crosslinked cells Untreated cells |
对细胞进行热处理,考察全细胞脂肪酶的热稳定性,由图 7(a)可见,戊二醛对细胞进行交联固定化对细胞的热稳定性有较大的提升。交联后细胞热处理30 min后,蒎烯环氧化的蒎烯转化率(98.4%)和环氧蒎烷收率(85.3%)与初始的蒎烯转化率(99.8%)和环氧蒎烷收率(88.3%)相近。热处理细胞60 min后,细胞催化蒎烯环氧化的转化率(50.1%)和收率(40.2%)仍为初始转化率和收率的一半,未交联细胞热处理30 min后全细胞脂肪酶基本失活。全细胞的热稳定性高于脂肪酶,而交联后的细胞能提高其热稳定性。
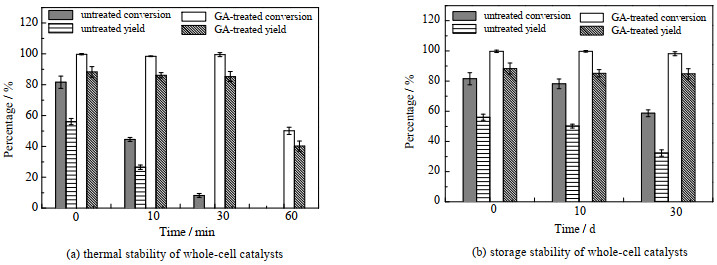
|
图 7 戊二醛交联对全细胞稳定性的影响 Fig.7 Effects of GA crosslinking on whole-cell stability |
考察细胞的储存稳定性,从图 7(b)可以看出,储存10 d时,交联细胞和未交联细胞都与新鲜细胞催化蒎烯环氧化有着相近的转化率和产率,放置30 d时,未交联细胞的催化活性有所下降,而戊二醛交联细胞的催化活性保持稳定,说明全细胞脂肪酶具有较好的储存稳定性,有着较好工业应用前景。采用戊二醛交联的方式对全细胞进行固定化后,全细胞的催化活性、回用稳定性、热稳定性及储存稳定性都有较大的提升,原因是戊二醛交联剂对整个细胞起支撑、固着作用,对糖原和核蛋白,尤其是对微管和内质网等膜系统起固定作用[31-32]。
3.3 柠檬酸三钠用量的影响在反应体系构建的过程中,发现柠檬酸钠的加入对收率有着非常积极的影响,进一步考察柠檬酸钠用量对反应体系稳定性的影响。发现当柠檬酸钠添加量为1~2.5 mmol时,环氧化收率逐渐提高,在2.5 mmol时达到最大收率92% (图 8(a)),而在之后收率保持相对稳定。然而反应初速度在2.5 mmol时达到最大后逐渐降低,原因是过多的柠檬酸钠的添加会导致过酸被过量消耗(图 8(b))。柠檬酸钠添加量为2.5 mmol和3.5 mmol时,环氧化收率相近,考察其回用稳定性时发现,3.5 mmol柠檬酸钠添加量的回用稳定性更高(p < 0.05)(图 8(c))。由于过氧有机酸会导致烯烃环氧化物发生开环反应[33],柠檬酸钠一般作为束酸剂来平衡反应体系中的氢离子,从而提高环氧化反应的选择性[4]。实验发现体系中过高的过氧有机酸浓度会影响细胞稳定性,柠檬酸三钠能有效控制反应体系中过氧有机酸浓度,进而提高其稳定性。该反应体系柠檬酸三钠添加量最佳选择为3.5 mmol。
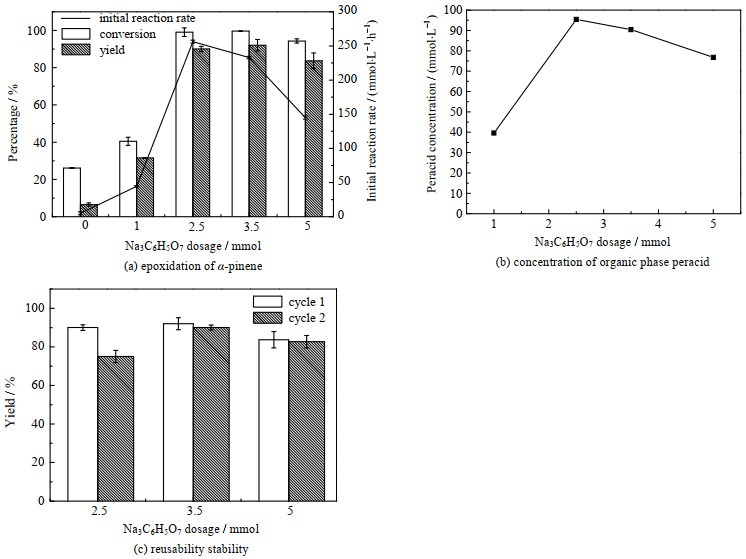
|
图 8 柠檬酸三钠用量对全细胞催化α-蒎烯环氧化反应稳定性的影响 Fig.8 Effects of trisodium citrate additions on the stability of whole-cell for α-pinene epoxidation |
H2O2作为脂肪酶催化过水解反应的底物之一,其物质的量浓度及用量对环氧化反应有着重要的影响。高浓度的H2O2溶液以及高H2O2用量都更有利于H2O2从水相屮向有机相屮传质,根据过酸生成的机制[1-2],有机相H2O2浓度的增加能加速过酸的生成,进而影响环氧化物的生成。然而过高的H2O2浓度会导致脂肪酶的失活[34],Zhao等[12]认为H2O2会进入脂肪酶的活性位点,进而使酶失去催化能力。脂肪酶对H2O2的耐受性是化学-酶法催化α-蒎烯环氧化反应稳定性的关键。
将水配制戊二醛溶液交联细胞设为对照组,考察PB7.0配制的戊二醛溶液交联细胞对H2O2的耐受性。从图 9(a)可看出,当H2O2用量从1 mmol提高到5 mmol时,PB7.0交联细胞催化蒎烯环氧化产率由49.2% 提升至90.4%,而对照组中当H2O2用量从1 mmol提高到2.5 mmol时,产率就提升至85.7% (图 9(b))。进一步对比不同H2O2用量时细胞回用情况,发现对照组在H2O2用量为1 mmol时,第一次回收细胞的催化能力却高于新鲜细胞,当H2O2用量高于2.5 mmol时,回收细胞的催化能力就开始下降。PB7.0交联细胞在H2O2用量从1 mmol提高到5 mmol时,第一次回收细胞的催化能力却高于新鲜细胞,当H2O2用量为1 mmol时,蒎烯二次环氧化产率由第一次的49.2% 提升至63.0%,但是当H2O2用量从5 mmol提高到10 mmol时,蒎烯环氧化产率由92.9% 降为53.8%。PB7.0交联细胞需要更多的H2O2用量才能实现最优转化率,但是却有着更好的回用稳定性,说明细胞经过PB7.0配制的戊二醛溶液交联后,胞液中磷酸缓冲液同样在体系中起到束酸剂的作用,一方面会消耗掉部分过酸,另一方面又会提高细胞对H2O2耐受性。
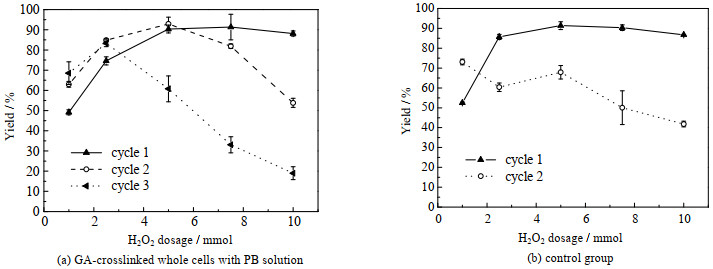
|
图 9 不同H2O2用量对全细胞催化α-蒎烯环氧化反应稳定性的影响 Fig.9 Effects of H2O2 dosages on the stability of whole-cell for α-pinene epoxidation |
反应体系在低H2O2用量时,回用反应的产率高于首轮反应,说明在首轮反应中过氧化氢溶液通过扩散作用进入细胞内,使胞内外物质的量浓度达到平衡,反应结束后抽滤有机溶剂不能去除胞内过氧化氢。在新一轮反应体系中,当消耗一定量的H2O2后细胞外H2O2浓度低于胞内浓度,首轮积累在胞内的H2O2会参与反应。因此当H2O2用量低于5 mmol时,回收产率高于首次产率,但是当H2O2含量从5 mmol提高到10 mmol时,首轮仅消耗部分H2O2,在新一轮的反应体系中继续累积H2O2,从而对细胞有毒害作用,造成酶的失活,同时说明需要进一步探究该反应体系中全细胞催化剂的回用方法。
3.5 回用方式的影响为解决全细胞在回用反应中由于前期过氧化氢未消耗完而积累的问题,本实验研究了水-甲苯洗、乙腈-甲苯洗,丙酮-甲苯洗、甲苯洗对于全细胞在重复回用过程活性的影响。如图 10(a)所示,水-甲苯洗之后,全细胞催化剂快速失活,说明水洗会在一定程度上造成脂肪酶的泄露,使得催化活性下降。各种方法均不能除去细胞中的H2O2,在新一轮的回用时,H2O2会在细胞中进一步累积,导致脂肪酶的失活。
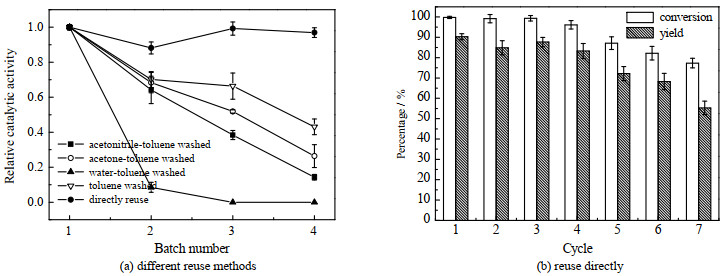
|
图 10 不同回用方式对回用稳定性的影响 Fig.10 Effects of recycling methods on recycling stability |
由于该反应体系为双水相,产物和底物都集中在有机相中,本实验采用加入过量H2O2,每轮反应结束后采用直接分离有机相,再加入新鲜有机相的方式进行回用,第4次使用时相对催化活力仍能达到96%,该回用的方式能较好地消耗H2O2,同时有利于保持全细胞催化剂稳定性。进一步消耗掉H2O2的全细胞,催化剂经抽滤后投入新的反应体系,再按照直接分离有机相的方式回用3次,反应7次后,该全细胞催化剂仍然有77.32%的转化率(图 10(b))。
Ankudey等[35]用Novozym 435研究了双氧水为氧化剂催化α-蒎烯环氧化反应,发现Novozym 435在第3次使用时完全失去活性。Su等[4]考察Novozym 435在异丙醇单相体系中催化α-蒎烯环氧化的重用性,发现Novozym435在第6次使用时,保持57.5% 左右的活力。这说明该全细胞催化剂与Novozym435相比,在以双氧水为氧化剂催化α-蒎烯环氧化反应体系中有着更好的回用稳定性。
4 结论研究考察Rhizopus oryzae CGMCC 3.5040全细胞脂肪酶在催化α-蒎烯环氧化反应体系中的稳定性,结果表明:
(1) 过氧有机酸会影响全细胞脂肪酶的稳定性,反应体系中添加柠檬酸三钠不仅能通过与过氧化氢水溶液形成高渗液,防止大量H2O2溶液进入细胞,同时作为束酸剂能有效维持氢离子的浓度在相对较低的水平,从而提高反应的选择性与细胞的回用稳定性,柠檬酸三钠用量为3.5 mmol最为适宜;
(2) 对细胞进行戊二醛交联后,全细胞催化剂的催化活性、热稳定性、储存稳定性都有显著提高,pH7.0磷酸盐缓冲液配制的戊二醛溶液交联细胞更有利于提高细胞的回用稳定性,考虑中性PB缓冲盐能减轻反应过程的产生的有机酸对细胞的损害;
(3) 反应体系中蒎烯环氧化的最适H2O2用量为5 mmol,为避免过量H2O2积累,该反应体系可提前加入过量H2O2采用直接分离有机相,再加入新鲜有机相的方式进行回用。优化回用方式后,该全细胞催化剂使用7次后,仍然有77.3% 的转化率。
| [1] |
BJÖRKLING F, GODTFREDSEN S E, KIRK O. Lipase-mediated formation of peroxycarboxylic acids used in catalytic epoxidation of alkenes[J]. Journal of the Chemical Society, Chemical Communications, 1990(19): 1301-1303. DOI:10.1039/C39900001301 |
| [2] |
GOOGHERI M S S, HOUSAINDOKHT M R, SABZYAN H. Theoretical studies on the deacylation step of acylated Candida Antarctica lipase B: Structural and reaction pathway analysis[J]. Journal of Molecular Graphics and Modelling, 2015, 57: 9-19. DOI:10.1016/j.jmgm.2015.01.003 |
| [3] |
XU Y, KHAW N R B J, LI Z. Efficient epoxidation of alkenes with hydrogen peroxide, lactone, and lipase[J]. Green Chemistry, 2009, 11(12): 2047-2051. DOI:10.1039/b913077b |
| [4] |
SU W, LI Q Y, LIU Y Y, et al. Improved efficiency of lipase-mediated epoxidation of α-pinene using H2O2 in single-phase systems[J]. Molecular Catalysis, 2021, 508: 111585. DOI:10.1016/j.mcat.2021.111585 |
| [5] |
BRUNO S M, VALENTE A A, PILLINGER M, et al. Efficient isomerization of α-pinene oxide to campholenic aldehyde promoted by a mixed-ring analogue of molybdenocene[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(16): 13639-13645. |
| [6] |
BICAS J L, DIONÍSIO A P, PASTORE G U M. Bio-oxidation of terpenes: An approach for the flavor industry[J]. Chemical Reviews, 2009, 109(9): 4518-4531. DOI:10.1021/cr800190y |
| [7] |
NEGOI A, PARVULESCU V I, TUDORACHE M. Peroxidase-based biocatalysis in a two-phase system for allylic oxidation of α-pinene[J]. Catalysis Today, 2018, 306: 199-206. DOI:10.1016/j.cattod.2017.02.052 |
| [8] |
KAMAITYTĖ-BUKELSKIENĖ L, LOŽIENĖ K, LABOKAS J. Dynamics of isomeric and enantiomeric fractions of pinene in essential oil of Picea abies annual needles during growing season[J]. Molecules, 2021, 26(8): 2138. DOI:10.3390/molecules26082138 |
| [9] |
NYAMWIHURA R J, OGUNGBE I V. The pinene scaffold: Its occurrence, chemistry, synthetic utility, and pharmacological importance[J]. RSC Advances, 2022, 12(18): 11346-11375. DOI:10.1039/D2RA00423B |
| [10] |
张晓光, 裴新华, 伍慧兰, 等. 疏水性脯氨酸离子液体化学修饰提升猪胰脂肪酶催化性能[J]. 高校化学工程学报, 2023, 37(2): 268-275. ZHANG X G, PEI X H, WU H L, et al. Improving catalytic performance of porcine pancreatic lipase by chemical modification using hydrophobic proline ionic liquid[J]. Journal of Chemical Engineering of Chinese Universities, 2023, 37(2): 268-275. DOI:10.3969/j.issn.1003-9015.2023.02.014 |
| [11] |
ZHANG Z J, DU Y J, KUANG G L, et al. Lipase-Ca2+ hybrid nanobiocatalysts through interfacial protein-inorganic self-assembly in deep-eutectic solvents (DES)/water two-phase system for biodiesel production[J]. Renewable Energy, 2022, 197: 110-124. DOI:10.1016/j.renene.2022.07.092 |
| [12] |
ZHAO Z X, LAN D M, TAN X Y, et al. How to break the Janus effect of H2O2 in biocatalysis? Understanding inactivation mechanisms to generate more robust enzymes[J]. ACS Catalysis, 2019, 9(4): 2916-2921. DOI:10.1021/acscatal.8b04948 |
| [13] |
熊阳, 覃益民, 唐爱星, 等. 在α-蒎烯生物环氧化反应过程中酯对反应的影响及机理探讨[J]. 化工进展, 2016, 35(1): 220-226. XIONG Y, QIN Y M, TANG A X, et al. Chemo-enzymatic epoxidation of α-pinene: Ester as influencing factors and mechanism of the reaction[J]. Chemical Industry and Engineering Progress, 2016, 35(1): 220-226. |
| [14] |
AOUF C, DURAND E, LECOMTE J, et al. The use of lipases as biocatalysts for the epoxidation of fatty acids and phenolic compounds[J]. Green Chemistry, 2014, 16(4): 1740-1754. DOI:10.1039/C3GC42143K |
| [15] |
DA SILVA J M R, BITENCOURT T B, MOREIRA M A, et al. Enzymatic epoxidation of β-caryophyllene using free or immobilized lipases or mycelia from the Amazon region[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 95: 48-54. DOI:10.1016/j.molcatb.2013.05.021 |
| [16] |
HOLLMANN F, ARENDS I W C E, BUEHLER K, et al. Enzyme-mediated oxidations for the chemist[J]. Green Chemistry, 2011, 13(2): 226-265. DOI:10.1039/C0GC00595A |
| [17] |
BRANDOLESE A, LAMPARELLI D H, PERICÀS M A, et al. Synthesis of biorenewable terpene monomers using enzymatic epoxidation under heterogeneous batch and continuous flow conditions[J]. ACS Sustainable Chemistry & Engineering, 2023, 11(12): 4885-4893. |
| [18] |
苏伟, 李青云, 刘幽燕, 等. ZIF-8原位合成法固定化脂肪酶CRL[J]. 中国油脂, 2021, 46(2): 107-113. SU W, LI Q Y, LIU Y Y, et al. Immobilization of lipase CRL on ZIF-8 by in situ synthesis[J]. China Oils and Fats, 2021, 46(2): 107-113. |
| [19] |
DU Y J, JIA X T, ZHONG L, et al. Metal-organic frameworks with different dimensionalities: An ideal host platform for enzyme@MOF composites[J]. Coordination Chemistry Reviews, 2022, 454: 214327. DOI:10.1016/j.ccr.2021.214327 |
| [20] |
涂林, 覃益民. 米根霉全细胞催化蒎烯环氧化反应的研究[J]. 现代化工, 2021, 41(8): 155-158, 164. TU L, QIN Y M. Epoxidation of α-pinene catalyzed by whole cell of Rhizopus oryzae[J]. Modern Chemical Industry, 2021, 41(8): 155-158, 164. |
| [21] |
HAMA S, TAMALAMPUDI S, FUKUMIZU T, et al. Lipase localization in Rhizopus oryzae cells immobilized within biomass support particles for use as whole-cell biocatalysts in biodiesel-fuel production[J]. Journal of Bioscience and Bioengineering, 2006, 101(4): 328-333. DOI:10.1263/jbb.101.328 |
| [22] |
LIU X L, ZHAO M, FAN X J, et al. Enhanced production of (S)-2-arylpropionic acids by protein engineering and whole-cell catalysis[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9: 697677. DOI:10.3389/fbioe.2021.697677 |
| [23] |
IKHUORIA E U, OBULEKE R O, OKIEIMEN F E. Studies on the kinetics of epoxidation of the methyl esters of parkia biglobosa seed oil[J]. Journal of Macromolecular Science, Part A: Pure and Applied Chemistry, 2007, 44(2): 235-238. DOI:10.1080/10601320601031424 |
| [24] |
ALAVARSE A C, FRACHINI E C G, DA SILVA R L C G, et al. Crosslinkers for polysaccharides and proteins: Synthesis conditions, mechanisms, and crosslinking efficiency, a review[J]. International Journal of Biological Macromolecules, 2022, 202: 558-596. DOI:10.1016/j.ijbiomac.2022.01.029 |
| [25] |
SENA R O, CARNEIRO C, MOURA M V H, et al. Application of rhizomucor miehei lipase-displaying Pichia pastoris whole cell for biodiesel production using agro-industrial residuals as substrate[J]. International Journal of Biological Macromolecules, 2021, 189: 734-743. DOI:10.1016/j.ijbiomac.2021.08.173 |
| [26] |
GREENSPAN F P, MACKELLAR D G. Analysis of aliphatic per acids[J]. Analytical Chemistry, 1948, 20(11): 1061-1063. DOI:10.1021/ac60023a020 |
| [27] |
DE FILIPPIS P, SCARSELLA M, VERDONE N. Peroxyformic acid formation: A kinetic study[J]. Industrial & Engineering Chemistry Research, 2009, 48(3): 1372-1375. |
| [28] |
SZEGHALMI A, KAMINSKYJ S, GOUGH K M. A synchrotron FTIR microspectroscopy investigation of fungal hyphae grown under optimal and stressed conditions[J]. Analytical and Bioanalytical Chemistry, 2007, 387(5): 1779-1789. DOI:10.1007/s00216-006-0850-2 |
| [29] |
YUAN T T, FEI J B, XU Y Q, et al. Stimuli-responsive dipeptide-protein hydrogels through schiff base coassembly[J]. Macromolecular Rapid Communications, 2017, 38(20): 1700408. DOI:10.1002/marc.201700408 |
| [30] |
JIA F, WANG J J, WANG Y X, et al. Fabrication and characterization of wheat gliadin hydrogels with high strength and toughness[J]. Journal of Cereal Science, 2020, 95: 103038. DOI:10.1016/j.jcs.2020.103038 |
| [31] |
BARBOSA O, ORTIZ C, BERENGUER-MURCIA Á, et al. Glutaraldehyde in bio-catalysts design: A useful crosslinker and a versatile tool in enzyme immobilization[J]. RSC Advances, 2014, 4(4): 1583-1600. DOI:10.1039/C3RA45991H |
| [32] |
SUN T, DU W, LIU D H, et al. Improved catalytic performance of GA cross-linking treated rhizopus oryzae IFO 4697 whole cell for biodiesel production[J]. Process Biochemistry, 2010, 45(7): 1192-1195. DOI:10.1016/j.procbio.2010.03.037 |
| [33] |
HU J, CHENG C S, LIU X, et al. Reaction mechanism of the green synthesis of glutaric acid[J]. RSC Advances, 2022, 12(4): 2270-2275. DOI:10.1039/D1RA08650B |
| [34] |
BRENNA E, COLOMBO D, DI LECCE G, et al. Conversion of oleic acid into azelaic and pelargonic acid by a chemo-enzymatic route[J]. Molecules, 2020, 25(8): 1882. DOI:10.3390/molecules25081882 |
| [35] |
ANKUDEY E G, OLIVO H F, PEEPLES T L. Lipase-mediated epoxidation utilizing urea-hydrogen peroxide in ethyl acetate[J]. Green Chemistry, 2006, 8(10): 923-926. DOI:10.1039/B604984B |




