正丁醇是一种重要的化工原料,不仅广泛用作有机溶剂,还可用于增塑剂、表面活性剂和有机中间体的生产。正丁醇也是一种较乙醇性能更优的发动机燃料,其能与汽油任意互溶、对现有发动机和管路没有腐蚀。正丁醇的能量密度(29 MJ×L-1)与汽油接近(32 MJ·L-1),而目前广泛使用的乙醇的能量密度(19.6 MJ·L-1)只是汽油的61%[1]。另外,正丁醇的汽化热(0.43 MJ·L-1)只有乙醇(0.92 MJ·L-1)的一半,与汽油(0.36 MJ·L-1)接近,因此具有更好的发动机低温启动性能[2]。正因为这些特征,正丁醇被称为“先进生物燃料”,具有作为汽油替代品的潜力。同时,正丁醇作为生物燃料可以减少SOx、NOx、CO、碳氢化合物以及温室气体的排放,具有良好的环境效益。
目前,生产正丁醇常用的方法有羰基合成法、乙醛缩合法和发酵法。发酵法生产效率低[3]。乙醛缩合法是两分子乙醛经羟醛缩合反应产生丁醇醛,脱水后生成丁烯醛,再经加氢得正丁醇。该方法设备腐蚀严重,生产成本高,已经基本被市场淘汰。羰基合成法是工业生产正丁醇的主要方法,先用钴或铑的络合物催化丙烯、氢甲酰化反应得到正丁醛、再经加氢得正丁醇[4]。羰基合成法催化剂价格昂贵、反应条件苛刻、工艺路线长。利用两个乙醇分子经过Guerbet反应合成正丁醇具有工艺流程短、反应过程清洁和生产成本低等特点,而且所用原料乙醇可来自纤维素或木薯等非粮生物质发酵,因此是一条可持续的生物燃料合成途径,符合“绿色化学”的要求。从传统反应机理看:乙醇Guerbet反应包括以下步骤[5],首先乙醇脱氢形成乙醛,接着乙醛发生羟醛缩合生成丁烯醛,最后经两步加氢生成正丁醇(如图 1所示)。因此,用于该反应的催化剂应该具有催化加氢/脱氢和羟醛缩合反应的多功能性。从活性组分划分,该反应所用的催化剂可分为碱催化剂、酸碱双功能催化剂以及含过渡金属的催化剂三类,下面分别进行评述。
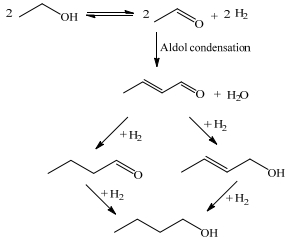
|
图 1 传统乙醇Guerbet反应机理 Fig.1 Typical ethanol Guerbet reaction mechanism |
用于醇类Guerbet反应的液体碱主要有KOH、NaOH以及醇钠等[6~8]。辛坤等[9]利用电石和乙醇反应所得的副产物乙醇钙催化乙醇自缩合反应,考察了反应时间、乙醇钙/乙醇摩尔比、反应温度以及保护气种类对反应的影响。结果表明,随着反应时间的延长,主产物正丁醇的选择性下降,而高碳醇的选择性上升,说明乙醇自缩合为连串反应,延长时间会加剧深度反应(产物正丁醇自身或者与反应物乙醇进一步发生缩合反应)。升高温度可以提高反应速率,但是正丁醇和长链醇的总选择性降低。另外,温度过高会加剧裂解反应,产生较多的气体副产物。相比于氢气作为保护气,N2作保护气时乙醇的转化率和长链醇的选择性均更高,这是因为乙醇脱氢生成乙醛是乙醇自缩合反应的速率控制步骤[10],氢气的存在抑制了该反应,从而导致总体系的反应速率降低。在最优条件下,乙醇转化率为74.42%,但正丁醇选择性仅为14.88%。
虽然液体碱催化剂廉价易得,但其会引起反应器金属的腐蚀和浸出,增加设备费用。同时,液体碱无法回收利用,造成处理成本的提高和环境污染。此外,乙醇Guerbet反应所产生的副产物水会导致该类催化剂失活。
2.1.2 固体碱催化剂相比液体碱,固体碱具有可循环使用、无腐蚀以及可使反应过程连续化等优点[11],因此在乙醇Guerbet反应研究中应用广泛。乙醇自缩合反应所用的固体碱催化剂主要为两大类:一类是碱金属和碱土金属的氧化物,另一类为碱性分子筛。
杨春等[12, 13]在常压固定床连续流动体系中,采用改性沸石催化乙醇缩合生成正丁醇反应。当反应温度为420℃、接触时间为5.6 g·h·mol-1时,Rb-LiX催化剂具有较高的活性和选择性,乙醇转化率为20.8%,正丁醇选择性为40.9%。他们还探究了该反应机理,认为不同于传统Guerbet反应机理,其反应过程更为直接:在碱催化剂作用下,乙醇β位C-H键被活化,与另一分子乙醇作用脱水生成C4醇(如图 2所示)。Ndou等[14]以MgO、CaO、BaO、10% Na/Al2O3、10% K/Al2O3、10% Cs/Al2O3、10% Mg/SiO2为催化剂,在常压气固相体系中研究了乙醇自缩合反应,发现450℃下MgO催化效果最好,乙醇转化率可达56.14%,正丁醇产率18.39%。作者通过研究认为,MgO催化乙醇Guerbet缩合反应机理符合杨春等人提出来的β位C-H键活化脱水机理[13]。
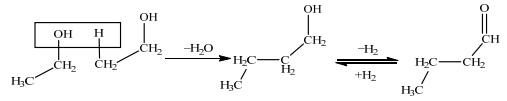
|
图 2 固体碱催化剂上乙醇直接缩合生成正丁醇 Fig.2 Dimerisation of ethanol to butanol with solid-base catalysts |
Birky等[15]在固定床反应器上以MgO为催化剂在400℃下催化乙醇Guerbet反应合成正丁醇。他们采用同位素追踪法分析了反应过程中反应物分子在MgO表面的分布情况,发现当达到吸附平衡时,约50%的MgO表面吸附了乙氧基。在乙醇偶联过程中,形成正丁醇的中间体的覆盖率比吸附的乙氧基几乎要低一个数量级,由此他们认为在MgO上乙醇的Guerbet偶联包括脱氢、羟醛缩合以及加氢等步骤。在MgO上羟醛缩合容易发生、甚至在室温下都可进行,但是乙醇脱氢需要较高的温度,因此该反应在400℃下较低的转化频率与在MgO上乙醇脱氢反应较为困难有关,导致乙醇转化率仅在20%左右,正丁醇的选择性也不超过34%。目前,所报道的利用固体碱催化乙醇Guerbet反应要求的反应温度都较高,乙醇转化率和正丁醇选择性也较低(如表 1所示)。
|
|
表 1 用于乙醇Guerbet反应的固体碱催化剂总结 Table 1 Summary of solid-base catalysts for ethanol Guerbet reaction |
酸碱双功能催化剂同时存在的酸中心和碱中心在催化过程中能起协同作用,提高了催化性能。另外,酸碱双功能催化剂大多是固体,具有易分离、污染少等优点[16]。随着对乙醇Guerbet反应研究的深入,人们发现反应的不同步骤是在催化剂的不同活性位点上进行的。目前,该反应所用的酸碱双功能催化剂主要有混合金属氧化物和羟基磷灰石。
2.2.1 混合金属氧化物Carvalhoa等[17]利用共沉淀法制备了水滑石前体,通过焙烧得到Mg-Al混合氧化物,在常压气固相体系中考察其对乙醇自缩合反应的催化性能。研究发现,具有高Mg含量的混合氧化物对正丁醇具有较高的选择性:当Mg/Al为3时,乙醇转化率为35%,正丁醇选择性在40%左右。相比于MgO,Mg/Al为3的Mg-Al混合氧化物具备较高的催化活性,是因为MgO仅有强碱性位点,导致其对乙醇脱氢反应非常低的活性。乙醇Guerbet反应需要相邻的酸性位点和中等强度的碱性位点以产生反应中间产物,而通过在MgO晶格中插入Al可获得酸性和中等强度的碱性位点。他们还利用原位红外光谱研究了在Mg/Al为1和3的Mg-Al氧化物上的反应途径[18],发现在Mg/Al为3的Mg-Al氧化物上,乙醇脱氢产生乙醛,之后乙醛迅速发生羟醛缩合反应生成2-丁烯醛,继而氢化生成正丁醇;而在Mg/Al为1的Mg-Al氧化物上,乙醛羟醛缩合的步骤进行的极为缓慢,这主要是因为羧酸盐物质在催化剂表面上的持续存在,该羧酸盐的形成与O2-、OH-有关。Di Cosimo等[19]通过热分解水滑石前体获得Mg/Al摩尔比为0.5~9.0的Mg-Al混合氧化物。以MgO为催化剂时主要产物是乙醛(选择性21%)和正丁醇(选择性28%),而当采用Mg/Al = 3的Mg-Al氧化物催化剂时正丁醇的选择性最高为44%,MgO为催化剂时的反应速率只是Mg-Al氧化物的十分之一左右。在Mg-Al混合氧化物上,酸碱活性位协同催化乙醇缩合反应,其机理如图 3。首先,乙醇被吸附在酸-强碱活性位点上,导致O-H键断裂形成乙氧基中间体,紧接着乙氧基中间体的α氢在另一个强碱性位点解离吸附生成乙醛,然后两个相邻的乙醛分子在酸-强碱基位点上经羟醛缩合生成烯醇化物,最后脱水、加氢生成正丁醇。在纯MgO上,强碱性位点主要由O2-阴离子组成,孤立的O2-碱性中心阻碍了形成乙氧基中间体的乙醇解离吸附步骤,造成MgO活性较差。煅烧水滑石得到的Mg-Al氧化物含有OH基团、Mg2+-O2-对和O2-阴离子三种类型的碱性位点,Al3+和Mg2+主要提供L酸位点。当Al含量较低时,中低强度的碱性位点的表面浓度随着样品中Al含量的增加而增加,因此具有低Al含量的Mg-Al氧化物选择性地将乙醇脱氢至乙醛,而高Al含量的Mg-Al氧化物具有高密度的Al3+-O2-对和较低密度的中低强度的碱性位点,导致乙醇更容易脱水形成乙烯和乙醚。
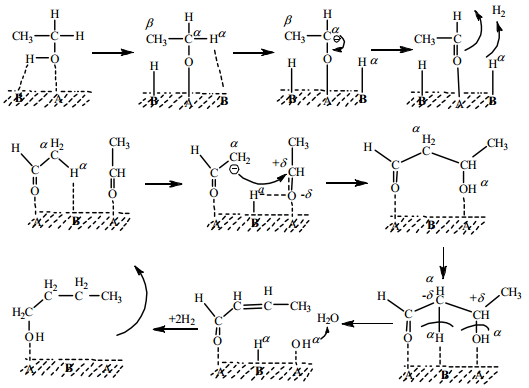
|
图 3 Mg-Al氧化物上乙醇Guerbet反应机理 Fig.3 Mechanism of ethanol Guerbet reaction on Mg-Al oxides |
León等[20]在低或高过饱和度情况下,通过共沉淀法合成了Mg/Al摩尔比为3的水滑石,并由此制备了Mg-Al氧化物,探究其催化乙醇Guerbet反应的催化性能。采用高过饱和度制备的催化剂具有较高的酸性位点浓度,因此其主要产物是C4类烯烃。当反应温度升高时,酸性位点促进脱水反应的效果会更加明显。低过饱和度下制备的催化剂主要催化生成缩合产物,这与其存在较高的Mg2+-O2-中等强度碱性位点有关。他们还研究了水滑石衍生的Mg-Al混合氧化物中的Al部分或全部被Fe取代时催化性能的变化[21]。用Fe取代Al会导致催化剂结晶度下降,同时酸性位点的浓度急剧下降,对乙醛和其缩合产物的选择性增加而对乙烯的选择性下降。作者在177~477℃下对乙醇自缩合反应进行研究,发现在350℃下Al完全被Fe取代的混合氧化物(Mg6Fe2O9)催化性能最好,乙醇的转化率为60%,正丁醇选择性15%。
|
|
表 2 用于乙醇Guerbet反应的混合金属氧化物催化剂总结 Table 2 Summary of mixed metal oxide catalysts for ethanol Guerbet reaction |
羟基磷灰石(Ca10(PO4)6(OH)2,简称HAP)的表面既有酸性中心又有碱性中心,而且其表面酸碱中心可通过Ca/P摩尔比进行调整。HAP能与大多数金属离子发生离子交换从而使得Ca2+以及PO43-被取代,因为HAP的这些性质使得其被广泛作为催化剂或催化剂载体。
Tsuchida等[22]制备了Ca/P为1.64的HAP,并将其催化乙醇Guerbet反应的催化性能与SiO2/Al2O3进行比较,发现在SiO2/Al2O3上主要产物为烯烃类产物,而HAP对醇、酮以及醚有较高的选择性。随着反应温度升高,乙醇的转化率增加,对烃类的选择性也增加。他们还比较了乙醇、正丁醇、己醇、辛醇、2-乙基-1-丁醇和2-乙基-1-己醇在相同条件下的反应性能,发现乙醇转化率最高,支链醇比相应的直链醇转化率低,表明乙醇比高级醇具有更高的反应活性,并且直链醇比具有相同碳数的支链醇更具反应活性。作者还制备了四种不同Ca/P比的HAP[23],发现高Ca/P比的HAP具有更多的碱性中心,对高碳醇具有较高的选择性。与乙醇在Mg-Al氧化物上缩合反应机理类似,作者发现HAP上乙醇Guerbet缩合机理如图 4:乙醇首先发生解离吸附形成乙氧基中间体,接着乙氧基中间体被碱中心脱除α-H生成醛中间体,两个相邻的醛中间体中一个分解为烯醇化物(碳负离子中间体)并与另一个醛中间体反应形成β-羟基醛(羟醛缩合),然后脱水生成不饱和醛,最后氢化生成正丁醇。他们还利用MgO催化乙醇自缩合反应,得到的产物主要为乙醛和不饱和醇。他们认为,在MgO (Mg-O距离为0.210 nm)上,分别在Mg (酸性位点)上和这些酸性位点键合的O (强碱性位点)上形成的氢之间的距离很短,氢不是被捕获在催化剂表面上,而是迁移形成H2分子,而在HAP (Ca-O距离为0.240 nm)上,解离吸附过程释放的氢之间有足够的距离,氢被捕获在催化剂表面而不迁移形成分子氢,因此在HAP上Guerbet醇(饱和醇)的收率比在MgO上高。
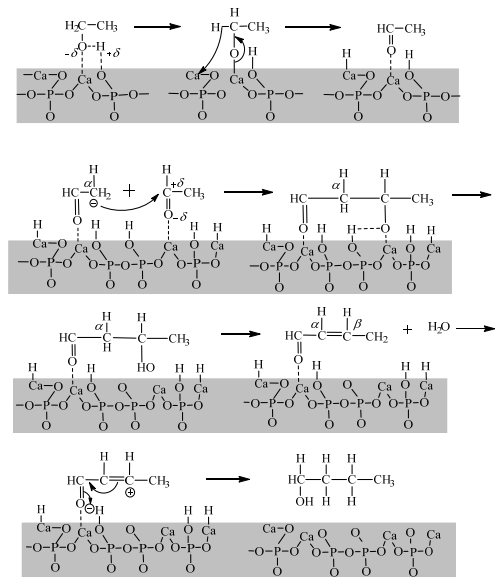
|
图 4 HAP上乙醇Guerbet反应机理 Fig.4 Mechanism of ethanol Guerbet reaction with HAP |
Ogo等[24]在水热条件下合成了具有不同Sr/P摩尔比的磷酸锶羟基磷灰石(Sr-HAP),并用以催化乙醇自缩合反应,发现Sr/P摩尔比在1.70时正丁醇选择性最高可达86.4%,此时乙醇转化率为11.3%。他们还发现正丁醇的选择性不仅与Sr/P摩尔比有关,而且还与乙醇转化率有关。在乙醇转化率较低(低于7%)时主要副产物是中间体如2-丁烯-1-醇和醛,而在乙醇转化率较高的情况下,主要副产物是C4醇继续缩合后的产物如C6和C8醇。高Sr/P摩尔比的Sr-HAP催化剂可以加速中间体2-丁烯-1-醇氢化为1-丁醇,同时也抑制C4产物继续反应成C6和C8醇,因此高Sr/P摩尔比的HAP具有更高的正丁醇选择性。他们还利用Sr、V等取代的HAP及其固溶体催化乙醇的Guerbet反应[25]。在300℃和W/F为130 h.g·mol-1的条件下,使用Sr-HAP催化剂,正丁醇选择性最高可达81.5%。随着HAP中Ca含量的增加,正丁醇的选择性下降,反应速率上升,反应中间产物为巴豆醛、2-丁烯-1-醇和丁醛。Ca-P羟基磷灰石催化剂在乙醛羟醛缩合中具有与Sr-P羟基磷灰石相同的巴豆醛选择性,但在2-丁烯-1-醇的氢转移反应中具有较低的正丁醇选择性。Ca-V羟基磷灰石在乙醛羟醛缩合中催化活性和巴豆醛选择性都高于Sr-P型羟基磷灰石,但其易催化乙醇脱水形成乙烯。而Sr-P羟基磷灰石对2-丁烯-1-醇到正丁醇的氢转移反应选择性相对较高且能抑制乙醇的脱水反应。Silvester等[26]在(Ca+Sr)/P = 1.67的化学计量比基础上,将Sr的比例从0增加至100%,并在缺陷型羟基磷灰石中用Sr逐渐取代Ca。无论是在化学计量还是缺陷型羟基磷灰石上,不含Sr的磷灰石表面(Ca+Sr)/P比低于体相摩尔组成。随着Sr含量的增加,表面(Ca+Sr)/P比逐渐接近体相摩尔组成。当Sr含量超过50%时,表面(Ca+Sr)/P比超过体相摩尔组成,说明相比于Ca而言,Sr更容易暴露于表面。在化学计量的磷灰石上,随着Sr含量的增加,正丁醇选择性增加,当乙醇转化率为13%时,正丁醇选择性最高可达63.2%;而缺陷型磷灰石正好相反,不含Sr的磷灰石对正丁醇选择性最大。Hanspal等[27]考察了磷酸三钙和氟取代羟基磷灰石催化乙醇自缩合反应的催化性能,发现在360℃时两者的乙醇转化率都不高,分别为4.2%和2.7%,正丁醇的选择性都在35%左右。他们还使用了Sr3(PO4)2作为催化剂,发现其对乙醇脱氢为乙醛有着高选择性(转化率4.2%,选择性91%),但是对于C-C偶联产物的选择性较差,而当仅使用乙醛作为原料时,Sr3(PO4)2对乙醛的缩合产物具有优异的选择性。在乙醇Guerbet反应中,作者认为是乙醇的竞争吸附造成乙醇脱氢产物乙醛吸附量较少,最终导致对Guerbet偶联产物较低的选择性。
|
|
表 3 用于乙醇Guerbet反应的HAP催化剂总结 Table 3 Summary of HAP catalysts for ethanol Guerbet reaction |
过渡金属有d轨道电子或者有空的d轨道,在化学反应中可以提供空轨道充当亲电试剂或者提供孤对电子充当亲核试剂,能够降低反应活化能,促进反应进行,因此过渡金属被广泛用作各种催化剂。在乙醇Guerbet反应中,加入过渡金属或其化合物可以提高催化性能,降低反应条件。
2.3.1 含过渡金属络合物过渡金属络合物催化的有机合成反应具有反应条件温和、操作简便、选择性好、产物收率高、污染少等特点,在有机合成及精细化工生产中有着广泛的应用。
Tseng等[28]开发了由双(吡啶基亚氨基)异吲哚酸酯钌(Ⅱ)衍生的一系列催化剂,用于催化乙醇Guerbet反应,发现N, N, N-1, 3-bis(6’-methyl-2’-pyridylimino)isoindolate Ru(Ⅱ)具有最好的催化效果。该催化剂与5%(mol)的NaOEt碱催化剂和0.1%(mol)三苯基膦协同作用,反应2 h后乙醇转化率为49%,正丁醇产率可达38%。Xie等[29]开发的一系列钌钳形复合物能有效催化醇的非氧化脱氢偶联反应,在0.001%(mol)的EtONa存在下,于110℃下反应40 h,乙醇转化率为25.6%,对正丁醇的选择性高达90.6%。增加碱的浓度会导致C6、C8醇的量增加;升高反应温度会提升乙醇的转化率,但是不会增加正丁醇产率。Dowson等[30]利用[RuCl2(η6-p-cymene)2]作为催化剂前体、bis(diphenylphosphanyl)methane作为配体组成的催化剂,在5%(mol)的EtONa存在的情况下,150℃下反应4 h后乙醇的转化率超过20%,正丁醇选择性高达94%。另外,他们还使用[RuCl2(η6-p-cymene)]2+3-methyl-2-diphenylphosphinoindole作为过渡金属催化剂,以NaOEt为碱催化剂,在150℃下反应2 h后乙醇转化率最高可达31.4%,正丁醇选择性高达92.4%[31]。Koda等[32]合成了[Ir(acac)(cod)](acac:乙酰丙酮,cod:1, 5-环辛二烯)催化剂,在5%(mol)的NaOEt以及1%(mol) 1, 7-辛二烯存在时,于120℃下催化乙醇自缩合反应,乙醇转化率达41%,正丁醇选择性51%。另外,使用[1, 3-双(二苯基膦基)丙烷]作为配体可提高反应速率,但转化率和选择性无明显提升。Chakraborty等[33]以Cp*Ir[(2-OH-6-phenyl)pyridine]Cl为催化剂,利用[Tp'Ni(μ-OH)]和(IPr)CuOH等碱性过渡金属络合物代替传统上使用的NaOEt、KOtBu和KOH等无机碱催化乙醇Guerbet反应。当在Cp*Ir[(2-OH-6-phenyl)pyridine]Cl和[Tp'Ni(μ-OH)]相对摩尔比例为1:25的条件下,于150℃反应24 h可得到唯一的产物正丁醇,乙醇的转化率也达到37%。利用(IPr)CuOH作为碱时也可使乙醇达到32%的转化率,正丁醇的选择性大于99%。他们还比较了在不同无机碱(NaOEt、KOtBu和KOH)存在下的催化效果,发现在KOH下催化剂具备良好的催化效果:乙醇转化率40%,正丁醇选择性77%。
|
|
表 4 用于乙醇Guerbet反应的含过渡金属络合物催化剂总结 Table 4 Summary of transition metal complex catalysts for ethanol Guerbet reaction |
目前文献所报道对乙醇自缩合生成正丁醇反应具备较高催化性能的过渡金属有Ni和Cu。
2.3.2.1 负载型NiYang等[34]利用γ氧化铝负载Ni催化剂催化乙醇自缩合反应,在200℃下,8%(wt) Ni/γ-Al2O3表现出较好的催化活性:乙醇转化率在20%左右,正丁醇选择性为64%。他们对催化剂进行半原位XRD和TPR分析,发现金属Ni是乙醇缩合反应的活性位点,负载较高含量Ni (15%(wt))的催化剂催化效果较差是因为大部份Ni仅能被还原为NiO而不是金属Ni。他们还通过在原料中添加巴豆醛以探究乙醇自缩合反应机理,结果表明,巴豆醛的添加导致正丁醛产率降低,证明该反应不是通过羟醛缩合过程进行的,而是杨春等所提出的β为C-H键活化脱水机理[13]。Jordison等[35]将Ni负载在γ-Al2O3上催化乙醇缩合反应,在230℃下反应10 h,乙醇转化率最高为41%,正丁醇的选择性为47.5%。他们还向Ni催化剂中加入氧化镧和氧化铈以改善其催化活性,发现加入氧化镧之后正丁醇的选择性提升到55%,总醇的选择性提高到71%。氧化镧改进催化效果是因为镧增加了催化剂上的强碱性位点密度,有助于更快地生成高级醇同时降低乙酸乙酯的选择性。Riittonen等[36]将Cu、Ni和Co分别负载到γ-Al2O3上并用其催化乙醇自缩合反应,发现Ni和低负载的Cu催化剂上主要产生正丁醇,而Co和高负载的Cu催化剂上的产物为乙酸乙酯。这是因为Ni和低负载Cu与γ-Al2O3形成八面体配位,其载体-金属相互作用较弱;而Co和高负载的Cu与γ-Al2O3主要形成四面体配位,具有很强的载体-金属相互作用。Ghaziaskar等[37]在γ-Al2O3上负载不同质量的Ni (8%,17%,27%),在超临界状态下催化Guerbet反应。在WHSV为6.4 h-1、250℃和176 bar下,负载8% Ni的催化剂具有最好的催化活性:乙醇转化率29.3%,正丁醇选择性63.2%。随着Ni负载量的增加,正丁醇收率下降,气态产物增加。在27%(wt) Ni/γ-Al2O3催化下仅存在H2、CH4等气体产物,表明金属Ni对于断裂C-C键具有很高的活性。他们还将Mn2O3负载到γ-Al2O3上并与27%(wt) Ni/γ-Al2O3共同催化乙醇自缩合反应,得到相对较好的催化活性:乙醇转化率18.7%,正丁醇选择性64%。田媛等[38]研究了Ni/HAP在H2或N2气氛下催化乙醇Guerbet反应性能,发现12% Ni/HAP具有最好的催化活性。在300℃、H2气相空速3000 h-1、乙醇液相空速2.0 h-1的条件下,乙醇转化率达15.6%,正丁醇选择性为83.6%。较之N2气氛,在H2气氛下乙醇的转化率提高了2倍,正丁醇的选择性提高了4.2倍,催化剂稳定性提高了3倍。而且,在N2气氛下的主要产物是丁烯醛,而在H2气氛下主要得到目的产物正丁醇。
|
|
表 5 用于乙醇Guerbet反应的负载型过渡金属催化剂总结 Table 5 Summary of supported transition metal catalysts for ethanol Guerbet reaction |
James等[39]将Cu负载到能够催化羟醛缩合反应的一系列载体上,包括高表面积的CeO2(HSACeO2)和一般表面积的CeO2以及四种酸性金属氧化物(Al2O3,TiO2,SiO2/ Al2O3和ZSM-5沸石)。他们使用超临界CO2作为反应介质,在260℃下进行反应,负载在HSACeO2上的Cu催化剂的催化效果最好:乙醇转化率67%,正丁醇产率可达30%。他们认为,在CO2存在下羟醛缩合的高速率可能是由于CO2和H2O形成的H2CO3提高了催化剂的酸性,而且CO2可氧化低价态Ce而不影响Cu。
2.3.3 其他含过渡金属的催化剂田戈等[40]利用碳酸氢钠和金属钴粉共同催化乙醇水热反应,于140~300℃下反应1~30天得到正丁醇,正丁醇的选择性最高可达87%。另外,他们用NaOH替换NaHCO3作为碱性催化剂,发现当pH小于13时不发生Guerbet反应,产物为乙酸和乙酸乙酯;pH大于13时发生Guerbet反应,但主要产物为乙酸。在NaHCO3作碱催化剂时,钴粉重复使用3次,催化活性保持不变[41]。Sun等[42]用Cu或Ni代替Mg-Al混合氧化物中的一部分Mg并保证M2+/M3+维持在3,在间歇反应釜中考察了其催化乙醇Guerbet反应性能。相比于Mg-Al混合氧化物,单独用Cu替换的催化剂在提升乙醇转化率上有明显效果,但是正丁醇的产率没有增加;仅使用Ni作为掺杂剂也仅仅对正丁醇产率有略微的提升;而含有等摩尔量Cu与Ni掺杂剂的催化剂具有最好的催化效果:在320℃下乙醇转化率为62.4%,正丁醇产率也可达到21.1%。随着温度从180℃逐渐增加至320℃,乙醇的转化率上升,正丁醇产率不变,但是高碳醇和乙酸乙酯的含量增加。Marcu等[43]利用M-Mg-Al (M = Pd,Ag,Mn,Fe,Cu,Sm,Yb)催化乙醇Guerbet反应。在200℃下反应5 h,含Pd的催化剂具有最好的催化效果:乙醇转化率3.7%,正丁醇选择性72.7%。含Cu的催化剂有着与Pd-Mg-Al相似的活性,但是主要产物为正丁醇和1, 1-二乙氧基乙烷。Sm-Mg-Al氧化物对正丁醇也有着较好的选择性,但是其活性低于Pd-Mg-Al氧化物。而含Fe和Mn的催化剂具有较高的酸性,因此主要反应产物为1, 1-二乙氧基乙烷和乙醛。对Pd-Mg-Al氧化物,升高温度会大幅提高催化活性:300℃下乙醇转化率17%,正丁醇选择性81%。氧化锆不是优异的乙醇Guerbet反应催化剂,因为其更容易催化乙醇脱水形成乙烯,降低乙醇在氧化锆上脱水速率的一种方法是加入少量碱金属来选择性地除去、阻断或失活负责脱水的酸性位点。Kozlowski[44]使用Na对氧化锆进行改性,在400℃下催化乙醇自缩合反应。在使用氧化锆催化剂时,乙醇转化率为9.4%,乙烯的选择性高达44%,而正丁醇选择性仅为2.2%。当氧化锆上Na负载量逐渐增加至1.0%(wt)时,正丁醇选择性最高可达12%,乙烯选择性下降至17%。通过TPD分析作者发现在氧化锆上负载少量Na降低了酸性位点的密度同时增加了碱性位点的密度,因此能抑制乙烯的形成。
|
|
表 6 用于乙醇Guerbet反应的其他含过渡金属催化剂总结 Table 6 Summary of others transition metal catalysts for ethanol Guerbet reaction |
随着生物乙醇产量的不断提高,将乙醇升级为燃料性能更优的正丁醇越来越具有现实意义。目前,乙醇Guerbet反应使用的催化剂在不同程度上存在问题:液体碱易腐蚀设备,含碱废水处理费用高,污染环境;固体碱要求的反应温度高(400℃以上),产物选择性低;混合金属氧化物和HAP对反应条件要求比固体碱略低,但仍达到300℃以上;在γ-Al2O3上负载过渡金属可达到较好催化效果,但γ-Al2O3易在副产物水的作用下转变为勃姆石而失活;过渡金属络合物催化剂虽然要求的反应条件低,反应产物选择性好,但是它们大部分采用贵金属(Ir、Rh等),成本较高,且分离回收困难,无法重复使用。与混合金属氧化物和HAP相比,负载型过渡金属催化剂可以使乙醇Guerbet反应在相对温和的条件下进行(200~250℃),催化性能也较好。与过渡金属络合物相比,负载型过渡金属催化剂对水的耐受力较强,重复使用性能较好。传统的反应机理认为乙醇Guerbet反应需经历脱氢、羟醛缩合和加氢过程,因此负载型过渡催化剂的载体需对羟醛缩合反应有一定的催化活性,同时还应考虑其耐水稳定性,所采用的金属活性组分也需对具有加氢/脱氢反应具有较好的催化活性。因此,开发高效的负载型过渡金属催化剂是今后研究的方向之一。
| [1] | Ranjan A, Moholkar V S. Biobutanol:science, engineering, and economics[J]. International Journal of Energy Research, 2012, 36(3): 277-323. |
| [2] | Dürre P. Biobutanol:an attractive biofuel[J]. Biotechnology Journal, 2007, 2(12): 1525-1534. DOI:10.1002/(ISSN)1860-7314. |
| [3] | LIN Yi-jun(林逸君), WEN Zhi-qiang(闻志强), ZHU Li(朱力), et al. Butanol production from corncob in the sequential co-culture of Clostridium thermocellum and Clostridium beijerinckii(Clostridium thermocellum与Clostridium beijerinckii偶联发酵玉米棒芯产丁醇)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2013, 27(3): 444-449. DOI:10.3969/j.issn.1003-9015.2013.03.013. |
| [4] | Uyttebroek M, Hecke W V, Vanbroekhoven K. Sustainability metrics of 1-butanol[J]. Catalysis Today, 2015, 239: 7-10. |
| [5] | Dvornikoff M N, Farrar M W. Condensation of alcohols[J]. Journal of Organic Chemistry, 1957, 22(5): 540-542. |
| [6] | Gast L E, Bitner E D, Cowan J C, et al. Reactions of unsaturated fatty alcohols. Ⅵ. Guerbet reaction of soybean and linseed alcohols[J]. Journal of the American Oil Chemists Society, 1958, 35(12): 703-707. |
| [7] | Waykole C, Bhowmick D N, Pratap A. Synthetic base stock based on Guerbet alcohols[J]. Journal of the American Oil Chemists Society, 2014, 91(8): 1407-1416. DOI:10.1007/s11746-014-2484-4. |
| [8] | Sulzbacher M. The Guerbet reaction of cetyl alcohol[J]. Journal of Chemical Technology & Biotechnology, 1955, 5(12): 637-641. |
| [9] | XIN Kun(辛坤), GUO Dan(郭丹), JIA Bing(贾冰), et al. Study on calcium ethoxide applied to the Guerbet reaction(乙醇钙应用于Guerbet反应的探索)[J]. Applied Chemical(应用化工), 2017, 46(5): 959-962. DOI:10.3969/j.issn.1671-3206.2017.05.036. |
| [10] | Carlini C, Girolamo M D, Marchionna M, et al. Selective synthesis of isobutanol by means of the Guerbet reaction:Part 1. Methanol/n-propanol condensation by using copper based catalytic systems[J]. Journal of Molecular Catalysis A:Chemical, 2002, 184(1-2): 273-280. |
| [11] | JIANG Shao-liang(蒋绍亮), ZHANG Fu-xiang(章福祥), GUAN Nai-jia(关乃佳). Progress on application of solid base catalysts in catalytic reactions(固体碱催化剂在催化反应中的应用进展)[J]. Petrochemical Technology(石油化工), 2006, 35(1): 1-10. |
| [12] | Yang C, Meng Z Y. Bimolecular condensation of ethanol to 1-butanol catalyzed by alkali cation zeolites[J]. Journal of Catalysis, 1993, 142(1): 37-44. |
| [13] | YANG Chun(杨春), MENG Zhong-yue(孟中岳). Bimolecular condensation of ethanol on alkali zeolites and its reaction mechanism(碱金属沸石上乙醇双分子缩合反应及其机理)[J]. Chinese Journal of Catalysis(催化学报), 1994, 15(1): 28-33. |
| [14] | Ndou A S, Plint N, Coville N J. Dimerisation of ethanol to butanol over solid-base catalysts[J]. Applied Catalysis A:General, 2003, 251(2): 337-345. |
| [15] | Birky T W, Kozlowski J T, Davis R J. Isotopic transient analysis of the ethanol coupling reaction over magnesia[J]. Journal of Catalysis, 2013, 298: 130-137. |
| [16] | YANG Ren-quan (杨任全). Preparation and application of solid base catalysts and acid-base bifunctional catalysts (固体碱催化剂及酸碱双功能催化剂的制备与应用)[D]. Shanghai (上海): Shanghai Normal University (上海师范大学), 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2284650 |
| [17] | Carvalho D L, De Avillez R R, Rodrigues M T, et al. Mg and Al mixed oxides and the synthesis of n-butanol from ethanol[J]. Applied Catalysis A:General, 2012, 415-416: 96-100. |
| [18] | Carvalho D L, Borges L E P, Appel L G, et al. In situ infrared spectroscopic study of the reaction pathway of the direct synthesis of n-butanol from ethanol over MgAl mixed-oxide catalysts[J]. Catalysis Today, 2013, 213(18): 115-121. |
| [19] | Di Cosimo J I, Dı́ez V K, Xu M, et al. Structure and surface and catalytic properties of Mg-Al basic oxides[J]. Journal of Catalysis, 1998, 178(2): 499-510. |
| [20] | León M, Díaz E, Ordóñez S. Ethanol catalytic condensation over Mg-Al mixed oxides derived from hydrotalcites[J]. Catalysis Today, 2011, 164(1): 436-442. |
| [21] | León M, Díaz E, Vega A, et al. Consequences of the iron-aluminium exchange on the performance of hydrotalcite-derived mixed oxides for ethanol condensation[J]. Applied Catalysis B:Environmental, 2011, 102(3-4): 590-599. |
| [22] | Tsuchida T, Yoshioka T, Sakuma S, et al. Synthesis of biogasoline from ethanol over hydroxyapatite catalyst[J]. Industrial & Engineering Chemistry Research, 2015, 47(5): 1443-1452. |
| [23] | Tsuchida T, Kubo J, Yoshioka T, et al. Reaction of ethanol over hydroxyapatite affected by Ca/P ratio of catalyst[J]. Journal of Catalysis, 2008, 259(2): 183-189. DOI:10.1016/j.jcat.2008.08.005. |
| [24] | Ogo S, Onda A, Iwasa Y, et al. 1-Butanol synthesis from ethanol over strontium phosphate hydroxyapatite catalysts with various Sr/P ratios[J]. Journal of Catalysis, 2012, 296(7): 24-30. |
| [25] | Ogo S, Onda A, Yanagisawa K. Selective synthesis of 1-butanol from ethanol over strontium phosphate hydroxyapatite catalysts[J]. Applied Catalysis A:General, 2011, 402(1-2): 188-195. |
| [26] | Silvester L, Lamonier J F, Lamonier C, et al. Guerbet reaction over strontium-substituted hydroxyapatite catalysts prepared with various (Ca+Sr)/P ratios[J]. ChemCatChem, 2017, 9(12): 2250-2261. |
| [27] | Hanspal S, Young Z D, Prillaman J T, et al. Influence of surface acid and base sites on the Guerbet coupling of ethanol to butanol over metal phosphate catalysts[J]. Journal of Catalysis, 2017, 352: 182-190. |
| [28] | Tseng K N, Lin S, Kampf J W, et al. Upgrading ethanol to 1-butanol with a homogeneous air-stable ruthenium catalyst[J]. Chemical Communications, 2016, 52(14): 2901-2904. DOI:10.1039/C5CC09913G. |
| [29] | Xie Y, Ben-David Y, Shimon L J, et al. Highly efficient process for production of biofuel from ethanol catalyzed by ruthenium pincer complexes[J]. Journal of the American Chemical Society, 2016, 138(29): 9077-9080. DOI:10.1021/jacs.6b05433. |
| [30] | Dowson G R M, Haddow M F, Lee J, et al. Catalytic conversion of ethanol into an advanced biofuel:unprecedented selectivity for n-butanol[J]. Angewandte Chemie International Edition, 2013, 125(34): 9175-9178. |
| [31] | Wingad R L, Gates P J, Street S T G, et al. Catalytic conversion of ethanol to n-butanol using ruthenium P-N ligand complexes[J]. ACS Catalysis, 2015, 5(10): 5822-5826. |
| [32] | Koda K, Matsu-Ura T, Obora Y, et al. Guerbet reaction of ethanol to n-butanol catalyzed by iridium complexes[J]. Chemistry Letters, 2009, 38(8): 838-839. DOI:10.1246/cl.2009.838. |
| [33] | Chakraborty S, Piszel P E, Hayes C E, et al. Highly selective formation of n-butanol from ethanol through the Guerbet process:a tandem catalytic approach[J]. Journal of the American Chemical Society, 2015, 137(45): 14264-14267. DOI:10.1021/jacs.5b10257. |
| [34] | Yang K W, Jiang X Z, Zhang W C. One-step synthesis of n-butanol from ethanol condensation over alumina-supported metal catalysts[J]. Chinese Chemical Letters, 2004, 15(12): 1497-1500. |
| [35] | Jordison T L, Lira C T, Miller D J. Condensed-phase ethanol conversion to higher alcohols[J]. Industrial & Engineering Chemistry Research, 2015, 54(44): 10991-11000. |
| [36] | Riittonen T, Eränen K, Mäki-Arvela P, et al. Continuous liquid-phase valorization of bio-ethanol towards bio-butanol over metal modified alumina[J]. Renewable Energy, 2015, 74: 369-378. |
| [37] | Ghaziaskar H, Xu C C. One-step continuous process for the production of 1-butanol and 1-hexanol by catalytic conversion of bio-ethanol at its sub-/supercritical state[J]. RSC Advances, 2013, 3(13): 4271-4280. |
| [38] | TIAN Yuan(田媛), SHAN Yu-hua(单玉华), SHI Jun(施骏), et al. Catalytic conversion of ethanol into n-butanol under hydrogen atmosphere with Ni/hydroxyapatite(氢气氛中Ni/羟基磷灰石催化乙醇合成正丁醇)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2016, 30(4): 857-863. DOI:10.3969/j.issn.1003-9015.2016.04.017. |
| [39] | Earley J H, Bourne R A, Watson M J, et al. Continuous catalytic upgrading of ethanol to n-butanol and > C4 products over Cu/CeO2 catalysts in supercritical CO2[J]. Green Chemistry, 2015, 17(5): 3018-3025. DOI:10.1039/C4GC00219A. |
| [40] | TIAN Ge (田戈), ZHANG Xian-long (张显龙), FENG Shou-hua (冯守华), et al. A method for preparing n-butanol from ethanol by using hydrothermal technique (一种利用水热技术由乙醇制备正丁醇的方法): CN, 103193593 B[P]. 2013-07-10. |
| [41] | Zhang X, Liu Z, Xu X, et al. Hydrothermal synthesis of 1-butanol from ethanol catalyzed with commercial cobalt powder[J]. ACS Sustainable Chemistry & Engineering, 2013, 1(12): 1493-1497. |
| [42] | Sun Z, Vasconcelos A C, Bottari G, et al. Efficient catalytic conversion of ethanol to 1-butanol via the Guerbet reaction over copper-and nickel-doped porous[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(2): 1738-1746. |
| [43] | Marcu I C, Tanchoux N, Fajula F, et al. Catalytic conversion of ethanol into butanol over M-Mg-Al mixed oxide catalysts (M=Pd, Ag, Mn, Fe, Cu, Sm, Yb) obtained from LDH precursors[J]. Catalysis Letters, 2013, 143(1): 23-30. |
| [44] | Kozlowski J T, Davis R J. Sodium modification of zirconia catalysts for ethanol coupling to 1-butanol[J]. Journal of Energy Chemistry, 2013, 22(1): 58-64. |




