2-甲基烯丙醇是一种重要的有机中间体,含有羟基和不饱和双键,能溶于有机物、部分溶于水,毒性比烯丙醇更低,反应活性较高,广泛用于农药、医药、香料、树脂和聚羧酸减水剂等的合成[1]。随着我国基础设施建设规模的增长,以2-甲基烯丙醇为原料的羧酸系水泥减水剂需求不断增大。深入研究2-甲基烯丙醇将使以其为中间体的下游产品更为丰富。探究2-甲基烯丙醇的合成方法、优化合成条件、反应机理及动力学对其实际工业生产具有指导意义。目前2-甲基烯丙醇的工业合成大多以2-甲基烯丙基氯为原料,通过直接水解一步法或酯化-水解两步法实现。2-甲基烯丙基氯和羧酸钠反应生成2-甲基烯丙醇羧酸酯后再水解得到2-甲基烯丙醇[2],与碱性条件下2-甲基烯丙基氯直接水解相比,先酯化再水解可以避免生成副产物二-(2-甲基烯丙基)-醚,从而降低分离难度,提高反应收率。固-液酯化反应产物单一、易于分离纯化、不产生含盐废水、可减少设备腐蚀。Devulapelli等[3]用肉桂酰溴和乙酸钠合成乙酸肉桂酯,探究了不同因素对反应速率的影响,拟合结果表明反应符合拟一级动力学。Vivekanand等[4]使用四丁基溴化铵在超声辅助下催化邻苯二甲酰亚胺钾盐与1-溴丁烷合成N-丁基邻苯二甲酰亚胺,研究了总反应速率的影响因素,验证了卤代烷与邻苯二甲酰亚胺钾盐在有机溶剂中的反应机理,同样得到拟一级反应动力学规律。固-液酯化反应备受关注,研究结果表明,与均相反应相比,固-液酯化反应具有溶剂用量少、分离速度快、反应收率高和总操作时间短等优点[5-8]。本文研究2-甲基烯丙基氯与乙酸钠的固-液相转移催化酯化反应机理及反应动力学,并探究反应温度、搅拌转速、催化剂用量和种类、溶剂种类等多种因素对反应影响,考察该酯化反应的动力学规律、求取动力学数据,为2-甲基烯丙基氯与乙酸钠固-液酯化反应的工业化提供参考。
2 实验部分 2.1 实验原料2-甲基烯丙基氯(质量分数≥99%),安耐吉化学;正丁醇(色谱纯)、无水乙酸钠(分析纯)、氯苯(分析纯)、甲苯(分析纯)、乙腈(分析纯),均购自国药集团化学试剂有限公司;四丁基氯化铵(质量分数≥99%)、四丁基溴化铵(质量分数≥99%)、四丁基碘化铵(质量分数≥99%)、四乙基氯化铵(质量分数≥99%)、十六烷基三甲基溴化铵(质量分数≥99%)、十二烷基三甲基氯化铵(质量分数≥99%),均购自上海麦克林生化科技有限公司;氯仿(分析纯)、十六烷基三甲基氯化铵(质量分数≥99%),均购自阿拉丁试剂有限公司。
2.2 实验方法称取2-甲基烯丙基氯、乙酸钠、相转移催化剂和溶剂,投入250 mL三口烧瓶,开启油浴加热和机械搅拌装置,控温精度为±0.1 ℃,在反应温度达到设定值并稳定后开始计时,每隔一定时间取样分析原料2-甲基烯丙基氯的转化率。
2.3 分析方法使用GC-5190气相色谱仪进行定量分析,内标为正丁醇。气相色谱分析条件:色谱柱为PEG20M强极性石英毛细管柱(30 m × 0.25 mm × 0.25 μm),氢火焰离子检测器,柱温初始值为70 ℃,保持6 min,之后以10 ℃·min-1升温至120 ℃并保持3 min,气化温度为250 ℃,检测器温度为280 ℃。
3 实验结果与讨论 3.1 鎓盐类相转移催化剂对固-液酯化反应的影响分别做有、无相转移催化剂的对照实验。结果表明,反应生成了2-甲基烯丙醇乙酸酯,有相转移催化剂时反应转化率较高、反应完全,而无相转移催化剂存在时反应转化率较低。因此,相转移催化剂必不可少。
3.2 2-甲基烯丙基氯固-液酯化反应动力学 3.2.1 反应机理及动力学模型根据Melville等[9]提出的固-液相转移催化机理,由于乙酸钠不溶于有机相,因此催化剂先吸附于乙酸钠表面,进行表面反应,生成可溶性离子对,进入有机相,在有机相中与2-甲基烯丙基氯发生亲核取代反应。反应机理如下:
| $ \begin{matrix} \text{QCl}(\text{org})\overset{{{K}_{\text{el}}}}{\mathop{\rightleftharpoons }}\, \text{QCl}(\text{ads}) \\ \text{QCl}(\text{ads})+\text{NaOAc}(\text{s})\overset{{{k}_{1}}}{\mathop{\rightleftharpoons }}\, \text{QOAc}(\text{ads})+\text{NaCl}(\text{s}) \\ \text{QOAc}(\text{ads})\overset{{{K}_{\text{c}2}}}{\mathop{\rightleftharpoons }}\, \text{QOAc}(\text{org}) \\ \text{RCl}(\text{org})+\text{QOAc}(\text{org})\underrightarrow{{{k}_{2}}}=\text{ROAc}(\text{org})+\text{QCl}(\text{org}) \\ \end{matrix} $ |
上述反应机理表明有机相是反应场所,反应速率方程可表示为:
| $ - {r_{\rm{RCl}}} = \frac{{{\rm{d}}c_{\rm{RCl}}^{\rm{{org}}}}}{{{\rm{d}}t}} = {k_2}c_{\rm{RCl}}^{\rm{org}}c_{\rm{QOAc}}^{\rm{org}}$ | (1) |
再根据质量守恒定律可得:
| ${V^{\rm{org}}}{c_{\rm{QCl, 0}}} = {V^{\rm{org}}}\left( {c_{{\rm{QCl}}}^{\rm{org}} + c_{{\rm{QOAc}}}^{\rm org}} \right) + {V^{\rm{s}}}\left( {c_{Q{\rm{Cl}}}^{{\rm{ads}}} + c_{Q{\rm{OAc}}}^{\rm ads}} \right)$ | (2) |
令分配系数
| $ {K_{{\rm{e1}}}} = c_{{\rm{QCl}}}^{{\rm{ads}}}/c_{{\rm{QCl}}}^{{\rm{org}}} $ | (3) |
| $ {K_{{\rm{e2}}}} = c_{{\rm{QOAc}}}^{{\rm{ads}}}/c_{{\rm{QOAc}}}^{{\rm{org}}} $ | (4) |
将式(3)、(4) 代入(2):
| $ {c_{\rm{QCl, 0}}} = c_{{\rm{QCl}}}^{\rm{org}} + c_{{\rm{QOAc}}}^{\rm org} + \frac{{{V^{\rm{s}}}}}{{{V^{\rm{org}}}}}\left( {{K_{\rm{e1}}}c_{{\rm{QCl}}}^{\rm{org}} + {K_{\rm{e2}}}c_{{\rm{QOAc}}}^{\rm org}} \right) $ | (5) |
变换式(5) 得到
| $c_{{\rm{QOAc}}}^{\rm org} = \frac{1}{{1{\rm{ + }}{V^{\rm{s}}}{{{K_{\rm{e2}}}} /{{V^{\rm{org}}}}}}}\left[ {{c_{\rm{QCl, 0}}} - \left( {1{\rm{ + }}\frac{{{V^{\rm{s}}}{K_{\rm{e1}}}}}{{{V^{\rm{org}}}}}} \right)c_{{\rm{QCl}}}^{\rm{org}}} \right]$ | (6) |
令
| $c_{{\rm{QOAc}}}^{\rm org}{\rm{ = }}\eta {c_{\rm{QCl, 0}}}$ | (7) |
将式(7) 代入(6):
| $\eta {\rm{ = }}\frac{1}{{1{\rm{ + }}{V^{\rm{s}}}{K_{{\rm{e2}}}}/{V^{{\rm{org}}}}}}\left[ {1 - \left( {1{\rm{ + }}\frac{{{V^{\rm{s}}}{K_{{\rm{e1}}}}}}{{{V^{{\rm{org}}}}}}} \right)\frac{{c_{{\rm{QCl}}}^{{\rm{org}}}}}{{{c_{{\rm{QCl, 0}}}}}}} \right]$ | (8) |
将式(7)代入(1):
| $ - {r_{\rm{RCl}}} = {k_2}\eta c_{\rm{RCl}}^{\rm{org}}{c_{\rm{QCl, 0}}}$ | (9) |
反应机理分析表明,η的影响因素有固相表面积、液相体积、相转移催化剂和离子对在两相的分配系数等。当η变化可以忽略时,反应速率对2-甲基烯丙基氯的浓度呈现为拟一级。Yang等[10]通过实验监测有机相中的离子对浓度,发现大量有机溶剂和少量相转移催化剂存在条件下,亲核试剂与卤代烃的摩尔比大于1即亲核试剂过量时,有机相中离子对浓度经历短暂的诱导期后可视为不变,因此该反应可视为拟一级反应。
定义2-甲基烯丙醇乙酸酯的收率
| $c_{\rm{RCl}}^{\rm{org}}{\rm{ = }}{c_{{\rm{R}}\rm{Cl, 0}}}\left( {1 - Y} \right)$ | (10) |
将式(10) 代入(1):
| $\frac{{{\rm{d}}Y}}{{{\rm{d}}t}} = {k_2}\eta {c_{\rm{QCl, 0}}}\left( {1 - Y} \right){\rm{ = }}k'\left( {1 - Y} \right)$ | (11) |
对式(11) 的左、右两边进行积分得:
| $ - \ln \left( {1 - Y} \right) = k't$ | (12) |
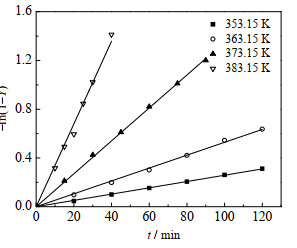
氯苯溶剂100 mL、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol、十六烷基三甲基氯化铵0.005 mol、搅拌转速600 r∙min-1时,分别在353.15、363.15、373.15和383.15 K四个温度下进行实验,在未达到所设反应温度时会有少量2-甲基烯丙醇乙酸酯生成,因此从反应温度达到设定值时开始计时,并指定此时的收率为0,其余取样时间点的收率在此基础上进行换算,换算后的2-甲基烯丙醇乙酸酯收率Y随时间的变化数据如表 1所示。不同温度下反应动力学拟合结果如图 1所示。
|
|
表 1 不同温度下2-甲基烯丙基氯与乙酸钠的反应数据 Table 1 Reaction results of 2-methylallyl chloride with sodium acetate at different temperatures |
|
图 1 不同温度下反应动力学拟合结果 Fig.1 Fitting results of reaction kinetic equations at different temperatures |
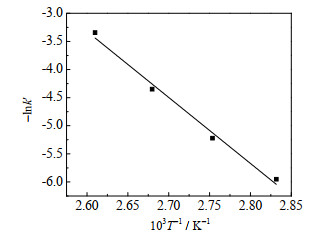
不同反应温度下的表观反应速率常数k' 见表 2。根据Arrhenius方程
|
|
表 2 不同反应温度下的表观反应速率常数 Table 2 Apparent reaction rate constants at different temperatures |
|
图 2 lnk' 与1/T关系 Fig.2 Plots of lnk' versus 1/T |
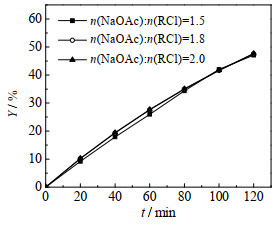
在363.15 K、氯苯100 mL、十六烷基三甲基氯化铵0.005 mol、搅拌转速600 r∙min-1条件下,使乙酸钠与2-甲基烯丙基氯的摩尔比n(NaOAc): n(RCl)分别为1.5、1.8和2.0时进行验证实验,结果如图 3所示。由图可见,乙酸钠用量增加不会显著提高反应收率,表明乙酸钠用量对反应无明显影响。
|
图 3 不同原料配比下2-甲基烯丙醇乙酸酯收率随时间变化 Fig.3 Yield evolution of 2-methylallyl acetate with time at different molar ratios |
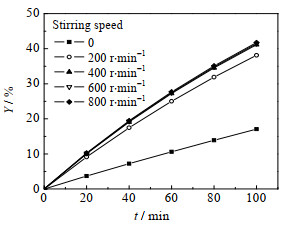
传质阻力是影响两相反应速率的重要因素。在383.15 K、氯苯溶剂100 mL、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol、十六烷基三甲基氯化铵0.005 mol等条件下改变搅拌转速进行实验,2-甲基烯丙醇乙酸酯收率随时间变化如图 4所示。由图可见,随着搅拌转速增加,2-甲基烯丙醇乙酸酯收率增大幅度逐渐减小;搅拌转速大于400 r∙min-1时,搅拌转速对2-甲基烯丙醇乙酸酯收率的影响可忽略不计,表明此时传质过程对反应的影响已经排除。
|
图 4 搅拌转速对2-甲基烯丙醇乙酸酯收率的影响 Fig.4 Effect of stirring speed on the yield of 2-methylallyl acetate |
在363.15 K、氯苯溶剂100 mL、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol、搅拌转速600 r∙min-1条件下,改变催化剂用量进行实验,2-甲基烯丙基乙酸酯收率随时间变化如图 5所示。图 6的拟合结果表明,其他条件相同时,在一定催化剂用量范围内,表观反应速率常数k' 与催化剂用量ncat呈正比。这是因为催化剂用量增加,进入有机相的、由季铵盐阳离子和亲核试剂阴离子形成的反应中间体离子对更多,这与式(11)相吻合,进一步验证了该动力学模型。
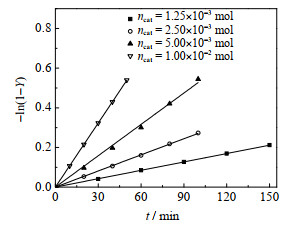
|
图 5 不同催化剂用量下动力学拟合结果 Fig.5 Fitting results of kinetic equations with different catalyst dosages |
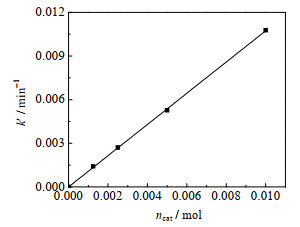
|
图 6 不同催化剂用量下表观反应速率常数拟合结果 Fig.6 Fitting results of apparent reaction rate constants with different catalyst dosages |
在363.15 K、100 mL氯苯、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol和搅拌转速600 r∙min-1条件下,分别取0.005 mol的四丁基溴化铵、四丁基氯化铵、四丁基碘化铵、十六烷基三甲基溴化铵、十六烷基三甲基氯化铵、四乙基氯化铵和十二烷基三甲基氯化铵等不同催化剂进行实验,2-甲基烯丙醇乙酸酯收率随时间变化如图 7所示。结果表明,不同催化剂的催化性能由高到低依次为:四丁基氯化铵>四丁基溴化铵>四丁基碘化铵>十六烷基三甲基氯化铵>十六烷基三甲基溴化铵>四乙基氯化铵>十二烷基三甲基氯化铵。
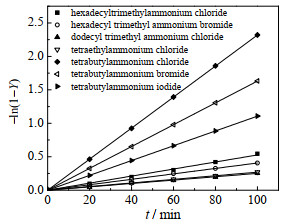
|
图 7 不同催化剂对2-甲基烯丙醇乙酸酯收率影响 Fig.7 Effect of different catalysts on the yield of 2-methylallyl acetate |
对催化剂的阴离子而言,催化性能从高到低依次为Cl->Br->I-,这是因为催化剂的阴离子亲核性越强,与季铵根阳离子的结合力越强,不利于季铵根阳离子与亲核试剂阴离子结合形成离子对进入有机相,导致催化性能降低。通常催化剂结构相同时,阳离子碳链数越高,催化性能越高,因为碳链越长,亲油性越好,形成的离子对更容易进入有机相。阳离子对称性越好,催化性能越高,如使用四丁基氯化铵催化的反应速率显著高于其他催化剂。离子对的中心原子正电荷越分散,与亲核试剂阴离子的结合就越不牢固,负离子裸露程度越高,亲核性更强,催化效率越高。
3.6 溶剂种类对2-甲基烯丙基氯固-液酯化反应的影响在333.15 K (由于氯仿的沸点为61~62 ℃,本实验选择较低反应温度)、乙酸钠0.15 mol、2-甲基烯丙基氯0.1 mol、溶剂用量100 mL、催化剂0.005 mol和搅拌转速600 r·min-1时,使用氯苯、甲苯、乙腈和氯仿探究溶剂种类对2-甲基烯丙基氯固-液酯化反应速率的影响,2-甲基烯丙基乙酸酯收率随时间变化如图 8所示。由图可见,不同溶剂进行反应时表观反应速率从大到小依次为:乙腈>氯仿>氯苯>甲苯,这与四种溶剂的极性高低顺序一致。这是因为溶剂极性越高,离子对在溶剂中的溶解度越大,高极性溶剂有利于离子对从固体表面扩散进入有机相。此外,对于底物不带电荷的双分子亲核取代反应(SN2反应)而言,溶剂会与过渡态形成偶极-偶极键;溶剂极性越强,形成偶极键的能力越强、过渡态的能量越低、SN2反应活化能越低,越有利于反应进行。这和Wang等[11-12]的研究结果一致,即溶剂极性是固-液反应速率的主要影响因素。除了溶剂极性,相关研究还表明,溶剂的电导率、表面张力等因素也可能影响反应速率[10, 13-14]。
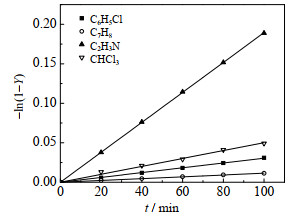
|
图 8 不同溶剂对2-甲基烯丙醇乙酸酯收率的影响 Fig.8 Effect of different solvents on the yield of 2-methylallyl acetate |
(1) 相转移催化剂对2-甲基烯丙基氯与乙酸钠的酯化反应是必不可少的;催化剂的阴离子亲核性越弱、阳离子的碳链数越长、对称性越好,则催化性能越好;在一定催化剂用量范围内,表观反应速率和催化剂用量呈正比;
(2) 吸附于固体表面的催化剂与亲核试剂进行表面反应,生成可溶性离子对进入有机相,再与2-甲基烯丙基氯发生亲核取代反应,该反应遵循SN2反应机理,对催化中间体离子对、卤代烃的浓度均呈拟一级。在大量有机溶剂和少量相转移催化剂存在条件下,当乙酸钠与2-甲基烯丙基氯的摩尔比大于1时,有机相中离子对浓度经过短暂的诱导期后可视为不变。固定催化剂种类、用量时反应遵循拟一级反应动力学规律,即在353.15~383.15 K、催化剂十六烷基三甲基氯化铵用量为0.005 mol时,反应动力学方程可表示为:
| $ - {r_{\rm{RCl}}} = 6.498 \times {10^{11}}\exp \left( { - \frac{{97.61}}{{RT}}} \right)c_{\rm{RCl}}^{\rm{org}} $ |
(3) 溶剂极性是2-甲基烯丙基氯与乙酸钠的固-液酯化反应速率的主要影响因素之一。
|
|
| [1] |
韩微微. 2-甲基烯丙醇生产技术研究进展及应用[J]. 辽宁化工, 2014, 43(12): 1513-1514. HAN W W. Research progress and application of beta-methallyl alcohol production technology[J]. Liaoning Chemical Industry, 2014, 43(12): 1513-1514. |
| [2] |
王涛, 范士敏, 冉千平, 等. 酯化水解两步"一锅法"合成2-甲基烯丙醇[J]. 化学试剂, 2014, 36(10): 946-948. WANG T, FAN S M, RAN Q P, et al. One-pot method of esterification and hydrolysis to synthesize 2-methyl-allyl alcohol[J]. Chemical Reagents, 2014, 36(10): 946-948. |
| [3] |
DEVULAPELLI V G, WENG H. Synthesis of cinnamyl acetate by solid-liquid phase transfer catalysis: Kinetic study with a batch reactor[J]. Catalysis Communications, 2009, 10(13): 1638-1642. DOI:10.1016/j.catcom.2009.04.032 |
| [4] |
VIVEKANAND P A, WANG M. Ultrasound-assisted n-alkylation of phthalimide under phase-transfer catalysis conditions and its kinetics[J]. Chemical Engineering Communications, 2012, 199(12): 1652-1667. DOI:10.1080/00986445.2012.664795 |
| [5] |
SELVARAJ V, ABIMANNAN P, RAJENDRAN V. Ultrasound assisted arylation of benzyl alcohol with 4-nitrochlorobenzene under a new multi-site phase-transfer catalyst in solid-liquid condition[J]. Ultrasonics Sonochemistry, 2014, 21(5): 1805-1814. DOI:10.1016/j.ultsonch.2014.04.010 |
| [6] |
DIWATHE M C, GOGATE P R. Ultrasound assisted intensified synthesis of 1-benzyloxy-4-nitrobenzene in the presence of phase transfer catalyst[J]. Chemical Engineering Journal, 2018, 346: 438-446. DOI:10.1016/j.cej.2018.04.027 |
| [7] |
PRASAD G S, WANG M, RAJU C N, et al. Recent developments on phase-transfer catalytic reactions under ultrasound irradiation[J]. Journal of the Taiwan Istitute of Chemcal Engineers, 2017, 70: 56-73. DOI:10.1016/j.jtice.2016.10.040 |
| [8] |
BHAVSAR K V, YADAV G D. Synthesis of geranyl acetate by transesterification of geraniol with ethyl acetate over Candida antarctica lipase as catalyst in solvent-free system[J]. Flavour and Fragrance Journal, 2019, 34(4): 288-293. DOI:10.1002/ffj.3502 |
| [9] |
MELVILLE J B, GODDARD J D. A solid-liquid phase-transfer catalysis in rotating-disk flow[J]. Industrial & Engineering Chemistry Research, 1988, 27(4): 551-555. |
| [10] |
YANG H, WU H. Kinetic study for synthesizing dibenzyl phthalate via solid-liquid phase-transfer catalysis[J]. Industrial & Engineering Chemistry Research, 1998, 37(12): 4536-4541. |
| [11] |
WANG M, TSENG Y. Kinetic model for synthesizing 4, 4'-diethanoxy biphenyl by phase transfer catalysis[J]. Journal of Molecular Catalysis A: Chemical, 2002, 188(1/2): 51-61. |
| [12] |
WANG M, LEE Z. Reaction of 4, 4'-bis(chloromethyl)-1, 1'-biphenyl and phenol in two-phase medium via phase-transfer catalysis[J]. Journal of Molecular Catalysis A: Chemical, 2007, 264(1/2): 119-127. |
| [13] |
YANG H M, WU P I, LI C M. Etherification of halo-ester by phase-transfer catalysis in solid-liquid system[J]. Applied Catalysis, A: General, 2000, 193(1/2): 129-137. |
| [14] |
YADAV G D, SHARMA M M. Kinetics of reaction of benzyl chloride with sodium acetate/benzoate: Phase transfer catalysis in solid-liquid system[J]. Industrial & Engineering Chemistry Process Design and Development, 1981, 20(2): 385-390. |




