正丁醇是一种重要的化工原料,广泛用于增塑剂与表面活性剂生产、有机中间体合成及有机溶剂。正丁醇还是一种较乙醇性能优异的发动机燃料,能与汽油任意互溶、对现有发动机和管路没有腐蚀。正丁醇的能量密度(29 MJ⋅L-1)与汽油接近(32 MJ⋅L-1),而目前广泛使用的乙醇,其能量密度(19.6 MJ⋅L-1)只是汽油的61%[1]。另外,正丁醇的汽化热(0.43 MJ⋅Kg-1)只有乙醇的一半(0.92 MJ⋅kg-1),与汽油的(0.36 MJ⋅kg-1)接近,从而具有更好的发动机冷启动性能[2],说明正丁醇是更理想的替代燃料。
目前,生产正丁醇的常用方法有羰基合成法、醇醛缩合法和发酵法。发酵法生产效率很低[3],羰基合成法是工业上最主要的正丁醇生产方法,其过程是用钴或铑的络合物催化丙烯、一氧化碳和氢气,经羰基合成、加氢得正丁醇和异丁醇[4]。合成一氧化碳和氢气能耗高、一氧化碳有毒,反应过程复杂。因此,寻找低能耗环保的生产方法,才能更加符合“绿色化学”理念[5]。两个乙醇分子经过Guerbet反应可以生成丁醇。反应过程清洁,所用原料乙醇现在基本上是来自淀粉或纤维发酵,因此是一条利用生物质转化合成生物质燃料的理想途径,符合“绿色化学”的要求。
通常,Guerbet反应所用的固体催化剂主要有碱金属氧化物与磷酸盐、羟基磷灰石、碱性分子筛等[6]。Yang等[7]报道了Li、Rb交换X型分子筛催化乙醇合成正丁醇,并提出了新的反应机理。Appel等[8]研究了一种镁铝混合氧化物的催化剂,当Mg/Al比为3:1时,乙醇转化率超过30%、正丁醇的选择性接近35%。Tsuchida等[9]发现Ca-P类羟基磷灰石具有很好的催化效果,当Ca/P比为1.67、在298℃下以N2为载气,乙醇转化率为20%,选择性为69.8%;在乙醇转化率为15%时,正丁醇选择性达到76%。Onda等 [10]研究了以金属锶代替羟基磷灰石中的钙,当Sr/P比达到1.70时,N2气氛中反应,乙醇转化率为11.3%,正丁醇选择性达到了86.4%。这些研究表明,固体催化体系效果总是不理想,正丁醇选择性低、收率低。其中,羟基磷灰石类催化剂虽有较高的正丁醇选择性,但由于高碳链有机物副产物的影响,很容易失活[11]。
为提高正丁醇的单程收率,近年来,出现了一些金属有机配合物催化Guerbet反应的报道。Wass等[12]使用了钌-膦配合物催化剂,乙醇转化率超过20%,正丁醇选择性高达94%。Xu Guoqiang等[13]报道了在铱配合物催化下,与乙醇等摩尔KOH水溶液中,150℃反应16 h,乙醇转化率高达52%,但产物复杂,丁醇选择性只有26%。Richard等[14]报道了在一种新型磷氮配合物催化下,碱性水溶液中反应,乙醇转化率可大于30%、正丁醇选择性可大于90%。这些金属有机配合物均相催化的反应,正丁醇收率有所提高。但碱性水溶液中反应,催化剂循环和碱回用都是工业上面临的挑战性问题。
为解决非均相催化过程正丁醇收率低且催化剂易失活、均相催化过程难以长期催化剂循环等问题,基于对如示意图 1所示的Guerbet反应机理[15, 16]的认识,作者研制了镍负载于羟基磷灰石的固体催化剂Ni/HAP,发现对于这样的金属/固体碱多功能催化剂,在H2气氛中较在常规的N2气氛中反应,正丁醇收率明显提高,而且催化剂稳定性也有很大提高,为开发具有工业化前景的催化合成正丁醇过程提供了潜在的可能。
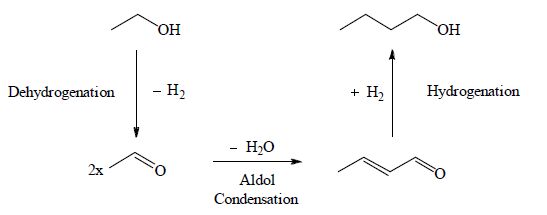
|
示意图 1 乙醇催化转化合成正丁醇过程 Scheme1 Reaction scheme of ethanol conversion into 1-butanol |
D/Max 2500PC型X射线衍射仪:日本理学;Autosorb-IQ2-MP型表面孔径吸附仪:美国康塔仪器公司;Shimadzu GCMS-2010型气相色谱-质谱联用仪:日本岛津公司;GC-7800气相色谱仪:滕州京鲁伟业科学仪器有限公司,30 m×0.250 mm×0.25 μm DB-210毛细管柱;SUPRA55型场发射扫描电子显微镜:德国-蔡司;Vista-AX型等离子体发射光谱仪:美国Varian公司;JEOL JEM-2100型高分辨透射电子显微镜:日本电子株式会社;SZB-1A双柱塞微量计量泵:北京卫星制造厂。
磷酸氢二铵、氨水、十六烷基三甲基溴化铵(CTAB):上海凌峰化学试剂有限公司;四水合硝酸钙、无水乙醇:国药集团化学试剂有限公司;六水合硝酸镍:上海恒鑫化工试剂有限公司。
2.2 催化剂的制备依次称取0.04 mol磷酸氢二铵溶于100 mL去离子水中,配制成0.40 mol⋅L-1的(NH4)2HPO4溶液;缓慢向其中滴入配制好的5%(wt) CTAB溶液,再称取0.06 mol四水合硝酸钙溶于100 mL去离子水,配制成0.60 mol⋅L-1的Ca(NO3)2溶液;将两种溶液同时缓慢滴加到500 mL的四口圆底烧瓶中,机械搅拌均匀后,继续搅拌,之后用氨水调节pH=9~10;80℃下水浴搅拌24 h后,加入一定量的六水合硝酸镍溶液,继续超声搅拌1 h,真空抽滤,滤饼于120℃恒温干燥;将干燥后的固体充分研磨,置于马弗炉中600℃焙烧4 h;最后在纯氢气下,从室温以5℃⋅min-1程序升温至320℃,并维持2 h还原,得到Ni负载型催化剂,标记为x%Ni/HAP,x为Ni负载量。改变Ni负载量用相同的方法制备不同的催化剂。
2.3 催化剂的活性评价在固定床反应器中进行催化性能评价。反应装置图如图 1所示。在催化剂床层中加入2.5 mL 20~40目的催化剂,在反应开始前,先通氮气让催化剂在500℃下预热活化1 h,之后原位降温至200℃。关闭氮气,改通氢气并调节氢气空速(如3000 h−1),用计量泵将乙醇泵入反应器(如5 mL⋅h-1)。通过冰水冷阱收集产物,用针阀取样。用GC-MS对产物进行定性分析、用GC(FID)对产物进行定量分析。

|
图 1 乙醇合成正丁醇反应装置图 Fig.1 Reaction setup for ethanol conversion into n-butanol 1. feed pump 2. N2 cylinder 3. H2 cylinder 4. heating furnace 5. catalyst bed 6. ice cold trap 7. discharge/sampling valve 8. exhaust regulating valve 9. soap foam flowmeter |
图 2是催化剂样品的XRD谱图。图中a曲线表示使用传统制备方法[5](即不添加模板剂)制备的羟基磷灰石,标记为HAP*,图中b曲线表示加入CTAB所制备的羟基磷灰石,标记为HAP。从图 2中可以看出a和b具有相似的衍射峰,表明制备过程加入CTAB并未改变羟基磷灰石的基本结构。从图 2中c曲线可以看出,含金属镍的催化剂 (12%Ni/HAP)与HAP基本结构相似。

|
图 2 催化剂样品的XRD 谱图 Fig.2 XRD patterns of the catalyst samples a. HAP* b. HAP c. 12% Ni/HAP |
图 3是催化剂样品的TEM照片。从图中可以看出,传统方法所制备HAP*棒状颗粒长度约在80~150 nm (图 3-A),加CTAB制备HAP纳米棒长度约在30~80 nm (图 3-B)。由图 3-C看出,含镍的催化剂(12%Ni/HAP)与HAP呈相似的纳米棒状,但其表面明显含有更细小的纳米颗粒,这些细小纳米颗粒尺寸约在20~40 nm,使得图 3-C颗粒轮廓不像图 3-B那样清晰。

|
图 3 催化剂样品的TEM 照片 Fig.3 TEM images of the catalyst samples A. HAP* B. HAP C. 12% Ni/HAP |
表 1列举了用BET法测定的样品微观结构参数,用ICP-AES方法测定的样品的元素(Ni,Ca,P) 摩尔比。与传统的HAP*载体相比,添加CTAB制备的HAP载体的比表面积增加了13.1 m2⋅g-1(增加了38.8%)。随着金属镍负载量由6% 提高到14%,比表面积略有下降(由43.6 m2⋅g-1降至41.7 m2⋅g-1),平均孔径差不多,都在13 nm左右。测得的元素(Ni,Ca,P) 摩尔比与实验投料比例相近。
| 表 1 催化剂元素(Ni, Ca, P) 摩尔比与微观结构参数 Table 1 Molar ratios of different elements (Ni, Ca, P) and microstructure parameters of the catalysts |
另外,实验还通过SEM-EDX方法测定12%Ni/HAP催化剂表面元素组成。 12%Ni/HAP样品SEM-EDX能谱见图 4,基于EDX能谱测得的其表面元素组成列于表 2。
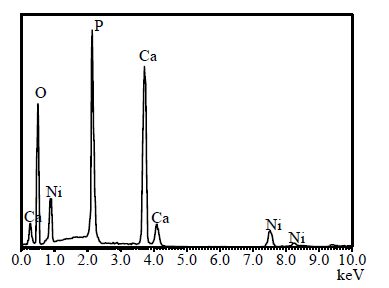
|
图 4 12%Ni/HAP 样品的SEM-EDX 能谱图 Fig.4 SEM-EDX spectrum of 12%Ni/HAP |
| 表 2 12%Ni/HAP 样品表面元素组成表 (SEM-EDX) Table 2 Surface elemental composition of 12%Ni/HAP (SEM-EDX) |
从表 2看出,12%Ni/HAP催化剂表面Ca、P、Ni比例与投料组成接近,但测出样品表面含C元素,这可能是来自样品表面吸附的CO2,因为HAP是一强碱性材料。
3.2 反应气氛对催化反应活性及选择性的影响以羟基磷灰石、碱金属化合物等固体催化剂催化乙醇合成正丁醇的反应一般是在N2或Ar等[17]惰性气氛中进行。从所报道的结果看,存在的主要问题是正丁醇收率低、催化剂易生焦失活。大部分的研究者是致力于新型高效催化剂的研发,但也有一些研究关注到反应气氛(介质)的影响。Earley等[18]研究了超临界CO2中,Cu/CeO2催化乙醇合成正丁醇反应,发现催化剂活性很高,乙醇转化率高达67%,正丁醇收率高达30%(正丁醇选择性只有45%)。认为CO2有利于保持CeO2化学稳定性,进而抑制Cu微晶的烧结,故使催化剂具有很高的活性。Stevens等人[19]也观察到了CO2的这种积极效果。
从一般的Guerbet反应机理(见示意图 1)看,乙醇缩合生成正丁醇的过程涉及脱氢、缩合、脱水、加氢等一系列反应步骤。根据这样的反应机理,作者研制了具有金属活性中心和酸碱活性中心的多功能催化剂Ni/HAP,分别考察这类催化剂在N2和H2气氛中的催化性能。
所制备的具有不同镍负载量的Ni/HAP,在氮气和氢气氛中的反应结果分别列于表 3和表 4。比较表 3与表 4可以看出:在N2气氛中反应,Ni/HAP的催化活性很低,乙醇最高转化率为5.4%,正丁醇的选择性也只有16.1%,主要生成丁烯醛(52.9%);而在H2气氛中反应,催化活性明显提高,乙醇转化率升高至15.6%(提高了2倍),正丁醇的选择性大大提高至83.6%(提高了4.2倍),通过GC-MS分析可知,少量的副产物是醋酸、丙二醇甲醚、丁烯醛和丁酸乙酯(见图 5);氢气氛中反应结果远好于在氮气中反应,这说明在示意图 1所示的复杂反应过程中,丁烯醛的加氢过程是整个反应的关键步骤。而且,在氢气氛下有利于维持还原态Ni的活性。结果表明:对具有金属活性中心和酸碱活性中心的多功能催化剂Ni/HAP而言,选择在H2气氛中反应是至关重要的。
| 表 3 N2 气氛中的反应结果 Table 3 Results of reaction studied in N2 atmosphere |
| 表 4 H2 气氛中的反应结果 Table 4 Results of reaction studied in H2 atmosphere |
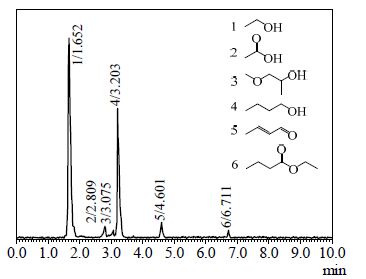
|
图 5 反应混合物的GC-MS 总离子流图 Fig.5 Total ion chromatogram of GC-MS for the reaction mixtures |
另外,随着催化剂中Ni负载量从6%增大至12%,催化活性逐渐增加,正丁醇的选择性显著提高;而Ni负载量增加至14%时,催化性能却有所下降,其原因可能是Ni的负载量过多,易造成孔道堵塞,使催化剂表面利用率下降。
3.2.1 反应温度的影响选择Ni负载量为12%的Ni/HAP催化剂,考察反应温度对催化乙醇合成正丁醇反应的影响(见图 6)。由图 6可见,N2气氛中,随反应温度由200℃升高到300℃,乙醇的转化率提高了3.7%,在300℃达到峰值5.4%,正丁醇的选择性在300℃到达峰值16.1%,而从300℃开始,乙醇转化率和对正丁醇的选择性都开始明显下降;H2气氛中,从200℃到300℃,乙醇的转化率提高了10.1%,在300℃达到峰值15.6%,正丁醇的选择性在200℃开始呈明显上升趋势,达到48.2%,在300℃时达到83.6%。与文献[9]报道的正丁醇的选择性(69.8%)相比,提高了13.8%。但当反应温度从300℃继续向上升到400℃,乙醇的转化率反而呈下降趋势,说明高温下,该复杂体系呈现化学平衡向左移的趋向。从350℃起,正丁醇的选择性明显降低,而丁烯醛的选择性开始明显变大。这是由于随着温度进一步升高,不利于加氢反应,脱氢反应逐渐处于优势,其它副反应也会加剧,从而使得主产物的选择性降低。结果表明:H2气氛中控制在300℃反应,催化反应效果最佳。

|
图 6 12% Ni/HAP 催化下反应温度的影响 Fig.6 Effects of reaction temperature on the reaction catalyzed with 12% Ni/HAP ▲ conversion of ethanol ● selectivity for n-butanol ■ selectivity for 2-butenal (in H2 atmosphere) △ conversion of ethanol ○ selectivity for n-butanol □ selectivity for 2-butenal (in N2 atmosphere) |
Ni/HAP催化下,H2体积空速(GHSV)对乙醇合成正丁醇的反应影响如图 7所示。由图 7可知,随着H2 GHSV由1500 h-1增加到3000 h-1,乙醇的转化率由1.7% 迅速提高到15.6%,相应的正丁醇的选择性由60%提高到83.6%;丁烯醛和其他副产物选择性相对较低,随着GHSV提高至3500 h-1,乙醇的转化率和正丁醇的选择性都开始降低,而丁烯醛的选择性有明显提高。这说明在示意图 1所示的复杂反应过程中,丁烯醛的加氢过程是整个反应的速率控制步骤。H2 GHSV过大,物料停留时间短,快速生成的丁烯醛未来得及加氢就被载气带离反应区。结果表明H2 GHSV控制在3000 h-1较为合适。

|
图 7 12% Ni/HAP 催化下H2 体积空速对反应结果的影响 Fig.7 Effects of H2 GHSV on the reaction catalyzed with 12% Ni/HAP ▲ conversion of ethanol ● selectivity for n-butanol ■ selectivity for 2-butenal (in H2 atmosphere) |
图 8考察了乙醇液相空速对12%Ni/HAP催化乙醇合成正丁醇反应的影响。从图 8中可以看出,氢气氛中,当乙醇空速为2.0 h-1时,乙醇的转化率和正丁醇的选择性都达到最高,但对副产物的影响不大。反应考察乙醇空速从0.4 h-1开始直到2.0 h-1,正丁醇的选择性从60%逐渐提高了20%,当乙醇空速高于2.0 h-1时,正丁醇的选择性出现了大幅度下降,下降了约55%,而乙醇的转化率也由15.6%降低到0.6%,对丁烯醛的选择性增加得不是很明显,约4%左右。结果表明当乙醇液相空速为2.0 h-1时,催化反应效率最高。

|
图 8 12% Ni/HAP 催化下乙醇液相空速对反应结果的影响 Fig.8 Effects of ethanol LHSV on the reaction catalyzed with 12% Ni/HAP ▲ conversion of ethanol ● selectivity for n-butanol ■ selectivity for 2-butenal (in H2 atmosphere) |
图 9是12% Ni/HAP催化乙醇合成正丁醇的连续固定床反应考察结果。考察时间为6 d,每8 h取样分析一次。从图中可以看出:在N2气氛中,反应运行32 h后,催化剂的活性就明显下降,88 h后催化剂基本失活;在H2气氛中反应,乙醇的转化率在128 h内没有明显下降(催化剂活性稳定性提高了3倍),之后的16 h内,乙醇转化率降低了15%,正丁醇的选择性总体呈缓慢下降 趋势,降低了约20%。在氢气氛下反应催化剂稳定性大为提高的原因:一方面是氢气氛下反应有利于维持还原态Ni活性中心的稳定;另一方面是氢气氛下反应有利于不稳定的中间产物丁烯醛及时加氢转化为较稳定的目的产物正丁醇,从而抑制其在催化剂上生焦而造成催化剂活性迅速衰退。

|
图 9 乙醇合成正丁醇的连续固定床反应性能 Fig.9 Performance of the contiuous fixed-bed in 1-butanol synthesis using ethanol ▲ conversion of ethanol ● selectivity for n-butanol ■ selectivity for 2-butenal (in H2 atmosphere) △ conversion of ethanol ○ selectivity for n-butanol □ selectivity for 2-butenal (in N2 atmosphere) *reaction conditions:300℃; H2 or N2 GHSV:3000 h-1; catalyst: 2.5 mL; ethanol: 5 mL⋅h-1 |
1) 对于Ni/HAP催化乙醇双分子合成正丁醇的过程,反应气氛对催化剂活性、正丁醇选择性和催化剂的稳定性都有很大的影响。在H2气氛下较在N2气氛下反应,乙醇的转化率提高了2倍,正丁醇的选择性提高了4.2倍。催化剂活性稳定性提高了3倍。H2使得12% Ni/HAP催化剂的加氢活性提高,降低副产物的产生。在N2气氛下主要产物是丁烯醛,而在H2气氛下主要得到目的产物正丁醇。
2) 12% Ni/HAP催化乙醇合成正丁醇适宜反应条件为:用CTAB为模板剂制备Ni/HAP催化剂,在H2气氛中、300℃反应、氢气体积空速3000 h-1、催化剂体积2.5 mL、乙醇液相空速2.0 h-1;乙醇转化率为15.6%,正丁醇的选择性为83.6%。
| [1] | Ranjan A, Moholkar V S . Biobutanol:science, engineering, and economics[J]. International Journal of Energy Research , 2012, 36 (3) : 277-323 DOI:10.1002/er.v36.3 |
| [2] | Dürre Peter . Biobutanol:an attractive biofuel[J]. Biotechnology Journal , 2007, 2 (12) : 1525-1534 DOI:10.1002/(ISSN)1860-7314 |
| [3] | LIN Yi-jun(林逸君), WEN Zhi-qiang(闻志强), ZHU Li(朱力) . Butanol production from corncob in the sequential co-culture of Closrtidium thermocellum and Clostridium beijerinckii(Closrtidium thermocellum与Clostridium beijerinckii偶联发酵玉米棒芯产丁醇)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27 (3) : 444-449 |
| [4] | Uyttebroek M, Van Hecke W, Vanbroekhoven K . Sustainability metrics of 1-butanol[J]. Catalysis Today , 2015, 239 : 7-10 DOI:10.1016/j.cattod.2013.10.094 |
| [5] | Tsuchida T, Sakuma S, Takeguchi T . Direct synthesis of n-butanol from ethanol over nonstoichiometric hydroxyapatite[J]. Industrial & Engineering Chemistry Research , 2006, 45 (25) : 8634-8642 |
| [6] | Kozlowski J T, Davis R J . Heterogeneous catalysts for the Guerbet coupling of alcohols[J]. ACS Catalysis , 2013, 3 (7) : 1588-1600 DOI:10.1021/cs400292f |
| [7] | Yang C, Meng Z Y . Bimolecular condensation of ethanol to 1-butanol catalyzed by alkali cation zeolites[J]. Journal of Catalysis , 1993, 142 (1) : 37-44 DOI:10.1006/jcat.1993.1187 |
| [8] | Carvalho D L, Avillez R R, Rodrigues M T . Mg and Al mixed oxides and the synthesis of n-butanol from ethanol[J]. Applied Catalysis A:General , 2012, 415 |
| [9] | Tsuchida T, Kubo J, Yoshioka T . Reaction of ethanol over hydroxyapatite affected by Ca/P ratio of catalyst[J]. Journal of Catalysis , 2008, 259 (2) : 183-189 DOI:10.1016/j.jcat.2008.08.005 |
| [10] | Ogo S, Onda A, Iwasa Y . 1-Butanol synthesis from ethanol over strontium phosphate hydroxyapatite catalysts with various Sr/P ratios[J]. Journal of Catalysis , 2012, 296 (12) : 24-30 |
| [11] | Leon M, Diaz E, Ordonez S . Ethanol catalytic condensation over Mg-Al mixed oxides derived from hydrotalcites[J]. Catalysis Today , 2011, 164 (1) : 436-442 DOI:10.1016/j.cattod.2010.10.003 |
| [12] | Dowson G R M, Haddow M F, Lee J . Catalytic conversion of ethanol into an advanced biofuel:unprecedented selectivity for n-butanol[J]. Angewandte Chemie International Edition , 2013, 125 (34) : 9175-9178 |
| [13] | XU Guo-qiang, Lammens T, LIU Qiang . Direct self-condensation of bio-alcohols in the aqueous phase[J]. Green Chemistry , 2014, 16 (8) : 3971-3977 DOI:10.1039/C4GC00510D |
| [14] | Wingad R L, Gates P J, Street S T G . Catalytic conversion of ethanol to n-butanol using ruthenium P-N ligand complexes[J]. ACS Catalysis , 2015, 5 (10) : 5822-5826 DOI:10.1021/acscatal.5b01327 |
| [15] | Koda K, Matsu-ura T, Obora Y, et al Ishii Y . Guerbet reaction of ethanol to n-butanol catalyzed by iridium complexes[J]. Chemistry Letters , 2009, 38 (8) : 838-839 DOI:10.1246/cl.2009.838 |
| [16] | Cosimo J I D, Apestegui C R, Gines M J L . Structural requirements and reaction pathways in condensation reactions of alcohols on MgyAlOx Catalysts[J]. Journal of Catalysis , 2000, 190 (2) : 261-275 DOI:10.1006/jcat.1999.2734 |
| [17] | Scalbert J, T-Starzyk F, Jacquot R . Ethanol condensation to butanol at high temperatures over a basic heterogeneous catalyst:How relevant is acetaldehyde self-aldolization[J]. Journal of Catalysis , 2014, 311 (3) : 28-32 |
| [18] | Earley J H, Bourne R A, Watson M J . Continuous catalytic upgrading of ethanol to n-butanol and >C4 products over Cu/CeO2 catalysts in supercritical CO2[J]. Green Chemistry , 2015, 17 (5) : 3018-3025 DOI:10.1039/C4GC00219A |
| [19] | Stevens J G, Bourne R A, Poliakoff M . The continuous self aldol condensation of propionaldehyde in supercritical carbon dioxide:a highly selective catalytic route to 2-methylpentenal[J]. Green Chemistry , 2009, 11 (3) : 409-416 DOI:10.1039/b819687g |




