2. 浙江大学衢州研究院,浙江 衢州 324000
2. Institute of Zhejiang University-Quzhou, Quzhou 324000, China
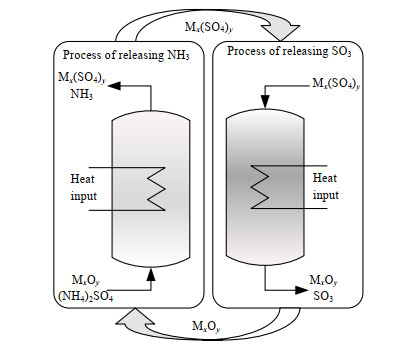
硫酸铵((NH4)2SO4)是生产己内酰胺、烟气脱硫工业过程的副产物,它是一种常用的氮肥,同时也应用于矿石浮选、金属回收等行业 [1-2]。上世纪末,随着尿素的广泛应用,硫酸铵在农业上的应用逐渐减少[3]。此外,根据DU等[4]的研究,大量施用硫酸铵肥料会导致空气中PM 2.5含量升高,这大大限制了其在农业上的使用,而其他行业对硫酸铵的需求较小,不足以消化每年产生的上千万吨的硫酸铵。因此,如果能将硫酸铵回收利用,对我国己内酰胺、烟气脱硫等行业的发展有促进作用。硫酸铵的直接热解过程中会有33.3%的-3价的氮元素被+6价的硫元素氧化成氮气,附加值较高的氨气不能完全回收[5-6]。而采用如图 1所示的化学链循环技术,将(NH4)2SO4与碱性金属氧化物或碱性溶液混合并加热[7],在释放出氨气的同时尽可能将硫元素固定得到硫酸盐。生成的硫酸盐可以在高温下分解为金属氧化物和硫的氧化物,其中金属氧化物作为化学链载体循环利用,硫氧化物可用于制备硫酸。针对上述释氨过程,本课题组提出了一种将硫酸铵与石灰乳混合热解得到氨气和硫酸钙的方法[8],并建立了CaSO4−(NH4)2SO4−NH3−H2O四元系统的非对称E-NRTL热力学模型;此外,在硫酸铵分解方面,范芸珠等[6, 9]利用热重法(TGA)研究了硫酸铵分解的反应动力学;在硫酸铵混合热解方面,曾丽等[10-12]用硫酸铵与金属矿物等混合提取其中的金属或金属氧化物;对于释硫阶段,SCHEIDEMA等[13]研究了不同氛围下硫酸镁的分解温度;张京京等[14-15]研究了硫酸镁热解制备氧化镁过程,得到了最优热解条件。
|
图 1 硫酸铵化学链技术分解流程图 Fig.1 Flow chart of the chemical chain technology for ammonium sulfate decomposition |
综上,硫酸铵热解过程中的释硫阶段的相关研究较为完备,而释氨过程的研究多集中在工业废渣及金属矿物中有价金属的回收,这些过程与回收硫酸铵中的氨气类似,但其关注点在有价金属的回收率而不是氨气的回收率。本文首先通过TGA分析筛选了合适的载体;为了系统地研究(NH4)2SO4与金属氧化物混合热解释氨动力学,克服热重实验中微量硫酸铵与金属氧化物不易混合均匀这一缺点,进行了固定床实验,研究了温度、反应物和载体粒径、反应物摩尔比等对热解释氨反应的影响,得到了相应的反应动力学方程,以期为该工艺的工业化提供指导。
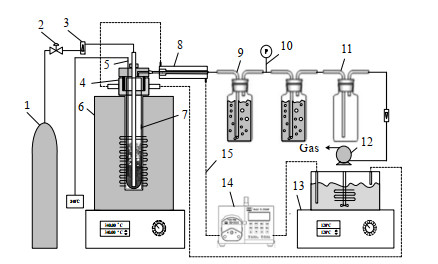
2 实验部分 2.1 药品及仪器硫酸铵为AR级试剂,轻质氧化镁纯度≥99.5%,氧化钙纯度≥98%,氧化铁纯度≥99%。TA-Q500热重分析仪(TA instruments),UV757CRT紫外可见光分光光度计(上海精密科学仪器有限公司),AUTOSORB-1-C气体吸附仪(quantachrome)。固定床实验装置如图 2所示。硫酸铵与载体混合后加入内径3 cm的固定床反应器7中,将反应器密封,开启电阻炉至目标温度。开启氮气阀门2,向固定床中通入适量氮气将热解生成的氨气吹至装有盐酸的吸收瓶9中吸收,吸收后的气体经含有酚酞试剂的检测瓶10进入缓冲瓶11,最后通过真空泵排出。吸收瓶9中的氨氮浓度采用纳氏试剂分光光度法测定。
|
图 2 固定床实验装置 Fig.2 Schematic diagram of the experimental setup of the fixed bed 1. nitrogen cylinder 2. valve 3. flowmeter 4. sealing device 5. thermocouple 6. electric heating furnace 7. quartz tube 8. heater sleeve 9. absorption bottle 10. pressure gage 11. buffer bottle 12. vacuum pump 13. oil-bath 14. peristaltic pump 15. conduction oil |
将(NH4)2SO4分别与Fe2O3、MgO、CaO混合后利用TA-Q500热重分析仪进行分析,得到TG/DTG曲线。分析条件为:氮气流量40mL·min-1,从室温开始以10 ℃·min-1的升温速率升至700 ℃。(NH4)2SO4的加入量为3 mg,(NH4)2SO4与三种金属氧化物的摩尔比为1:1.5。
2.3 固定床实验将MgO与(NH4)2SO4混合进行动力学实验。以(NH4)2Mg2 (SO4)3为中间产物,将实验划分为高温段和低温段,主要考察了反应温度、MgO与(NH4)2SO4的粒径及两者摩尔比对反应速率的影响(见表 1)。固定床实验的条件如未特殊说明,均与表 1相同。
|
|
表 1 实验条件 Table 1 Experiment conditions |
对于粒径影响的考察,固体(NH4)2SO4采用电动振筛机筛分成三组:< 300 μm,300~600 μm,600~900 μm。而新购的MgO为粉末状,平均粒径小于10 μm,须加入少量铝凝胶(质量分数小于3%),在30 MPa下压制10 min,然后放入马弗炉中700 ℃下焙烧4 h,取出后研磨过筛,得到粒径范围分别为125~200 μm、200~300 μm、300~450 μm和600~900 μm的四种MgO。压制后的MgO使用气体分析仪采用气体吸附法分析其比表面积。由分析结果可知,MgO比表面积为40.87m2·g-1。为了将(NH4)2SO4分解完全,每次试验加入MgO 0.15 mol。除了考察摩尔比影响的实验之外,每次加入的(NH4)2SO4量均为0.075 mol。
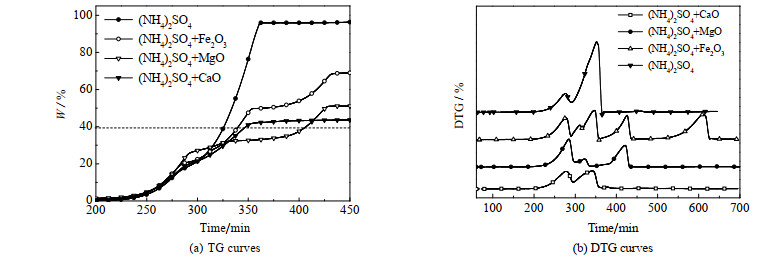
3 实验结果与讨论 3.1 载体筛选对硫酸铵、硫酸铵与氧化铁、硫酸铵与氧化镁和硫酸铵与氧化钙的混合物进行热重分析,得到TG/DTG曲线如图 3所示。图 3(a)的纵坐标为硫酸铵反应的热失重率W,其定义如下:
| $W=\frac{{{w}_{0}}-{{w}_{\text{t}}}}{{{w}_{{{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\text{,0}}}}\times 100%\] $ | (1) |
|
图 3 TG/DTG曲线 Fig.3 Profiles of the TG/DTG results |
式中:w0为加热前加入系统中的反应物重量,wt为加热到t时刻系统中的剩余质量,
时刻加入的硫酸铵质量。图 3(a)中的虚线表示理想情况下热失重率,是指将硫酸铵中的氨气完全释放后的系统失重率,由图可见其值为39.4%。若在回收氨气的过程中+6价的硫元素被还原生成SO2,则热失重率将大于理想值。由图 3可以看出,(NH4)2SO4与Fe2O3混合热解时偏离理想情况的程度较大,即Fe2O3不是一个好的载体。与载体CaO相比,虽然载体MgO偏离理想情况也稍多,但仍在可以接受的范围内。另外,MgSO4的分解温度在1 000 ℃左右[14],与木炭混合后,其分解温度还可以进一步降低至800 ℃[15];而CaSO4在1 500 ℃才开始分解[16]。考虑到释硫过程,本文选择使用MgO为载体进行反应动力学实验。
由图 3(a)可见,200~280 ℃时,四种情况下的热失重曲线(TG曲线)基本重合,说明在此温度范围内反应机理一致,再结合文献[3, 6, 9],可推测出(NH4)2SO4与MgO的热解释氨反应过程可以分为A、B、C、D四步(见表 2)。由表 2可见,以(NH4)2Mg2 (SO4)3为中间产物,可将释氨反应分为低温段(< 370 ℃)和高温段(> 370 ℃)。二者的反应机理和表观动力学方程可能不同。
|
|
表 2 (NH4)2SO4与MgO热解步骤及反应方程式 Table 2 Reaction steps and equations of thermal decomposition of (NH4)2SO4 with MgO |
温度对低温段反应和高温段反应的影响如图 4所示。由图可见,随着温度升高,反应速率加快。达到反应终点时,氨的回收率大于90%,这说明加入氧化镁载体后,+6价的硫元素被载体固定,从而提高了氨气的回收率。这也证明了采用化学链循环方法分解硫酸铵是可靠的。氨气回收率α的计算式如式(2):
| $\alpha = \frac{{{n_{\text{t}}}}}{{{n_0}}} \times 100\% $ | (2) |
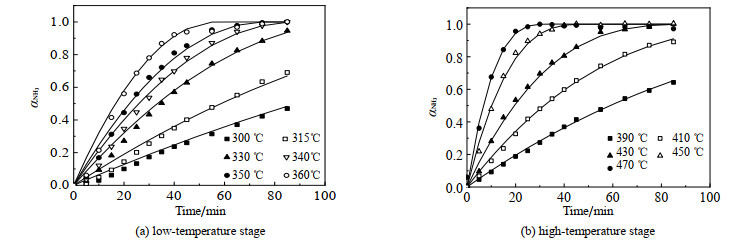
|
图 4 温度对反应速率的影响 Fig.4 Effects of temperature on reaction rates (The solid line represents the fitted value, the scatter represents the experimental value) |
式中:n0为初始时刻系统中加入的硫酸铵的量,nt为
硫酸铵和氧化镁的粒径对低温段和高温段反应的影响如图 5所示。由图可见,无论是低温段还是高温段,硫酸铵和氧化镁的粒径对反应速率几乎没有影响。从热重分析结果及范芸珠等[6]的研究可知,硫酸铵转化为硫酸氢铵(NH4HSO4)过程在300 ℃以下即可较快完成,而低温段的反应温度为370 ℃,因此,该步骤不是本反应的控制步骤。对于NH4HSO4与MgO反应生成(NH4)2Mg2(SO4)3过程以及(NH4)2Mg2(SO4)3继续分解过程,不受反应物和载体粒径的影响,可认为受化学反应控制。由于成型后氧化镁比表面积较大,因此,反应速率常数和氧化镁颗粒粒径无关,而与比表面积有关。
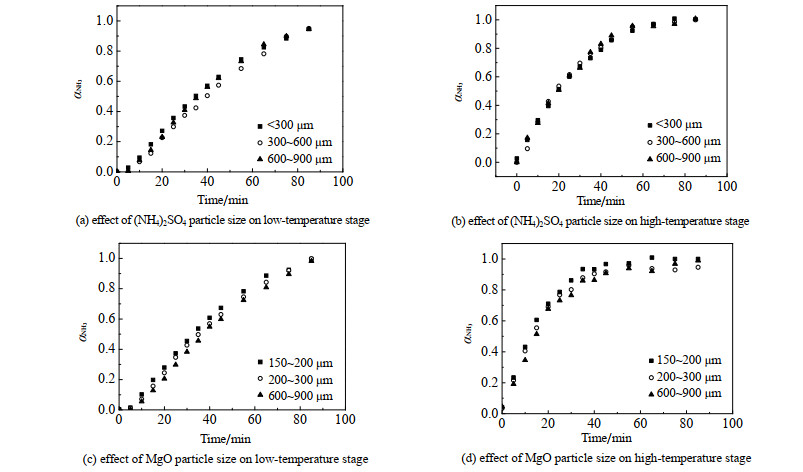
|
图 5 (NH4)2SO4和MgO粒径对反应速率的影响 Fig.5 Effects of (NH4)2SO4 and MgO particle sizes on reaction rates |
MgO与(NH4)2SO4的摩尔比对反应的影响如图 6所示。由图可见,MgO的加入量越多,(NH4)2SO4的分散程度越高,反应速率越快。此外,当MgO与(NH4)2SO4的摩尔比从1.5增加到2、从2增加到3时,对反应速率的影响显著,但从3增加到5时,对反应速率的影响较小。因此,可以推测反应物的摩尔比有一上限,超过此值,反应速率将不再增加。
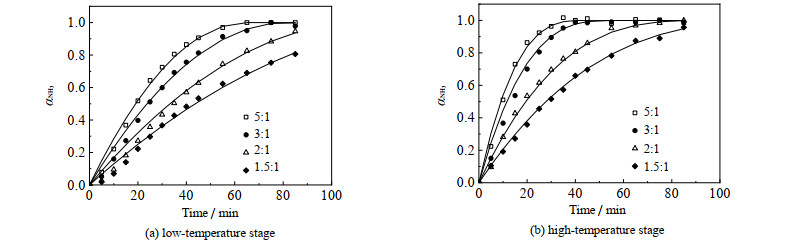
|
图 6 MgO与(NH4)2SO4的摩尔比对反应速率的影响 Fig.6 Effects of molar ratio of MgO to (NH4)2SO4 on reaction rates (The solid line represents the fitted value, and the scatter represents the experimental value) |
(NH4)2SO4与MgO在低温段和高温段的反应动力学方程可以用下式表示[6]:
| $g(\alpha ) = kt$ | (3) |
式中:
借鉴界面化学反应控制的反应动力学方程表观速率常数的表达形式[17],将反应速率常数
| $k = \varphi (T) \cdot \theta (m)$ | (4) |
式中:
| $\varphi (T)=A{{\text{e}}^{-\frac{E}{RT}}}$ | (5) |
式中:
根据实验结果,函数θ(m)的边界条件为m=0时,
| $\theta \left( m \right)=a{{\text{e}}^{-\frac{b}{m}}}$ | (6) |
式中:常数
低温段,(NH4)2SO4先分解,生成熔融态的NH4HSO4,熔融态的NH4HSO4与MgO继续发生反应,生成(NH4)2Mg2 (SO4)3。这个过程由两个反应串联而成,反应速率较慢的为控制步骤。根据相关文献[6],(NH4)2SO4分解得到熔融态的NH4HSO4的反应速率方程的积分形式可以写成:
| $1 - {\left( {1 - \alpha } \right)^{\frac{1}{3}}} = {k_1}t$ | (7) |
熔融态的NH4HSO4与MgO的反应可以看作有固体产物的浸出反应[17],若反应由液体边界层的扩散控制,机理函数可写为:
| $\alpha = {k_2}t$ | (8) |
若反应由固体产物层的扩散控制,则机理函数可写为:
| $1 - \frac{2}{3}\alpha - {\left( {1 - \alpha } \right)^{\frac{2}{3}}} = {k_3}t$ | (9) |
若反应由界面化学反应控制,则机理函数可写为:
| $1 - {\left( {1 - \alpha } \right)^{\frac{1}{3}}} = {k_4}t$ | (10) |
其中,
|
|
表 3 低温段不同机理反应动力学方程拟合的相关系数 Table 3 Correlation coefficients of the reaction kinetics fitted by diverse mechanism functions at low temperature stage |
由表中相关系数的大小可以看出,低温段的机理函数与界面化学反应控制的液-固反应机理函数相符程度较高,这与上文的分析一致,故认为其反应动力学方程可以用式(11)表示,kl为低温段的反应速率常数。
| $1 - {\left( {1 - \alpha } \right)^{\frac{1}{3}}} = {k_l}t$ | (11) |
对于高温段,表 2中的步骤C为固-固非均相反应,步骤D为固相分解为气相和固相的反应。对前者,可将实验结果直接用不同的反应机理方程进行拟合[18],结果见表 4。对后者,可根据文献[17]中的有固体产物层的颗粒气体反应模型进行拟合,具体就是,由于反应过程为固相分解为气相和固相、气相扩散至固相表面的过程,因此,反应可能为化学反应控制或扩散控制的过程,前者的机理方程模型与固-固反应中的三维界面反应模型相同,后者的机理方程则与固-固反应中的一维界面反应相同,拟合结果见表 4。由表中相关系数的大小可以看出,高温段的机理函数与表面反应控制的固-固反应过程或固体分解过程机理函数相符程度较高,故认为高温段的反应动力学方程可用式(12)表示,kh为高温段的反应速度常数。
| $1-{{\left( 1-\alpha \right)}^{\frac{1}{3}}}={{k}_{\text{h}}}t$ | (12) |
|
|
表 4 高温段不同机理反应动力学方程拟合的相关系数 Table 4 Correlation coefficients of the reaction kinetics fitted at high temperature stage |
先将实验值代入机理函数,得到不同温度下的
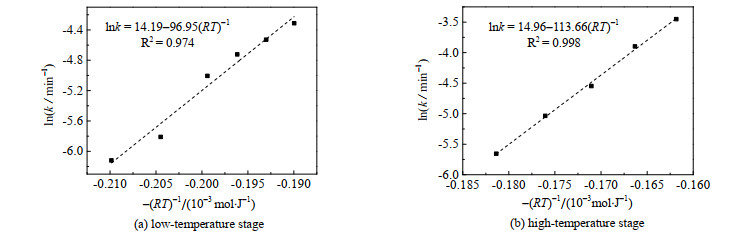
|
图 7 不同温度下Arrhenius方程拟合 Fig.7 Fitting results of Arrhenius equation under different temperatures |
用相同的方法对反应物摩尔比进行拟合,拟合直线如图 8所示。由图可得,经验参数bl=1.808,bh =2.497。将拟合得到的低温和高温段的活化能、经验参数bl和bh代入式(4),并结合图 7和图 8拟合得到的反应速率随温度、粒径的变化关系,可以得到低温段和高温段的反应动力学方程如下:
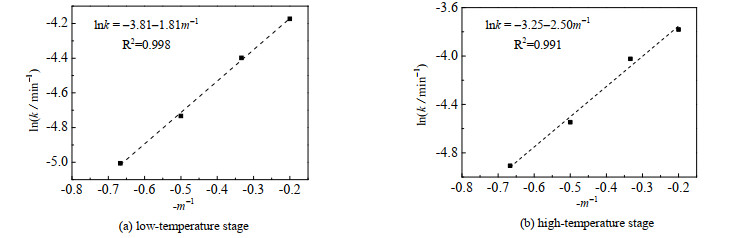
|
图 8 不同反应物摩尔比下类Arrhenius方程拟合 Fig.8 Fitting results of Arrhenius-like equation under different reactant molar ratios |
低温段:
| $1-{{\left( 1-\alpha \right)}^{\frac{1}{3}}}={{k}_{\text{l}}}t,{{k}_{\text{l}}}=3.6\times {{10}^{6}}\times {{\text{e}}^{-\frac{{{96}_{{}}}950}{RT}}}\times {{\text{e}}^{-\frac{1.808}{m}}}$ | (13) |
高温段:
| $1-{{\left( 1-\alpha \right)}^{\frac{1}{3}}}={{k}_{\text{h}}}t,{{k}_{\text{h}}}=1.02\times {{10}^{6}}\times {{\text{e}}^{-\frac{{{113}_{{}}}656}{RT}}}\times {{\text{e}}^{-\frac{2.497}{m}}}$ | (14) |
采用热重法对硫酸铵与Fe2O3、MgO、CaO混合热解过程进行实验分析,筛选出了适合作为载体的MgO;对硫酸铵分解反应中的释氨过程进行了固定床实验,得到了释氨过程中的反应动力学方程。结果表明,释氨过程为反应控制过程,温度及反应物摩尔比对反应速率均有影响,反应物和载体的粒径对反应速率基本无影响。
低温段反应动力学方程为
高温段反应动力学方程为
| [1] |
周绿山, 明大增, 李志祥, 等. 硫酸铵的应用研究进展[J]. 化学工程师, 2013, 27(5): 60-62, 78. ZHOU L S, MING D Z, LI Z X, et al. Development of application for ammonium sulfate[J]. Chemical Engineer, 2013, 27(5): 60-62, 78. |
| [2] |
郭宏飞, 郭宝曼, 张菁, 等. 35 ℃时Na2SO4-MgSO4-(NH4)2SO4-H2O体系相图及其应用[J]. 高校化学工程学报, 2015, 29(2): 264-269. GUO H F, GUO B M, ZHANG J, et al. Phase diagram of a Na2SO4-MgSO4-(NH4)2SO4-H2O system at 35 ℃ and its application[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(2): 264-269. |
| [3] |
SONG X F, ZHAO J, LI Y Z, et al. Thermal decomposition mechanism of ammonium sulfate catalyzed by ferric oxide[J]. Frontiers of Chemical Science and Engineering, 2013, 7(2): 210-217. |
| [4] |
DU J, ZHANG X, HUANG T, et al. Removal of PM2.5 and secondary inorganic aerosols in the North China Plain by dry deposition[J]. Science of the Total Environment, 2019, 651: 2312-2322. DOI:10.1016/j.scitotenv.2018.10.024 |
| [5] |
KIYOURA R, URANO K. Mechanism, kinetics, and equilibrium of thermal decomposition of ammonium sulfate[J]. Industrial and Engineering Chemistry: Process Design and Development, 1970, 9(4): 489-494. DOI:10.1021/i260036a001 |
| [6] |
范芸珠, 曹发海. 硫酸铵热分解反应动力学研究[J]. 高校化学工程学报, 2011, 25(2): 341-346. FAN Y Z, CAO F H. Thermal decomposition kinetics of ammonium sulfate[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(2): 341-346. |
| [7] |
ZENG L, CHENG Z, FAN J A, et al. Metal oxide redox chemistry for chemical looping processes[J]. Nature Reviews Chemistry, 2018, 2(11): 349-364. DOI:10.1038/s41570-018-0046-2 |
| [8] |
PAN T, LIU Y, QIN W, et al. Thermodynamic modeling of CaSO4-(NH4)2SO4-NH3-H2O quaternary system with asymmetric E-NRTL model[J]. Industrial and Engineering Chemistry Research, 2019, 58(16): 6811-6821. DOI:10.1021/acs.iecr.9b00454 |
| [9] |
潘腾, 成有为, 王丽军, 等. 多重扫描速率法的硫酸铵热分解动力学[J]. 高校化学工程学报, 2019, 33(5): 1086-1091. PAN T, CHENG Y W, WANG L J, et al. Thermal decomposition kinetics of ammonium sulfate studied with multiple scanning methods[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(5): 1086-1091. |
| [10] |
曾丽, 孙红娟, 彭同江. 硫酸铵焙烧活化石棉尾矿提取镁实验研究[J]. 非金属矿, 2012, 35(2): 8-11. ZENG L, SUN H J, PENG T J. Research of magnesium extracted from asbestos tailings by ammonium sulfate calcination method[J]. Non-Metallic Mines, 2012, 35(2): 8-11. |
| [11] |
COLINA F G, ABELLAN M N, CABALLERO I. High-temperature reaction of kaolin with ammonium sulfate[J]. Industrial and Engineering Chemistry Research, 2006, 45(2): 495-502. DOI:10.1021/ie050872f |
| [12] |
朱国才, 李赋屏, 肖明贵. 采用硫酸铵焙烧方法从低品位碳酸锰矿中富集回收锰[J]. 桂林工学院学报, 2005, 25(4): 534-537. ZHU G C, LI B P, XIAO M G. Process of enriching and recovering Mn by roasting the low-grade manganese carbonate ore with ammonium sulfate[J]. Journal of Guilin University of Technology, 2005, 25(4): 534-537. |
| [13] |
SCHEIDEMA M N, TASKINEN P. Decomposition thermodynamics of magnesium sulfate[J]. Industrial and Engineering Chemistry Research, 2011, 50(16): 9550-9556. DOI:10.1021/ie102554f |
| [14] |
张京京, 冯雅丽, 李浩然. 硫酸镁直接热解制备氧化镁的研究[J]. 无机盐工业, 2010, 42(5): 11-14. ZHANG J J, FENG Y L, LI H R. Preparation of magnesia by solid phase direct decomposition of magnesium sulfate[J]. Inorganic Chemicals Industry, 2010, 42(5): 11-14. |
| [15] |
张萍, 冯雅丽, 李浩然, 等. 硫酸镁还原热解制备高纯氧化镁[J]. 中南大学学报(自然科学版), 2011, 42(9): 2595-2599. ZHANG P, FENG Y L, LI H R, et al. Preparation of high-purity magnesia by solid phase reduction decomposition of magnesium sulfate[J]. Journal of Central South University (Science and Technology), 2011, 42(9): 2595-2599. |
| [16] |
YAN Z Q, WANG X F, WANG Z A, et al. Kinetic model for calcium sulfate decomposition at high temperature[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(10): 3490-3497. DOI:10.1016/S1003-6326(15)63986-3 |
| [17] |
华一新. 冶金过程动力学导论[M]. 北京: 冶金工业出版社, 2004. HUA Y X. Introduction to metallurgical process dynamic[M]. Beijing: Metallurgical Industry Press, 2004. |
| [18] |
杨秀山, 邓少刚, 黄鹏辉, 等. 硫化钙磷石膏固固反应的热分析动力学[J]. 高校化学工程学报, 2016, 30(3): 588-596. YANG X S, DENG S G, HUANG P H, et al. Thermal analysis kinetic studies on solid-solid reaction of calcium sulfide and phosphogypsum[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(3): 588-596. |




