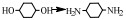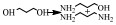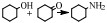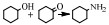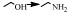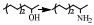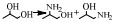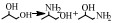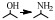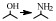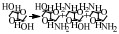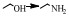2. 浙江大学生物质化工教育部重点实验室,浙江大学 化学工程与生物工程学院 浙江 杭州 310027
2. Key Laboratory of Biomass Chemical Engineering of the Ministry of Education, College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China
胺类物质(包括伯胺、仲胺、叔胺)是一种重要的化工产品,作为中间体化合物广泛用于医药、农用化学品、表面活性剂、橡胶、固化剂、交联剂等众多领域。此外,许多胺类物质在生物、生命科学领域也扮演着十分重要的角色。而在众多的胺类化合物中,伯胺因具有广泛衍生性被认为是最重要的一类有机胺[1]。
胺类物质的合成方法很多,例如卤代烃氨(胺)解[2, 3]、腈类化合物加氢[4, 5]、烯烃氨(胺)化[6, 7]、硝基芳香化合物还原[8, 9]、醛/酮[10~12]以及醇[10, 13~16]的还原胺化等。随着石油工业的不断完善和生物质制备醇类化合物[17, 18]技术的发展,醇的胺化反应因其具有来源广、原料成本低、生产工艺简单等优点而成为胺合成最有效、最有应用潜力的方法之一[19]。根据反应机理,醇的胺化可以分为缩合胺化法和还原胺化法。缩合胺化法使用的催化剂一般是脱水催化剂(包括沸石分子筛[20]、金属氧化物及其混合物[21]等),醇胺化催化剂的研究就是始于金属氧化物催化剂。早在1909年,Sabatier等[22]首次以醇为原料,在氧化钍催化剂的作用下得到了伯胺、仲胺和叔胺的混合物。此后,脱水催化剂在醇胺化体系的研究与应用越来越多,并成功用于工业化生产。例如工业上甲醇胺化制备甲胺(甲胺、二甲胺和三甲胺的统称),常用的催化剂有氧化铝、氧化硅、氧化铬等物质及其混合物,反应通常在250~500℃,NH3压0.5~5.0 MPa下进行的[23~25]。但是由于此类反应往往需要在较高的温度下进行,原料醇在高温下存在热稳定性问题,选择性也较难以调控,因此只能用于少数碳数较少的醇胺化制备伯胺、仲胺和叔胺的混合物,并不适用于一般的选择性合成伯胺。而还原胺化法使用的催化剂一般是金属加氢/脱氢催化剂,包括均相的金属配合物催化剂[26~30]以及非均相的负载型/非负载型金属催化剂[16, 31, 32],他们在醇的胺化反应中适用性更广,并且对于醇与氨反应选择性制备伯胺有着较好的效果。均相金属催化剂主要应用于氢转移胺化方面[33~36]对伯胺的选择性高,但是通常使用的都是Ru[15, 26, 37, 38]、Ir[28, 29, 39]等贵金属,也存在产品分离、催化剂重复使用等方面的问题,有些均相催化剂的反应体系中还需要加入酸、碱、盐等助催化剂[16, 40]。因此,从环境和经济方面来看,可重复利用的非均相金属催化剂的研究显得尤为重要[40]。
本文将对近年来醇还原胺化合成伯胺的研究进行综述,重点阐述醇胺化反应机理以及非均相催化体系,同时对醇与氨还原胺化制伯胺的前景进行展望。
2 醇胺化反应机理缩合胺化法与还原胺化法是醇胺化制备胺类化合物的主要方法[41]。缩合胺化法使用的是脱水催化剂,如沸石分子筛、金属氧化物(氧化铝、氧化硅、氧化铬、二氧化钛)等,人们对其催化反应机理研究较多,先后提出了经历烷基钍酸酯、醚、烯烃等中间体以及直接取代的反应过程,尽管具体历程不尽相同,但总体看来该反应是醇与氨(胺)的脱水缩合反应,其反应产物受热力学控制,通常得到伯胺、仲胺和叔胺的混合物[21] (图 1)。
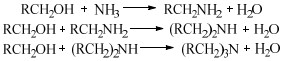
|
图 1 醇与NH3生成伯胺、仲胺和叔胺的反应路径[21] Fig.1 Reaction pathway between alcohols and NH3 to prepare primary amines, secondary amines and tertiary amines[21] |
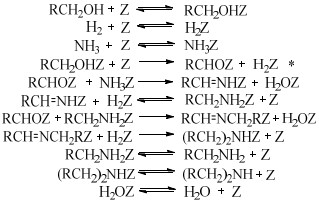
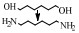
还原胺化法使用的是金属加氢/脱氢催化剂,包括均相的金属配合物催化剂以及非均相的负载型/非负载型金属催化剂。醇的还原胺化反应也可以称为醇的脱氢胺化反应,这是由其机理决定的[10]。早期的醇还原胺化是醇与NH3在氢气气氛中由非均相金属催化剂催化的反应,其催化机理最早是由Schwegler等[42]在1939年提出的,他们以雷尼镍为催化剂催化醇与NH3在氢气条件下胺化合成有机胺,提出了“脱氢-亚胺化-加氢胺化”的反应机理,即在脱氢/加氢催化剂的催化作用下,醇首先通过脱氢生成醛或者酮,醛/酮中间体与NH3或者有机胺脱水缩合生成亚胺或希夫碱,最后通过催化加氢还原成为胺。随后,Bashkirov等[21]的一系列工作进一步证实了脱氢-亚胺化-加氢的机理。他们在乙醇的胺化反应中研究发现,乙醇首先经历脱氢,脱氢的步骤包含一个α-氢的提取过程,并且这一步是速率控制步,而β-氢原子的脱去并不包含在速率控制步骤中,其反应历程如图(图 2)。其中,Z代表催化剂的活性中心,*代表的是速率控制步骤。
尽管研究者们一致认为醇的还原胺化反应中间体是醛或酮,但是直到1983年,Baiker等[43]才从醇胺化反应中分离出中间体醛,他们的研究证实了这一反应机理的确定性。此外,在还原胺化中,值得注意的是,以非均相金属加氢/脱氢催化剂催化醇还原胺化的反应通常都是在一定的氢气压力下进行的,这是因为氢气既是亚胺中间体生成胺的还原剂,同时也是防止催化剂因生成金属氮化物、金属碳化物或者结焦失活的保护气[10, 13, 32, 44~46],此外氢气也是调控反应中伯胺选择性的重要因素[13, 47, 48]。
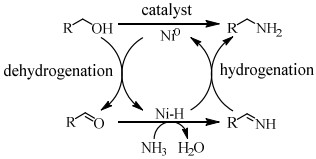
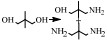
近年来,氢转移胺化成为醇胺化领域的新焦点,与传统的还原胺化反应相比,氢转移胺化不需要额外提供氢气作为亚胺中间体的还原剂,在催化剂作用下,醇脱氢形成活泼的羰基化合物,脱下来的“氢”暂时与催化剂形成氢化物过渡结构,然后催化剂再将“氢”还给羰基化合物与氨(胺)结合形成的中间体亚胺,实现氢转移,从而得到目标产物胺[16]。也就是说,在反应过程中会形成氢转移循环,即反应物不断进行给出氢和消耗氢的反应,因此氢转移机理又称为“借氢”机理[34, 35]。氢转移反应最大的优点是原子经济性高[34],除此之外,反应中只生成水这一种副产物是其另一优点[49, 50]。氢转移机理的研究是从均相催化剂催化的醇与有机胺的胺化反应开始的,由Grigg等[27]和Watanabe等[37]在1981年分别报道的。但是,相对于NH3来说,有机胺的亲核性更强,也就是说醇与NH3的反应相对于有机胺来说更难一些。而对于醇与NH3氢转移胺化制备伯胺的研究,最早则是在2008年由Gunanathan等[14]报道的,他们使用Ru-PNP配合物为催化剂,成功催化伯醇与NH3反应制备伯胺。此后,用于催化醇的氢转移胺化反应的催化剂大多是Ru [15, 26, 37, 38]、Ir[28, 29, 39]等金属配合物。近些年,非均相催化剂用于氢转移胺化反应的研究也有了一定的进展[16, 40, 51],Shimizu等[16]报道了负载型金属催化剂Ni/Al2O3催化醇与氨反应直接合成伯胺的研究。他们提出该反应机理的假设,认为反应开始时醇通过Ni(0)活性位点脱氢得到羰基化合物,该羰基化合物与NH3反应形成亚胺,最后氢从Ni-H中转移出来与亚胺反应生成伯胺(图 3)。
从反应机理来看,氢转移胺化实际上也是还原胺化的一类,总体上都是底物醇通过脱氢-亚胺化-加氢的过程得到目标产物胺。
3 非均相催化剂在醇的还原胺化反应中的应用非均相金属催化剂反应条件相对温和,对伯胺的选择性较好,反应后处理容易且可以重复利用,因此越来越多地应用于醇与氨还原胺化反应制备伯胺。当前醇与氨还原胺化制伯胺反应体系中常用的金属活性组分有Rh、Ru、Pt等贵金属,以及Co、Ni、Cu等非贵金属,相对于前者,非贵金属的催化剂由于在还原胺化反应中活性较高,对伯胺的选择性更好,价格相对便宜,因此应用更为广泛。表 1对近30年来非均相金属催化剂在醇与氨还原胺化制备伯胺反应中的应用进行了总结,并从催化剂种类、模型反应、溶剂、NH3和H2压力、反应温度及时间等方面进行了分类比较。
|
|
表 1 醇与NH3还原胺化合成伯胺的反应 Table 1 Reductive amination of alcohols with ammonia to synthesize primary amines |
Ni基催化剂在醇的还原胺化反应中活性较好,对伯胺的选择性高,因此应用的最多。早在1990年,Baiker等[13]报道了Ni/SiO2催化1-甲氧基-2-丙醇(MPOL)与NH3还原胺化反应的研究,在反应温度190℃,MPOL:NH3:H2摩尔比为1:8:2,空速40.5 g·g-1·h-1的条件下,MPOL的转化率达到70%,伯胺产物2-氨基-1-甲氧基丙烷的选择性达82.9%。他们研究了反应温度、底物与氢、氨的摩尔比以及质量空速等反应参数对催化剂性能的影响,当反应温度在130~190℃,底物醇的转化率与伯胺的选择性随着温度的升高而增大,但是当温度大于190℃时,尽管MPOL的转化率继续增大,但是由于甲氧基裂解产物的生成导致伯胺的选择性降低;当NH3与MPOL摩尔比增加即反应体系中加入过量的氨时,醇的转化以及伯胺的选择性均增大;而H2与MPOL摩尔比的变化几乎不影响该反应的转化率和选择性,但是当反应体系中没有氢时,催化剂逐渐失活,而在重新通入氢气后催化剂的活性和选择性恢复至初始状态。
Fischer等[57]以Ni/SiO2为催化剂,1, 3-丙二醇、2-甲基-1, 3-丙二醇、2, 2-二甲基-1, 3-丙二醇为底物,研究了2号位上的碳被不同个数的甲基取代后对还原胺化反应的影响。实验结果表明,二胺的选择性很大程度取决于底物醇的结构,其中2, 2-二甲基-1, 3-丙二醇氨化生成相应的二胺(收率53%)和氨基醇(收率5%),而在相同的反应条件下2-甲基-1, 3-丙二醇和1, 3-丙二醇的氨化反应产物中二胺和氨基醇的选择性较低,因为这些二醇更容易发生降解反应,特别是直接脱水生成烯烃,而2, 2-二甲基-1, 3-丙二醇2位碳上由于没有氢原子所以不可能发生降解反应。
为了研究Ni负载量对催化剂性能的影响,Shin等[47]采用等体积浸渍法制备了五种不同负载量4%~27%(wt)的Ni/γ-Al2O3用于催化异丙醇与NH3还原胺化合成异丙胺的反应。结果显示,当Ni的负载量为17%(wt)时金属Ni在载体γ-Al2O3上有较好的分散度,金属的还原度最高,因此异丙醇转化率也最高。此外,通过XPS表征研究了在没有氢气条件下催化剂失活的原因,表征结果显示,没有氢气的保护,催化剂活性组分与NH3反应形成了金属氮化物,从而导致失活。该课题组还研究了负载在五种不同形态Al2O3载体上的Ni基催化剂对该反应的影响[65]。结果表明载体形态对催化剂理化性质和催化性能有一定的影响,在相同反应条件下五种不同催化剂活性按从小到大的顺序为:Ni/δ-Al2O3 < Ni/κ-Al2O3 < Ni/θ-Al2O3 < Ni/γ-Al2O3 < Ni/η-Al2O3,其中Ni/η-Al2O3和Ni/γ-Al2O3在该反应中表现出良好的催化性能。Ni/η-Al2O3催化剂中的Ni粒径最小,具有较大的金属分散度,因而有最好的催化性能。另外,他们认为该催化剂表面Lewis酸性位点的数量较多与异丙胺的选择性较高有一定的关系。
最近,Shin等[69]又将Ni/Al2O3催化剂用于乙醇与NH3还原胺化制乙胺的反应中,研究了NH3、H2的分压对还原胺化反应的影响。当反应体系中不存在NH3时,乙醇主要发生脱水反应生成乙烯,而当反应体系中不存在H2时,由于亚胺中间体的脱氢反应使得乙腈的选择性增大,降低了胺类物质(乙胺、二乙胺、三乙胺)的选择性。反应体系中NH3分压增大时乙胺的选择性增大,而H2压增加使得三种胺的总选择性增大。
通过以上的研究可以看出,在醇与氨还原胺化制伯胺体系中,温度、氢压、氨压、底物醇的结构、催化剂等都对催化反应有着重要的影响。在醇的还原胺化反应中,较高的温度有利于脱氢步骤的发生,但是过高的温度也会使底物醇发生其他副反应(如裂解、脱水等)从而导致伯胺的选择性降低;向反应体系中加入过量的氨可以在一定程度上抑制仲胺、叔胺的生成,从而增加伯胺的选择性;此外,尽管醇的还原胺化反应不消耗氢,但是氢气的存在可以避免金属氮化物的形成,防止催化剂失活。同时,催化剂载体的比表面积、孔容及酸碱度等性质由于会影响金属分散度和抗烧结能力,因此也会对催化剂的活性和选择性产生影响。
最近,Shimizu等[16]报道了非均相金属催化剂用于氢转移还原胺化制备伯胺的反应,他们制备了一系列不同载体负载的金属催化剂,并用于催化2-辛醇与NH3反应制备伯胺的反应。通过将不同金属负载在γ-Al2O3载体上,发现Ni相对于贵金属(Pt、Re、Au等)和Cu、Co来说,催化氢转移胺化的活性更好,且2-辛胺选择性非常高(选择性95.6%)。此外,通过与雷尼镍对比,发现负载型Ni催化剂的活性与载体有关,于是他们进一步研究了不同载体负载的Ni催化剂的催化氢转移胺化性能,将不同载体的影响归因于载体酸碱性位点的差异,并初步假设氧化铝的碱性位可能有助于从醇中提取质子而促进脱氢步骤,而酸性位可能与氢转移步骤有关。此外,该课题组还通过离子交换法制备了Ni/CaSiO3催化剂,并成功用于多种不同的脂肪醇和芳醇氢转移胺化制伯胺的反应[51]。
相对于传统的还原胺化反应来说,氢转移胺化反应最大的优点是原子经济性高,另外避免高压H2的使用也使生产环境更安全。氢转移胺化催化剂能够催化醇与NH3反应高选择性的制备伯胺,为伯胺的合成提供了一种高效、经济的方法,但是就目前来说,非均相的金属催化剂在氢转移胺化反应的研究还处于初步阶段,主要原因还是在于无氢条件下催化剂的失活问题。
3.1.2 改性Ni催化剂Shin等[66]在研究了金属负载量以及载体形态对异丙醇与NH3还原胺化反应的影响后,对双金属催化剂Ni-Fe/γ-Al2O3中Ni/Fe摩尔比对催化剂活性的作用进行了研究。他们通过等体积浸渍法制备了一系列Fe/Ni不同摩尔比(0~0.7)的17%(wt) Ni-Fe/γ-Al2O3双金属催化剂,通过XRD表征发现还原后的催化剂有Ni-Fe合金生成。H2-TPR表征显示,与单金属的Ni/γ-Al2O3相比双金属催化剂中Ni的还原度明显增加,还原温度下降。进一步通过XPS表征催化剂中Ni0组分含量与Fe的加入量的关系发现Ni0组分的含量随着Ni/Fe摩尔比的变化而变化,当Ni/Fe摩尔比为0.3时,催化剂表面Ni0组分含量达最多且有最好的还原能力。在使用Ni/Fe摩尔比为0.3的催化剂时,异丙醇的转化率以及目标产物异丙胺的选择性均达到最大,并且在氢气存在下连续反应100 h催化剂也没有明显的失活现象。
Cui等[49]通过共沉淀法制备了一种在空气中稳定的Ni基多金属催化剂NiCuFeOx,并成功用于催化醇与NH3、伯胺和仲胺的还原胺化反应。在研究醇与NH3的反应时,为了控制NH3的用量,以碳酸铵为NH3源,发现在等摩尔量的醇与氨反应时产物主要是相应的仲胺。因此,为了选择性的制备伯胺,使用过量的NH3,即底物醇在1.0 MPa NH3下反应12 h,取得了较好的伯胺产率(59%~77%)。值得注意的是,反应是在无氢气条件下进行的,也就是通过氢转移机理实现的还原胺化反应,并且催化剂可以重复使用多次,这无疑为非均相金属催化剂催化的醇与NH3通过氢转移胺化制备伯胺提供了新的思路。
3.2 Co系催化剂上醇还原胺化制备伯胺 3.2.1 Co单组分催化剂Sewell等[31]研究了Co/SiO2催化乙醇与NH3还原胺化的反应,并与Ni/SiO2进行了比较。研究发现,增加反应物停留时间,两种催化剂催化乙醇的转化率均增加,且同一空速下,钴催化剂效果比镍好,对于伯胺的选择性也更好。降低氢压,乙醇的转化率下降,钴催化下降低的更多,可能是由于钴更易与氨形成钴氮化物。而且降低氢压的同时,胺类物质的选择性下降,因为生成了副产物醚类物质,但是三种胺类产物中,伯胺的选择性相对增加,而二乙胺和三乙胺的选择性相对降低。增加氨气分压,乙醇的转化率下降,可能是因为氨气量增加,金属氮化物增加,导致催化剂脱氢活性降低,同时伯胺的选择性增加,二乙胺和三乙胺的选择性降低。另外,作者认为产物的选择性还受活化过程和载体类型的影响,增加载体的酸度有利于乙胺的形成,这可能是由于产物二乙胺在载体的酸性位点可以发生歧化反应产生乙胺而造成的[52]。
负载型Co/Al2O3对异丙醇与NH3气相反应制异丙胺有较好的活性,产物伯胺选择性较好。Shin等[48]研究发现,随着Co负载量增大,异丙醇转化率和异丙胺收率显著增大,负载量达23%后转化率和选择性稍有降低,表明负载量为23%(wt)的Co/Al2O3催化活性最好。在没有氢气的情况下,催化剂逐渐失活,底物醇转化率迅速降至10%以下,通入氢气后催化剂的活性和选择性恢复至初始状态。这与前面提到的Baiker等[13]在研究H2的存在与否对Ni/SiO2影响的结果一致。究其原因是因为氨在金属表面强吸附形成的金属氮化物导致催化剂失活,而过量的氢能避免金属氮化物的形成,防止催化剂失活。
3.2.2 改性Co催化剂Fischer等[56]以Fe改性的Co催化剂(95%(wt) Co-5%(wt) Fe)对1, 3-丙二醇和2, 2-二甲基-1, 3-丙二醇在超临界氨(scNH3)体系中的还原胺化反应进行了研究,发现超临界氨体系下,反应物与NH3、H2共同形成均相的体系,促进了反应的传质传热过程,并且提供了非常高的催化剂表面NH3量,大大抑制了氢解等副反应,从而提高了目的产物二胺的选择性,反应体系中少量的H2(NH3/H2=60/1)即可抑制催化剂的失活。接着他们又将95%(wt) Co-5%(wt) Fe用于催化1, 4-环己二醇气相还原胺化制备1, 4-环己二胺的研究[55],发现氨的量越大,接触时间越短,目的产物氨基醇和二胺的选择性越好。在165℃反应时氨基醇收率最高为32%,在185℃反应时二胺收率最高为54%。当1, 4-环己二醇的转化率为76%时,氨基醇和二胺的总选择性最高可以达到97%。
为了详细研究Co-Fe催化剂与超临界NH3体系对二醇类物质还原胺化制备伯胺的影响,Fischer等[54]以1, 3-丙二醇为模型反应进行了系统的研究。首先,通过对反应产物分布的研究发现,超临界NH3反应体系的使用,明显的提高了伯胺产物的选择性,同时抑制了聚合、裂解等副反应。而助剂Fe的加入可以使Co含有更多亚稳态fcc晶型的β-Co(该作者认为这种晶型明显比更为稳定的hcp晶型的α-Co活性更好),因而具有更高活性。此外,Fe的添加量也有影响,Fe的量大于5%时,金属会形成Co-Fe合金(钴铁矿)也会导致催化剂的活性下降。最后,通过NaOAc和(NH4)2HPO4对Co-Fe催化剂进行处理,研究了酸碱性对催化剂性能的影响,结果证明无论是酸性还是碱性的改变,都会降低催化剂的性能,原因不仅在于酸碱性位点会促进裂解、聚合等副反应的发生,也会使催化剂中α-Co的含量增加,甚至会有Co的磷酸盐生成。
为了进一步研究底物醇的影响,Fischer等[58]继续采用Co-Fe催化剂以及超临界氨体系,对1, 3-环己二醇和2, 4-戊二醇的还原胺化进行了研究。结果证明,仲醇与氨的还原胺化反应活性明显要比伯醇高,但是选择性却较低,而选择性主要取决于底物醇是否容易发生脱水反应。
Zhao等[62]在Co-Ba/γ-Al2O3催化1, 2-丁二醇气相还原胺化制备2-氨基-1-丁醇的基础上进一步合成了一系列改性的Co-Ba/γ-Al2O3催化剂,他们将Sr、Ni、Ca、Zn、La、Fe、Mg、Zr、Mn和Cr等金属分别掺杂进Co-Ba/γ-Al2O3催化剂中,其中Co-Ba-Fe/γ-Al2O3表现出最好的催化性能。通过XRD、XPS和TPR等表征发现,催化剂在加入Fe后会形成Co7Fe3晶粒,它不仅改变了Co的催化性能也抑制了CoAl2O4的形成,因此提升了催化剂的稳定性以及还原性。在最优的反应条件下,Co-Ba-Fe/γ-Al2O3催化1, 2-丁二醇在氢气氛中氨化反应100 h,底物醇的转化率维持在67.4%~72.9%,目标产物选择性保持在73.3%以上。
3.3 贵金属催化剂上醇还原胺化制备伯胺贵金属由于具有非常好的加氢/脱氢活性,在醛、酮、醇与有机胺反应制备仲胺或者叔胺的反应中应用十分广泛,但是在醛、酮和醇与NH3还原胺化反应制备伯胺中应用较少。本课题组在异佛尔酮腈氢氨化制备异佛尔酮二胺的一系列研究中也发现,贵金属催化剂相对于Ni、Co等催化剂来说活性和选择性都没有优势[5, 70]。
醇与NH3的还原胺化反应催化剂中,Ru是用的最多的金属。Zhao等[67]研究了1, 6-己二醇在超临界氨体系中的反应,考察了负载型的Ru、Pt、Pd等催化剂的活性。在这些催化剂中,Ru/Al2O3表现出较高的催化活性和对1, 6-己二胺的选择性,作者认为是由于Ru的分散度较大以及催化剂表面的特性如酸碱性引起的。另外,在Co/Al2O3催化下目标产物选择性为35.8%,与Ru/Al2O3催化下的选择性(38.4%)相差无几。
Ruiz等[32]研究了不同贵金属催化剂(Ru/C、Pd/C、Ir/C、Pt/C、Os/C)对于十二醇与氨还原胺化合成十二胺的催化效果。以Ru/C为催化剂,十二醇在150℃,0.4 MPa NH3,0.2 MPa H2的条件下反应24 h,十二胺的收率达到83.8%。他们研究了氢压和氨压对反应的影响,在NH3均过量的情况下(为了抑制仲胺的生成),改变NH3的压力对反应的转化率与选择性没有明显的影响;在没有引入氢气时,十二醇的转化率和十二胺的选择性相对较低,主要的副产物是十二腈,而在反应体系中引入氢气后,醇转化率和十二胺选择性均有所提高,但是当氢气压力过高,十二醇裂解生成大量十一烷而导致十二胺的选择性降低。此外,实验发现Ru/C催化剂的失活是由于表面结焦。
Rose等[68]将Ru/C、Pd/C、Pt/C等商业催化剂用于催化生物质二醇(异甘露糖醇、异山梨醇等)与氨水还原胺化合成醇胺或二胺的反应。研究发现,在以水为溶剂,140~180℃的反应条件下,Pd/C基本没有活性,Pt/C活性也非常低,而Ru/C被证明是活性最好的催化剂。以Ru/C为催化剂,1 MPa H2,1 g 25% (wt)氨水,在170℃下反应6 h,醇胺与二胺的总收率达到45%。
Becker等[59]将Ⅷ族金属(Pd,Ru,Rh,Pt等)催化剂用于催化环己醇/环己酮质量比为9:1的混合物的气相还原胺化反应。作者发现该反应受热力学的控制:改变反应温度可以选择性地制备环己胺和苯胺。在较低的温度下(≤ 250℃)环己醇首先脱氢生成环己酮,进一步与NH3缩合成中间体环己亚胺,再加氢生成环己胺;而当温度高于250℃时,环己醇在Ⅷ族金属催化剂作用下同时胺化和深度脱氢,得到的主要产物则是苯胺。其中使用Pt催化剂(JBK21)在350℃下得到最高的苯胺收率(95.5%)。
Takanashi等[63]将Rh与不同种类的金属(Ga、Sn、Zn、Ge、Bi等)负载在活性炭上,用于5.0 MPa氢气气氛下,1, 2-丙二醇与氨在水溶剂中还原胺化制备氨基醇的反应。研究发现Rh-In双金属催化剂催化醇胺化反应的活性明显高于其他几种金属,而将Rh/C、In/C单独催化该反应时基本没有活性,证明了催化剂对于醇胺化的活性是源于Rh-In两种金属的协同作用。此外,通过1, 2-丙二醇的脱氢实验发现,In的加入明显提高了Rh/C催化醇的脱氢反应的效率,尤其是在有NH3或者有机胺的存在下,他们认为这是因为In的加入降低了生成的氨基醇、NH3以及羰基化合物中间体在催化剂活性组分上的吸附。
为了进一步确定Rh-In/C催化剂的结构反应的影响,Takanashi等[64]选用几种不同In/Rh摩尔比的催化剂用于1, 2-丙二醇与NH3合成氨基醇的反应。在较低的In/Rh比(≤ 0.2)时,载体表面的Rh是小于3 nm的fcc晶型的颗粒,并且颗粒部分被In的氧化物所覆盖,这种催化剂对催化1, 2-丙二醇与氨发生还原胺化反应有一定的效果,当加入更多的In的时候,形成正方晶型的RhIn合金,这是一种由立方晶型的RhIn合金转变而来的晶型,合金形成较大的颗粒(20 nm),当In/Rh摩尔比为1的时候,催化剂的TOF最高,使用此催化剂,产物1-氨基-2-丙醇和2-氨基-1-丙醇的选择性可达到90%左右,而当In/Rh含量大于1的时候,金属变为被In覆盖的立方晶型的RhIn合金,催化活性又开始下降。
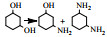
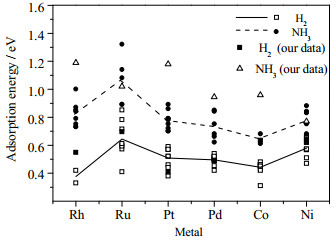
综合以上研究结果,相对Ni、Co来说,贵金属的应用较少,由于在伯胺制备过程中,通常要用到过量的NH3来抑制仲胺和叔胺以及加氢裂解等副产物,而贵金属对NH3和有机胺的吸附作用较强,一定程度上抑制了其脱氢/加氢活性因而导致催化剂活性并不好,因此并不适合于在大量NH3条件下的伯胺的制备。此外,在相同的反应条件下,贵金属催化剂对伯胺的选择性不高,因此更多的应用于醇与有机胺还原胺化制备仲胺和叔胺的反应中。本课题组最近在对糠醇与NH3还原胺化反应的研究中也发现,相对于贵金属和Co催化剂来说,Ni的催化活性更好。通过DFT(密度泛函理论)计算从理论上证明了NH3和H2在Ni(111)表面的吸附能相差最小,也就是说相对于贵金属来说,NH3在Ni表面吸附量最少,因此活性更好(图 4)[71]。
3.4 其他催化剂上醇还原胺化制备伯胺 3.4.1 Cu系催化剂Chary等[60]采用等体积浸渍法制备了一系列不同负载量(1%~15%(wt))的Cu/ZrO2催化剂,用于催化环己醇/环己酮的还原胺化反应,之所以使用ZrO2作为载体,是因为它是唯一包含酸性、碱性、还原性以及氧化性的载体。通过N2O在催化剂上的分解测定金属的分散度以及金属比表面积,结果显示负载量为3.5%(wt)的催化剂Cu分散度最高,催化效果最好。另外,通过催化环己醇脱氢反应研究催化剂的酸碱性,并与NH3-TPD的结果对比,发现中等强度的酸性位有利于环己醇的脱水,而弱强度的酸性位有利于环己醇的脱氢。Zhao等[61]在研究乙醇与氨的反应时,在较高的反应温度(420℃)与较低的NH3/乙醇摩尔比条件下,产物中乙腈的选择性达92.5%,远远大于其他几种产物(乙醛、乙胺等)的选择性。而选择不同的催化剂可以改变几种产物所占比例,在Cu/γ-Al2O3催化下乙腈选择性24.3%,乙胺选择性26.2%。
在醇的还原胺化反应中,单独以铜为活性组分的研究并不多,一般都是与Co或者Ni等一起作为多组分的催化剂。
3.4.2 Fe系催化剂用于醇胺化反应的金属催化剂主要以Ni、Co为主,鲜少有文献报道将Fe单独用于催化该反应的研究。在早期的研究中,Kliger等[45]以金属Fe催化剂对醇的还原胺化反应的机理进行了研究,他们提出醇发生氢胺化反应主要经历三个步骤:即醇脱氢得到羰基化合物;该化合物与胺化剂反应得到中间体亚胺或烯胺;最后亚胺或烯胺被氢气还原得到胺类化合物。Fischer等[54]研究了Co-Fe催化剂在醇胺化反应体系中的作用机理。他们发现Co-Fe催化剂比单金属Co的稳定性更好,Fe可以使催化剂中的Co维持在一种亚稳态的fcc晶型(β-Co),这种晶型明显比更稳定的hcp晶型(α-Co)活性更好,而单金属的Co催化剂中两种晶型的Co都存在,且α-Co越多,活性越差。
4 总结与展望本文综述了近年来醇与NH3还原胺化反应制备伯胺的研究,重点阐述了醇胺化的反应机理以及用于醇与NH3还原胺化反应制备伯胺的非均相金属催化剂的研究。总体来看,非均相催化体系中醇与NH3还原胺化反应最常用的催化剂是以金属氧化物、炭材料等为载体负载Ni、Co等金属的负载型催化剂,贵金属催化剂相对活性较差,对伯胺的选择性较低,应用较少。此外,Cu和Fe更多用于与Co、Ni催化剂组成多组分催化剂。现有的研究中,可以通过调整反应温度、反应时间、控制NH3/H2比例、增大催化剂的用量等方法来提高底物醇的转化率以及伯胺的选择性。在今后的研究过程中,研究者们可以从以下几个方面对醇还原胺化合成伯胺进行更深入的研究:
(1) 开发适用于无氢条件下氢转移胺化的非均相催化剂。目前氢转移胺化主要采用的是均相的贵金属配合物催化体系,因此可以通过制备新型的Ni或Co-贵金属合金催化剂,实现无氢气条件下的氢转移胺化;
(2) 进一步研究载体对醇类还原胺化的影响。醇的脱氢步骤是醇还原胺化反应的速率控制步骤,载体的碱性位可能有助于从醇中提取质子而促进脱氢步骤,而酸性位可能与氢转移步骤有关。因此更深入地研究载体效应有助于开发更高效的醇还原胺化催化剂;
(3) 相较于传统石化产品来说,生物质来源广、可再生且对环境友好。因此开发以生物质醇为起始原料来合成伯胺的催化技术有利于生物质资源的高效利用。
| [1] | Bähn S, Imm S, Neubert L, et al. The catalytic amination of alcohols[J]. ChemCatChem , 2011, 3(12): 1853-1864. DOI:10.1002/cctc.201100255. |
| [2] | Shen Q, Hartwig J F. Palladium-catalyzed coupling of ammonia and lithium amide with aryl halides[J]. Journal of the American Chemical Society , 2006, 128(31): 10028-10029. DOI:10.1021/ja064005t. |
| [3] | Willis M C. Palladium-catalyzed coupling of ammonia and hydroxide with aryl halides:the direct synthesis of primary anilines and phenols[J]. Angewandte Chemie International Edition , 2007, 46(19): 3402-3404. DOI:10.1002/(ISSN)1521-3773. |
| [4] | Laval S, Dayoub W, Favre-Reguillon A, et al. A mild and efficient method for the reduction of nitriles[J]. Tetrahedron Letters , 2009, 50(50): 7005-7007. DOI:10.1016/j.tetlet.2009.09.164. |
| [5] | Liu Y X, Zhou K, Lu M, et al. Acidic/basic oxides-supported cobalt catalysts for one-pot synthesis of isophorone diamine from hydroamination of isophorone nitrile[J]. Industrial & Engineering Chemistry Research , 2015, 54(37): 9124-9132. |
| [6] | Yin B L, Hu T S, Wu Y L. Hydroamination of olefin in a special conjugated spiroketal enol ether system, diastereoselective synthesis of amino-containing tonghaosu analogs[J]. Tetrahedron Letters , 2004, 45(9): 2017-2021. DOI:10.1016/j.tetlet.2003.11.106. |
| [7] | Klein H, Jackstell R, Kant M, et al. First catalytic hydroaminomethylation in supercritical ammonia[J]. Chemical Engineering & Technology , 2007, 30(6): 721-725. |
| [8] | Junge K, Wendt B, Shaikh N, et al. Iron-catalyzed selective reduction of nitroarenes to anilines using organosilanes[J]. Chemical Communications , 2010, 46(10): 1769-1771. DOI:10.1039/b924228g. |
| [9] | Lou X B, He L, Qian Y, et al. Highly chemo-and regioselective transfer reduction of aromatic nitro compounds using ammonium formate catalyzed by supported gold nanoparticles[J]. Advanced Synthesis & Catalysis , 2011, 353(2-3): 281-286. |
| [10] | Baiker A, Kijenski J. Catalytic synthesis of higher aliphatic amines from the corresponding alcohols[J]. Catalysis Reviews-Science and Engineering , 1985, 27(4): 653-697. DOI:10.1080/01614948508064235. |
| [11] | Hayes K S. Industrial processes for manufacturing amines[J]. Applied Catalysis A:General , 2001, 221(1-2): 187-195. DOI:10.1016/S0926-860X(01)00813-4. |
| [12] | Wang T, Dong Z, Fu T, et al. Nickel embedded in N-doped porous carbon for the hydrogenation of nitrobenzene to p-aminophenol in sulphuric acid[J]. Chemical Communications , 2015, 51(100): 17712-17715. DOI:10.1039/C5CC06268C. |
| [13] | Bassili V A, Baiker A. Catalytic amination of 1-methoxy-2-propanol over silica supported nickel:study of the influence of the reaction parameters[J]. Applied Catalysis , 1990, 65(2): 293-308. DOI:10.1016/S0166-9834(00)81604-8. |
| [14] | Gunanathan C, Milstein D. Selective synthesis of primary amines directly from alcohols and ammonia[J]. Angewandte Chemie International Edition , 2008, 47(45): 8661-8664. DOI:10.1002/anie.v47:45. |
| [15] | Imm S, Bahn S, Neubert L, et al. An efficient and general synthesis of primary amines by ruthenium-catalyzed amination of secondary alcohols with ammonia[J]. Angewandte Chemie International Edition , 2010, 49(44): 8126-8129. DOI:10.1002/anie.v49:44. |
| [16] | Shimizu K, Kon K, Onodera W, et al. Heterogeneous Ni catalyst for direct synthesis of primary amines from alcohols and ammonia[J]. ACS Catalysis , 2013, 3(1): 112-117. DOI:10.1021/cs3007473. |
| [17] | Kobayashi H, Ohta H, Fukuoka A. Conversion of lignocellulose into renewable chemicals by heterogeneous catalysis[J]. Catalysis Science & Technology , 2012, 2(5): 869-883. |
| [18] | Crews K, Reeves C, Thomas P, et al. Heterogeneous catalysis of C-O bond cleavage for cellulose deconstruction:a potential pathway for ethanol production[J]. ISRN Nanotechnology , 2014, 2014: 1-8. |
| [19] | Likhar P R, Arundhathi R, Kantam M L, et al. Amination of alcohols catalyzed by copper-aluminium hydrotalcite:a green synthesis of amines[J]. European Journal of Organic Chemistry , 2009, 2009(31): 5383-5389. DOI:10.1002/ejoc.v2009:31. |
| [20] | Veefkind V A, Lercher J A. Zeolite catalysts for the selective synthesis of mono-and diethylamines[J]. Journal of Catalysis , 1998, 180(2): 258-269. DOI:10.1006/jcat.1998.2275. |
| [21] | Klyuev M V, Khidekel' M L. Catalytic amination of alcohols, aldehydes, and ketones[J]. Russian Chemical Reviews , 1980, 49(1): 14-27. DOI:10.1070/RC1980v049n01ABEH002442. |
| [22] | Sabatier P, Reid E E. Catalysis in organic chemistry[M].London: D. Van Nostrand Company, 1922. |
| [23] | Segawa K, Ilao M C. Methanol amination over small-pore zeolite catalysts[J]. Studies in Surface Science and Catalysis , 1997, 105: 1219-1226. DOI:10.1016/S0167-2991(97)80760-4. |
| [24] | Hu Z S, Wei L H, Chen S Y, et al. External modification of zeolite by metal surfactant for methanol amination[J]. Microporous and Mesoporous Materials , 1998, 21(1-3): 7-12. DOI:10.1016/S1387-1811(97)00015-2. |
| [25] | Maeda N, Meemken F, Hungerbühler K, et al. Selectivity-controlling factors in catalytic methanol amination studied by isotopically modulated excitation IR spectroscopy[J]. Acs Catalysis , 2013, 3(2): 219-223. DOI:10.1021/cs3007507. |
| [26] | Bui-The-Khai , Concilio C, Porzi G. A facile synthesis of symmetrical secondary amines from primary amines promoted by the homogeneous catalyst RuCl2(Ph3P)3[J]. Journal of Organometallic Chemistry , 1981, 208(2): 249-251. DOI:10.1016/S0022-328X(00)82680-7. |
| [27] | Grigg R, Mitchell T R B, Sutthivaiyakit S, et al. Transition metal-catalysed N-alkylation of amines by alcohols[J]. Journal of the Chemical Society, Chemical Communications , 1981, 12(12): 611-612. |
| [28] | Fujita K I, Li Z Z, Ozeki N, et al. N-Alkylation of amines with alcohols catalyzed by a Cp*Ir complex[J]. Tetrahedron Letters , 2003, 44(13): 2687-2690. DOI:10.1016/S0040-4039(03)00371-X. |
| [29] | Prades A, Corberán R, Poyatos M, et al. [IrCl2Cp*(NHC)] complexes as highly versatile efficient catalysts for the cross-coupling of alcohols and amines[J]. Chemistry-A European Journal , 2008, 14(36): 11474-11479. DOI:10.1002/chem.200801580. |
| [30] | Das K, Shibuya R, Nakahara Y, et al. Platinum-catalyzed direct amination of allylic alcohols with aqueous ammonia:selective synthesis of primary allylamines[J]. Angewandte Chemie International Edition , 2012, 51(1): 150-154. DOI:10.1002/anie.201106737. |
| [31] | Sewell G, O'Connor C, Steen E V. Reductive amination of ethanol with silica-supported cobalt and nickel catalysts[J]. Applied Catalysis A:General , 1995, 125(1): 99-112. DOI:10.1016/0926-860X(95)00010-0. |
| [32] | Ruiz D, Aho A, Saloranta T, et al. Direct amination of dodecanol with NH3 over heterogeneous catalysts. Catalyst screening and kinetic modelling[J]. Chemical Engineering Journal , 2017, 307: 739-749. DOI:10.1016/j.cej.2016.08.083. |
| [33] | Guillena G, Ramón D J, Yus M. Alcohols as electrophiles in C-C bond-forming reactions:the hydrogen autotransfer process[J]. Angewandte Chemie International Edition , 2007, 46(14): 2358-2364. DOI:10.1002/(ISSN)1521-3773. |
| [34] | Guillena G, Ramón D J, Yus M. Hydrogen autotransfer in the N-alkylation of amines and related compounds using alcohols and amines as electrophiles[J]. Chemical Reviews , 2010, 110(3): 1611-1641. DOI:10.1021/cr9002159. |
| [35] | Dobereiner G E, Crabtree R H. Dehydrogenation as a substrate-activating strategy in homogeneous transition-metal catalysis[J]. Chemical Reviews , 2010, 110(2): 681-703. DOI:10.1021/cr900202j. |
| [36] | Klinkenberg J L, Hartwig J F. Catalytic organometallic reactions of ammonia[J]. Angewandte Chemie International Edition , 2011, 50(1): 86-95. DOI:10.1002/anie.v50.1. |
| [37] | Watanabe Y, Tsuji Y, Ohsugi Y. The ruthenium catalyzed N-alkylation and N-heterocyclization of aniline using alcohols and aldehydes[J]. Tetrahedron Letters , 1981, 22(28): 2667-2670. DOI:10.1016/S0040-4039(01)92965-X. |
| [38] | Pridmore S J, Slatford P A, Daniel A, et al. Ruthenium-catalysed conversion of 1, 4-alkynediols into pyrroles[J]. Tetrahedron Letters , 2007, 48(29): 5115-5120. DOI:10.1016/j.tetlet.2007.05.070. |
| [39] | Defieber C, Ariger M A, Moriel P, et al. Iridium-catalyzed synthesis of primary allylic amines from allylic alcohols:sulfamic acid as ammonia equivalent[J]. Angewandte Chemie International Edition , 2007, 46(17): 3139-3143. DOI:10.1002/(ISSN)1521-3773. |
| [40] | Shimizu K. Heterogeneous catalysis for the direct synthesis of chemicals by borrowing hydrogen methodology[J]. Catalysis Science & Technology , 2015, 5(3): 1412-1427. |
| [41] | Fischer A, Mallat T, Baiker A. Amination of diols and polyols to acyclic amines[J]. Catalysis Today , 1997, 37(2): 167-189. DOI:10.1016/S0920-5861(97)00009-6. |
| [42] | Schwoegler E J, Adkins H. Preparation of certain amines[J]. Journal of American Chemical Society , 1939, 61(12): 3499-3502. DOI:10.1021/ja01267a081. |
| [43] | Baiker A, Caprez W, Holstein W L. Catalytic amination of aliphatic alcohols in the gas and liquid phases:kinetics and reaction pathway[J]. Industrial & Engineering Chemistry Product Research & Development , 1983, 22(2): 217-225. |
| [44] | Kliger G A, Glebov L S, Shuikin A N, et al. Mechanism of amine formation in the amination of alcohols in the presence of metal catalysts[J]. Russian Chemical Bulletin , 1990, 39(2): 431. DOI:10.1007/BF00960693. |
| [45] | Kliger G A, Shuikin A N, Glebov L S, et al. Mechanism of the hydroamination of alcohols and carbonyl compounds on a fused iron catalyst[J]. Russian Chemical Bulletin , 1990, 39(8): 1750-1753. DOI:10.1007/BF00961521. |
| [46] | Bassili V A, Baiker A. Catalytic amination of 1-methoxypropan-2-ol over silica supported nickel:modelling of reaction kinetics[J]. Applied Catalysis , 1991, 70(1): 325-338. DOI:10.1016/S0166-9834(00)84174-3. |
| [47] | Cho J H, Park J H, Chang T S, et al. Reductive amination of 2-propanol to monoisopropylamine over Ni/γ-Al2O3 catalysts[J]. Catalysis Letters , 2013, 143(12): 1319-1327. DOI:10.1007/s10562-013-1086-3. |
| [48] | Cho J H, Park J H, Chang T S, et al. Reductive amination of 2-propanol to monoisopropylamine over Co/γ-Al2O3 catalysts[J]. Applied Catalysis A:General , 2012, 417-418: 313-319. DOI:10.1016/j.apcata.2012.01.011. |
| [49] | Cui X J, Dai X C, Deng Y Q, et al. Development of a general non-noble metal catalyst for the benign amination of alcohols with amines and ammonia[J]. Chemistry-A European Journal , 2013, 19(11): 3665-3675. DOI:10.1002/chem.v19.11. |
| [50] | Watson A J A, Williams J M J. The give and take of alcohol activation[J]. Science , 2010, 329(5992): 635-636. DOI:10.1126/science.1191843. |
| [51] | Shimizu K, Kanno S, Kon K, et al. N-alkylation of ammonia and amines with alcohols catalyzed by Ni-loaded CaSiO3[J]. Catalysis Today , 2014, 232: 134-138. DOI:10.1016/j.cattod.2013.09.002. |
| [52] | Sewell G S, O'Connor C T, Steen E V. Effect of activation procedure and support on the reductive amination of ethanol using supported cobalt catalysts[J]. Journal of Catalysis , 1997, 167(2): 513-521. DOI:10.1006/jcat.1997.1596. |
| [53] | Zamlynny V, Kubelková L, Babůrek E, et al. Amination of cyclohexanol over metallosilicate-based materials[J]. Applied Catalysis A:General , 1998, 169(1): 119-125. DOI:10.1016/S0926-860X(98)00011-8. |
| [54] | Fischer A, Maciejewski M, Bürgi T, et al. Cobalt-catalyzed amination of 1, 3-propanediol:effects of catalyst promotion and use of supercritical ammonia as solvent and reactant[J]. Journal of Catalysis , 1999, 183(2): 373-383. DOI:10.1006/jcat.1999.2408. |
| [55] | Fischer A, Mallat T, Baiker A. Synthesis of 1, 4-diaminocyclohexane in supercritical ammonia[J]. Journal of Catalysis , 1999, 182(2): 289-291. DOI:10.1006/jcat.1999.2410. |
| [56] | Fischer A, Mallat T, Baiker A. Continuous amination of propanediols in supercritical ammonia[J]. Angewandte Chemie International Edition , 1999, 38(3): 351-354. DOI:10.1002/(ISSN)1521-3773. |
| [57] | Fischer A, Mallat T, Baiker A. Nickel-catalyzed amination of 1, 3-propanediols differently substituted at C2-position:influence of reactant structure on diamine production[J]. Journal of Molecular Catalysis A:Chemical , 1999, 149(1-2): 197-204. DOI:10.1016/S1381-1169(99)00174-0. |
| [58] | Jenzer G, Mallat T, Baiker A. Cobalt-catalyzed amination of 1, 3-cyclohexanediol and 2, 4-pentanediol in supercritical ammonia[J]. Catalysis Letters , 1999, 61(3-4): 111-114. |
| [59] | Becker J, Niederer J P M, Keller M, et al. Amination of cyclohexanone and cyclohexanol/cyclohexanone in the presence of ammonia and hydrogen using copper or a group Ⅷ metal supported on a carrier as the catalyst[J]. Applied Catalysis A:General , 2000, 197(2): 229-238. DOI:10.1016/S0926-860X(99)00482-2. |
| [60] | Chary K V R, Seela K K, Naresh D, et al. Characterization and reductive amination of cyclohexanol and cyclohexanone over Cu/ZrO2 catalysts[J]. Catalysis Communications , 2008, 9(1): 75-81. DOI:10.1016/j.catcom.2007.05.016. |
| [61] | Zhang Y N, Zhang Y C, Feng C, et al. Amination of ethanol to acetonitrile over Ni-doped Co/γ-Al2O3 catalyst[J]. Catalysis Communications , 2009, 10(10): 1454-1458. DOI:10.1016/j.catcom.2009.03.019. |
| [62] | Zhao G L, Yu L, Yan X L, et al. The role of iron in the selective amination of 1, 2-butanediol to 2-amino-1-butanol over Co-Ba-Fe/γ-Al2O3[J]. Reaction Kinetics, Mechanisms and Catalysis , 2010, 100(2): 449-457. |
| [63] | Takanashi T, Nakagawa Y, Tomishige K. Amination of alcohols with ammonia in water over Rh-In catalyst[J]. Chemistry Letters , 2014, 43(6): 822-824. DOI:10.1246/cl.140051. |
| [64] | Takanashi T, Tamura M, Nakagawa Y, et al. Structure of catalytically active Rh-In bimetallic phase for amination of alcohols[J]. RSC Advances , 2014, 4(54): 28664-28672. DOI:10.1039/c4ra03984j. |
| [65] | Cho J H, An S H, Chang T S, et al. Effect of an alumina phase on the reductive amination of 2-propanol to monoisopropylamine over Ni/Al2O3[J]. Catalysis Letters , 2016, 146(4): 811-819. DOI:10.1007/s10562-016-1695-8. |
| [66] | Hong E, Bang S, Cho J H, et al. Reductive amination of isopropanol to monoisopropylamine over Ni-Fe/γ-Al2O3 catalysts:synergetic effect of Ni-Fe alloy formation[J]. Applied Catalysis A:General , 2017, 542: 146-153. DOI:10.1016/j.apcata.2017.05.003. |
| [67] | Li Y, Cheng H Y, Zhang C, et al. Reductive amination of 1, 6-hexanediol with Ru/Al2O3 catalyst in supercritical ammonia[J]. Science China Chemistry , 2017, 60(7): 920-926. DOI:10.1007/s11426-017-9049-5. |
| [68] | Niemeier J, Engel R V, Rose M. Is water a suitable solvent for the catalytic amination of alcohols?[J]. Green Chemistry , 2017, 19: 2839-2845. DOI:10.1039/C7GC00422B. |
| [69] | Park J H, Hong E, An S H, et al. Reductive amination of ethanol to ethylamines over Ni/Al2O3 catalysts[J]. Korean Journal of Chemical Engineering , 2017, 34(10): 2610-2618. DOI:10.1007/s11814-017-0164-4. |
| [70] | LIU Ying-xin(刘迎新), ZHOU Kuo(周阔), LU Meng(卢蒙), et al. Synthesis of isophorone diamine and its reaction condition optimization(异佛尔酮二胺的合成及工艺优化)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(3): 616-620. |
| [71] | Liu Y X, Zhou K, Shu H M, et al. Switchable synthesis of furfurylamine and tetrahydrofurfurylamine from furfural alcohol over Raney nickel[J]. Catalysis Science & Technology , 2017, 7: 4129-4135. |