2. 中海国亚环保工程有限公司, 山西 太原 030012
2. CHINASEA GROUP Co. Ltd., Taiyuan 030012, China
含氮杂环化合物(NHCs)作为化工行业的关键中间体,广泛存在于焦化、制药、染料和炼油等工业废水中。NHCs分子结构上杂原子氮的存在使其具有高的水溶性,氮杂环C─N键在自然降解条件下较难断裂[1]。NHCs易在环境中迁移并长期存在,一些NHCs即使在低浓度下也表现出毒性和致癌性,环境中NHCs的存在对人类及其他自然生命构成了严重威胁。因此,需寻找高效低耗去除NHCs的方法。
目前,针对NHCs的处理技术主要有生物降解法[2-3]、吸附法[4-5]、高级氧化法[6]。由于NHCs结构不易破坏,生物降解法一般需培养特异性菌群才能使其达到理想的降解效果。吸附法主要是通过将NHCs转移或浓缩在吸附剂上,以达到处理效果,故存在吸附剂后续处理等问题。高级氧化法因其氧化能力强、反应速度快、处理效率高等特点成为目前最流行的处理方法之一。这些方法通常采用高活性物质(如羟基自由基HO⋅、硫酸根自由基SO4−⋅)氧化降解有机污染物,其中高铁酸盐(K2FeO4,Fe(Ⅵ))自身具有强氧化性且无须外加药剂即可生成HO⋅[7]。Fe(Ⅵ)在酸性和碱性溶液中的氧化还原电位分别为+2.2和+0.7 V[8-9],与其他传统氧化剂相比具有更高的反应性和选择性[10],且Fe(Ⅵ)分解的最终产物Fe(Ⅲ)可在后续的吸附和混凝过程中起重要作用[11]。研究表明,Fe(Ⅵ)能氧化降解低质量浓度(μg⋅L−1)的NHCs,并促进其矿化[12]。然而,目前关于Fe(Ⅵ)对NHCs的降解机理尚未完全明晰。
因此,选取苯环稠合五元氮杂环吡咯形成的吲哚(ID)、苯环稠合六元氮杂环吡啶所形成的喹啉(QL)、六元氮杂环吡啶(PD)这3种典型的NHCs为目标有机物,进行高铁酸钾氧化这3种化合物的实验研究,目的是:(1)考察Fe(Ⅵ)投加量、pH、温度等因素对Fe(Ⅵ)降解NHCs的影响;(2)识别氧化产物并讨论降解机理;(3)评估Fe(Ⅵ)对NHCs的矿化效果。结果可完善Fe(Ⅵ)氧化NHCs有机物理论,为实际废水中NHCs的降解去除提供理论依据。
2 实验材料与方法 2.1 试剂与仪器试剂:吲哚(分析纯,质量分数≥99%)、喹啉、吡啶(分析纯,体积分数≥99%)、高铁酸钾(分析纯,质量分数≥95%)、甲醇(色谱纯),上海麦克林生化科技有限公司。磷酸氢二钠、磷酸二氢钾、磷酸氢二钾、硼砂、亚硫酸钠,分析纯,天津市恒兴化学试剂有限公司;氢氧化钠、盐酸,分析纯,天津市凯通化学试剂有限公司;二氯甲烷,分析纯,天津市光复精细化工研究所;无水硫酸钠,分析纯,天津市风船化学试剂科技有限公司;对苯二甲酸,分析纯,天津市大茂化学试剂厂。
仪器:FA1004型电子天平、pHS-3C型pH计、六联恒温磁力加热搅拌器,上海雷磁仪器厂;G7111A型高效液相色谱仪HPLC,德国安捷伦科技公司;气相色谱/三重四极杆质谱联用仪GC-MS-TQ8040,RF-6000型荧光分光光度仪,日本岛津公司。
2.2 实验方法 2.2.1 储备液的配制储备液配制:称取25 mg吲哚粉末溶于约100 mL超纯水,控制转速约为300 r⋅min−1搅拌24 h后用超纯水定容至250 mL,得到100 mg⋅L−1的吲哚储备液;吸取22.9 μL喹啉原液加入约100 mL超纯水中,使用恒温磁力加热搅拌器加热溶液至40 ℃,控制转速为500 r⋅min−1充分搅拌,溶解后用超纯水定容至250 mL,得到100 mg⋅L−1的喹啉储备液;吸取22.5 μL吡啶原液用超纯水定容至250 mL,得到100 mg⋅L−1的吡啶储备液。
缓冲溶液:pH值为5和6的缓冲溶液采用磷酸氢二钠(Na2HPO4·12H2O)配制,pH值为7和8的缓冲溶液采用磷酸氢二钾(K2HPO4·3H2O)和磷酸二氢钾(KH2PO4)配制,pH值为9的缓冲溶液采用硼砂(Na2B4O7·10H2O)配制,使用盐酸稀溶液或氢氧化钠稀溶液调节溶液pH。
2.2.2 实验步骤Fe(Ⅵ)对吲哚、喹啉、吡啶的氧化实验:在一定环境温度下,取25 mL目标物质储备液,使用对应pH的缓冲溶液定容至250 mL,得到10 mg⋅L−1目标物质反应液。在采样管中提前加入20 μL浓度为1 mol⋅L−1的亚硫酸钠猝灭剂。控制磁力搅拌器转速为500 r⋅min−1,将一定质量(根据投加比来称量)的高铁酸钾粉末加入反应液并开始计时,按0 s、5 s、15 s、30 s、45 s、1 min、3 min、5 min、10 min、15 min的时间节点各取样5 mL,将水样注入采样管中充分摇匀,水样经0.22 μm有机滤膜过滤后测定其中目标物质浓度。其中,投加比用NHCs与Fe(Ⅵ)的物质的量比n(NHCs): n[Fe(Ⅵ)]来表示。所有条件下均设3组平行实验。
羟基自由基(HO⋅)捕获实验:Fe(Ⅵ)氧化降解有机物实验前在反应液中加入过量的对苯二甲酸(p-phthalic acid,PTA),以捕获氧化过程中产生的HO⋅,利用三维荧光检测其产物2-羟基对苯二甲酸的生成情况。氙灯为光源,激发波长为312 nm,步长为3 nm,扫描范围为325~575 nm,扫描速度为2 000 nm⋅min−1。
气相色谱-质谱(GC-MS)检测:取样并终止反应后,加入约1 g的NaCl粉末溶解,用二氯甲烷进行液液萃取,氮吹至1 mL,用GC-MS检测反应产物。
2.3 检测方法采用高效液相色谱法(HPLC)测定氧化过程中吲哚、喹啉、吡啶浓度的变化。采用GC-MS检测产物。
HPLC检测条件:色谱柱InfinityLab Poroshell 120,流动相甲醇与水的体积比为70:30,流速为1 mL⋅min−1,进样量为100 μL,色谱柱温度为35 ℃。目标物的检测波长及保留时间见表 1。
|
|
表 1 目标有机物检测方法 Table 1 Detection methods of the target organic compounds |
GC-MS检测:采用GC-MS-TQ8040气相色谱/三重四级杆,Rxi-5Sil色谱柱(30 m×0.25 mm×0.25 μm)进行产物检测。采用DB-5MS柱分离有机物,载气为高纯氮气(99.99%)。具体检测条件见表 2,表中m/z为质荷比。数据处理与曲线图绘制均采用OriginPro 8.0软件,降解路径推测图及位点图绘制采用ChemBioDraw Ultra 14.0软件。
|
|
表 2 目标有机物GC-MS检测条件 Table 2 GC-MS detection conditions of the target organic compounds |
25 ℃下,在吲哚、喹啉、吡啶的pH分别为7、5、7的缓冲溶液中进行Fe(Ⅵ)对吲哚、喹啉、吡啶的氧化实验,分别控制ID与Fe(Ⅵ)的物质的量比n(ID): n[Fe(Ⅵ)]=1:5、1:8、1:10、1:15、1:20,QL与Fe(Ⅵ)物质的量比n(QL): n[Fe(Ⅵ)]=1:3、1:4、1:5、1:8、1:10,PD与Fe(Ⅵ)的物质的量比n(PD): n[Fe(Ⅵ)]=1:1、1:2、1:3、1:4、1:5,得到吲哚剩余质量浓度ρID, re、喹啉剩余质量浓度ρQL, re、吡啶剩余质量浓度ρPD, re随时间的变化如图 1所示。

|
图 1 Fe(Ⅵ) 投加量对吲哚、喹啉、吡啶去除效果的影响 Fig.1 Effects of Fe(Ⅵ) dosage on indole, quinoline and pyridine removal efficiency |
吲哚的降解主要发生在前3 min(图 1(a))。15 min内,随着n(ID): n[Fe(Ⅵ)]从1:5增至1:20,吲哚的去除率从32.49% 增至83.08%。随着Fe(Ⅵ)投加量的增大,Fe(Ⅵ)作用于氮杂环可攻击位点上氧化剂的量越多,对吲哚降解的促进作用越显著。但n(ID): n[Fe(Ⅵ)]从1:15增至1:20时,去除率仅增加了5.17%,这可能是由于较高剂量的Fe(Ⅵ)在水溶液中更易发生自分解反应(4K2FeO4+10H2O→4Fe(OH)3↓+3O2↑+8KOH) [13],使得Fe(Ⅵ)的实际浓度低于理论值。结合降解效果和经济成本,选取n(ID): n[Fe(Ⅵ)]= 1:15进行后续实验。
喹啉的降解主要发生在前2 min(图 1(b)),且在前5 s内完成大部分反应。10 min内,随着n(QL): n[Fe(Ⅵ)]从1:3增至1:10,喹啉的去除率从37.17% 增至89.56%。当n(ID): n[Fe(Ⅵ)]为1:5时,喹啉的去除率已达到81.16%,但当投加比增至1:10时,喹啉的去除率仅增加了8.40%。前5 s内Fe(Ⅵ)攻击喹啉分子自身,但随着反应进行生成了大量中间产物,中间产物会和喹啉共同消耗Fe(Ⅵ),这一影响随Fe(Ⅵ)投加量的增多而更显著。此外,较高投加比下Fe(Ⅵ)自分解反应加剧,使参与氧化喹啉的Fe(Ⅵ)有效浓度降低。而吡啶的降解主要发生在前1 min(图 1(c)),随着投加比从1:1增至1:3,吡啶的去除率从28.25%增至36.89%。投加比继续增加,吡啶的去除率基本无提高。吡啶结构中氮原子的存在使环上各个位置π电子密度不同,形成“缺电子π键”,导致亲电试剂Fe(Ⅵ)对吡啶的反应较难,吡啶整体去除率不高。考虑经济性,选取n(QL): n[Fe(Ⅵ)]=1:5、n(PD): n[Fe(Ⅵ)]=1:3进行后续实验。
3.1.2 pH的影响25 ℃下,考察pH对Fe(Ⅵ)氧化吲哚、喹啉、吡啶的影响。结合3.1.1节Fe(Ⅵ)投加量对降解效果及经济成本的影响,确定反应条件为:n(ID): n[Fe(Ⅵ)]=1:15、n(PD): n[Fe(Ⅵ)]=1:3,调节Fe(Ⅵ)氧化吲哚、吡啶反应体系的pH分别为5、6、7、8、9。控制投加比n(QL): n[Fe(Ⅵ)]=1:5,调节Fe(Ⅵ)氧化喹啉反应体系的pH分别为4、5、6、7、8。ρID, re、ρQL, re、ρPD, re随时间的变化如图 2所示。
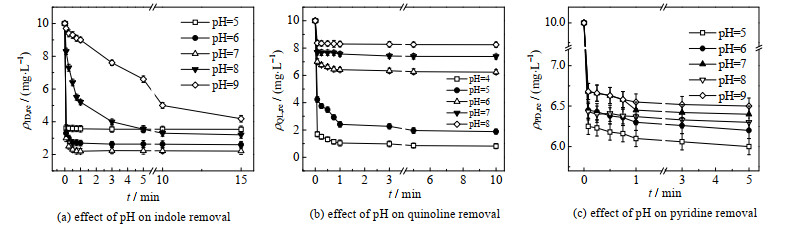
|
图 2 pH对喹啉、吡啶、吲哚去除效果的影响 Fig.2 Effects of pH on indole, quinoline and pyridine removal efficiency |
由图 2(a)可知,15 min内,当体系pH从5升至7时,吲哚的去除率从64.61% 升至77.91%,但当pH进一步升至9时,去除率却降到了58.14%。这一趋势可通过Fe(Ⅵ)的不同存在形态和吲哚(非常弱的碱,无pKa)之间的反应来解释。Fe(Ⅵ)在溶液酸性条件下具有较高的氧化还原电位(+2.20 V),主要以HFeO4−形式存在[14] (
由图 2(b)可知,10 min内,喹啉的去除率随pH的升高而逐渐降低。当体系pH从4升至8时,喹啉的去除率从91.92% 降至17.53%。弱酸性条件(pH=4、5)下,Fe(Ⅵ)对喹啉去除效果较佳,原因可能是在该条件下,Fe(Ⅵ)主要以单质子(HFeO4−)和双质子(H2FeO4)形式存在,这2种物质在含氧配体上自旋密度较大,比去质子形式(FeO42−)氧化能力更强。酸性缓冲溶液中HCl的存在也可能活化了Fe(Ⅵ),提升了体系的氧化能力[18]。此外,喹啉作为一种有机碱,当溶液pH与pKa相近时,喹啉分子主要以QH+、Q形式存在(
由图 2(c)可知,5 min内,pH的变化对吡啶去除率的影响不大。由于吡啶(pKa=5.2)与喹啉碱性相近,弱酸性条件下吡啶的去除率略高于中性和碱性条件下,但在各pH条件下去除率(40.03%~35.00%)均达35%以上。Zhou等[20]也发现pH对Fe(Ⅵ)降解布洛芬影响不大。总之,pH对NHCs去除的影响需综合考虑Fe(Ⅵ)存在形态、稳定性及NHCs的自身性质等。
3.1.3 温度的影响在pH分别为7、5、7的缓冲溶液中进行Fe(Ⅵ)对吲哚、喹啉、吡啶的氧化实验,投加比n(ID): n[Fe(Ⅵ)]=1:15,n(QL): n[Fe(Ⅵ)]=1:5,n(PD): n[Fe(Ⅵ)]=1:5,调节温度分别为15、25、35、45 ℃,考察温度对Fe(Ⅵ)氧化吲哚、喹啉、吡啶的影响,结果如图 3所示。

|
图 3 温度对喹啉、吡啶、吲哚去除效果的影响 Fig.3 Effects of temperature on indole, quinoline and pyridine removal efficiency |
温度的变化对吲哚去除率的影响不明显。温度由15增至35 ℃时,去除率由76.78% 增至78.85%。温度继续增至45 ℃时,去除率却降至76.42%。温度的升高会降低水的黏度系数、促进分子间的有效碰撞,利于吲哚的降解。但温度过高会加剧Fe(Ⅵ)的自分解作用,使反应体系中Fe(Ⅵ)含量降低,导致吲哚的去除率略下降。综合考虑去除率和加热设备等成本,选定25 ℃为实验温度。喹啉的去除率随温度的升高而略有增长。当温度从15升至45 ℃时,喹啉的去除率从78.50% 升至90.37%。Fe(Ⅵ)对喹啉的反应瞬间发生,因此过程中温度升高导致分子间有效碰撞增强大于Fe(Ⅵ)自分解作用对反应的影响。温度的变化对吡啶去除率的影响也不明显,当温度从15升至45 ℃时,吡啶的去除率从35.59% 升至39.75%。
3.2 Fe(Ⅵ)氧化降解NHCs的机理及路径 3.2.1 羟基自由基捕获实验高铁酸钾氧化过程中起主要作用的是高价态铁和活性氧上的持久性自由基,包括羟基自由基(HO⋅) (2K2FeO4+H2O→2Fe(OH)3↓+5[O], 5[O]+H2O→2HO⋅) [21]。对苯二甲酸(PTA)可与HO⋅反应,生成稳定且具有荧光性的2-羟基对苯二甲酸,所以选取PTA作为HO⋅的捕获剂、采取荧光光谱法来确定反应过程中HO⋅的生成[22-23]。反应过程中2-羟基对苯二甲酸随时间的生成情况如图 4所示。

|
图 4 Fe(Ⅵ)氧化降解吲哚,喹啉,吡啶过程中2-羟基对苯二甲酸随时间的荧光强度变化 Fig.4 Profiles of fluorescence intensity of 2-hydroxyterephthalic acid during Fe(Ⅵ) degradation of indole, quinoline and pyridine |
溶液为碱性时(图 4(c)),Fe(Ⅵ)氧化吲哚过程中产生的HO⋅远多于溶液酸性(图 4(a))和中性(图 4(b))条件下。而吲哚在中性环境下去除率最高,这表明最优反应条件下只有少数HO⋅参与反应,高价态铁仍然发挥着主要的氧化作用。Fe(Ⅵ)氧化喹啉的过程中酸性(图 4(d))条件下产生的HO⋅多于中性(图 4(e))和碱性(图 4(f))条件下,且溶液为弱酸性时喹啉的降解效果最好。这表明HO⋅在Fe(Ⅵ)对喹啉的氧化过程中起了主要作用。Fe(Ⅵ)氧化吡啶过程中HO⋅的生成量酸性环境(图 4(g)) > 中性环境(图 4(h)) > 碱性环境(图 4(i)),且由3.1.2节可知pH对吡啶降解的影响不大但酸性条件下略强,这表明HO⋅对吡啶的降解贡献有限。
3.2.2 产物分析及反应路径推测为明确Fe(Ⅵ)氧化吲哚、喹啉、吡啶的反应路径,25 ℃时,在吲哚、喹啉、吡啶的pH分别为7、5、7,投加比n(ID): n[Fe(Ⅵ)]=1:15,n(QL): n[Fe(Ⅵ)]=1:5,n(PD): n[Fe(Ⅵ)]=1:3条件下取Fe(Ⅵ)氧化NHCs反应的样品。对样品预处理后进行GC-MS检测。Fe(Ⅵ)降解吲哚(P1-P3)、喹啉(P4-P7)、吡啶(P8-P9)过程中检测到的9种主要产物见表 3。通过产物识别,推测NHCs可能的活性位点和Fe(Ⅵ)氧化吲哚、喹啉和吡啶主要反应路径见图 5。
|
|
表 3 Fe(Ⅵ)降解典型NHCs产物信息 Table 3 Typical products of NHCs degradation by Fe(Ⅵ) |
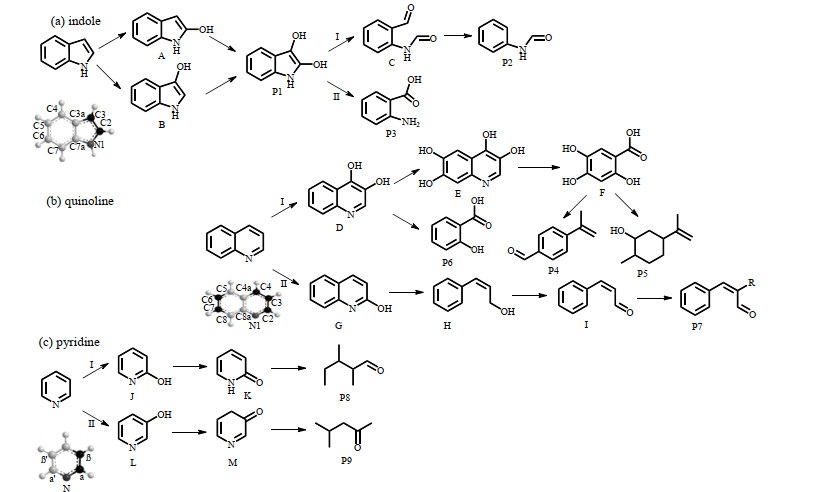
|
图 5 吲哚、喹啉、吡啶的降解路径 Fig.5 Possible degradation pathways of indole, quinoline and pyridine |
在Fe(Ⅵ)氧化吲哚的过程中,Fe(Ⅵ)先与吡咯环上C2、C3位的碳原子发生氢原子取代反应,形成2-羟基吲哚(A)或3-羟基吲哚(B),得到的单羟基吲哚会进一步与Fe(Ⅵ)反应生成2,3-双羟基吲哚(P1)。由于吲哚是吡咯和苯环稠合而成的化合物,其分子结构中吡咯环上的电子密度比苯环高,因此氧化剂与吲哚发生亲电取代反应时取代基主要进入C2和C3位[24],得到吡咯环上的取代产物2,3-双羟基吲哚。2,3-双羟基吲哚在相邻羟基的影响下,可能经过2条路径发生开环反应。路径Ⅰ:吡咯环相邻羟基间C─C键(富电子基团)断裂,形成N-(2-醛基苯基)-甲酰胺(c),继续发生脱羰反应,最终生成甲苯酰胺(P2)。该过程的反应位点与吲哚生物降解的位点相同,但二者的产物不同[25]。路径Ⅱ:吡咯环上氮原子与相邻羟基间的C─N键断裂,生成氨基甲苯酸(P3)。该产物也是好氧条件下吲哚生物降解的主要产物[26]。
Fe(Ⅵ)氧化喹啉可能的降解路径有2条。路径Ⅰ:Fe(Ⅵ)先后攻击C3、C4和C6、C7 4个活性位点,形成二羟基喹啉(D)。部分二羟基喹啉(D)逐渐生成四羟基喹啉(E)后,发生脱碳、脱氮、苯环的加成反应,最终形成紫苏醛(P4)或二氢香芹醇(P5)。而部分二羟基喹啉(D)则直接经过脱碳脱氮、进一步氧化最终形成聚合水杨酸(P6)。聚合水杨酸也是O3/UV工艺降解喹啉的产物之一[27]。喹啉分子C2位点的电荷虽不如C3、C4位点丰富,但也是可被攻击的活性位点[28]。因此,也可能发生路径Ⅱ的反应,即:Fe(Ⅵ)攻击C2位点,形成单羟基喹啉(G),随后发生脱氮反应生成反式-肉桂醇(H),进一步氧化为反式-肉桂醛(I),最终与长链反应生成反式-肉桂醛衍生物(P7)。
Fe(Ⅵ)氧化吡啶可能的降解路径有2条。Fe(Ⅵ)与吡啶氮原子邻(α)位(路径Ⅰ)或间(β)位(路径Ⅱ)上的碳原子发生反应形成2-羟基吡啶(J)或3-羟基吡啶(L),该攻击位点与Lv等[29]利用电化学方法及Shi等[30]利用电辅助生物光降解系统降解吡啶的位点一致,是由于氮原子的存在造成了其α、β位碳原子电子云密度降低。随后发生加成及氧化反应形成2-吡啶酮(K)或3-吡啶酮(M),经脱氮、加成后最终形成2, 3-二甲基戊醛(P8)或4-甲基-2-戊酮(P9)。在中性(pH=7)条件下,Fe(Ⅵ)降解吡啶的最终产物P8、P9与其他方法降解吡啶的产物不同,这可能与反应溶液的pH值有关。Lv等[29]发现在酸性条件下吡啶具有强极性,HO⋅首先攻击N═C双键,开环后形成2-甲基-1-戊烷、2-甲基-1-戊烯、乙基环丁烷等烯烃或烷烃。在碱性条件下,具有较强电子倾向的HO⋅优先攻击β位,发生亲电取代反应生成2-酮-3,4,5-三甲基二氢呋喃、2,4-二甲基-3-戊酮等呋喃类和酮类。可见,pH值会影响吡啶的化学性质,进而影响其开环方式及不同开环中间体的形成。
综上所述,Fe(Ⅵ)降解NHCs的第一步均为羟基化产物的生成,随后经过加成、脱氮、脱羰等反应实现氮杂环的开环,从而达到氧化降解NHCs的目的。
3.2.3 TOC变化监测反应过程中TOC的变化如图 6。反应条件:25 ℃,吲哚、喹啉、吡啶的pH分别为7、5、7,n (ID): n[Fe(Ⅵ)]=1:15,n(QL): n[Fe(Ⅵ)]=1:5,n(PD): n[Fe(Ⅵ)]=1:3。

|
图 6 吲哚、喹啉、吡啶反应过程中的TOC变化 Fig.6 TOC variations during indole, quinoline and pyridine degradation |
上述条件下,吲哚的矿化率可达24.07 %。结合产物分析可知,Fe(Ⅵ)降解吲哚除生成甲苯酰胺、氨基甲苯酸外,有约24% 的吲哚最终被完全矿化。对比文献报道可见,Fe(Ⅵ)对吲哚的矿化率高于臭氧对吲哚[6]的矿化率。喹啉的矿化率可达43.87%,说明Fe(Ⅵ)降解喹啉除生成紫苏醛、二氢香芹醇、聚合水杨酸外,有约44% 的喹啉最终被矿化。而吡啶矿化率较低。
4 结论(1) 25 ℃下,Fe(Ⅵ)可在pH=7,n(ID): n[Fe(Ⅵ)]=1:15的条件下,15 min内对吲哚的去除率达77.91%,矿化率达24.07%;在pH=5,n (QL): n[Fe(Ⅵ)]=1:5时,10 min内对喹啉的降解率达81.16%,矿化率达43.87%;在pH=7,n(PD): n[Fe(Ⅵ)]=1:3时,5 min内对吡啶的去除率达36.89%,矿化率达8.23%。
(2) 中性条件下Fe(Ⅵ)氧化吲哚过程中只有少数HO⋅参与反应,高价态铁发挥了主要作用。而酸性条件下Fe(Ⅵ)氧化喹啉过程中产生的HO⋅较多,HO⋅在反应过程中起了重要作用。酸性条件下Fe(Ⅵ)氧化吡啶过程中HO⋅起了一定作用。
(3) Fe(Ⅵ)对吲哚的降解包括羟基取代及氧化、脱羰等过程,生成氨基苯甲酸和甲苯酰胺。Fe(Ⅵ)对喹啉的降解包括羟基取代及氧化、苯环加成等过程,生成紫苏醛、二氢香芹醇、聚合水杨酸、反式-肉桂醛衍生物。Fe(Ⅵ)对吡啶的降解包括羟基取代与氧化、氮杂环的加成等过程,生成2, 3-二甲基戊醛、4-甲基-2-戊酮。Fe(Ⅵ)降解NHCs的第一步均为羟基化产物的生成。
| [1] |
PHILIPP B, ANNE S, ANDREAS T, et al. Importance of heterocylic aromatic compounds in monitored natural attenuation for coal tar contaminated aquifers: A review[J]. Journal of Contaminant Hydrology, 2011, 126(3): 181-194. |
| [2] |
SHI J X, HAN H J, XU C Y. A novel enhanced anaerobic biodegradation method using biochar and Fe(OH)3@biochar for the removal of nitrogen heterocylic compounds from coal gasification wastewater[J]. Science of the Total Environment, 2019, 697(C): 134052. |
| [3] |
ZHU G, XING F F, TAO J Z, et al. Synergy of Strains that accelerate biodegradation of pyridine and quinolone[J]. Journal of Environmental Management, 2021, 285: 112119. DOI:10.1016/j.jenvman.2021.112119 |
| [4] |
SUN Y, GU Y P, YANG J P. Adsorption of N-heterocyclic compounds from aqueous solutions by sulfonic acid-functionalized hypercrosslinked resins in batch experiments[J]. Chemical Engineering Journal, 2022, 428: 131163. DOI:10.1016/j.cej.2021.131163 |
| [5] |
OKHRIMENKO D V, LAKSHTANOV L Z, OLSSON M H M, et al. Adsorption of nitrogen heterocyclic compounds(NHC) on soil minerals: Quinoline as an example[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2020, 611: 125899. |
| [6] |
YAO Y, XIE B, ZHAO L, et al. N-dependent ozonation efficiency over nitrogen-containing: A combined density functional theory study on reaction kinetics and degradation pathway[J]. Chemical Engineering Journal, 2020, 382(C): 122708. |
| [7] |
ZHANG P, ZHANG G, DONG J, et al. Bisphenol A oxidative removal by ferrate(Fe(Ⅵ)) under a weak acidic condition[J]. Separation & Purification Technology, 2012, 84: 46-51. |
| [8] |
MANOLI K, GHOSH M, RENAUD L, et al. Rapid removal of acesulfame potassium by acid-activated ferrate(Ⅵ) under mild alkaline conditions[J]. Chemosphere, 2019, 230: 416-423. DOI:10.1016/j.chemosphere.2019.05.069 |
| [9] |
LIU M Z, WU N N, TIAN B R, et al. Experimental and theoretical study on the degradation of Benzophenone-1 by Ferrate(Ⅵ): New insights into the oxidation mechanism[J]. Journal of Hazardous Materials, 2022, 425: 127877. DOI:10.1016/j.jhazmat.2021.127877 |
| [10] |
ZHANG Z, LI X, ZHANG C, et al. Combining ferrate(Ⅵ) with thiosulfate to oxidize chloramphenicol: Influencing factors and degradation mechanism[J]. Journal of Environmental Chemical Engineering, 2020(9): 104625. |
| [11] |
LU D Y, ZHENG L, ZHANG H Q, et al. Coagulation of colloidal particles with ferrate(Ⅵ)[J]. Environmental Science: Water Research & Technology, 2018, 4(5): 701-710. |
| [12] |
LIU Y L, WANG L, HUANG Z S, et al. Oxidation of odor compound indole in aqeous solution with ferrate(Ⅵ): Kinetics, pathway and variation of assimilable organic carbon[J]. Chemical Engineering Journal, 2018, 331: 31-38. DOI:10.1016/j.cej.2017.07.171 |
| [13] |
ZHU J H, YU F L, MENG J R, et al. Overlooked role of Fe(Ⅳ) and Fe(Ⅴ) in organic contaminant oxidation by Fe(Ⅵ)[J]. Environmental Science & Technology, 2020, 54(15): 9702-9710. |
| [14] |
YANG B, YING G G. Oxidation of benzophenone-3 during water treatment with ferrate(Ⅵ)[J]. Water Research, 2013, 47(7): 2458-2466. DOI:10.1016/j.watres.2013.02.018 |
| [15] |
HAN Q, WANG H J, DONG W, et al. Degradation of bisphenol A by ferrate(Ⅵ) oxidation: Kinetics, products and toxicity assessment[J]. Chemical Engineering Journal, 2015, 262: 34-40. DOI:10.1016/j.cej.2014.09.071 |
| [16] |
SHARMA V K. Ferrate(Ⅵ) and ferrate(Ⅴ) oxidation of organic compounds: Kinetics and mechanism[J]. Coordination Chemistry Reviews, 2013, 257(2): 495-510. DOI:10.1016/j.ccr.2012.04.014 |
| [17] |
WILDE M L, MAHMOUD W M M, KUMMEREE K, et al. Oxidation-coagulation of β-blocks by K2FeⅥO4 in hospital wastewater: Assessment of degradation products and biodegradability[J]. Science of the Total Environment, 2013, 452/453: 137-147. DOI:10.1016/j.scitotenv.2013.01.059 |
| [18] |
CASBEER E M, SHARMA V K, ZAJICKOVA Z, et al. Kinetics and mechanism of oxidation of tryptophan by ferrate(Ⅵ)[J]. Environmental Science & Technology, 2013, 47(9): 4572-4580. |
| [19] |
LUO Z Y, LI X M, ZHAI J. Kinetic investigations of quinolone oxidation by ferrate(Ⅵ)[J]. Environmental Technology, 2016, 37(10): 1249-1256. DOI:10.1080/09593330.2015.1111424 |
| [20] |
ZHOU Z W, JIANG J Q. Reaction kinetics and oxidation products formation in the degradation of ciprofloxacin and ibuprofen by ferrate(Ⅵ)[J]. Chemosphere, 2015, 119: S95-S100. DOI:10.1016/j.chemosphere.2014.04.006 |
| [21] |
XIE X D, CHENG H F. A simple treatment method for phenylarsenic compounds: Oxidation by ferrate(Ⅵ) and simultaneous removal of the arsenate released with in situ form Fe(Ⅲ) oxide-hydroxide[J]. Environment International, 2019, 127: 730-741. DOI:10.1016/j.envint.2019.03.059 |
| [22] |
TIAN S Q, WANG L, LIU Y L, et al. Degradation of organic pollutants by ferrate/biochar: Enhanced formation of strong intermediate oxidative iron species[J]. Water Research, 2020, 183: 116054. DOI:10.1016/j.watres.2020.116054 |
| [23] |
BUXTON G V, GREENSTOCK C L, HELMAN W P, et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals(⋅OH/⋅O−) in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 2009, 17(2): 513-886. |
| [24] |
XING X, ZHU X P, LI H N, et al. Electrochemical oxidation of nitrogen-heterocyclic compounds at boron-doped diamond electrode[J]. Chemosphere, 2011, 86(4): 368-375. |
| [25] |
MA Q, ZHANG X W, QU Y Y, et al. Biodegradation and Biotransformation of Indole: Advances and Perspectives[J]. Frontiers in Microbiology, 2018, 9: 2625. DOI:10.3389/fmicb.2018.02625 |
| [26] |
KUMARA P, ASHUTOSH S, HAN B. Microbial degradation of Indole and its derivatives[J]. E-Journal of Chemistry, 2015, 2015: 1-13. |
| [27] |
LUO Y H, YUE X P, WEI P, et al. A state-of-the-art review of quinolone degradation and technical bottlenecks[J]. Science of the Total Environment, 2020, 747: 141136. DOI:10.1016/j.scitotenv.2020.141136 |
| [28] |
JIAO Z J, ZHANG X M, GONG H F, et al. CuO-doped Ce for catalytic wet peroxide oxidation degradation of quinoline wastewater under wide pH conditions[J]. Journal of Industrial and Engineering Chemistry, 2022, 105: 49-57. DOI:10.1016/j.jiec.2021.10.006 |
| [29] |
LV P, YANG C Q, DENG J J, et al. Detection of HO⋅ in electrochemical process and degradation mechanism of pyridine[J]. Journal of Applied Electro-Chemistry, 2020, 50: 1139-1147. DOI:10.1007/s10800-020-01468-3 |
| [30] |
SHI H F, CHEN D, JIANG X B, et al. Simultaneous high-concentration pyridine removal and denitrification in an electricity assisted bio-photodegradation system[J]. Chemical Engineering Journal, 2022, 430(P4): 132598. |