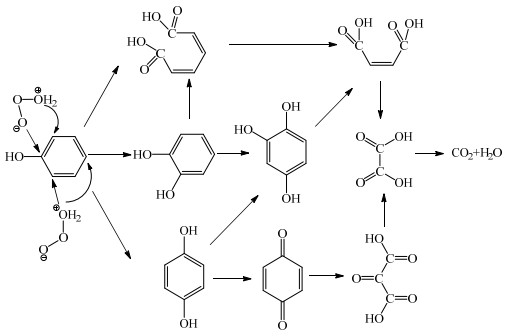
臭氧(O3)是一种三原子分子,由三个氧原子组成。低层大气中的臭氧是对动物呼吸系统有害的空气污染物。暴露在浓度为0.1~1 mg·L-1的臭氧环境中会导致头痛,眼睛烧灼感和对呼吸道的刺激[1]。即使空气中低浓度的臭氧也会破坏乳胶,塑料和肺部组织等各种有机物质。臭氧可以通过几种方法产生,例如电晕放电,紫外线和等离子体[2]。在工业上,臭氧可被用于氧化降解水中的污染物,如铁,砷,硫化氢,亚硝酸盐和复杂的有机物。在各种工业生产过程中,苯酚是重要的原料或中间体之一。现已知苯酚具有致癌性、高稳定性和高毒性。即使它浓度非常低,仍被归为有害污染物[3]。它损害人类和动物的皮肤和其他组织。含酚液体可能会导致肝脏损伤,尿液变黑和心脏跳动不规则。因此,酚类废水的处理在环境保护中具有相当重要的意义。许多技术已经被尝试用于处理酚类废水,然而均具有技术上的局限性,例如生物处理中微生物有限的降酚能力[4],化学沉淀或氧化方法易产生二次污染[5],离子交换方法的复杂过程、二次污染等问题[6]和吸附方法中吸附剂的回收、二次污染等问题[7]。生化法等传统方法对于高COD (化学需氧量,chemical oxygen demand)浓度废水处理效果较好,而对于低COD浓度废水的处理收益不佳,若通过臭氧氧化降解高COD浓度废水需要消耗大量臭氧,臭氧的利用率低且降解效果较差,可先通常采用生化法等传统处理方法进行前处理,再通过臭氧非均相催化氧化法彻底降解传统处理方法无法处理的低COD浓度含酚废水。本文通过建立臭氧非均相氧化体系有效的降解COD浓度为500 mg·L-1的苯酚废水,降解体系使用新型多组分催化剂(活性成分为铁、钴、铜和锰金属氧化物,总含量为10%,文中催化剂用量均指活性成分含量),检测水样的COD和TOC (total organic carbon)以考察降解效果,苯酚废水的降解机理见图 1[8]。
|
图 1 臭氧氧化苯酚的反应历程 Fig.1 Simplified reaction network of phenol ozonation |
主要试剂:苯酚,硫酸,邻苯二甲酸氢钾,氢氧化钠,硫酸亚铁,重铬酸钾,硫酸亚铁铵,硫酸银,碘化钾,硫代硫酸钠,硫酸汞,淀粉,1, 10-菲绕啉,硝酸铁,硝酸铜,硝酸钴,硝酸锰,均为分析纯,陶粒。
仪器:三口烧瓶(500 mL)、BSA224S型分析天平、JJ-1型电动搅拌器、DC-2006型低温恒温槽、SZCL-2型数显智能控温磁力搅拌器、DZF-6050型真空干燥箱、GZX-9070MBE型数显鼓风干燥箱、CF-YG20型臭氧制氧一体机、5B-3A型COD快速测定仪、TOC-V CPH型TOC分析仪。
2.2 催化剂制备选用粒径3~5 mm的陶粒用去离子水洗净烘干经过热活化后备用。将活化处理后的陶粒载体取100 g置于500 mL一定浓度的硝酸盐溶液(制备Fe2O3催化剂时,加入Fe(NO3)3溶液;制备多组分催化剂时,加入同物质的量的Fe(NO3)3,Co(NO3)2,Cu(NO3)2和Mn(NO3)2混合溶液)中搅拌6~8 h,浸渍24 h,过滤后在120 ℃烘干,置于马弗炉中在800 ℃下焙烧6 h,最终制得金属氧化物催化剂,金属氧化物负载量约占催化剂含量10%。
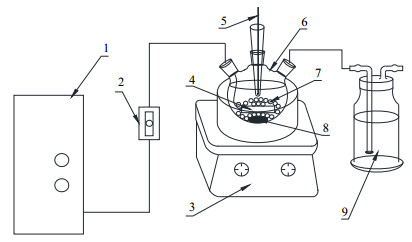
2.3 实验及分析方法臭氧非均相催化氧化实验装置如图 2。在三口烧瓶中加入一定量苯酚,控制原水COD为500 mg·L-1。催化剂2 g·L-1 (催化剂含量均指活性成分含量),用4 mg·L-1 NaOH和稀硫酸调节至特定pH,搅拌升温至指定温度。以空气为气源,通过臭氧制氧一体机制备出60 mg·L-1的臭氧,再经气体流量计调节至特定的臭氧气量。待升至指定温度,开始通入臭氧,反应计时开始。反应结束后,用5B-3A型COD快速测定仪和TOC-V CPH型TOC分析仪进行产物分析;采用碘量法(CJ/T 3028.2—1994)[9]测定臭氧质量浓度。
|
图 2 非均相臭氧化反应装置图 Fig.2 Schematic diagram of the experimental setup for heterogeneous ozonation 1. ozonator 2. gas flow meter 3. temperature controlled magnetic stirrer 4. aerator 5. temperature sensor 6. tree-necked flask 7. catalyst layer 8. magnet rotor 9. tail gas absorption bottle |
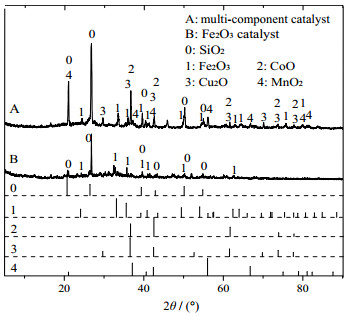
对制得的Fe2O3催化剂和多组分催化剂进行XRD (X射线单晶衍射,X-ray diffraction)表征,得到的XRD图谱如图 3所示。
|
图 3 催化剂的XRD图谱 Fig.3 X-ray powder diffraction patterns of the catalysts |
由图 3可见:通过对比PDF标准卡片,发现陶粒的主要物相为SiO2,负载金属活性组分后的催化剂的物相除了SiO2,Fe2O3催化剂的XRD图谱中出现了Fe2O3 (24.138°、33.152°、35.611°、39.276°、40.854°、49.479°)的衍射峰,铁已成功负载在陶粒上;多组分催化剂XRD图谱中出现了Fe2O3 (24.138°、33.152°、35.611°、39.276°、40.854°、49.479°和54.089°)、CoO (36.503°、42.401°、61.520°、73.700°和77.562°)、Cu2O (29.554°、36.418°、42.297°、61.344°、69.569°、73.526°和77.323°)和MnO2 (21.034°、37.120°、42.401°、56.027°、66.761°、81.087°和82.350°)的衍射峰,分别对应PDF标准卡片33-0664、43-1004、05-0667和30-0820,说明铁、钴、铜和锰4种金属氧化物均已成功负载在陶粒上。
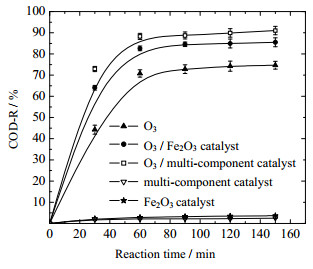
3.2 不同催化剂的影响对于拥有特殊价电子结构的过渡金属元素,它们的d轨道未排满,既可以作为亲核试剂提供孤对电子,又可以作为亲电试剂提供空轨道,因此具有很强的催化性能。相关的研究[10-12]发现,过渡金属氧化物对臭氧具有较为明显的催化作用。在COD为500 mg·L-1,进料pH为6.63,催化剂用量2 mg·L-1,反应温度20 ℃,反应时间150 min,臭氧浓度60 mg·L-1,气体流量1 L·min-1条件下,每30 min取一次样,考察不同催化剂对水样COD和TOC去除率的影响如图 4和5所示。
|
图 4 不同催化剂对COD去除率的影响 Fig.4 Effects of different catalysts on COD removals |
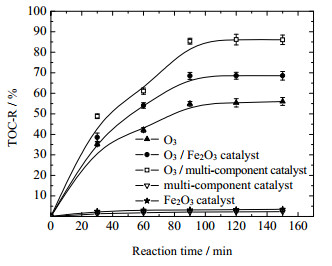
|
图 5 不同催化剂对TOC去除率的影响 Fig.5 Effects of different catalysts on TOC removals |
从图 4可以看出,不同反应体系下水样COD的去除率增势均在反应时间60 min时趋于平缓,水样COD的去除率从大到小排列为:O3/多组分催化剂 > O3/Fe2O3催化剂 > O3,分别对应88.29%,82.60%和70.75%。与无催化剂O3氧化体系相比,O3/多组分催化剂体系和O3/Fe2O3催化剂体系对水样COD去除率分别增加了15.87%和11.72%。
从图 5可以看出,不同反应体系下水样TOC的去除率增势均在反应时间90 min时趋于平缓,水样TOC的去除率从大到小排列为:O3/多组分催化剂 > O3/Fe2O3催化剂 > O3,分别为85.39%,68.49%和54.89%。与无催化剂O3氧化体系相比,O3/多组分催化剂体系和O3/Fe2O3催化剂体系对水样TOC去除率分别增加了30.50%和13.60%。这是由于催化剂除了自身对水样中的有机物具有一定吸附作用并能利用间隙分割臭氧气泡使其变小从而增加气液混合程度,还可以与臭氧、水样形成非均相催化氧化体系,增加臭氧在水中分解产生的羟基自由基数量,从而促进水样深度氧化。多组分催化剂相较于Fe2O3催化剂,多了钴、铜、锰的氧化物,能够进一步促进臭氧分解反应;可能含有p型氧化物,p型氧化物较之n型金属氧化物的氧吸附量更大,且吸附的O3、O2会电离成O-、O2-和OH-,使阴离子物质趋于稳定,对臭氧分解反应更有活性[13-15]。
综合3种催化氧化体系对水样COD和TOC去除效果考虑,选用多组分催化剂为本实验催化剂。
3.3 催化剂用量的影响在COD为500 mg·L-1,进料pH为6.63,反应温度20 ℃,反应时间90 min,臭氧浓度60 mg·L-1,气体流量1 L·min-1条件下,考察多组分催化剂用量对水样COD和TOC去除率的影响,如图 6所示。
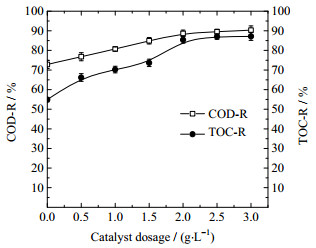
|
图 6 催化剂用量对水样COD和TOC去除率的影响 Fig.6 Effects of catalyst dosage on COD and TOC removals |
从图 6可以看出,随多组分催化剂用量增加,水样的COD和TOC去除率均先增加,在催化剂用量2 g·L-1时分别达到88.71%和85.39%后,增势开始趋于平缓,与仅通入臭氧处理水样相比,对应增加了15.87%、30.50%。再增加催化剂用量,COD和TOC的去除率会稍微增加,考虑到催化剂本身有的吸附作用,可见过量的催化剂对水样处理并没有明显促进效果,因此选择催化剂用量2 g·L-1。
3.4 反应时间的影响图 7为反应时间对水样COD和TOC去除率的影响。反应条件:COD为500 mg·L-1,进料pH为6.63,催化剂用量2 g·L-1,反应温度20 ℃,臭氧浓度60 mg·L-1,气体流量1 L·min-1,每30 min取一次样并测定其COD和TOC。
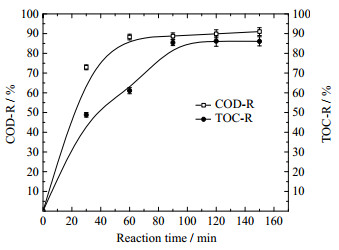
|
图 7 反应时间对水样COD和TOC去除率的影响 Fig.7 Effects of reaction time on COD and TOC removals |
从图 7可以看出,随反应的进行,水样的COD去除率快速增加,在60 min时达到为88.29%,而后趋于平缓;在0~60 min内,水样的TOC降解速度明显低于COD,去除率表现为快速增加后增势稍稍变缓,60 min后又快速增加,90 min后达到85.39%并趋于平缓。这是由于,反应时间在0~60 min时,臭氧主要氧化苯酚成邻苯二酚、顺丁烯二酸等中间产物[16],COD的去除率较高,而TOC的去除率较低;60 min后,主要发生臭氧氧化中间产物的过程,COD在前一阶段已经降解很大部分,因而变化不大,而TOC的去除效果显著提高。因此反应时间适宜控制在90 min。
3.5 臭氧进气量的影响图 8为臭氧进气量对水样COD和TOC去除率的影响。反应条件:COD为500 mg·L-1,进料pH为6.63,催化剂用量2 g·L-1,反应时间90 min,反应温度20 ℃,臭氧浓度60 mg·L-1,在不同臭氧进气量下反应并测定其COD和TOC。
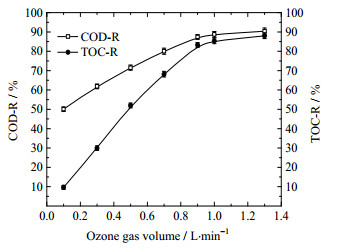
|
图 8 臭氧进气量对水样COD和TOC去除率的影响 Fig.8 Effects of ozone gas volume on COD and TOC removals |
从图 8可以看出,其它条件不变,当臭氧进气量在0.1~0.9 L·min-1时,COD去除率明显高于TOC,随着臭氧进气量的增加,两者差距慢慢减少,分别于臭氧进气量1.0 L·min-1时达到最高为88.71%和85.39%。可以认为,低气量下,臭氧氧化苯酚过程具有选择性,主要将其氧化为邻苯二酚、顺丁烯二酸等非彻底氧化产物,反应前后,COD发生明显变化而相应TOC变化较小。由此说明,最佳进气量为1 L·min-1。
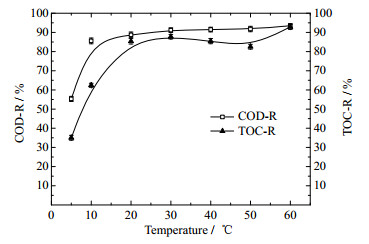
3.6 反应温度的影响图 9为进料温度对水样COD和TOC去除率的影响。反应条件:COD为500 mg·L-1,进料pH为6.63,催化剂用量2 g·L-1,反应时间90 min,臭氧浓度60 mg·L-1,气体流量1 L·min-1,在不同进料温度下反应并测定其COD和TOC。
|
图 9 进料温度对水样COD和TOC去除率的影响 Fig.9 Effects of temperature on COD and TOC removals |
从图 9可以看出,在低温5~15 ℃时,COD和TOC的去除率均急剧增加,在此进料温度范围内,主要进行了苯酚的初步氧化,O3对COD与TOC的去除均有明显效果;当进料温度处于15~30 ℃时,COD去除率增势趋于平缓,而TOC去除率仍在快速增加,此阶段主要进行了苯酚的深度氧化,如顺丁烯二酸和草酸等羧酸类的氧化过程,体现在TOC的大幅去除;在温度范围30~50 ℃内,COD去除率略有下降,TOC去除率有明显下降趋势,作者认为此阶段臭氧溶解度降低导致反应方式以气液接触占主导,使得苯酚的氧化程度变低;对于大于50 ℃的中高进料温度,温升对于反应的促进拮抗于臭氧溶解度的下降并慢慢占据了主导,体现在TOC和COD去除率的提高[17]。
结果表明,当进料温度达到30 ℃时,COD和TOC的去除率分别达到第一次峰值91.16和87.74%;在进料温度高于50 ℃后,二者去除率呈现上升趋势,并均于60 ℃时超过进料温度30 ℃,但考虑到经济性,在实际应用时的废水不采取升温的方式来提高COD和TOC去除率。因此,选择进料的最佳温度为30 ℃。
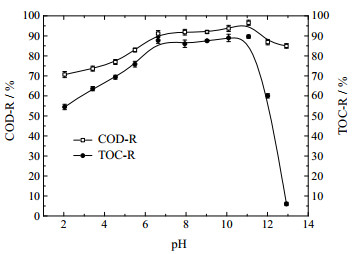
3.7 pH的影响图 10为进料pH对水样COD和TOC去除率的影响。反应条件:COD为500 m g·L-1,进料温度为30 ℃,催化剂用量2 g·L-1,反应时间90 min,臭氧浓度60 m g·L-1,气体流量1 L·min-1,在不同进料温度下反应并测定其COD和TOC。
|
图 10 进料pH对水样COD和TOC去除率的影响 Fig.10 Effects of pH on COD and TOC removals |
从图 10可以看出,其它条件不变,当进料pH在2.00~6.63时,COD和TOC去除率随着pH的增大而快速增高,此阶段为臭氧直接氧化占主导地位,主要发生初始快速反应[18-19];当进料pH在6.63~11.00时,COD和TOC去除率均达到较高水平并随着pH的增大而提高,在进料pH为11.00时分别达到最高去除率96.56%和89.63%,此阶段为自由基间接氧化占主导地位,不仅发生初始快速反应,更进行了深度慢速氧化反应[19-20];当进料pH高于11.00时,随着进料pH的增大,COD和TOC去除率均迅速下降,这是由于少部分苯酚被深度氧化为CO2在强碱性体系中转化为CO32-及HCO3-离子,抑制了苯酚的氧化过程[19]。由此说明,最佳为进料pH为11.00。
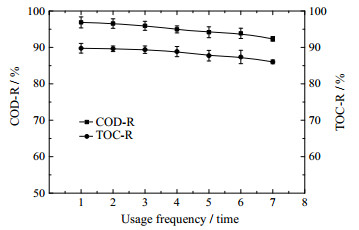
3.8 多组分催化剂的稳定性研究图 11为多组分催化剂的使用频率对水样COD和TOC去除率的影响。反应条件:COD为500 mg·L-1,进料pH为11.00,催化剂用量2 g·L-1,反应时间90 min,反应温度20 ℃,臭氧浓度60 mg·L-1,气体流量1 L·min-1,分别反应1、2、3、4、5、6和7次后测定相应的COD和TOC。
|
图 11 催化剂使用频率对COD和TOC去除率的影响 Fig.11 Effects of usage frequency of catalyst on COD and TOC removals |
从图 11可以看出,催化剂的重复使用对COD和TOC的去除效果有一定影响,随着催化剂重复使用的频率增加,COD和TOC去除率都略有下降,催化剂经过7次的重复使用,COD和TOC去除率分别降低了4.53%和3.73%。这是由于在此催化氧化体系中,催化剂的活性组分会略有流失,并有少量污染物沉积于催化剂孔隙中,造成臭氧和有机物在催化剂上的反应位点减少,从而导致COD和TOC的去除率略有降低[21]。总体而言,催化剂稳定性良好。
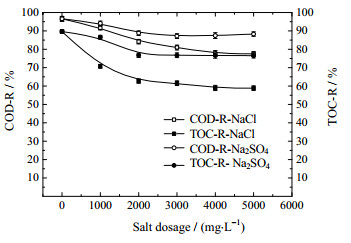
3.9 盐含量的影响许多工业上的污水中往往含有一定的钠盐,为了将此工艺推广至工业应用,考察钠盐对体系降解的影响必不可少。图 12为单盐(NaCl、Na2SO4)含量对水样COD和TOC去除率的影响,表 1为混合盐含量配比对水样COD和TOC去除率的影响。反应条件:COD为500 mg·L-1,进料温度为30 ℃,进料pH为11.00,催化剂用量2 g·L-1,反应时间90 min,臭氧浓度60 mg·L-1,气体流量1 L·min-1,在不同盐含量下反应并测定其COD和TOC。
|
图 12 盐含量对COD和TOC去除率的影响 Fig.12 Effects of salt dosage on COD and TOC removals |
|
|
表 1 混合盐含量对COD和TOC去除率的影响 Table 1 Effects of mixed salt dosage on COD and TOC removals |
从图 12和表 1可以看出,其它条件不变,NaCl的含量变化对COD和TOC去除率的影响较之Na2SO4明显很多。已有研究表明[22],溶液中的NaCl和Na2SO4会通过竞争苯酚在催化剂上的吸附位点抑制苯酚的降解过程,因此,随着盐含量的增加,COD和TOC去除率会呈现下降趋势,然而影响有限;另一方面,NaCl在水中以Na+和Cl-形态存在,Cl-为低价态阴离子,氧化还原电位低于高价态离子ClO- (E0=1.49V)会消耗体系中部分氧化剂O3 (E0=2.07 V)、OH·自由基(E0= 2.73V),从而对苯酚的降解过程产生更大抑制[23]。通过控制六组不同盐配比,可以看出,添加NaCl和Na2SO4混合盐于水样,COD和TOC去除率总体趋势随NaCl含量增加而降低,并由于溶液效应相比于仅添加NaCl时的去除率略低。
4 结论本文采用臭氧非均相氧化法对主要含苯酚的废水进行降解处理,并对非均相催化剂进行了对比筛选,反应较佳条件为:COD为500 mg·L-1,进料温度为30 ℃,进料pH为11.00,催化剂用量2 g·L-1,反应时间90 min,臭氧浓度60 mg·L-1,气体流量1 L·min-1,COD和TOC值分别为17和16 mg·L-1,去除率分别达到96.56%和89.63%,均可达到国家一级排放标准(COD ≤ 60 mg·L-1,TOC ≤ 20 mg·L-1) [24]。在其它条件维持不变时,其中进料pH、反应时间和臭氧气体流量对含酚废水的COD和TOC去除影响最显著,为主要控制因素。通过控制添加钠盐的含量,考察钠盐对体系降解程度的影响。其它条件不变,控制添加单盐含量可以得出,NaCl的含量变化对COD和TOC去除率的影响较之Na2SO4明显很多,COD和TOC去除率均随盐含量增加而降低;添加NaCl和Na2SO4混合盐于水样,COD和TOC去除率总体趋势随NaCl含量增加而降低,并由于溶液效应相比于仅添加NaCl时的去除率略低。
| [1] |
BROWN T L. Chemistry: The central science[M]. Niscair-Csir: Pearson Education, 2009.
|
| [2] |
WEI L S, YUAN D K, ZHANG Y F, et al. Experimental and theoretical study of ozone generation in pulsed positive dielectric barrier discharge[J]. Vacuum, 2014, 104(2): 61-64. |
| [3] |
ZAZO J A, CASAS J A, MOHEDANO A F, et al. Catalytic wet peroxide oxidation of phenol with a Fe/active carbon catalyst[J]. Applied Catalysis B: Environmental, 2006, 65(3/4): 261-268. |
| [4] |
STEPHEN D P, AVALUR K B. Phycoremediation of phenolic effluent of a coal gasification plant by chlorella pyrenoidosa[J]. Process Safety and Environmental Protection, 2017, 111: 31-39. DOI:10.1016/j.psep.2017.06.006 |
| [5] |
LUCAS M S, DIAS A A, SAMPAIO A, et al. Degradation of a textile reactive azo dye by a combined chemical-biological process: Fenton's reagent-yeast[J]. Water Research, 2007, 41(5): 1103-1109. DOI:10.1016/j.watres.2006.12.013 |
| [6] |
谢祖芳, 童张法, 陈渊, 等. 717阴离子交换树脂选择吸附分离水杨酸和苯酚[J]. 高校化学工程学报, 2011, 25(1): 49-54. XIE Z F, TONG Z F, CHEN Y, et al. Selective adsorption and separation of salicylic acid and phenol by 717 anion exchange resin[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(1): 49-54. DOI:10.3969/j.issn.1003-9015.2011.01.009 |
| [7] |
谷峥, 高芒来, 罗忠新, 等. 双吡啶盐改性膨润土的制备及其对苯酚的吸附性能研究[J]. 高校化学工程学报, 2013, 27(2): 309-315. GU Z, GAO M L, LUO Z X, et al. Preparation of bentonite modified by bis-pyridinium dibromides and its adsorption of phenol from aqueous solution[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(2): 309-315. |
| [8] |
BIGLARI H, AFSHAMIA M, ALIPOUR V, et al. A review and investigation of the effect of nanophotocatalytic ozonation process for phenolic compound removal from real effluent of pulp and paper industry[J]. Environmental Science and Pollution Research, 2016, 24(4): 1-12. |
| [9] |
中华人民共和国建设部.臭氧发生器臭氧浓度、产量、电耗的测量: CJ 3028.2-1994[S].北京: 中国标准出版社, 1994. Ministry of Construction of the People's Republic of China. The measures of ozone concentration, output and specific energy consumption for ozone generator: CJ 3028.2-1994[S]. Beijing: Standards Press of China, 1994. |
| [10] |
SUN Q, LI L, YAN H, et al. Influence of the surface hydroxyl groups of MnOx/SBA-15 on heterogeneous catalytic ozonation of oxalic acid[J]. Chemical Engineering Journal, 2014, 242(8): 348-356. |
| [11] |
ZHANG F, WEI C, HU Y, et al. Zinc ferrite catalysts for ozonation of aqueous organic contaminants: Phenol and bio-treated coking wastewater[J]. Separation and Purification Technology, 2015, 156: 625-635. DOI:10.1016/j.seppur.2015.10.058 |
| [12] |
QI F, CHU W, XU B. Ozonation of phenacetin in associated with a magnetic catalyst CuFe2O4: The reaction and transformation[J]. Chemical Engineering Journal, 2015, 262: 552-562. DOI:10.1016/j.cej.2014.09.068 |
| [13] |
IWAMOTO M, YODA Y, YAMAZOE N, et al. Study of metal oxide catalysts by temperature programmed desorption. 4. Oxygen adsorption on various metal oxides[J]. The Journal of Physical Chemistry, 1978, 82(24): 2564-2570. DOI:10.1021/j100513a006 |
| [14] |
NAWROCKI J, KASPLZYK-HORDEM B. The efficiency and mechanisms of catalytic ozonation[J]. Applied Catalysis B: Environmental, 2010, 99(1-2): 27-42. DOI:10.1016/j.apcatb.2010.06.033 |
| [15] |
WANG S, ZHAO W, GIUSTINIANO F, et al. Effect of oxygen and ozone on p-type doping of ultra-thin WSe2 and MoSe2 field effect transistors[J]. Physical Chemistry Chemical Physics, 2016, 18(6): 4304-4309. DOI:10.1039/C5CP07194A |
| [16] |
BELTRAN F J. Ozone reaction kinetics for water and wastewater systems[M]. Boca Raton: CRC Press, 2003.
|
| [17] |
STYLIANOU S K, KOSTOGLOU M, ZOUBOULIS A I. Ozone mass transfer studies in a hydrophobized ceramic membrane contactor: Experiments and analysis[J]. Industrial & Engineering Chemistry Research, 2016, 55(28): 7587-7597. |
| [18] |
HOIGNE J, BADER H. Rate constants of reactions of ozone with organic and inorganic compounds in water - I: Non-dissociating organic compounds[J]. Water Research, 1983, 17(2): 173-183. DOI:10.1016/0043-1354(83)90098-2 |
| [19] |
HOIGNE J, BADER H. Rate constants of reactions of ozone with organic and inorganic compounds in water - Ⅱ: Dissociating organic compounds[J]. Water Research, 1983, 17(2): 185-194. |
| [20] |
BOCZKAJ G, FEMANDS A. Wastewater treatment by means of advanced oxidation processes at basic pH conditions: A review[J]. Chemical Engineering Journal, 2017, 320: 608-633. DOI:10.1016/j.cej.2017.03.084 |
| [21] |
蔡应康, 刘茂春, 李卫星, 等. 臭氧催化氧化降解2, 4, 6-三氯苯酚研究[J]. 高校化学工程学报, 2018, 32(3): 725-730. CAI Y K, LIU M C, LI W X, et al. Study on catalytic ozonation of 2, 4, 6-trichlorophenol[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(3): 725-730. DOI:10.3969/j.issn.1003-9015.2018.03.030 |
| [22] |
YANG S Y, KIM D, PARK H. Shift of the reactive species in the Sb-SnO2-electrocatalyzed inactivation of E. coli and degradation of phenol: Effects of nickel doping and electrolytes[J]. Environmental Science & Technology, 2014, 48(5): 2877-2884. |
| [23] |
WANG H, SHEN Y, LOU Z, et al. Hydroxyl radicals and reactive chlorine species generation via E+-ozonation process and their contribution for concentrated leachate disposal[J]. Chemical Engineering Journal, 2019, 360(6): 721-727. |
| [24] |
国家环境保护总局, 污水综合排放标准: GB 8978-1996 [S], 北京: 中国标准出版社, 1996. State Environmental Protection Administration of the People's Republic of China. Integrated wastewater discharge standard: GB 8978-1996[S]. Beijing: Standards Press of China, 1996. |




