2. 浙江众成包装材料股份有限公司, 浙江 嘉善 314100;
3. 浙江众立合成材料科技股份有限公司, 浙江 平湖 314200
2. Zhejiang Zhongcheng Packing Material Co. Ltd., Jiashan 314100, China;
3. Zhejiang Zhongli Synthetic Material Technology Co. Ltd., Pinghu 314200, China
PIM447又称LGH447,是莫洛尼小鼠白血病病毒前病毒整合激酶(Provirus integrationin maloney murine leukemia virus,PIM)抑制剂[1-2]。PIM激酶可通过多种机制影响肿瘤细胞的存活与增殖[3-5]。PIM447是诺华通过先导化合物修饰制备得到[1],PIM447不仅体外可抑制mTORC1产生细胞毒性[6],在体内也具有调节靶标(pS6RP)作用。当前PIM447处于治疗多发性骨髓瘤的临床试验阶段[7]。Burger等[1, 9-13]对合成PIM447的报道多集中于构建手性环部分,而对另一重要中间体6-(2, 6-二氟苯基)-5-氟吡啶甲酸的合成描述相对简单。6-(2, 6-二氟苯基)-5-氟吡啶甲酸合成方法主要有2种:1)以2-溴-3-氟-6-甲基吡啶为起始物料,先与2, 6-二氟苯硼酸发生Suzuki反应,再经KMnO4氧化得到目标产物[9];2)以2-溴-3-氟-6-甲基吡啶为起始物料,依次经KMnO4氧化、酯化、Suzuki偶联、水解反应制备得到目标产物[12]。2种合成方法均使用强氧化剂KMnO4,具有一定的危险性,且后处理比较繁冗,更为关键的是郑宝富等[8]报道的氧化收率均不到20%。同时,路线较短的方法1)中Suzuki偶联反应需在高温微波下进行。此外,原料2-溴-3-氟-6-甲基吡啶在市场上无法大量购得。2种方法存在的不足之处严重制约工业化制备6-(2, 6-二氟苯基)-5-氟吡啶甲酸,进而影响PIM447的量产。
为了研究6-(2, 6-二氟苯基)-5-氟吡啶甲酸可放大的合成工艺,本文通过改变起始物料,经过优化反应条件,开发了收率高、操作简便、成本低的工艺。以价格低廉的5-氟吡啶-2-甲酸为原料,依次经氧化、氯代、卤素交换、酯化、Suzuki偶联、水解反应得到6-(2, 6-二氟苯基)-5-氟吡啶-2-甲酸。
2 实验方法 2.1 实验试剂与仪器 2.1.1 实验材料Avance III 400核磁共振仪(CDCl3为溶剂,TMS为内标)、Waters 3100 SQ单四极杆液质联用仪、Agilent高效液相色谱仪1200、巩义予华仪器有限公司循环水真空泵SHZ-DIII、北京泰克公司X-4型数字显微熔点仪。化学品均是市售分析纯试剂,未经精制直接使用。
2.2 分析方法化合物1纯度用高效液相色谱法(HPLC)检测。色谱柱:Symmetry C8,5 μm,4.6 mm×250 mm;检测波长:UV 230 nm;流速:1.0 mL·min-1;柱温:40 ℃;进样量:5 µL。流动相A:0.1% 磷酸水溶液;流动相B:乙腈;0~10 min:90%流动相A,10%流动相B;10~13 min:0% 流动相A,100% 流动相B梯度洗脱。
2.3 方法与步骤合成路线见图 1。
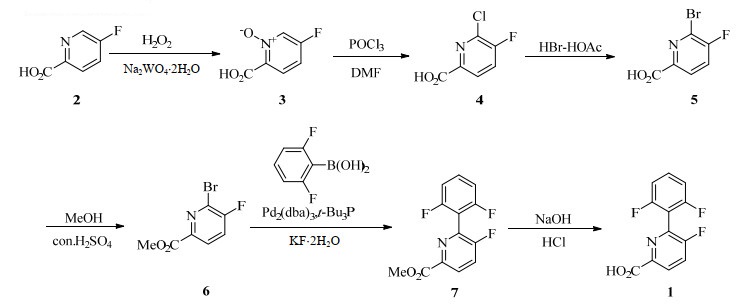
|
图 1 6-(2, 6-二氟苯基)-5-氟吡啶甲酸的合成路线 Fig.1 Synthesis route of 6-(2, 6-difluorophenyl)-5-fluoropicolinic acid |
在装有机械搅拌桨、温度计、滴液漏斗和回流冷凝器的4口瓶中,加入水100.0 g,Na2WO4·2H2O (3.5 g,0.01 mol),5-氟吡啶-2-甲酸(50.0 g,0.35 mol),开启搅拌并升温至100 ℃。缓慢滴加35% 双氧水(86.1 g,0.89 mol),再保温反应4 h。降温到0~5 ℃搅拌反应12 h,过滤,滤饼在60 ℃烘干得白色固体2-羧基-5-氟吡啶-1-氧化物(3) 53.0 g,收率:96.4%。
往4口烧瓶中加入化合物3(105.7 g,0.67 mol)与DMF(147.5 g,2.02 mol),开启搅拌并控温15~30 ℃,滴加POCl3(156.7 g,1.01 mol),滴毕反应1 h,将反应液倒入冰水,搅拌后过滤,烘干得到6-氯-5-氟吡啶-2-甲酸(4)113.8 g,收率:96.8%。
往干燥4口烧瓶中加入化合物4(108.3 g,0.62 mol),醋酸216.6 g,搅拌下加入33.0% HBr-HOAc溶液(226.9 g,0.93 mol),升温至70 ℃反应2 h。然后60 ℃减压蒸馏至无馏分流出,残留物为6-溴-5-氟吡啶-2-甲酸(5)。拆去蒸馏装置,直接往烧瓶中加入甲醇135.7 g,开启搅拌,然后室温下慢慢滴加浓硫酸(6.0 g,0.06 mol)。滴毕回流1 h,冷却至室温,加入冰水192.3 g,搅拌后过滤,烘干,得到浅灰色固体6-溴-5-氟吡啶-2-甲酸甲酯(6)115.9 g,收率:84.5%。
往4口烧瓶中加入化合物6(150.0 g,0.64 mol),2, 6-二氟苯硼酸(151.8 g,0.96 mol),KF·2H2O (120.7 g,1.3 mol),THF 400.0 g,水180.0 g。在氮气气氛中,向溶液中迅速加入t-Bu3P(50%)甲苯溶液(12.9 g,0.032 mol),再加入Pd2(dba)3 (5.9 g,0.006 4 mol),将体系温度升至50~55 ℃,反应1 h,加入乙酸乙酯1 100.0 g,水640.0 g,分液,有机相旋干,重结晶得到白色固体6-(2, 6-二氟苯基)-5-氟吡啶-2-甲酸甲酯(7)139.0 g,收率:81.3%。
往4口烧瓶中加入化合物7(120.0 g,0.45 mol),甲醇240.0 g,水80.0 g,30% 氢氧化钠(90.0 g,0.68 mol),室温下搅拌1 h,TLC检测反应完全,减压蒸馏除去溶剂。残留物加入水100.0 g,20% 盐酸调pH至1~2,再加入乙酸乙酯(100 g×3次)萃取,减压蒸馏除去有机溶剂,得到产品6-(2, 6-二氟苯基)-5-氟吡啶-2-甲酸(1)111.7 g,收率:98.0%。
化合物3核磁与质谱数据:1H NMR (400 MHz, CDCl3)化学位移δ: 8.49(dd, J = 6.8, 6.8 Hz, 1 H), 8.34(t, J = 2.8 Hz, 1 H), 7.49(m, 1 H);13C NMR (100 MHz, CDCl3) δ: 163.7, 160.7, 136.6, 133.5, 132.1, 125.3;LC-MS (EI) m/z (相对丰度): 158 ([M+1]+, 25), 113 (100), 89 (46), 67 (28);熔点:234~237 ℃。
化合物4核磁与质谱数据:1H NMR (400 MHz, CDCl3) δ: 8.24(dd, J = 3.6, 3.2 Hz, 1 H), 7.71(m, 1 H);13C NMR (100 MHz, CDCl3) δ: 164.3, 157.8, 144.9, 138.8, 127.5, 126.9;LC-MS (EI) m/z (相对丰度): 176([M+1]+, 22), 174(85), 132(32), 130(100);熔点:215~216 ℃。
化合物5核磁与质谱数据:1H NMR (400 MHz, CDCl3) δ: 8.26(d, J = 3.6 Hz, 1 H), 7.68(m, 1 H);13C NMR (100 MHz, CDCl3) δ: 164.2, 157.3, 144.6, 138.1, 127.1, 126.6;LC-MS (EI) m/z (相对丰度): 221([M+1]+, 46), 152(63), 139(34), 117(100), 83(27);熔点:227~229 ℃。
化合物6核磁与质谱数据:1H NMR (400 MHz, CDCl3) δ: 8.15(dd, J = 3.6, 3.2 Hz, 1 H), 7.62(m, 1 H), 4.02(m, 3 H);13C NMR (100 MHz, CDCl3) δ: 163.4, 158.9, 146.3, 126.8, 125.4, 124.7, 52.3;LC-MS (EI) m/z (相对丰度): 235([M+1]+, 42), 176(51), 143(12), 107(100);熔点:241~243 ℃。
化合物7核磁与质谱数据:1H NMR (400 MHz, CDCl3) δ: 8.28(dd, J = 4.0, 4.0 Hz, 1 H), 7.68(t, J = 8.4 Hz, 1 H), 7.44(m, 1 H), 7.04(m, 2 H), 4.02(m, 3 H);13C NMR (100 MHz, CDCl3) δ: 168.1, 163.4, 160.6, 160.2, 145.6, 139.2, 128.5, 127.7, 127.0, 118.5, 111.8, 111.4, 53.1;LC-MS (EI) m/z (相对丰度): 268([M+1]+, 100), 236(22), 208(5), 150(15);熔点:263~266 ℃。
化合物1核磁与质谱数据:1H NMR (400 MHz, CDCl3) δ: 10.60(s, 1 H), 8.75(dd, J = 4.0, 4.0 Hz, 1 H), 7.81(t, J = 8.0 Hz, 1 H), 7.52(m, 1 H), 7.10(t, J = 8.0 Hz, 2 H);13C NMR (100 MHz, CDCl3) δ: 167.9, 163.1, 159.4, 158.2, 146.7, 138.4, 128.3, 127.1, 126.9, 116.4, 112.6, 112.1;LC-MS (EI) m/z (相对丰度): 254([M+1]+, 98), 236(100), 226(22), 208(15);熔点:252~255 ℃。
3 实验结果与讨论 3.1 2-羧基-5-氟吡啶-1-氧化物(3)的合成因吡啶环中氮原子的存在使吡啶环上亲电反应条件变得苛刻。通过氧化吡啶环上氮原子可有效破坏环上的大π键,从而实现官能团的引入或者转化[14~16]。吡啶环制备N-氧化物常用氧化剂有H2O2[17]、过氧乙酸[18]、m-CPBA[19]等。过氧乙酸分解后产生大量醋酸,腐蚀性较强,并会导致后处理繁琐;m-CPBA价格昂贵,不利于工业化。选择廉价的H2O2可规避以上2种试剂的弊端。在实验探索阶段发现,当反应温度小于100 ℃时,会出现原料无法及时转化的现象,为确保滴加后的H2O2能够迅速消耗,从安全角度考虑,反应体系采用100 ℃较为妥当。
本工艺以H2O为溶剂,在100 ℃条件下反应1 h,以Na2WO4·2H2O[20]为催化剂,采用H2O2滴加的方式投入,研究了Na2WO4·2H2O、H2O2对5-氟吡啶-2-甲酸氧化较佳工艺用量,结果见表 1。
|
|
表 1 Na2WO4·2H2O与H2O2的用量对反应收率的影响 Table 1 Effect of the amount of Na2WO4·2H2O and H2O2 on the yield |
从表 1中可看出,当量比n(H2O2): n(compound 2)=2.5:1.0时,n(Na2WO4·2H2O): n(compound 2)=0.05:1.0或0.03:1.0均可使化合物3收率超过95.0%;而当n(Na2WO4·2H2O): n(compound 2)降至0.01:1.0时,反应收率降至87.6%。当n(Na2WO4·2H2O): n(compound 2)=0.03:1.0,并将反应设置在n(H2O2): n(compound 2)=2.0:1.0时,反应收率仅为85.4%,其原因应是H2O2分解引起反应中H2O2的量不足。因此,综合成本因素,选择量比n(Na2WO4·2H2O): n(compound 2)=0.03:1.0,n(H2O2): n(compound 2)=2.5:1.0较好。此外,氧化反应需控制好H2O2滴加速度,阻止反应体系中气泡过多。过滤操作完成后,可加入Na2SO3溶液对滤液进行还原,经淀粉KI试纸检测合格后方可进行废水处理。
3.2 6-氯-5-氟吡啶-2-甲酸(4)的合成吡啶环N-氧化物在氯代试剂如POCl3、光气、三光气、草酰氯等存在下可发生转位氯代反应,其反应的位置发生在2-位[21]。此反应以DMF为溶剂、POCl3为氯代试剂,实现了2-羧基-5-氟吡啶-1-氧化物向6-氯-5-氟吡啶-2-甲酸转化,推测其反应机理如图 2所示。实验发现,反应温度在15~30 ℃,搅拌时间1 h便可使底物实现完全转化。因此选择反应温度在15~30 ℃符合节能减排的要求。
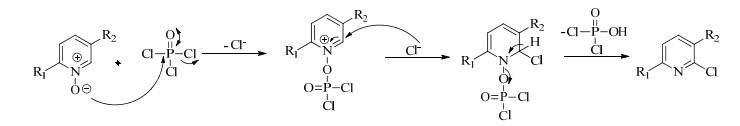
|
图 2 POCl3氯代反应的机理 Fig.2 Mechanism of POCl3 chlorination |
控制反应温度在15~30 ℃,搅拌时间为1 h,研究此反应各物料较佳的投料比,设计了4组试验,结果见表 2。从表 2中可看出,当量比n(POCl3): n(compound 3)=1.5:1.0,n(DMF): n(compound 3)为3.0:1.0,4.0:1.0时,化合物4收率可分别达96.4%,96.5%,较量比n(DMF): n(compound 3)=2.5:1.0收率高,其原因是DMF量多,体系流动性更好。而当n(DMF): n(compound 3)=3.0:1.0、n(POCl3): n(compound 3)=1.0:1.0时,化合物4收率仅为82.7%,较对应的n(POCl3): n(compound 3)=1.5:1.0反应收率低。由于n(DMF): n(compound 3)为3.0:1.0,4.0:1.0时,化合物4收率较为接近,考虑到成本,n(DMF): n(compound 3)=3.0:1.0更占优。因此,氯代反应的量比以n(POCl3): n(compound 3)=1.5:1.0,n(DMF): n(compound 3)=3.0:1.0较佳。
|
|
表 2 POCl3与DMF的用量对反应收率的影响 Table 2 Effect of the amount of POCl3 and DMF on the yield |
在Suzuki偶联反应中,因溴活性比氯高,故通过卤素交换反应将6-氯-5-氟吡啶-2-甲酸制备成6-溴-5-氟吡啶-2-甲酸。杜秋江[22]报道了在乙酸溶液中持续通入HBr气体,使2-氯吡啶转化成2-溴吡啶。而直接采用HBr-HOAc试剂可避免大量HBr气体损失,且使工艺操作更为简便与适合工业化。理论上,量比n(HBr-HOAc): n(compound 4)=1.0:1.0时可实现6-氯-5-氟吡啶-2-甲酸完全转化,但由于加热过程中难免会有少量HBr逸出,经试验选择n(HBr-HOAc): n(compound 4)=1.5:1.0时,底物便可转化完全。同时发现,选择反应温度70 ℃既可避免过高温度时HBr气体大量逸出,又能确保反应在2 h内反应完全。
当卤素交换反应完成后,经减压蒸馏除去溶剂,直接投入甲醇,加入硫酸和化合物5 (n(H2SO4): n(compound 5)=0.1),回流1 h,可完成6-溴-5-氟吡啶-2-甲酸与甲醇的酯化反应。研究发现,进一步减少浓硫酸的用量会导致反应时间延长,考虑到节省生产工时,且浓硫酸价格低廉,选择量比n(H2SO4): n(compound 5)=0.1:1.0时,反应温度选择65 ℃回流,底物转化时间缩短至1 h,效果较佳。此两步总收率可达80.3%。
3.4 6-(2, 6-二氟苯基)-5-氟吡啶-2-甲酸甲酯(7)的合成Suzuki偶联反应[23-24]是构建Aryl-Aryl架构有效方式之一。Suzuki反应一般以金属Pd(0)作为催化剂,并加入配体来稳定或活化催化剂。Suzuki偶联常用催化剂体系有Pd(PPh3)4、Pd(OAc)2/PPh3、Pd2(dba)3/P(t-Bu)3。为了获取较佳催化反应体系,在氮气氛中,设置各物料量比n(compound 6): n(2, 6-二氟苯硼酸): n(KF·2H2O): n(催化体系)=1:1:1:0.01,反应温度为70~75 ℃,反应1 h, 研究各催化体系对化合物7收率影响,结果见表 3。
|
|
表 3 不同催化体系对化合物7收率的影响 Table 3 Effect of different catalytic systems on the yield of compound 7 |
与Pd(PPh3)4、Pd(OAc)2/PPh3相比,采用Pd2(dba)3/P(t-Bu)3催化体系时,化合物7收率较高,TLC检测显示各反应均有原料剩余。根据表 3结果,确定以Pd2(dba)3/P(t-Bu)3为催化体系。为了反应呈均相溶液,采用THF/H2O为溶剂体系。因2, 6-二氟苯硼酸在反应中存在自身偶联,设定量比n(compound 6): n(2, 6-二氟苯硼酸)=1.0:1.5以促进化合物6完全反应,反应时间1 h,通过对反应跟踪检测,对Pd2(dba)3、P(t-Bu)3、KF·2H2O的用量、反应温度进行考察。实验发现体系对氧气的控制显得尤为重要,当有氧气存在时,苯硼酸自身偶联反应会导致化合物6大量剩余,甚至无目标产物生成。P(t-Bu)3对空气比较敏感,存放与投料时需防止氧化。在探索实验的基础上,设计了4因素(A、B、C、D)3水平(1、2、3)正交试验,结果见表 4和5。表中ki(i =1、2、3)表示每一个因素(例)下i水平时3组实验的平均收率;R为每一个因素(例)下3水平的平均收率的极差,极差越大,说明对应的因素对收率的影响程度最大。从表 5中极差分析结果可以看出,各因素对收率影响程度为:A > C > B > D,最优组合为A1B1C2D3。此工艺较佳合成条件为量比n(compound 6): n(Pd2(dba)3): n(P(t-Bu)3): n(KF·2H2O)=1:0.01:0.05:2,反应温度为50~55 ℃。确立的工艺参数经3次以上的平行实验证明了反应工艺与收率都比较稳定。
|
|
表 4 L9(34)正交实验的因素和水平 Table 4 Factors and levels of the L9(34) orthogonal experiment |
|
|
表 5 L9(34)正交实验结果 Table 5 Results of the L9(34) orthogonal experiment |
6-(2, 6-二氟苯基)-5-氟吡啶甲酸甲酯水解生成6-(2, 6-二氟苯基)-5-氟吡啶-2-甲酸,一般在碱性条件下反应便可实现。常用的NaOH替代LiOH[11],用甲醇/H2O溶液体系取代THF/H2O[11]可有效降低生产成本。在常温条件下,n(compound 7): n(NaOH)=1.0:1.5,反应1 h,可实现底物完全转化,而减少NaOH用量则会延长反应时间,不利于设备流转。采用质量投料比m(compound 7): m(甲醇): m(H2O)=1.5:3.0:1.0的比例可兼顾反应底物溶解性与原材料成本的控制。反应结束后,采用蒸馏可有效脱去溶剂,而蒸馏回收溶剂可进行多批次套用。盐酸调节pH值至1~2是此步操作的关键,化合物1的收率会因pH值偏高而偏低。产物经HPLC检测见图 3,图中t为时间,A为吸光度,产物纯度可达到99.0%以上,杂质≤0.5%。
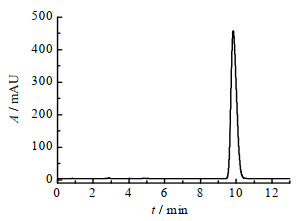
|
图 3 6-(2, 6-二氟苯基)-5-氟吡啶-2-甲酸HPLC谱图 Fig.3 HPLC spectrum of 6-(2, 6-difluorophenyl)-5-fluoropicolinic acid |
以5-氟吡啶-2-甲酸为原料,经过氧化、氯代、卤素交换、酯化、Suzuki偶联以及水解反应合成了目标化合物PIM447中间体6-(2, 6-二氟苯基)-5-氟吡啶-2-甲酸。氧化反应以Na2WO4·2H2O催化剂,探索出n(Na2WO4·2H2O): n(compound 2)=0.03:1.0,n(H2O2): n(compound 2)=2.5:1.0为较佳投料比;氯代反应采用DMF为溶剂、POCl3为氯代试剂,得到n(POCl3): n(compound 3)=1.5:1.0,n(DMF): n(compound 3)=3.0:1.0为较佳工艺参数;卤素交换反应采用HBr-HOAc溶液实现了溴氯交换,确定了n(HBr-HOAc): n(compound 4)=1.5:1.0为较优投料比;酯化反应选择了n(H2SO4): n(compound 5)=0.1:1.0投料比在甲醇中进行酯化反应;Suzuki偶联反应确定以Pd2(dba)3/P(t-Bu)3为催化体系,得出较佳工艺条件为:n(compound 6): n(2, 6-二氟苯硼酸): n(Pd2(dba)3): n(P(t-Bu)3): n(KF·2H2O)=1:1.5:0.01:0.05:2,反应温度为50~55 ℃;水解反应采用加入NaOH,在甲醇/H2O溶液中进行,控制pH值至1~2后得到目标产物,产物纯度可达到99.0%以上,反应总收率58.7%。
| [1] |
BURGER M T, NISHIGUCHI G, HAN W, et al. Identification of N-(4-((1R, 3S, 5S)-3-Amino-5-methylcyclohexyl)pyridin-3-yl)- 6-(2, 6-difluorophenyl)-5-fluoropicolinamide(PIM447), a potent and selective proviral insertion site of moloney murine leukemia(PIM)1, 2 and 3 kinase inhibitor in clinical trials for hematological malignancies[J]. Journal of Medicinal Chemistry, 2015, 58(21): 8373-8386. DOI:10.1021/acs.jmedchem.5b01275 |
| [2] |
PAINO T, GARCIA-GOMEZ A, GONZALEZ-MENDEZ L, et al. The novel pan-PIM kinase inhibitor, PIM447, displays dualanti-myeloma and bone protective effects, and potently synergizes with current standards of care[J]. Clinical Cancer Research, 2017, 23(1): 225-238. DOI:10.1158/1078-0432.CCR-16-0230 |
| [3] |
ELLWOOD-YEN K, GRAEBER T G, WONGVI-PAT J, et al. Myc-driven murineprostate cancer sharesmolecular features with human prostate tumors[J]. Cancer Cell, 2003, 4(3): 223-238. DOI:10.1016/S1535-6108(03)00197-1 |
| [4] |
HOGAN C, HUTCHISON C, MARCAR L, et al. Elevated levels of oncogenic protein kinase PIM-1 induce the p53 pathway in cultured cells and correlate with increased Mdm2 in mantle cell lymphoma[J]. The Journal of Biological Chemistry, 2008, 283(26): 18012-18023. DOI:10.1074/jbc.M709695200 |
| [5] |
MORISHITA D, KATAYAMA R, SEKIMIZU K, et al. PIM kinases promote cell cycle progression byphosphorylating and down-regulating p27Kip1 at the transcriptional and posttranscriptional levels[J]. Cancer Research, 2008, 68(13): 5076-5085. DOI:10.1158/0008-5472.CAN-08-0634 |
| [6] |
GARCIA P D, LANGOWSKI J, HOLASH J, et al. The pan-PIM kinase inhibitor LGH447 shows activity in PIM2-dependent multiple myeloma and in AML models[J]. Blood, 2013, 122(21): 1666-1666. DOI:10.1182/blood.V122.21.1666.1666 |
| [7] |
GARCIA P D, LANGOWSKI J L, WANG Y, et al. Pan-PIM kinase inhibition provides a novel therapy for treating hematological[J]. Cancers Clinic Cancer Research, 2014, 20(7): 1834-1845. DOI:10.1158/1078-0432.CCR-13-2062 |
| [8] |
郑保富, 高强, 岳庆磊, 等. PIM447关键中间体的制备方法: CN, 110452164[P]. 2019-11-15. ZHENG B F, GAO Q, YUE Q L, et al. Preparation method for pim447 key intermediate: CN, 110452164[P]. 2019-11-15. |
| [9] |
BURGER M, NISHIGUCHI G, RICO A, et al. N-(3-pyridyl)-biarylamides as kinase inhibitors: WO, 2014033631[P]. 2014-03-06.
|
| [10] |
BURGER M, DING Y, HAN W, et al. Tetrasubstituted cyclohexyl compounds as kinase inhibitors: US, 20120225061[P]. 2012-09-06.
|
| [11] |
BURGER M, NISHIGUCHI G, MACHAJEWSKI T D, et al. Novel kinase inhibitors: US, 20120225062[P]. 2012-09-06.
|
| [12] |
BURGER M, DRUMM Ⅲ J, NISHIGUCHI G, et al. Novel ring-substituted N-pyridinyl amides as kinase inhibitors: WO, 2013175388[P]. 2013-11-28.
|
| [13] |
BURGER M T, HAN W, LAN J, 等. 作为激酶抑制剂的吡啶甲酰胺衍生物: CN, 102203079[P]. 2011-09-28. BURGER M T, HAN W, LAN J, et al. Picolinamide derivatives as kinase inhibitors: CN, 102203079[P]. 2011-09-28. |
| [14] |
周立山, 冯亚青, 宋传君, 等. 吡啶氮氧化物研究进展[J]. 化工时刊, 1999, 13(2): 11-13, 7. ZHOU L S, FENG Y Q, SONG C J, et al. Advances in the study of pyridine N-oxide[J]. Chemical Industry Times, 1999, 13(2): 11-13, 7. |
| [15] |
齐艳, 陈煦, 王越, 等. 吡啶-N-氧化物的研究进展[J]. 天津化工, 2005, 19(2): 1-3. QI Y, CHEN X, WANG Y, et al. Advances in pyridin-N-oxide and its derives[J]. Tianjin Chemical Industry, 2005, 19(2): 1-3. |
| [16] |
章梦帅, 黄湛媛, 郑土才, 等. 吡啶类化合物氧化制备吡啶N-氧化物研究进展[J]. 化工生产与技术, 2015, 22(3): 33-41. ZHANG M S, HUANG Z Y, ZHENG T C, et al. Research advances in the oxidations of pyridines compounds to pyridine N-oxides[J]. Chemical Production and Technology, 2015, 22(3): 33-41. DOI:10.3969/j.issn.1006-6829.2015.03.012 |
| [17] |
钱豪, 瞿军, 陆文辉, 等. 4-氯吡啶的合成研究[J]. 山东化工, 2010, 39(8): 1-2, 5. QIAN H, QU J, LU W H, et al. Study on the synthesis of 4-chloropyridine[J]. Shandong Chemical Industry, 2010, 39(8): 1-2, 5. DOI:10.3969/j.issn.1008-021X.2010.08.001 |
| [18] |
DIEMER V, CHAUMEIL H, DEFOIN A, et al. Synthesis of sterically hindered zwitterionic pyridinium phenolates as model compounds in nonlinear optics[J]. European Journal of Organic Chemistry, 2008, 10: 1767-1776. |
| [19] |
PAILLOUX S, SHIRIMA C E, RAY A D, et al. . Synthesis and coordination properties of trifluoromethyl decorated derivatives of 2, 6-bis[(diphenyl phosphinoyl)methyl]pyridine N-oxide ligands with lanthanide ions[J]. Inorganic Chemistry, 2009, 48(7): 3104-3113. DOI:10.1021/ic802390c |
| [20] |
王谦, 迟毅男, 李洪江. 从3-氰基吡啶合成烟酰胺-N-氧化物的研究[J]. 化学工程师, 2005, 117(6): 57-58. WANG Q, CHI Y N, LI H J. Study on synthesis of nicolinamide-N-oxide from 3-cyanpridine[J]. Chemical Engineer, 2005, 117(6): 57-58. |
| [21] |
赵若含, 邬倩倩, 郑土才, 等. 吡啶类化合物合成氯代吡啶的研究进展[J]. 化工生产与技术, 2015, 22(2): 23-29. ZHAO R H, WU Q Q, ZHENG T C, et al. Research advances in the synthesis of chloropyridines from pyridines[J]. Chemical Production and Technology, 2015, 22(2): 23-29. |
| [22] |
杜秋江. 由2-氯吡啶制备2-溴吡啶[J]. 化工时刊, 2005, 19(2): 39-40. DU Q J. Preparation of 2-bromopyridine from 2-chloropyridine by halogen exchange[J]. Chemical Industry Times, 2005, 19(2): 39-40. |
| [23] |
SUZUKI A, MIYAURA N, YANAGI T. The palladium-catalyzed cross-coupling reaction of phenylboronic acid with haloarenes in the presence of bases[J]. Synthesis Communication, 1981, 11(7): 513-519. |
| [24] |
周少林, 徐利文, 夏春谷, 等. Suzuki偶联反应的最新研究进展[J]. 有机化学, 2004, 24(12): 1501-1512. ZHOU S L, XU L W, XIA C G, et al. Recent progress of Suzuki coupling reaction[J]. Chinese Journal of Organic Chemistry, 2004, 24(12): 1501-1512. |




