当今时代,CO2的减排已成为目前亟待解决的全球性问题。因此人们研发出各种CO2固定方法,如:物理法、化学法和生物法等。其中,使用微藻或蓝细菌生物固定二氧化碳是一种绿色可持续发展技术,主要通过光合作用将CO2转化成微藻类物质,具有微藻繁殖速度快、生长周期短、环境适应性强等优势,逐渐成为固碳领域的研究热点[1, 2],而提高微藻固碳速率就成为该技术的关键[3]。
为了提高微藻的固碳速率和生物量产率,人们开展了包括筛选高效固碳菌株、基因工程改造菌株、提高光利用率、改善传质和设计新型光反应器等各方面的研究与开发[4, 5]。由于大部分微藻能够吸收利用的碳源种类是CO2和HCO3-,因此在低含量CO2气体通入的条件下,培养基中CO2溶解量和溶解速度就成为主要的限制性因素[6, 7]。故增加微藻培养液中CO2的溶解效率是改进微藻固碳技术的关键。
有机胺类物质是一类广泛应用于工业化CO2捕集技术的化学吸收剂,固碳效率较高[8, 9],并已被应用于微藻的培养过程[3]。如Wookjin Choi等研究表明低浓度MEA (乙醇胺) 的添加能够将Scenedesmus sp.生长和固碳速率显著提高63%[10]。Garam Kim等研究了有机胺类CO2吸收剂对于Scenedesmus sp.生长和固碳的影响,结果表明当添加5 mmol·L-1 TEA (三乙醇胺) 时,Scenedesmus sp.的生物量和固碳效率分别为2750 mg·L-1和1015.2 mg·(L·d)-1,比对照组均提高了30.5%[11]。Gabriel等研究了Spirulina sp. LEB 18在半连续培养过程中添加0.4 mmol·L-1的MEA (乙醇胺) 后,CO2的固定速率达到103.6 mg·(L·d)-1,比对照组提高约40.3%。同时,总生物量提高约31.4%[12]。
尽管人们对螺旋藻的培养技术的研究已经有很多[13~15],但是各种有机胺对螺旋藻培养过程的影响关系研究仍不多见。本研究通过考察、比较、筛选多种有机胺类型和添加量对培养液中溶解性无机碳浓度、螺旋藻生物量和固碳速率等方面的影响效果,最终探究其最佳添加策略。为大规模螺旋藻培养技术的建立,以及固碳速率的提高提供一定的技术支持。同时,也可以为其他微藻培养技术改造与升级提供借鉴。
2 实验材料与方法 2.1 实验材料本实验所用藻种为钝顶螺旋藻,编号FACHB-901,购自中科院水生生物研究所淡水藻种库。实验采用改良的Zarrouk培养基 (g·L-1):NaNO3 2.5,NaCl 1.0,K2HPO4 0.5,K2SO4 1.0,MgSO4·7H2O 0.2,CaCl2 0.04,FeSO4·7H2O 0.01,Na2-EDTA 0.08,1 mLA5溶液[1000 mL蒸馏水中加 (g) ZnSO4·7H2O 0.22,H3BO3 2.86,CuSO4·5H2O 0.08,MnCl2·4H2O 1.81和Na2MoO40.21]。
2.2 实验方法 2.2.1 钝顶螺旋藻以CO2作为碳源时生长特性实验在1000 mL三角烧瓶中加入700 mL的新鲜培养基,接入培养至对数期的螺旋藻,使其光密度值约为0.3。在温度30℃,光强4000 Lux,光照周期16/8(day/night),转速180 r·min-1条件下在摇床培养箱中培养。在光照前以鼓泡的方式通入10% CO2浓度的空气,气速为0.2 vvm,通气时间为30 min·d-1,通过转子流量计来控制气体流量。培养过程中主要考察了螺旋藻的生长周期、pH、生物量以及固碳速率等性能。
2.2.2 有机胺的添加对螺旋藻生长及固碳速率的影响实验为了考察不同类型的有机胺对于螺旋藻生长个固碳速率的影响,在螺旋藻培养开始阶段分别添加乙醇胺 (MEA)、二乙醇胺 (DEA)、N-甲基二乙醇胺 (MDEA) 和三乙醇胺 (TEA) 至1 mmol·L-1。定时取样,测定螺旋藻干重、pH、溶解性无机碳含量 (DIC)、营养物质消耗等参数。经过计算获得螺旋藻生长速率和固碳速率,并以此为参考结果筛选出适合的有机胺类型。
2.2.3 TEA添加策略实验为考察TEA的添加时间和添加量对钝顶螺旋藻生长和固碳速率的影响,在螺旋藻生长的延滞期、对数前期、对数后期、稳定期等生长阶段,分别添加不同含量的TEA,定时取样,测定螺旋藻干重、pH、DIC、固碳速率等。然后计算获得螺旋藻的生物量和固碳速率并作为参考结果,确定螺旋藻生长过程中的TEA添加策略。
2.3 关键参数的测定及计算方法细胞干重 (DCW)[16]:收集5 mL螺旋藻液,使用高速坑洞离心机在20000 r·min-1条件下离心10 min,反复用蒸馏水洗涤,继续离心3次后,置于60℃干燥箱中烘干至恒重,称量干重并记录。生长速率和比生长速率[17, 18]:指在某一时间间隔内藻类生长的速率和单位质量的速率,计算公式:
| $ {P_x} = ({X_2}-{X_1})/({t_2}-{t_1}) $ | (1) |
| $ \mu = ({\rm{ln}}{X_2}-{\rm{ln}}{X_1})/({t_2}-{t_1}) $ | (2) |
X2—在培养周期内t2(d) 时间的螺旋藻干重 (g·L-1);X1—在培养周期内t1(d) 时间的螺旋藻干重 (g·L-1);t2和t1—培养周期内某一段时间间隔 (d);Px—生长速率[g·(L·d)-1];μ—比生长速率 (d-1)。
螺旋藻干细胞含碳率Xcbm使用CHN元素分析仪 (Vario Macro Cube,德国Elementar公司) 检测;固碳速率,即CO2固定速率[15]用以下公式计算:
| $ {R_{\rm{c}}} = {P_{\rm{x}}} \cdot {X_{{\rm{cbm}}}} \cdot {M_{{\rm{C}}{{\rm{O}}_{\rm{2}}}}}/{M_{\rm{c}}} $ | (3) |
Rc—CO2固定速率[g·(L·d)-1];Px—生长速率[g·(L·d)-1];Xcbm—螺旋藻干细胞含碳率 (%);MCO2 —CO2的相对分子质量;Mc—碳的相对分子质量。
溶解性无机碳 (dissolved inorganic carbon,DIC) 浓度采用酸碱指示剂滴定法[16];蛋白质含量 (Cp,g·g-1) 采用Bradford法测定[19];多糖含量 (Cg, ,g·g-1) 采用苯酚-硫酸法测定[20];脂肪含量 (Cf,g·g-1) 采用氯仿-甲醇提取法测定[21]。
3 结果与讨论 3.1 螺旋藻以CO2为碳源时的生长特性在30℃、4000 Lux、光暗比16/8的条件下,考察了以含有10% CO2空气作为碳源时,钝顶螺旋藻的基本生长特性。图 1表示螺旋藻生长曲线,从图 1中可以发现前2 d为延滞期,第3~5 d是对数生长前期,第5~7 d为对数生长后期,第7~8 d为稳定期。OD值随着培养时间的延长逐渐增加,OD值最大为1.01,对应的DCW是0.816 g·L-1,最大比生长速率出现在第3 d,为0.257 d-1,固碳速率为118.6 mg·(L·d)-1。这表明采用气体二氧化碳可以作为螺旋藻生长的碳源。
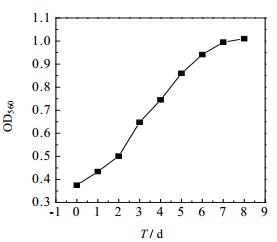
|
图 1 螺旋藻以CO2作为碳源时的生长曲线 Fig.1 Spirulina growth curve with CO2 as the carbon source |
有机胺的添加对于螺旋藻生长和固碳的影响如图 2和表 1所示。由图 2 A、和表 1可知,在8 d的培养周期内,螺旋藻细胞干重随时间的延长而增加,而添加了1 mmol·L-1 TEA的实验组细胞干重始终高于其它实验组。按照最终细胞干重的大小排序,可知有机胺对细胞干重的影响关系如下:DCWTEA > DCWNONE > DCWMEA > DCWDEA > DCWMDEA。由图 2 B可知,各实验组的比生长速率μ随时间呈现出先增加后降低的趋势,添加1 mmol·L-1 TEA的实验组的最大比生长速率μ出现在第3 d,为0.328 d-1。按照最大比生长速率进行排序,可获得有机胺类物质对螺旋藻细胞生长速率的影响关系如下:μTEA > μNONE > μDEA > μMEA > μMDEA。
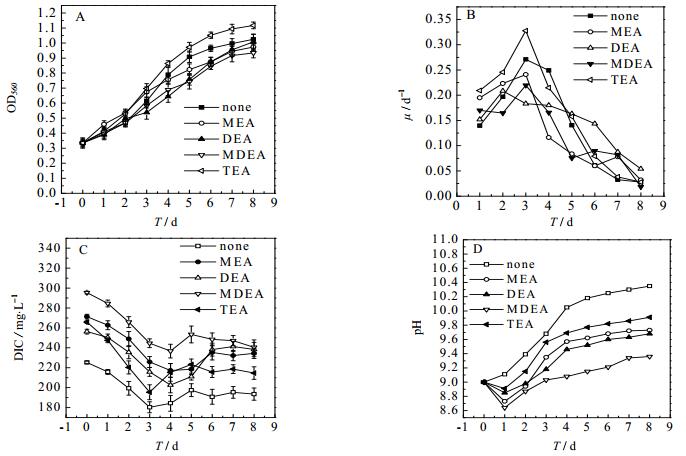
|
图 2 胺类化合物对于螺旋藻生长过程的影响 Fig.2 Effects of different alkanolamine compounds on cell growing processes A. OD B. specific growth rate C. DIC D. pH |
| 表 1 胺类CO2吸收剂对钝顶螺旋藻生长及固碳速率的影响 Table 1 Effects of different alkanolamine compounds on Spirulina platensis growth and CO2 fixation rates |
由于CO2气体是螺旋藻生长的唯一碳源,所以培养基中DIC的含量和pH对于螺旋藻生长有较大影响。由图 2 C可知由于培养液中的DIC含量均呈现出先降低,最终趋于稳定的趋势。这表明随着螺旋藻的生长与代谢过程的进行,碳源消耗速率先增加后降低。这是由于指数生长期的前期,螺旋藻细胞对碳源代谢速率较快,二氧化碳的溶解速率远低于菌体代谢速率,因此液相中DIC含量呈现逐渐下降的趋势;而指数生长期的后期,二氧化碳的溶解速率与菌体消耗速率达到平衡,最终液相中DIC含量趋于恒定。
图 2D示出螺旋藻培养溶液中pH随时间的变化趋势。由图 2 D可知,各实验组的pH均呈现出先降低后升高的趋势,相同时间范围内有机胺的添加可以明显降低pH的增张幅度,使溶液中的pH控制在螺旋藻最佳生长pH 8~10的范围,而空白对照组的pH却能够超过10.5。这主要是由于二氧化碳的溶解平衡能够降低液相pH,而螺旋藻能够消耗液相中的HCO3-,从而使溶液的pH升高。当二氧化碳的溶解速率低于螺旋藻的固碳速率时,就会出现pH升高的现象。以对照组为例,可以看出随着培养液pH由初始9.0上升至10.35,培养液的CO32-浓度不断增加,最后溶液中剩余的DIC大多以CO32-的形式存在,CO32-含量的增高是造成pH上升的主要原因之一。文献报道藻类可以吸收利用的碳源只有CO2与HCO3-两类,而CO32-不能被藻类吸收利用[22]。对照组溶液中尽管有大量无机碳剩余,但是可吸收利用HCO3-的量较少,每天定时通入10%CO2含量的气体,不仅可以补充HCO3-的量,还可以缓解由于培养液pH值上升对其螺旋藻生长的不利影响。有机胺的加入可以明显提高二氧化碳的溶解速率,以平衡螺旋藻固碳速率。从而可以使溶液中的pH变化范围处于有利于螺旋藻生长的8~10。这也体现出有机胺类物质的添加具有稳定螺旋藻培养溶液pH的功效。
另外,由表 1可知,不同类型的有机胺会显著影响螺旋藻的固碳速率Rc,其中TEA的添加可以获得最佳的固碳速率RcTEA为139.3 mg·(L·d)-1,各种有机胺对螺旋藻固碳速率的影响关系如下:RcTEA > RcNONE > RcDEA > RcMEA > RcMDEA。
研究发现MEA、DEA在吸收CO2的同时产生了氨基甲酸盐中间体,对螺旋藻产生一定的毒性,因此造成螺旋藻生长放缓。而氨基甲酸盐中间体水解反应的速率取决于CO2结合的链烷醇胺的分子结构。TEA与CO2所形成的氨基甲酸酯比较不稳定,更容易水解[17],对螺旋藻产生的毒性较低,因此具有较高的固碳速率。
表 2表示添加1 mmol·L-1有机胺对于螺旋藻营养成分含量的影响效果。蛋白质、多糖和粗脂肪是组成钝顶螺旋藻最重要的营养成分,三种营养成分的含量深受环境条件的影响。不同胺类化合物对于螺旋藻粗营养成分的影响如表 2所示。由表 2可知,螺旋藻细胞中多糖含量 (Cg) 随不同种类有机胺的添加呈现如下次序:Cg, TEA > Cg, MEA > Cg, NONE > Cg, DEA > Cg, MDEA。蛋白含量 (Cp) 随不同种类有机胺的添加呈现如下次序:Cp, MDEA > Cp, DEA > Cp, MEA > Cp, None > Cp, TEA。
| 表 2 不同胺类化合物对于螺旋藻粗营养成分含量的影响 Table 2 Effects of different alkanolamine compounds on the concentration of Spirulina crude nutrients |
由以上实验结果可知,胺类化合物增加了溶液中的DIC含量,在一定程度上可以增加螺旋藻的生长速度以及固碳速率。当添加1 mmol·L-1 TEA时,螺旋藻的固碳速率得到提高,比生长速率更大,最终生物量最高,相应地会改变藻内生物成分的含量,由于固碳速率更高,造成多糖含量上升,相应的蛋白质和脂肪含量下降;而添加1 mmol·L-1 MDEA的实验组则表现出了相反趋势,这一点与Gabriel等[18]报道一致。
综上,根据螺旋藻的生物量、多糖含量和固碳速率为标准,筛选结果表明添加1 mmol·L-1 TEA的实验组生长状况最佳,因此有必要以TEA作为研究对象,开展TEA添加策略的研究。
3.3 TEA的添加策略研究为了获得TEA在螺旋藻培养过程的添加策略,本研究针对螺旋藻生长的不同阶段 (如延滞期,对数生长前期,对数生长后期和稳定期等) 分别添加不同浓度的TEA,实验跟踪并考察在生长过程不同阶段添加TEA对螺旋藻生长和固碳效果的影响。
3.3.1 在螺旋藻生长延滞期添加TEA时对其生长与固碳过程的影响关系在螺旋藻培养的延滞期阶段分别添加不同浓度的TEA,对螺旋藻生长和固碳影响效果如图 3和表 3所示。由图 3 A可知,随着TEA添加浓度的升高,螺旋藻生物量呈现出先升后降的趋势。而5 mmol·L-1 TEA为螺旋藻生长的最佳添加浓度,最优DCW为1.015 g·L-1,最优比生长速率为0.351 d-1,最佳固碳速率为154.8 mg·(L·d)-1,明显高于其它添加浓度的结果。
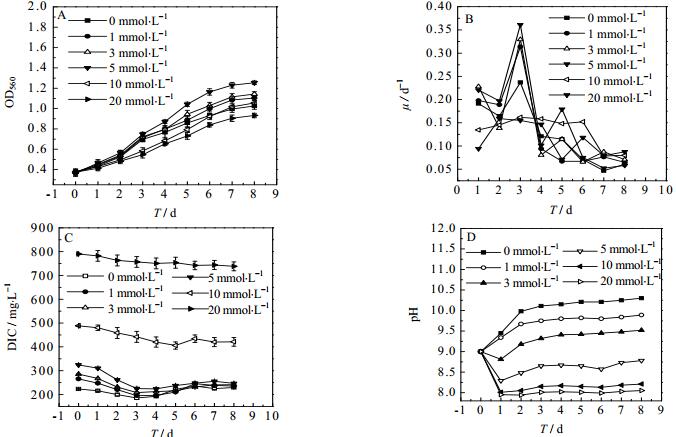
|
图 3 在延滞期添加TEA的浓度对于螺旋藻生长的影响 Fig.3 Effects of TEA concentration in the lag phase on Spirulina growth A. OD B. specific growth rate C. DIC D. pH |
| 表 3 在螺旋藻延滞期添加不同浓度的TEA对其生长及固碳速率的影响 Table 3 Effects of TEA concentration in the lag phase on Spirulina growth and CO2 fixation rates |
图 3 C和图 3 D表示在延滞期添加TEA对于螺旋藻培养液中的DIC和pH的影响。随着TEA添加浓度的增加,培养液中DIC含量也呈现增大的趋势。同时,由图 3 C可知,添加5 mmol·L-1的实验组初始DIC为324.3 mg·L-1,结合图 3D可知,pH在通气第1 d有所下降,从第2 d开始基本稳定在8.5~9.0,更适宜螺旋藻的生长。较低浓度的TEA添加量会导致较低的DIC含量,而较高浓度的TEA添加量会导致培养液中pH的变化很小,维持在8.0~8.5,低于适宜螺旋藻生长的pH范围,这是由于较高浓度的TEA导致培养液中较高的HCO3-含量,使溶液pH一直维持在较低水平,影响到螺旋藻的生长速率。水中的大量的HCO3-向细胞质内扩散,造成胞内pH下降过快,这种酸化导致螺旋藻麻醉,降低了光合作用相关酶的活性,从而进一步降低光合作用水平[23],并且对藻细胞质的毒性作用会阻碍微藻对于CO2的进一步吸收和利用,最终导致微藻生长缓慢[24]。因此在延滞期添加5 mmol·L-1的TEA最有利于螺旋藻的生长和二氧化碳的固定。
3.3.2 对数前期补加TEA对于螺旋藻生长及固碳效果的影响为了探究在钝顶螺旋藻对数生长前期补加TEA后对其生长过程的影响关系,故在延滞期添加5 mmol·L-1 TEA的基础上继续培养至对数前期,然后分别补加不同浓度的TEA。图 4和表 4显示在螺旋藻对数生长前期补加TEA对其生长和固碳效果的影响。实验结果如图 4 A、4 B和表 4所示,随着TEA添加量的增加,螺旋藻生物量呈现出先增加然后逐渐降低的趋势:OD560(1 mmol·L-1) > OD560(0 mmol·L-1) > OD560(3 mmol·L-1) > OD560(5 mmol·L-1)。其中,在补加了1 mmol·L-1 EA的实验组中螺旋藻生长状况最佳,最大比生长速率为0.302 d-1,最大DCW为1.114 g·L-1,固碳速率为179.3 mg·(L·d)-1;而补加了5 mmol·L-1 TEA实验组的最大比生长速率、最大DCW、固碳速率都明显低于其他三组。这表明,当螺旋藻前期生物量较低时,添加过多的TEA会抑制螺旋藻的生长。此时培养基中TEA的总含量为6 mmol·L-1。
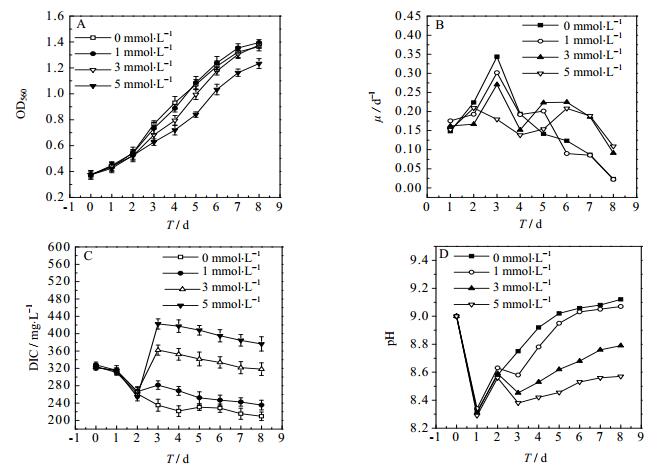
|
图 4 在对数生长前期添加TEA的浓度对于螺旋藻生长的影响关系 Fig.4 Effects of TEA concentration in early log phase on Spirulina growth A. OD B. specific growth rate C. DIC D. pH |
| 表 4 在螺旋藻对数生长前期补加不同浓度的TEA对其生长及固碳速率的影响 Table 4 Effects of additional TEA in the early log phase on Spirulina growth and the CO2 fixation rate |
图 4 C和4 D是在螺旋藻对数生长前期补加不同浓度的TEA后对培养液DIC含量和pH的影响。图 4 C和4 D可知,在第2 d补加3 mmol·L-1和5 mmol·L-1的TEA后,培养液中的DIC含量明显增加,这表明高浓度的TEA添加量能够增加液相中二氧化碳的溶解量。而pH却骤然下降,3 mmol·L-1实验组的pH基本维持8.5~8.8,5 mmol·L-1实验组的pH维持在8.4~8.6的较低范围内,这表明此时二氧化碳的溶解速率是高于螺旋藻的消耗速率。而在此阶段补加1 mmol·L-1 TEA的实验组的DIC含量与空白对照组相差不大,并且pH基本保持在螺旋藻生长的适合pH范围8.5~9.1内。综上所述,在对数前期补加1 mmol·L-1的TEA时,更适合螺旋藻生长。
3.3.3 对数生长后期补加TEA对于螺旋藻生长及固碳效果的影响图 5和表 5是在对数生长后期补加TEA后对于螺旋藻生长和固碳效果的影响。根据前面的研究结果,在螺旋藻培养过程的延滞期添加5 mmol·L-1的TEA,然后在第2 d添加1 mmol·L-1 TEA,在此基础上培养至对数后期后,分别补加0 mmol·L-1、1 mmol·L-1、2 mmol·L-1、3 mmol·L-1的TEA,研究在钝顶螺旋藻对数生长后期补加TEA对于螺旋藻生长和固碳效果的影响。如图 5A和表 5所示,随着TEA添加量的增加,螺旋藻的生物量、最大比生长速率、固碳速率均呈现出先增加而后降低的趋势。当在螺旋藻对数生长后期补加2 mmol·L-1时,TEA实验组的生长状况最佳,最大比生长速率为0.329 d-1,最大DCW为1.248 g·L-1,固碳速率为191.4 mg·(L·d)-1。
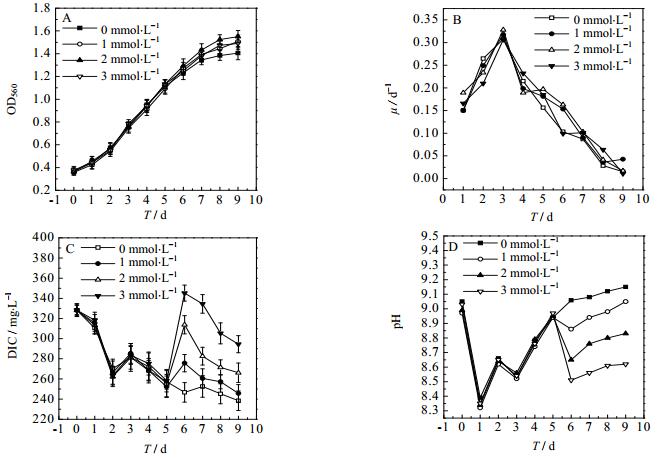
|
图 5 在螺旋藻培养对数生长后期补加TEA的浓度对于螺旋藻生长的影响 Fig.5 Effects of additional TEA in the end log phase on Spirulina growth A. OD B. specific growth rate C. DIC D. pH |
| 表 5 在钝顶螺旋藻对数生长后期补加不同浓度的TEA对其生长及固碳速率的影响 Table 5 Effects of additional TEA in the end log phase on Spirulina growth and CO2 fixation rates |
图 5C和5D可以看到在第5 d补加1 mmol·L-1、2 mmol·L-1和3 mmol·L-1的TEA后,培养液中的DIC含量有明显增加的趋势:DIC (3 mmol·L-1) > DIC (2 mmol·L-1) > DIC (1 mmol·L-1) > DIC (0 mmol·L-1)。培养液中的pH随着TEA添加量的增加而逐渐下降:pH (0 mmol·L-1) > pH (1 mmol·L-1) > pH (2 mmol·L-1) > pH (3 mmol·L-1)。
在螺旋藻生长的不同阶段,适应的pH以及能够利用的HCO3-的量有所差异。在延滞期时,过高的HCO3-量会对螺旋藻细胞的光合作用途径的酶产生麻醉作用,导致光合作用速率减慢,生长较差;相反HCO3-含量不足时,会限制螺旋藻生长,此时5 mmol·L-1 TEA的添加量比较适宜螺旋藻的生长。但处于对数前期时,螺旋藻生长加快,消耗的HCO3-增加,造成pH快速升高。而补加1 mmol·L-1的TEA以及每天通入CO2,可以使HCO3-的量和pH一直维持在适宜水平。当对培养至对数后期,生长速率减缓,但是维持螺旋藻自身消耗,也需要消耗大量碳源,补加2 mmol·L-1TEA,提高了HCO3-含量,更加适合其生长。
3.3.4 稳定期补加TEA对于螺旋藻生长及固碳效果的影响图 6表示在螺旋藻生长至稳定期补加TEA对于螺旋藻生长的影响。在螺旋藻开始培养时添加5 mmol·L-1TEA,培养至第2 d补加1 mmol·L-1 TEA,第5 d补加2 mmol·L-1 TEA,第8 d达到稳定期时分别补加0 mmol·L-1、2 mmol·L-1和5 mmol·L-1的TEA。结果发现,三组实验最后的生物量基本没有差别。这表明处于生长稳定期的螺旋藻具有的固碳速率相对比较低,固碳阶段处于速率控制步骤,单纯提高二氧化碳的溶解量不会对固碳速率产生较大的影响。因此,在螺旋藻生长稳定期不需要补加TEA。
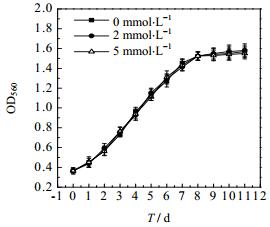
|
图 6 在螺旋藻培养稳定期补加TEA的浓度对于螺旋藻生长的影响 Fig.6 Effects of additional TEA in the stable phase on Spirulina growth |
综上所述,本研究通过实验获得了螺旋藻培养过程的TEA添加策略,具体为:在培养延滞期时添加5 mmol·L-1 TEA,对数前期时补加1 mmol·L-1 TEA,对数后期时补加2 mmol·L-1的TEA。最终获得螺旋藻的生物量为1248 mg·L-1,固碳速率为191.4 mg·(L·d)-1,比对照组分别提高了25.6%和41.2%。
表 6给出了本研究结果于文献报道结果的对比。由表 6可知,Garam Kim[11]等研究了胺类二氧化碳吸收剂对于Scenedesmus sp.生长和固碳的影响,在空白培养基中分别添加100 ppm的MEA、AMP、DEA、TEA时,MEA的DIC含量最高,为22.3 mg·L-1,是对照组的2.59倍。分别添加2 mmol·L-1的MEA、AMP、DEA、TEA进行试验。与本研究的结果相同,TEA试验组得到最大的生物量和固碳速率,分别为2619 mg·L-1和991.8 mg·(L·d)-1。针对TEA添加量进行优化, 结果表明当添加了5 mmol·L-1的TEA时,Scenedesmus sp.的生物量和固碳速率分别为2750 mg·L-1和1015.2 mg·L-1,比对照组均提高了30.5%。
| 表 6 本研究结果同其他相似文献的研究对比 Table 6 Results comparison with related studies in literature |
Gabriel等[12]研究了Sprirulina sp. LEB 18在半连续培养中添加0.4 mmol·L-1的MEA对其生长和固碳速率的影响。结果表明生产速率增大,比生长速率增大,传代周期缩短。二氧化碳的固定速率达到103.6 mg·(L·d)-1,比对照组提高约40.3%,总的生物量提高约31.4%。这表明有机胺类物质的确可以提高螺旋藻的生物量和固碳速率。
3.4 TEA的添加对于螺旋藻生物学成分的影响表 7给出了当按照最佳添加策略添加TEA时,螺旋藻中营养成分含量的影响关系。螺旋藻的多糖含量达到0.268 g·g-1,比对照组提高了23.5%,但是蛋白含量较低,只有0.372 g·g-1,比对照组降低了8.8%,脂肪含量也略有降低。Gabriel等[12]的研究发现,添加了0.4 mmol·L-1的MEA的培养体系中,细胞生物学成分也发生了改变,分析结果表明,蛋白质的含量大约为44.4%,比对照组降低了26.97%;碳水化合物含量为28.2%,比对照组提高95.8%,脂肪含量略微降低。由此可见,有机胺的添加会降低螺旋藻的蛋白质和脂肪含量,但增加多糖含量。
| 表 7 TEA的添加对于螺旋藻营养成分含量的影响 Table 7 Effects of TEA on crude nutrient yields of Spirulina |
然而,在相同的培养周期中,多糖的总产量为0.334 g,蛋白质总产量为0.464 g,比对照组分别提升了78.6%和24.4%。因此,本次研究所获得的最佳TEA添加策略可以显著提高螺旋藻生产多糖和蛋白质的总产量
虽然有机胺类物质有一定的弱毒性,但是在本研究的培养体系中属于封闭循环培养体系,对环境影响可以忽略。同时,有机胺类物质的处理也相对简单,可以通过简单的氧化法就可以将其降解[25]。因此本研究所获得的结果具有一定的应用和理论价值。
4 结论(1) 通过间歇通气批培养实验结果表明当钝顶螺旋藻 (FACHB-901) 以CO2作为碳源时,生长周期约为8 d,最大细胞干重为0.816 g·L-1,固碳速率为118.6 mg·(L·d)-1,最大比生长速率出现在第3 d,为0.257 d-1。
(2) 在螺旋藻培养中添加不同种类的有机胺后,发现添加了1 mmol·L-1 TEA的实验组生长情况最佳,最大DCW为0.894 g·L-1,固碳速率分别为139.3 mg·(L·d)-1,分别比对照组提升了8.6%和14.7%。
(3) 通过实验确定了TEA的最佳添加策略:延滞期添加5 mmol·L-1的TEA,对数前期补加1 mmol·L-1 TEA,对数后期补加2 mmol·L-1的TEA。最佳DCW为1.248 g·L-1,固碳速率分别为191.4 mg·(L·d)-1,比对照组分别提高了25.6%和41.2%。与对照组想白,多糖含量提高了23.5%,蛋白含量却降低了8.8%。但是,由于提高了螺旋藻的产量,因此其中的多糖和蛋白质最终产量比对照组分别增大了78.6%和24.4%。
| [1] | Kumar A, Ergas S, Yuan X, et al. Enhanced CO2 fixation and biofuel production via microalgae:recent developments and future directions[J]. Trends in biotechnology , 2010, 28(7): 371-380. DOI:10.1016/j.tibtech.2010.04.004. |
| [2] | Wang B, Li Y, Wu N, et al. CO2 bio-mitigation using microalgae[J]. Applied Microbiology and Biotechnology , 2008, 79(5): 707-718. DOI:10.1007/s00253-008-1518-y. |
| [3] | Eduardo B S, Wilerson S, Julio C C, et al. Potential carbon dioxide fixation by industrially important microalgae[J]. Bioresource Technology , 2010, 101(15): 5892-5896. DOI:10.1016/j.biortech.2010.02.088. |
| [4] | Jacob-Lopes E, Revah S, Hernández S, et al. Development of operational strategies to remove carbon dioxide in photobioreactors[J]. Chemical Engineering Journal , 2009, 153(1): 120-126. |
| [5] | Chiu S Y, Tsai M T, Kao C Y, et al. The air-ift photobioreactors with flow patterning for high-density cultures of microalgae and carbon dioxide removal[J]. Engineering in life sciences , 2009, 9(3): 254-260. DOI:10.1002/elsc.v9:3. |
| [6] | De Morais M G, Costa J A V. Carbon dioxide fixation by Chlorella kessleri, C. vulgaris, Scenedesmus obliquus and Spirulina sp. cultivated in flasks and vertical tubular photobioreactors[J]. Biotechnology Letters , 2007, 29(9): 1349-1352. DOI:10.1007/s10529-007-9394-6. |
| [7] | Murakami M, Ikenouchi M. The biological CO2 fixation and utilization project by rite (2)-Screening and breeding of microalgae with high capability in fixing CO2[J]. Energy Conversion and Management , 1997, 38(96): S493-S497. |
| [8] | Ma'mun S, Nilsen R, Svendsen H F, et al. Solubility of carbon dioxide in 30 mass% monoethanolamine and 50 mass% methyldiethanolamine solutions[J]. Journal of Chemical & Engineering Data , 2005, 50(2): 630-634. |
| [9] | Puxty, G., Rowland, R., Attalla, M. 2010, Comparison of the rate of CO2 absorption into aqueous ammonia and monoethanolamine[J]. Chemical Engineering Science, 2010, 65(2):915-922. |
| [10] | Choi W, Kim G, Lee K. Influence of the CO2 absorbent monoethanolamine on growth and carbon fixation by the green alga Scenedesmus sp[J]. Bioresource Technology , 2012, 120(17): 295-299. |
| [11] | Kim G, Choi W, Lee C H, et al. Enhancement of dissolved inorganic carbon and carbon fixation by green alga Scenedesmus sp. in the presence of alkanolamine CO2 absorbents[J]. Biochemical Engineering Journal , 2013, 78(5): 18-23. |
| [12] | GM a Rosa d G M, Moraes L, Cardias B B, et al. Chemical absorption and CO2 biofixation via the cultivation of Spirulina in semicontinuous mode with nutrient recycle[J]. Bioresource Technology , 2015, 192: 321-327. DOI:10.1016/j.biortech.2015.05.020. |
| [13] | LI Zi(李姿), REN Hong-yan(任红艳), ZHOU Qian-qian(周骞骞), et al. Interaction effect of light intensity and CO2 concentration on Spirulina platensis growth and carbon sequestration(光强和CO2体积分数对不同生长时期的钝顶螺旋藻生长和固碳的交互影响)[J]. Journal of Food Science and Biotechnology(食品与生物技术学报) , 2014, 33(8): 827-836. |
| [14] | LIU Qing(柳青), ZHANG Duan(张端), HE Ya-long(贺亚龙), et al. Study on the cultivation of Spirulina with beer wastewater(啤酒废水培养螺旋藻的研究)[J]. Journal of Anhui Agricaultural Sciences(安徽农业科学) , 2014, 42(1): 54-56. |
| [15] | SONG Zhi-hui(宋志慧), WANG Ai-li(王爱丽), WANG Xiu-juan(王秀娟), et al. Culture of Spirulina subsalsa for dyes decoloration(盐泽螺旋藻培养用于染料脱色)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2006, 20(1): 134-137. |
| [16] | Sydney E B, Sturm W, de Carvalho J C, et al. Potential carbon dioxide fixation by industrially important microalgae[J]. Bioresource Technology , 2010, 101(15): 5892-5896. DOI:10.1016/j.biortech.2010.02.088. |
| [17] | Brennan L, Owende P. Biofuels from microalgae-a review of technologies for production, processing, and extractions of biofuels and co-products[J]. Renewable and sustainable energy reviews , 2010, 14(2): 557-577. DOI:10.1016/j.rser.2009.10.009. |
| [18] | Chiu S Y, Kao C Y, Chen C H, et al. Reduction of CO2 by a high-density culture of Chlorella sp. in a semicontinuous photobioreactor[J]. Bioresource technology , 2008, 99(9): 3389-3396. DOI:10.1016/j.biortech.2007.08.013. |
| [19] | Song P, Li L, Liu J. Proteomic analysis in nitrogen-deprived Isochrysis galbana during lipid accumulation[J]. Plos one , 2013, 8(12): 1-13. |
| [20] | Kruger N J. The Bradford method for protein quantitation[J]. Methods Molecular Biology , 1994, 32: 9-15. |
| [21] | Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry , 1956, 28(3): 350-356. DOI:10.1021/ac60111a017. |
| [22] | WU Hong-yan(吴红艳). The inorganic carbon absorption of Spirulina platensis and its effects on the carbonic anhydrase(钝顶螺旋藻的无机碳吸收及其碳酸酐酶作用)[J]. Progress in natural science(自然科学进展) , 2006, 16(5): 633-636. |
| [23] | Gilmour D J, Hipkins M F, Webber A N, et al. The effect of ionic stress on photosynthesis in Dunaliella tertiolecta[J]. Planta , 1985, 163(2): 250-256. DOI:10.1007/BF00393515. |
| [24] | YANG Qi-peng(杨启鹏), YUE Li-hong(岳丽宏), KANG A-qing(康阿青). Course of biological fixation of high-CO2 using microalage(微藻固定高浓度CO2技术的研究进展)[J]. Journal of Qingdao Technological University(青岛理工大学学报) , 2009, 30(5): 69-74. |
| [25] | SHI Jian-gong(史建公), LIU Zhi-jian(刘志坚), ZHAO Liang-ying(赵良英), et al. Advances in organic amine CO2 absorbent research(二氧化碳有机胺吸收剂研究进展)[J]. Sino-Global Energy(中外能源) , 2014, 9(14): 16-25. |




