三羟甲基乙烷(trimethylolethane,TME,CAS号:77-85-0),系统命名为1,1,1-三羟甲基乙烷,是一种重要的反应性多元醇中间体和精细化工产品,主要用于生产特殊功能的树脂,二氧化钛的包覆剂[1]。近年来,其作为相变贮热材料也受到广泛关注,应用领域已经延伸到医疗、保健、汽车、军用等[2]。随着市场对该产品的需求量不断增加,对产品的纯度、粒度等提出了更高的要求。三羟甲基乙烷是利用结晶对其进行分离提纯的[3, 4],其在不同溶剂中的溶解度数据为其结晶工艺提供热力学基础数据。同时,固液平衡数据研究既是化工热力学非常重要的内容,也为工业结晶过程操作提供关键性的理论指导。它不仅决定着结晶分离的极限,也对结晶设备选型、尺寸等结晶设计方面具有重要影响。国内外文献对三羟甲基乙烷的溶解度数据尚未见报道,据此本文选取了工业中常用的甲醇、乙醇、正丙醇、异丙醇和二氧六环作为溶剂,采用静态平衡法,测定了在不同温度下三羟甲基乙烷在五种不同的溶剂中的溶解度。利用Apelblat方程和λh方程对溶解度数据进行关联,结果表明实验中的二元体系的关联结果都较好的与实验值相吻合,为其合成及纯化工艺中溶剂的选择提供理论依据。
2 实验部分 2.1 试剂与仪器三羟甲基乙烷、甲醇、乙醇、正丙醇、异丙醇、二氧六环,均为分析纯,购于上海晶纯生化科技股份有限公司。
AR124CN分析天平(精确度±0.1 mg),奥豪斯仪器有限公司;DCY3006超级低温恒温槽(精确度±0.05 K),上海舜宇恒平科学仪器有限公司;TOP强磁力搅拌器,上海振荣科学仪器有限公司;DUG-9030电热恒温鼓风干燥箱,上海精宏实验设备有限公司。
2.2 实验方法本实验采用静态平衡法进行溶解度测定,即在一定的温度下,溶液中存在过量固体溶质在搅拌下达到平衡。具体操作步骤简述如下。在溶解釜中加入过量的样品(待测溶质)和适量的溶剂,用带有温度计的胶皮塞紧溶解釜,开启磁力搅拌器,溶液用超级恒温水浴加热到预先设定的温度。恒温搅拌2~3 h后,使其充分达到溶解平衡,再静置3~4 h。待固体颗粒充分沉降后,用三支预热过的一次性注射器在相同位置分别抽三份等量的上层清液,快速移至质量为m0的容量瓶中,迅速盖紧称重m1,故抽出溶液的质量为(m1-m0)。打开瓶盖,用滤纸盖上瓶口,防止样品污染,然后放入干燥箱中烘干。完全干燥的小瓶质量为m2,用减重法得出其溶质质量为(m2-m0),此时溶液中溶质的摩尔分数可由公式计算:
| $x=\frac{{({{m}_{2}}-{{m}_{0}})}/{{{M}_{1}}}\;}{{({{m}_{2}}-{{m}_{0}})}/{{{M}_{1}}+({{m}_{1}}-{{m}_{2}})/{{M}_{2}}}\;}$ | (1) |
其中,M1为溶质的摩尔质量,M2为溶剂的摩尔质量。同一温度下,在相同位置取三次样,结果取三次测量的平均值。
为了验证实验装置测定数据的可靠性,测定了氯化钾-水体系固液平衡数据,结果表明,实验值和文献值[5]吻合较好,两者平均相对偏差小于0.5%。说明本方法可靠,可用于三羟甲基乙烷溶解度的测定。
3 实验结果与讨论 3.1 实验数据处理Apelblat等人根据固液相平衡热力学提出了Apelblat方程
| $\ln x = A + B/T + C\ln T$ | (2) |
其中A、B、C为溶解度方程参数,可由关联实验数据计算得到。
lh方程是在1980年由Buchowski等人[8, 9]提出的,是专门用于固液相平衡研究的方程,其具体形式如下:
| $\ln \left[ {1 + \lambda \frac{{(1 - {x_1})}}{{{x_1}}}} \right] = \lambda h\left( {\frac{1}{T} - \frac{1}{{{T_m}}}} \right)$ | (3) |
其中,x1为溶质的摩尔分数,Tm是溶质的熔点,λ与h为方程的拟合参数。
以上两个模型的相对误差(RD)和相对标准偏差定义(RSD)如下:
| $RD = \frac{{{x^{\exp }} - {x^{cal}}}}{{{x^{\exp }}}} \times 100\% $ | (4) |
| $RSD = {\left[ {\frac{1}{N}\sum\limits_1^N {{{\left( {\frac{{x_i^{\exp } - x_i^{cal}}}{{x_i^{\exp }}}} \right)}^2}} } \right]^{1/2}}$ | (5) |
式中,N为实验数据点,xexp,xcal分别为实验测定结果和根据拟合方程计算的某点下的溶解度。
实验测定了288.15~318.15 K三羟甲基乙烷在甲醇、乙醇、正丙醇、异丙醇和二氧六环五种溶剂中的溶解度,采用Apelblat方程模型和λh方程对实验数据进行了关联。溶解度实验值和模型方程回归结果列于表 1,拟合参数和相对标准偏差定义(RSD)列于表 2。
| 表 1 三羟甲基乙烷在不同溶剂中的溶解度(摩尔分数)及方程回归结果 Table 1 Mole fraction solubility data and correlation results of TME in different solvents |
| 表 2 三羟甲基乙烷在不同溶剂中的溶解度方程参数及相对标准偏差(RSD) Table 2 Parameters and RSD of TME solubility equations when dissolved in different solvents |
在五种选定溶剂中,三羟甲基乙烷的溶解度随温度的变化关系如图 1所示。可见,在所研究的温度范围内,三羟甲基乙烷的溶解度均随温度的升高而增加,溶解度曲线相似,但每种溶剂中的溶解度增加幅度略有不同。溶解度大小依次为:甲醇>正丙醇>乙醇>异丙醇>1,4-二氧六环,在甲醇和异丙醇中的溶解度随温度的变化趋势比其它三种溶剂明显。由表 1、2和图 1可以看出Apelblat方程和λh方程的数据关联拟合结果与实验值能够很好地相吻合,二元体系的相对误差均处于7%以内,对比平均相对标准偏差,Apelblat方程(平均RSD=1.41%)关联结果要优于λh方程(平均RSD=2.19%)。
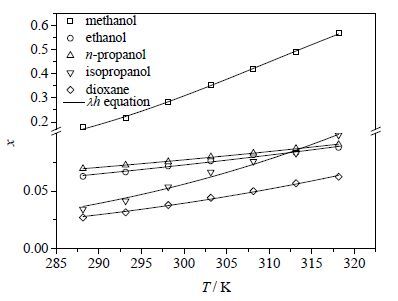
|
图 1 三羟甲基乙烷在不同溶剂中的溶解度曲线 Fig.1 Solubility profiles of TME in different solvents |
(1)采用静态平衡法测定了在288.15~318.15 K三羟甲基乙烷在甲醇、乙醇、正丙醇、异丙醇和二氧六环五种溶剂中的溶解度,结果表明,其溶解度均随温度升高而增大。
(2) 三羟甲基乙烷在五种溶剂中的溶解度大小依次为:甲醇>正丙醇>乙醇>异丙醇>1,4-二氧六环,在甲醇和异丙醇中的溶解度随温度的变化趋势比其它三种溶剂明显。
(3) 采用Apelblat方程和lh方程三羟甲基乙烷的溶解度数据进行了关联,获得了相关模型参数,实验中的所有二元体系的关联结果都较好地与试验所测值相吻合,相对而言,Apelblat方程关联结果要优于lh方程。
符号说明:
| 表 Table |
| [1] | BIAN Yong-dong(卞永东), WANG Dan-dan(王丹丹), FAN Da-he(范大和) . Determination of trimethylolethane by gas chromatography(气相色谱法测定三轻甲基乙烷的含量)[J]. Technology & Development of Chemical Industry(化工技术与开发) , 2008, 37 (4) : 38-39 |
| [2] | WU Ke-zhong(武克忠), WANG Xin-dong(王新东), LIU Xiao-di(刘晓地) . Phase diagram of binary system PG-TAM(多元醇PG-TAM二元体系相图)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2005, 19 (4) : 541-545 |
| [3] | PAN Jin-song(潘劲松), JIA Wei-bin(贾卫斌), ZHANG Xiao-qian(张晓谦) . Synthesis technology of trimethylolethane(三羟甲基乙烷合成工艺研究)[J]. Applied Chemical Industry(应用化工) , 2009, 38 (3) : 465-468 |
| [4] | ZHOU Kai-xi(周开锡), TANG Hong-mei(唐红梅), XIE Jia-li(谢家理) . The technological improvement on catalytic synthesis of trimethylolethane(三羟甲基乙烷催化合成的工艺改进)[J]. Chemical Research and Application(化学研究与应用) , 2009, 21 (2) : 273-276 |
| [5] | Pinho S P, Marcedo E A . Solubility of NaCl, NaBr, and KCl in water, methanol, ethanol, and their mixed solvents[J]. Journal of Chemial & Engineering Data , 2005, 50 (1) : 29-32 |
| [6] | Apelblat A, Manzurola E . Solubilities of o-acetylsalicylic, 4-aminosalic, 3,5-dinitrosalicylic and p-toluic acid and magnesium-DL-aspartate in water from 278 to 348 K[J]. The Journal of Chemical Thermodynamics , 1999, 31 (1) : 85-91 DOI:10.1006/jcht.1998.0424 |
| [7] | XU Qing-qing(许青青), SU Bao-gen(苏宝根), CHEN Wei(陈蔚) . Determination, correlation and prediction of solubilities of desmosterol in five organic solvents(链甾醇在五种有机溶剂中溶解度的测定、关联及预测)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28 (3) : 443-448 |
| [8] | Buchowski H, Ksiazczak A, Pietrzyk S . Solvent activity along a saturation line and solubility of hydrogen-bonding solids[J]. Journal of Physical Chemistry , 1980, 84 (9) : 975-979 DOI:10.1021/j100446a008 |
| [9] | LI Yu-gang(李玉刚), KONG Ling-qi(孔令启), MA Lei(马磊) . Measurement and correlation of the solubility of isophthalonitrile in four solvents(间苯二甲腈在四种溶剂中溶解度的测定及关联)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2011, 25 (3) : 390-394 |




