2. 教育部生物系统稳态与保护重点实验室,浙江大学 生命科学学院,浙江 杭州 310027
2. The MOE Key Laboratory of Biosystems Homeostasis & Protection, College of Life Sciences, Hangzhou 310027, China
蛋白质的三维结构是研究生物大分子结构与功能关系的科学依据,测定蛋白质三维结构的主要实验方法有X射线衍射、低温冷冻电镜和二维核磁共振。蛋白质结构数据库中90%的结构均来自X射线衍射,是获得蛋白质三维结构最常用、最准确的方法[1]。但目前仅少部分蛋白质可以形成符合衍射要求的单晶,因此获得符合衍射要求的蛋白质晶体成为解析蛋白质结构的瓶颈问题[2-3]。致力于阐明蛋白质结晶机制的大多数研究均是使用溶菌酶进行,这是由于其易于获得、易于储存、化学性质稳定,在很宽的条件范围内可以获得大晶体[3-4]。溶菌酶广泛存在于人、动物、植物的组织及微生物细胞,主要分为C型(鸡)、G型(鹅)、细菌型和噬菌体型[5],不同物种来源的溶菌酶氨基酸数量、氨基酸组成、等电点和三维结构等都存在差异,因此,不同物种溶菌酶的结晶条件也会有显著的不同[6]。尽管在蛋白质结晶领域有许多研究和实验进展[7-8],但仍然没有清晰的模型来解释蛋白质结晶各个阶段的机理,因此,需要投入大量的时间和样品量,通过反复试验来优化结晶条件[9]。
通过对蛋白质溶解度的研究,将增强对潜在晶体形成的预测。许多实验室通过对蛋白质溶解度研究来探究结晶机理[10-11]。1991年,Ries-Kautt等[12]得到了不同条件下鸡蛋清溶菌酶的溶解度曲线,但不同物种的溶菌酶溶解度曲线并不一致。蛋白质晶体的质量取决于许多参数,如温度、pH值、沉淀剂、蛋白质种类、蛋白质初始浓度、生长方法、蒸发速率等[7]。大量文献报道了溶菌酶结晶条件的相关研究[9, 13],溶菌酶具有很强的温度依赖性,温度是最常用于改变晶体生长的参数之一[14];溶液的pH值会影响蛋白质表面净电荷的数量,从而影响溶菌酶结晶成核的速率[15-16];沉淀剂是溶菌酶结晶的另一个重要因素[15],通过添加沉淀剂,颗粒之间的相互作用从排斥性变为吸引性,不同沉淀剂的相互作用力不同[17-18];蛋白质初始浓度影响着结晶液滴的过饱和度,过饱和度的大小影响晶核形成的数量与质量[19]。
为了建立高效的蛋白质结晶方法,本文以鸡蛋清溶菌酶、芽孢杆菌溶菌酶和人源溶菌酶3种不同物种来源的溶菌酶为研究对象,采用气相扩散座滴法,探究溶菌酶初始浓度、温度、pH值和沉淀剂对这3种溶菌酶结晶的影响,优化溶菌酶结晶条件,提高结晶效率,为深入研究蛋白质结晶的方法和拓展蛋白质结晶的应用提供依据。
2 材料与方法 2.1 溶菌酶本文使用了3种不同来源的溶菌酶,分别是人源溶菌酶,购自武汉中昌国研标物科技有限公司;芽孢杆菌溶菌酶,购自北京华迈科生物技术有限责任公司;鸡蛋清溶菌酶,购自生物工程(上海)股份有限公司,以上3种溶菌酶纯度均大于95%。3种溶菌酶的相关信息列于表 1中。
|
|
表 1 3种物种来源的溶菌酶的氨基酸序列 Table 1 Amino acid sequences of lysozymes from three species |
由表 1可知,3种不同物种来源的溶菌酶氨基酸序列和氨基酸数量存在差异。鸡蛋清溶菌酶由129个氨基酸组成,等电点pH在10.8左右,最适pH为6.2,相对分子量为14 kDa,主要由4个二硫键、氢键以及疏水键等维持其稳定性结构;芽孢杆菌溶菌酶由143个氨基酸组成,最适pH为8.0,相对分子量为16.0 kDa;人源溶菌酶由130个氨基酸组成,最适pH为6.5,相对分子量为14.72 kDa,由于Lys108的取代,不具有其他两种溶菌酶所具有的二聚体结构和转糖基化活性。3种溶菌酶的催化残基都是天冬氨酸和谷氨酸,处于保守区域,但位置存在差异。不同物种来源的溶菌酶酶活也不相同,人源溶菌酶最高,约为鸡蛋清溶菌酶的3倍[20-22]。
2.2 其他试剂与仪器Thermo Shaker,型号MSC-100;eppendorf小型高速离心机,型号Centrifuge 5415R;紫外可见分光光度计,日本岛津公司产品,型号UV-1800;96和48条件双孔座滴晶体培养板,均购自博亚捷晶科技(北京)有限公司;Bio Tiss微孔板封板膜,购自云城办公专营店;晶体筛选剂Crystal Screen HR2-110、Index HR2-144、晶体染色液Izit crystal dye,购自美国Hampton Research公司;Nikon光学显微镜,型号ECLIPSE E200,放大倍数80×;I-cube培养箱,产自日本亚速旺公司,型号FCI-280。
2.3 实验方法 2.3.1 溶菌酶的溶解度溶解度是指可溶性蛋白质占总蛋白质的百分比,蛋白质分散指数(protein dispersibility index,PDI)为蛋白质溶解度的常用表示方法之一,指水分散蛋白质占总蛋白质的百分比,蛋白质样品体积和浓度的乘积可以得到水分散蛋白质的含量。
称取3种溶菌酶各350 mg,加入5 mL蒸馏水后,1 500×g(相对离心力)旋转振荡5 h,12 000×g (相对离心力)离心15 min,吸取上清液。量取上清液体积,并通过Bradford法测量上清液的蛋白质浓度[23],根据牛血清白蛋白(BSA)标准曲线得出上清液蛋白质浓度,得到水分散蛋白质含量。BSA标准曲线为y=7.228 3x+0.417 8,y为上清液样品的吸光度A595,x为上清液中溶菌酶的浓度。溶菌酶溶解度为
| $ S = \frac{{\left( {y - 0.417\;8} \right) \times V}}{{7.228\;3 \times 350}} \times 100 $ | (1) |
式中:V为上清液体积。
测定不同温度(5、10、15、25、30和40 ℃)和不同pH值(3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0和8.5)时3种溶菌酶的溶解度。以温度作为变量时,pH值均为5.5,以pH值作为变量时,温度均为25 ℃。
2.3.2 座滴法制备溶菌酶晶体在室温下,配制溶菌酶溶液,如图 1所示,吸取80 μL晶体筛选剂于储液池(liquid reservoir)中,1 μL溶菌酶溶液于点样孔(sample hole)中,再从储液池中吸取1 μL晶体筛选剂于点样孔中,用封板膜密封,在培养箱中静置生长,定期观察并记录晶体的生长情况,第1周每天观察,第2周3 d观察一次晶体。
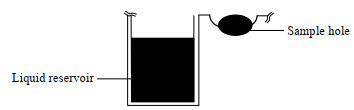
|
图 1 座滴板的横截面 Fig.1 Cross section of the sitting-drop plate |
利用Hampton Research公司的Izit Crystal Dye进行晶体染色。Izit是一种小分子染料,用于区分生物大分子晶体、小分子晶体和无机晶体。生物大分子晶体含有大溶剂通道,允许Izit渗透并使晶体呈现深蓝色,小分子晶体和无机晶体不具有大的溶剂通道,无法吸收Izit。若添加Izit后出现薄的针状蓝色晶体,是由于具有高相对过饱和度的筛选剂促使染料结晶后形成的,可以通过添加1 μL Izit染色液和1 μL筛选剂形成2 μL液滴的对照实验将这种假阳性与阳性区分开[24]。将10 μL Izit与储液池中80 μL的晶体筛选剂混合均匀,从混合液中吸取1 μL至点样孔中的结晶液滴,对晶体进行染色。在特定温度的培养箱中静置6 h后,观察染色情况,根据整个晶体是否被染成深蓝色来判断晶体是否为蛋白质。
2.3.4 溶菌酶结晶条件的研究从溶菌酶初始浓度、温度、pH值、沉淀剂4个方面对3种物种来源的溶菌酶的最适结晶条件进行实验探究。
2.3.4.1 溶菌酶初始浓度对溶菌酶结晶的影响在25 ℃下培养3种溶菌酶,初始质量浓度分别为10、20、40、80和120 mg·mL-1。鸡蛋清溶菌酶以及芽孢杆菌溶菌酶的筛选剂均含有浓度为0.1 mol·L-1乙酸钠的缓冲液以及浓度为2.0 mol·L-1甲酸钠沉淀剂,pH为5.5;人源溶菌酶的筛选剂中含有0.1 mol·L-1双(2-羟乙基)氨基(三羟甲基)甲烷(Bis-(2-Hydroxyethyl)amino-tris(Hydroxymethyl)methane, BIS-TRIS)缓冲液及2.0 mol·L-1硫酸铵沉淀剂,pH为6.1。
2.3.4.2 温度对溶菌酶结晶的影响在5、15、25和40 ℃ 4个温度下对3种溶菌酶进行晶体培养。鸡蛋清溶菌酶和芽孢杆菌溶菌酶初始质量浓度均为40 mg·mL-1,筛选剂均含有0.1 mol·L-1乙酸钠的缓冲液以及2.0 mol·L-1甲酸钠沉淀剂,pH为5.5;人源溶菌酶的初始质量浓度为80 mg·mL-1,筛选剂含有0.1 mol·L-1 BIS-TRIS的缓冲液以及2.0 mol·L-1硫酸铵的沉淀剂,pH为6.1。
2.3.4.3 pH对溶菌酶结晶的影响在25 ℃的温度下培养3种溶菌酶晶体,pH设置为3.5、4.5、5.5、6.5、7.5和8.5。鸡蛋清溶菌酶和芽孢杆菌溶菌酶的初始质量浓度均为40 mg·mL-1,筛选剂均含有0.1 mol·L-1乙酸钠的缓冲液和2.0 mol·L-1甲酸钠的沉淀剂;人源溶菌酶的初始质量浓度为80 mg·mL-1,筛选剂含有0.1 mol·L-1 BIS-TRIS的缓冲液和2.0 mol·L-1硫酸铵的沉淀剂。
2.3.4.4 沉淀剂对溶菌酶结晶的影响在25 ℃的温度下培养3种溶菌酶晶体,鸡蛋清溶菌酶和芽孢杆菌溶菌酶的初始质量浓度均为40 mg·mL-1,筛选剂pH值为5.5;人源溶菌酶的初始质量浓度为80 mg·mL-1,筛选剂pH值为6.1。沉淀剂设置如表 2所示。
|
|
表 2 3种物种来源的溶菌酶的沉淀剂种类 Table 2 Precipitants for lysozyme from three species |
测定了不同温度(5、10、15、25、30和40 ℃)和pH值(3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0和8.5)条件下3种溶菌酶在缓冲液中的溶解度,结果如图 2所示。以温度为变量时,pH值为5.5。如图 2(a)所示,温度为5~40 ℃,鸡蛋清和芽孢杆菌溶菌酶的溶解度呈现了相同的变化规律,人源溶菌酶与它们不同。在5~25 ℃,人源溶菌酶溶解度是鸡蛋清和芽孢杆菌溶菌酶溶解度的5~7倍,在30~40 ℃,3种溶菌酶溶解度的差距趋于0。在15 ℃时,人源溶菌酶溶解度达到最大值,而其余2种溶菌酶却降至最小值。在25 ℃时,人源溶菌酶的溶解度开始大幅下降,而鸡蛋清和芽孢杆菌溶菌酶的溶解度达到最大值。以pH值为变量时,温度为25 ℃。图 2(b)示出在pH为3.5~8.5时3种溶菌酶溶解度的变化,由图可知人源溶菌酶溶解度是其余2种溶菌酶的6倍左右。3种溶菌酶的溶解度均随着pH值增大而增大,在pH值为7.5时3种溶菌酶溶解度均达到最大值,其后便开始下降; 并且pH值在4.5~6.0,溶解度大幅上升,随pH值变化显著。这些溶解度数据的获得,为研究溶菌酶结晶条件提供了主要依据。
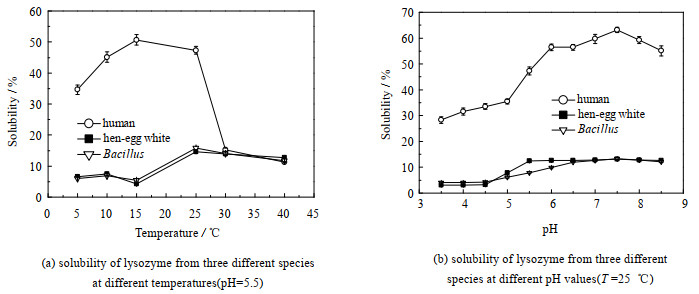
|
图 2 3种物种来源的溶菌酶在不同温度和pH值下的溶解度 Fig.2 Solubility of lysozymes from three species at different temperatures and pH values |
由溶解度数据测定可知,人源溶菌酶溶解度为鸡蛋清和芽孢杆菌溶解度的5~7倍,因此研究溶菌酶初始浓度对晶体生长的影响时,溶菌酶的初始浓度范围要宽一点,以覆盖人源溶菌酶溶解度最大值以及其余2种溶菌酶溶解度最小值。因此设置了蛋白质初始质量浓度为10~120 mg·mL-1。同样将温度设置为5、15、25和40 ℃,在这个温度范围内,人源溶菌酶溶解度与其余2种溶菌酶溶解度呈现不一样的变化规律。设置了pH为3.5~8.5,3种溶菌酶溶解度在这个pH值范围内均呈现出相同的变化规律。
3.2 影响3种溶菌酶晶体生长的因素 3.2.1 溶菌酶初始浓度对晶体生长的影响图 3示出了3种溶菌酶在不同的初始浓度下晶体生长的情况,表示了溶菌酶初始浓度对晶体生长的影响程度。

|
图 3 3种物种来源的溶菌酶在10~120 mg·mL-1初始浓度下的结晶状态 Fig.3 Crystallization of lysozyme from three species under initial concentrations of 10~120 mg·mL-1 (a) hen-egg white, 10 mg·mL-1 (b) hen-egg white, 20 mg·mL-1 (c) hen-egg white, 40 mg·mL-1 (d) hen-egg white, 80 mg·mL-1 (e) hen-egg white, 120 mg·mL-1 (hen-egg white: pH=5.5, T=25 ℃, precipitant: 0.1 mol·L-1 sodium acetate, 2.0 mol·L-1 sodium formate) (f) Bacillus, 10 mol·L-1 (g) Bacillus, 20 mol·L-1 (h) Bacillus, 40 mol·L-1 (i) Bacillus, 80 mol·L-1 (j) Bacillus, 120 mol·L-1 (Bacillus: pH=5.5, T=25 ℃, precipitant: 0.1 mol·L-1 sodium acetate, 2.0 mol·L-1 sodium formate) (k) human, 10 mol·L-1 (l) human, 20 mol·L-1 (m) human, 40 mol·L-1 (n) human, 80 mol·L-1 (o) human, 120 mol·L-1 (human: pH=6.1, T=25 ℃, precipitant: 0.1 mol·L-1 BIS-TRIS, 2 mol·L-1 ammonium sulfate) |
图 3(a)、(b)、(c)、(d)和(e),为鸡蛋清溶菌酶在10、20、40、80和120 mg·mL-1初始质量浓度下的状态,分别是:未形成沉淀或晶体;出现数量较少的四方块状晶型;形成多个四方块状晶体的理想晶型;形成四方块和六面体等不规则形状的晶体交叠在一起;形成了大量形状各不相同的晶体。图 3(f)、(g)、(h)、(i)和(j),芽孢杆菌溶菌酶在10、20、40、80和120 mg·mL-1初始浓度下的状态, 分别是:未形成沉淀或晶体;形成了单个板块状晶体;形成多个板块状晶体的理想晶型;形成大量的微小晶体;生成小麦束状的晶体。图 3(k)、(l)、(m)、(n)和(o),为人源溶菌酶在10、20、40、80和120 mg·mL-1初始浓度下的状态,分别是:出现不透明沉淀;形成棒簇状晶体;形成不透明沉淀以及小型针状晶体;生成了分散的晶体并且呈现最理想的晶型,针状晶体;形成了大量的聚集的针状晶体。研究发现,在溶菌酶初始浓度过高时会形成过多的晶核,晶体生长速度过快, 会形成大量的细小微晶, 晶体质量比较差;初始浓度过低时无法形成沉淀和晶体或生成的晶体数量过少。因此想要获得高质量的晶体, 溶菌酶初始浓度应处于较低或中等的水平,避免产生过多晶核,形成质量较差的晶体。鸡蛋清溶菌酶和芽孢杆菌溶菌酶最适蛋白质初始质量浓度均为40 mg·mL-1,最理想晶型分别为四方块状和板块状。人源溶菌酶的最适蛋白质初始质量浓度与上述二者不同,为80 mg·mL-1,最理想晶型呈现针状。由此可以说明,初始质量浓度不仅影响了晶体的形状,而且不同物种溶菌酶也显示了晶型的不同变化。
3.2.2 温度对晶体生长的影响图 4示出了在不同温度下晶体的生长情况,表示了温度对晶体生长的影响程度。

|
图 4 3种物种来源的溶菌酶在5~40 ℃温度下的结晶状态 Fig.4 Crystallization of lysozyme from three different species at temperatures of 5~40 ℃ (a) hen-egg white, 5 ℃ (b) hen-egg white, 15 ℃ (c) hen-egg white, 25 ℃ (d) hen-egg white, 40 ℃ (hen-egg white: pH=5.5, c=40 mg·mL-1, precipitant: 0.1 mol·L-1 sodium acetate, 2.0 mol·L-1 sodium formate) (e) Bacillus, 5 ℃ (f) Bacillus, 15 ℃ (g) Bacillus, 25 ℃ (h) Bacillus, 40 ℃ (Bacillus: pH=5.5, c=40 mg·mL-1, precipitant: 0.1 mol·L-1 sodium acetate, 2.0 mol·L-1 sodium formate) (i) human, 5 ℃ (j) human, 15 ℃ (k) human, 25 ℃ (l) human, 40 ℃ (human: pH=6.1, c=80 mg·mL-1, precipitant: 0.1 mol·L-1 BIS-TRIS, 2 mol·L-1 ammonium sulfate) |
如图 4(a)、(b)、(c)和(d)所示,鸡蛋清溶菌酶在5、15、25和40 ℃的状态分别是:形成了大量的晶体;形成了少量板块状晶体;生成了数量适中的方块状理想晶型;形成了聚集的棒簇状晶体且表面残缺不平整,多处出现裂纹。如图 4(e)、(f)、(g)和(h)所示,芽孢杆菌溶菌酶在5、15、25和40 ℃的状态分别是:形成了数量庞大的孪晶;形成了少量不规则的多面体晶体;形成了板块状的理想晶型;形成了大量的针状晶体。如图 4(i)、(j)、(k)和(l)所示,人源溶菌酶在5、15、25和40 ℃的状态分别是:形成了大量交叉的针状晶体;形成了多层重叠的板块状晶体,表面残缺不规整;形成了针状晶体的理想晶型,数量适中,呈现分散状态;形成了小麦束状晶体。溶菌酶在低温时会迅速结晶,产生过多的晶核或者孪晶,造成晶体聚集,无法获得达到衍射要求的晶体;高温会造成晶体变形,表面出现各种裂纹,因此过高或过低的温度都无法获得质量较高的晶体。25 ℃为3种物种溶菌酶的最适结晶温度。由此可以说明,温度也是一个影响晶体形状的重要因素。
3.2.3 pH值对晶体生长的影响图 5示出了3种溶菌酶在不同pH条件下形成的晶体大小、数量、形状各不相同,表示了pH对晶体生长的影响程度。

|
图 5 3种物种来源的溶菌酶在3.5~8.5的pH值下的结晶状态 Fig.5 Crystallization of lysozyme from three species under pH values of 3.5~8.5 (a) hen-egg white, pH 3.5 (b) hen-egg white, pH 4.5 (c) hen-egg white, pH 5.5 (d) hen-egg white, pH 6.5 (e) hen-egg white, pH 7.5 (f) hen-egg white, pH 8.5(hen-egg white: T=25 ℃, c=40 mg·mL-1, precipitant: 0.1 mol·L-1 sodium acetate, 2.0 mol·L-1 sodium formate) (g) Bacillus, pH 3.5 (h) Bacillus, pH 4.5 (i) Bacillus, pH 5.5 (j) Bacillus, pH 6.5 (k) Bacillus, pH 7.5 (l) Bacillus, pH 8.5(Bacillus: T=25 ℃, c=40 mg·mL-1, precipitant: 0.1 mol·L-1 sodium acetate, 2.0 mol·L-1 sodium formate) (m) human, pH 3.5 (n) human, pH 4.5 (o) human, pH 5.5 (p) human, pH 6.5 (q) human, pH 7.5 (r) human, pH 8.5(human: T=25 ℃, c=80 mg·mL-1, precipitant: 0.1 mol·L-1 BIS-TRIS, 2 mol·L-1 ammonium sulfate) |
如图 5(a)、(b)、(c)、(d)、(e)和(f)所示,鸡蛋清溶菌酶在pH 3.5、4.5、5.5、6.5、7.5和8.5的条件下的状态分别是:形成了不规则形状的晶体;形成了数个不规则六面体;形成了方块状理性晶型,数量适中;形成了多个板块状晶体,大小各异,晶型不均匀;形成了大小各异的六面体晶体;形成了微小的大量聚集的针状晶体。如图 5(g)、(h)、(i)、(j)、(k)和(l)所示,芽孢杆菌溶菌酶在pH 3.5、4.5、5.5、6.5、7.5和8.5的条件下的状态分别是:形成了大量聚集的针状晶体;形成了数个六面体晶体,但形状各异;形成了理想晶型,多个板块状晶体,晶型均匀一致形成了数量较少的板块状晶体,边缘凸起,晶型不均匀;形成了单个六面体晶体;未形成沉淀或晶体。如图 5(m)、(n)、(o)、(p)、(q)和(r)所示,人源溶菌酶在pH 3.5、4.5、5.5、6.5、7.5和8.5的条件下的状态分别是:形成了棒簇状晶体;数个小麦束状晶体,且尾部表面出现残缺不平整;多个大小不一的针状晶体,处于聚集状态;多个针状晶体,均匀分散;单个双头的小麦束状晶体;形成了不透明沉淀,未出现晶体。一般情况下,蛋白质的溶解度在等电点处是最低的,此时蛋白质表面的净电荷几乎为零,当pH值高于或低于等电点时,蛋白质所带的净电荷为正电荷或负电荷,溶解度增大,从而对晶体的大小和晶型产生影响。本实验中3种物种溶菌酶的最适结晶pH均不在溶菌酶的等电点(11.1)附近,在5.5附近的pH值更适合鸡蛋清以及芽孢杆菌溶菌酶结晶,在6.5附近的pH值更适合人源溶菌酶进行结晶。由此说明pH对晶体生长的影响也十分明显。
3.2.4 沉淀剂对晶体生长的影响图 6中示出了在不同沉淀剂下3种溶菌酶的晶型存在差异,表示了沉淀剂对晶体生长的影响程度。如图 6(a)所示,鸡蛋清溶菌酶在浓度为0.1 mol·L-1醋酸钠,2.0 mol·L-1甲酸钠的沉淀剂下形成了最理想的晶型,四方块状晶体;图 6(b)所示,在0.1 mol·L-1柠檬酸,3 mol·L-1氯化钠下形成六面体晶型;图 6(c),在1 mol·L-1琥珀酸,0.1 mol·L-1 HEPES,在ρ=0.01 kg·L-1 MPEG-2000下产生的不规则方块状晶体表面存在大量裂纹;图 6(d)所示,芽孢杆菌溶菌酶在0.1 mol·L-1醋酸钠,2.0 mol·L-1甲酸钠沉淀剂形成了最理想的晶型,板块状晶体;图 6(e),在0.1 mol·L-1 HEPES Na,0.8 mol·L-1酒石酸钾钠下形成棒簇状晶型;图 6(f),在φ=5% Tacsimate,0.1 mol·L-1 HEPES,ρ=0.1 kg·L-1 MPEG-5000下形成了大量重叠的板块状晶体。图 6(g)所示,人源溶菌酶在0.1 mol·L-1 BIS-TRIS,2 mol·L-1硫酸铵沉淀剂下形成了最理想晶型,针状晶体;图 6(h)和图 6(i),人源溶菌酶分别在φ=60% Tacsimate以及1.26 mol·L-1磷酸二氢钠,0.14 mol·L-1磷酸氢二钾的沉淀剂下形成了小麦束状晶型。不同种类的沉淀剂,与蛋白质结晶的相互作用力不同,最终形成的晶体晶型也各不相同。鸡蛋清溶菌酶以及芽孢杆菌溶菌酶的最适结晶沉淀剂为0.1 mol·L-1乙酸钠,2.0 mol·L-1甲酸钠;人源溶菌酶的最适结晶沉淀剂为0.1 mol·L-1 BIS-TRIS,2 mol·L-1硫酸铵。
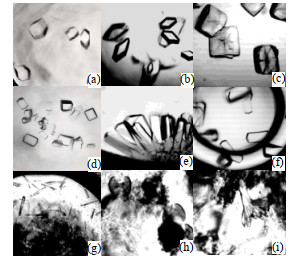
|
图 6 3种物种来源的溶菌酶在不同沉淀剂条件下的结晶状态 Fig.6 Crystallization of lysozyme from three species under different precipitant conditions (a) hen-egg white, 0.1 mol·L-1 sodium acetate, 2.0 mol·L-1 sodium formate (b) hen-egg white, 0.1 mol·L-1 sodium acetate, 2.0 mol·L-1 sodium formate (c) hen-egg white, 1 mol·L-1 succinic acid, 0.1 mol·L-1 HEPES, ρ = 0.01 kg·L-1 MPEG-2000(hen-egg white: T=25 ℃, c=40 mg·mL-1, pH=5.5) (d) Bacillus, 0.1 mol·L-1 sodium acetate, 2.0 mol·L-1 sodium formate (e) Bacillus, 0.1 mol·L-1 HEPES Na, 0.8 mol·L-1 sodium tartrate (f) Bacillus, φ=5% tacsimate, 0.1 mol·L-1HEPES, ρ = 0. 1 kg·L-1 MPEG-5000(Bacillus: T=25 ℃, c=40 mg·mL-1, pH=5.5) (g) human, 0.1 mol·L-1BIS-TRIS, 2 mol·L-1 ammonium sulfate (h) human, φ=60% tacsimate (i) human, 1.26 mol·L-1 sodium dihydrogen phosphate, 0.14 mol·L-1 dipotassium phosphate(human: T=25 ℃, c=80 mg·mL-1, pH=6.1) |
通过Bradford法测定上清液蛋白浓度,计算得到3种不同物种来源的溶菌酶在不同温度和pH值下的溶解度,发现人源溶菌酶在不同温度和pH值下的溶解度均为其余2种溶菌酶的5~7倍;鸡蛋清与芽孢杆菌溶菌酶在不同温度和pH值下的溶解度变化规律一致,与人源溶菌酶溶解度在不同pH值下的变化规律一致,但在不同温度下的变化趋势存在较大差异。通过气相扩散座滴法培养3种溶菌酶的晶体,结果表明不同物种的溶菌酶的结晶条件和形成的晶型也不同。鸡蛋清溶菌酶、芽孢杆菌溶菌酶和人源溶菌酶形成的晶型分别是四方块状、板块状和针状。鸡蛋清溶菌酶通常是在150 mg·mL-1的高蛋白质初始质量浓度,25 ℃,pH 4.5,0.3 mol·L-1 NaCl作为沉淀剂,0.1 mol·L-1乙酸钠作为缓冲液的条件下形成晶体。
本文对不同物种的溶菌酶的溶解度、结晶条件和形成的不同晶型进行探究,发现3种溶菌酶的结晶条件中,温度和pH值与以往报道的差距不大,但沉淀剂和蛋白质初始浓度存在较大差异;对不同晶型的研究,将有利于探究蛋白质的多态行为。
本文总结的结晶条件将不仅为球形蛋白质、也对常规的蛋白质结晶条件优化具有参考价值,从而为解析更多蛋白质的三维结构提供基础。
| [1] |
熊强, 丁立新, 姜晓燕, 等. X射线测定蛋白质结构的技术进展与研究现状[J]. 癌变·畸变·突变, 2019, 31(1): 84-87. XIONG Q, DING L X, JIANG X Y, et al. Technical progress and research status of X-ray determination of protein structure[J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2019, 31(1): 84-87. |
| [2] |
BRICE J C, RUDOLPH P. Crystal growth[M]. Hoboken: Wiley-VCH, 2007.
|
| [3] |
CROWFOOT D, BERNAL J D. X-Ray photographs of crystalline pepsin[J]. Nature, 1934, 133(3369): 794-795. |
| [4] |
丹媛媛, 徐晓冬, 李欣欣, 等. 溶菌酶的结晶研究[J]. 生物技术通报, 2007(3): 84-87. DAN Y Y, XU X D, LI X X, et al. Study of lysozyme crystallization[J]. Biotechnology Bulletin, 2007(3): 84-87. DOI:10.3969/j.issn.1002-5464.2007.03.018 |
| [5] |
KUWANO Y, YONEDA K, KAWAGUCHI Y, et al. The complete amino acid sequence and enzymatic properties of an i-type lysozyme isolated from the common orient clam (Meretrix lusoria)[J]. Bioscience Biotechnology and Biochemistry, 2013, 77(11): 2269-2277. DOI:10.1271/bbb.130534 |
| [6] |
VIRELLA G. The electrophoretic mobility of serum lysozyme[J]. Experientia, 1975, 31(12): 1465-1467. DOI:10.1007/BF01923245 |
| [7] |
MCPHERSON A, CUDNEY B. Optimization of crystallization conditions for biological macromolecules[J]. Acta Crystallographica, Section F:Structural Biology Communications, 2014, 70(11): 1445-1467. DOI:10.1107/S2053230X14019670 |
| [8] |
BOYKO K M, POPOV V O, KOVALCHUK M V. Promising approaches to crystallization of macromolecules suppressing the convective mass transport to the growing crystal[J]. Russian Chemical Reviews, 2015, 84(8): 853-859. DOI:10.1070/RCR4557 |
| [9] |
PLAZA-GARRIDO M, SALINAS-GARCIA M C, Camara-Artigas A. Orthorhombic lysozyme crystallization at acidic pH values driven by phosphate binding[J]. Acta Crystallographica, Section D:Structural Biology, 2018, 74(5): 480-489. DOI:10.1107/S205979831800517X |
| [10] |
DAVEY R J, BACK K R, SULLIVAN R A. Crystal nucleation from solutions-transition states, rate determining steps and complexity[J]. Faraday Discussions, 2015, 179: 9-26. DOI:10.1039/C5FD00037H |
| [11] |
VORONTSOVA M A, MAES D, VEKILOV P G. Recent advances in the understanding of two-step nucleation of protein crystals[J]. Faraday Discussions, 2015, 179: 27-40. DOI:10.1039/C4FD00217B |
| [12] |
RIÈS-KAUTT M M, DUCRUIX A F. Crystallization of basic proteins by ion pairing[J]. Journal of Crystal Growth, 1991, 110(1): 20-25. |
| [13] |
BOIKOVA A S, DYAKOVA Y A, ILINA K B, et al. Octamer formation in lysozyme solutions at the initial crystallization stage detected by small-angle neutron scattering[J]. Acta Crystallographica, Section D:Structural Biology, 2017, 73(7): 591-599. DOI:10.1107/S2059798317007422 |
| [14] |
KOVALCHUK M V, BLAGOV A E, DYAKOVA Y A, et al. Investigation of the initial crystallization stage in lysozyme solutions by small-angle X-ray scattering[J]. Crystal Growth & Design, 2016, 16(4): 1792-1797. |
| [15] |
张承.鸡蛋白溶菌酶结晶学研究[D].广州: 中山大学, 2007. ZHANG C. Crystallographic study on hen egg white lysozyme[D]. Guangzhou: Sun Yat-sen University, 2007. |
| [16] |
戴国亮, 于泳, 康琦, 等. 溶菌酶晶体生长前期溶液中聚集体研究[J]. 化学学报, 2004, 62(8): 757-761. DAI G L, YU Y, KANG Q, et al. Study of the aggregates in lysozyme solution before crystal growth[J]. Acta Chimica Sinica, 2004, 62(8): 757-761. DOI:10.3321/j.issn:0567-7351.2004.08.003 |
| [17] |
JIE L, WANG X J, CHING C B. Batch crystallization of soluble proteins:Effect of precipitant, temperature and additive[J]. Progress in Crystal Growth & Characterization of Materials, 2002, 45(3): 201-217. |
| [18] |
代小虎, 毕汝昌. 沉淀剂类型对蛋白质晶体分子堆积的影响[J]. 生物物理学报, 2002, 8(4): 394-398. DAI X H, BI R C. Effects of the precipitant kinds on the molecular packing of protein crystals[J]. Acta Biophysica Sinica, 2002, 8(4): 394-398. DOI:10.3321/j.issn:1000-6737.2002.04.004 |
| [19] |
KUZNETSOV Y G, MALKIN A J, MCPHERSON A. The influence of precipitant concentration on macromolecular crystal growth mechanisms[J]. Journal of Crystal Growth, 2001, 232(1): 114-118. |
| [20] |
ARAKI T, KURAMOTO M, TORIKATA T. The amino acid sequence of copper pheasant lysozyme[J]. Bioscience Biotechnology & Biochemistry, 1994, 58(4): 794-795. |
| [21] |
HEINEMAN R H, MOLINEUX I J, BULL J J. Evolutionary robustness of an optimal phenotype:Re-evolution of lysis in bacteriophage deleted for its lysin gene[J]. Journal of Molecular Evolution, 2005, 61(2): 181-191. DOI:10.1007/s00239-004-0304-4 |
| [22] |
SONG H, INAKA K, MAENAKA K, et al. Structural changes of active site cleft and different saccharide binding modes in human lysozyme co-crystallized with hexa-N-acetyl-chitohexaose at pH 4.0[J]. Journal of Molecular Biology, 1994, 244(5): 522-540. DOI:10.1006/jmbi.1994.1750 |
| [23] |
张志涛, 刘金生, 许强, 等. Bradford法测定牛奶中蛋白质含量[J]. 食品与机械, 2011, 27(5): 128-130. ZHANG Z T, LIU J S, XU Q, et al. Protein determination of milk by Bradford method[J]. Food & Machinery, 2011, 27(5): 128-130. DOI:10.3969/j.issn.1003-5788.2011.05.033 |
| [24] |
WILKOSZ P A, CHANDRASEKHAR K, ROSENBERG J M. Preliminary characterization of EcoRI-DNA co-crystals:Incomplete factorial design of oligonucleotide sequences[J]. Acta Crystallographica, Section D:Biological Crystallography, 1995, 51(6): 938-945. DOI:10.1107/S0907444994005251 |




