我国镁资源储量十分丰富,其中海水中含有大量的镁元素,在海水制盐及盐湖卤水提钾过程中富产大量的镁盐[1],主要是氯化镁和硫酸镁。六水氯化镁(Magnesium chloride hexahydrate),分子式MgCl2·6H2O,无色透明至白色半透明晶体,具有玻璃光泽,味苦涩,吸水性强,易溶于水和酒精[2],在水中的溶解度随着温度的升高而增大。六水氯化镁是重要的工业原料,广泛用作阻燃剂、聚凝剂、防冻剂[3, 4]等。
随着科技的发展,对六水氯化镁的综合开发利用拓展至非水体系[5],如水合氯化镁有机溶剂络合脱水、镁离子液体、合成含镁功能材料等。在非水体系中合成含镁无机功能材料需要相关物质的溶解度参数,现有文献报道了MgCl2·6H2O在正丁醇中的溶解度[6],另有作者测定了MgCl2·6H2O在乙二醇中的溶解度[7],MgCl2·6H2O在其他有机溶剂中溶解度还未见详细报道。
本文系统地测定了MgCl2·6H2O在乙醇、正丙醇、异丙醇、丙三醇、正丁醇、异丁醇六种醇类有机溶剂中的溶解度数据,并采用Apelblat方程、λh方程、理想状态方程和多项式经验方程分别对溶解度实验数据进行关联,关联结果良好,为MgCl2·6H2O在非水体系中的应用提供了基础数据。
2 实验部分 2.1 试剂与仪器试剂:实验中所用试剂见表 1。乙醇、正丙醇、异丙醇、丙三醇、正丁醇、异丁醇均为分析纯,实验用水为去离子水。
| 表 1 实验中使用的试剂 Table 1 Detailed information of the reagents used |
仪器:DF-101S集热式恒温加热磁力搅拌器(精度±0.1℃),郑州长城科工贸有限公司;BP221S型精密电子天平(精度±0.0001 g),德国赛多利斯集团;DZF-6020真空干燥箱,上海精宏实验设备有限公司。
2.2 实验方法本实验采用平衡法[8, 9](analytical method)测定溶解度。将过量的MgCl2·6H2O加入至盛有有机溶剂的具塞三角烧瓶中,保持温度恒定,搅拌24 h以上至溶解平衡。停止搅拌后恒温静置6 h以上,待溶液中的剩余固体颗粒全部沉淀下来后,取一定量的上清液,稀释定容,待测。采用EDTA滴定法测定Mg2+的含量。取一定体积的稀释液于锤形瓶中,加入蒸馏水、缓冲溶液、铬黑T指示剂,用EDTA标准溶液滴定,平行滴定三次,同时做空白实验。
通过如下公式计算溶解度x。
| $ x = \frac{{{m_1}/{M_1}}}{{{m_1}/{M_1} + {m_2}/{M_2}}} $ |
式中m1、m2分别为溶质和溶剂的质量,M1、M2分别为溶质和溶剂的摩尔质量。
2.3 实验误差控制及可靠性验证为了准确测量溶解度数据,对试剂进行预处理:六水氯化镁在使用前在50℃条件下真空恒温干燥6 h,以脱除晶体表面的吸附水[7];由于使用的有机溶剂具有一定的挥发性,因此在实验过程中采用回流冷凝装置,避免溶剂挥发。
为了验证实验装置测定数据的可靠性,测定了不同温度下MgCl2·6H2O在正丁醇中的溶解度,实验值与文献值[6]比较,平均相对偏差小于2%,说明本方法可靠,可用于MgCl2·6H2O溶解度的测定。
3 实验结果与讨论 3.1 溶解度数据实验测定了293.15~338.15K时MgCl2·6H2O在乙醇、正丙醇、异丙醇、丙三醇、正丁醇、异丁醇中的溶解度,溶解度实验值及各方程拟合值见表 2。
| 表 2 六水合氯化镁在不同溶剂中的溶解度以及相对偏差(ε) Table 2 Solubility of magnesium chloride hexahydrate in different solvents and their relative deviations (ε) |
采用相对偏差ε和平均相对偏差σ衡量各拟合值的准确度。
| $ \begin{gathered} \varepsilon = \left| {\frac{{x_i^{\exp }-x_i^{{\rm{cal}}}}}{{x_i^{\exp }}}} \right| \hfill \\ \sigma = \frac{1}{n}\sum\limits_{i = 1}^n {\left| {\left( {x_i^{\exp }-x_i^{{\rm{cal}}}} \right)/x_i^{\exp }} \right|} \hfill \\ \end{gathered} $ |
Apelblat方程[10]假定溶液的焓变为温度的线性函数,并依据Clausius-Clapeyron方程导出表述固液平衡状态的简化方程:
| $ \ln x = {A_1} + {B_1}/T + {C_1}\ln T $ |
式中A1、B1、C1为方程参数。各溶剂体系的方程参数、相关系数R2及标准偏差σ结果见表 3。
| 表 3 各体系中Apelblat模型参数回归结果 Table 3 Parameters of Apelblat equation for different solvents |
λh是1980年由Buchowski等首先提出的一个针对固体溶解度平衡的方程[11],该方程具有只需要溶质的熔点Tm而不需要活度系数的优点,其表达式如下:
| $ \ln \left[{1 + \frac{{\lambda \left( {1-x} \right)}}{x}} \right] = \lambda h\left( {\frac{1}{T} -\frac{1}{{{T_{\rm{m}}}}}} \right) $ |
式中λ、h为方程参数,拟合结果见表 4。
| 表 4 各体系中λh模型参数回归结果 Table 4 Parameters of λh equation for different solvents |
根据热力学原理描述的固液平衡,有普适溶解度方程[12, 13],表示为:
| $ \ln \left( {\frac{1}{{{\gamma _1}{x_1}}}} \right) = \frac{{{\Delta _{{\rm{fus}}}}{H_1}}}{{R{T_{t, 1}}}}\left( {\frac{{{T_{t, 1}}}}{T}-1} \right) + \frac{{\Delta {c_{{\rm{p, 1}}}}}}{R}\left( {\ln \frac{{{T_{t, 1}}}}{T}-\frac{{{T_{t, 1}}}}{T} + 1} \right) $ |
由于溶液中溶质与其纯固体物质的等压热容差
| $ \ln \left( {\frac{1}{{{\gamma _1}{x_1}}}} \right) = \frac{{{\Delta _{{\rm{fus}}}}{H_1}}}{{R{T_{t, 1}}}}\left( {\frac{{{T_{t, 1}}}}{T}-1} \right) $ |
在活度系数系数一般可近似表示为
因为
| $ \ln {x_1} = {A_2} + \frac{{{B_2}}}{T} $ |
式中x1为溶质的摩尔分数,a1、b1、A2、B2为方程参数[14, 15],△fusH1为三相点的熔化焓,Tt, 1为三相点温度。六种溶剂体系的方程参数、相关系数R2及标准偏差σ结果见表 5。
| 表 5 各体系中理想状态方程参数回归结果 Table 5 Parameters of ideal solution model for different solvents |
在工业应用方面,固液平衡数据的拟合公式越简单,应用越方便,因此本文采用形式简洁的多项式经验方程对数据进行关联[16],具体形式如下:
| $ x = {a_1} + {b_1}T + {c_1}{T^2} $ |
式中a1、b1、c1为方程参数。不同溶剂体系的方程参数、相关系数R2及标准偏差σ结果见表 6。
| 表 6 各体系中多项式经验方程参数回归结果 Table 6 Parameters of empirical equation for different solvents |
(1) MgCl2·6H2O在六种醇类有机溶剂中的溶解度随温度变化曲线见图 1,其中MgCl2·6H2O在正丁醇中的溶解度数据与文献中报道的基本一致。在293.15~338.15 K,MgCl2·6H2O在乙醇、正丙醇、异丙醇、丙三醇、正丁醇、异丁醇中的溶解度有比较明显的差异,但是均随着温度的升高而增大,且MgCl2·6H2O在丙三醇、乙醇中的溶解度随温度的变化趋势比其他四种溶剂明显。MgCl2·6H2O在六种醇类有机溶剂中的溶解能力大小依次为:丙三醇 > 乙醇 > 正丙醇 > 正丁醇 > 异丙醇 > 异丁醇,而六种醇类溶剂的极性大小为:丙三醇 > 乙醇 > 正丙醇 > 异丙醇 > 正丁醇 > 异丁醇,两者不完全相符,其原因主要是:无机盐在有机溶剂中溶解度除了遵循相似相溶原理外,还受到溶质溶剂物理化学性质、溶质与溶剂分子间作用力等因素的影响[17]。
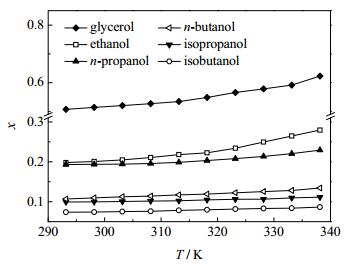
|
图 1 MgCl2·6H2O在六种醇类溶剂中的溶解度曲线 Fig.1 Solubility curves of MgCl2·6H2O in six alcohol solvents |
(2) 拟合结果见表 2~6,结果显示用Apelblat方程、λh方程、理想状态方程、多项式经验方程对MgCl2·6H2O在乙醇、正丙醇、异丙醇、丙三醇、正丁醇、异丁醇中的溶解度关联结果良好,平均相对误差均在1.5%以内,其中Apelblat方程的拟合结相关性系数R2>0.98,σ < 0.52优于其他拟合方程。
4 结论(1) 实验采用平衡法测定了在293.15~338.15 K时,MgCl2·6H2O在乙醇、正丙醇、异丙醇、丙三醇、正丁醇、异丁醇六种醇类有机溶剂中的溶解度,结果显示MgCl2·6H2O在这六种醇类溶剂中的溶解度均随温度升高而增大,其中在丙三醇中的溶解度最大。
(2) 采用Apelblat方程、λh方程、理想状态方程、多项式经验方程对实验数据进行关联,四种模型方程均能较好的关联MgCl2·6H2O在所研究体系中的溶解度数据,且Apelblat方程拟合效果最好。
符号说明:
| m | —质量,g | x | —溶解度,摩尔分数 |
| M | —摩尔质量,g·mol-1 | γ | —活度系数 |
| n | —实验次数 | 上标 | |
| R | —气体常数,J·(mol·K)-1 | cal | —理论值 |
| T | —温度,K | exp | —实验值 |
| [1] | Jin M M, Sun Y Z, Li P, et al. The thermal decomposition study of MgCl2·6H2O·1, 4-C4H8O2[J]. Chemical Engineering Research and Design , 2015, 104: 256-263. DOI:10.1016/j.cherd.2015.08.011. |
| [2] | QUAN Yue(全跃). Production and application of magnesium compounds(镁质材料生产与应用)[M].Beijing(北京): Metallurgical Industry Press(冶金工业出版社), 2008. |
| [3] | Farnam Y, Wiese A, Bentz D, et al. Damage development in cementitious materials exposed to magnesium chloride deicing salt[J]. Construction and Building Materials , 2015, 93: 384-392. DOI:10.1016/j.conbuildmat.2015.06.004. |
| [4] | Li M, Chen F S, Yang B, et al. Preparaion of organic tofu using organic compatible magnesium chloride incorporated with polysaccharide coagulants[J]. Food Chemistry , 2015, 167: 168-174. DOI:10.1016/j.foodchem.2014.06.102. |
| [5] | LIU Ling (刘玲). Synthesis and properties of manganese oxides micro/nanostructured materials via nonaqueous solvent routes (非水介质中锰氧化物微纳结构材料的合成与性质研究)[D]. Jinan (济南): Shandong University (山东大学), 2011. |
| [6] | Zhang D M, Huang J F, Gang T M, et al. The dehydration of magnesium chloride by butanol distillation[J]. Journal of Central-South Institute of Mining and Metallurgy , 1988, 19(4): 388-394. |
| [7] | CUI Zhen-hua (崔振华). Dissolution and crystallization behavior of magnesium chloride hexahydrate in ethylene glycol (六水氯化镁在乙二醇中的溶解结晶行为研究)[D]. Xining (西宁): Qinghai Institute of Salt Lakes, Chinese Academy of Sciences (中国科学院青海盐湖研究所), 2014. |
| [8] | YU Yu-zhen(于玉振), ZHANG Xiao-hui(张晓慧), LI Peng-kun(李鹏坤), et al. Measurement and correlation of pregabalin form I solubility in pure solventsand acetone-water mixtures(普瑞巴林晶型Ⅰ在纯溶剂及丙酮-水混合溶剂中的溶解度测定与关联)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2017, 31(1): 7-12. |
| [9] | SUN Xian-xiang(孙贤祥), CHEN Yu-ting(陈玉婷), XIA Tian-xi(夏天喜). Measurement and prediction of solubility of S-timolol-D-tartrate salt in organic solvents(S-噻吗洛尔-D-酒石酸非对映体盐在有机溶剂中的溶解度测定和预测)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26(1): 7-12. |
| [10] | Li J, Zhang X W, Liu Q J, et al. Measurement and correlation of solubility of 1, 3, 5-trioxane in binary solvents from (288.15 to 328.15) K[J]. Journal of Molecular Liquids , 2017, 234: 469-480. DOI:10.1016/j.molliq.2017.03.108. |
| [11] | Li X B, Wang M J, Cong Y, et al. Solubility of 4-methyl-2-nitroaniline in fourteen organic solvents from T=(278.15 to 313.15) K andmixing properties of solutions[J]. The Journal of Chemical Thermodynamics , 2017, 110: 33-40. DOI:10.1016/j.jct.2017.02.008. |
| [12] | SUN Peng(孙鹏), LIU Jun-guo(刘俊果), YANG Yu-huai(杨玉淮), et al. Determination and correlation of solubilities of avermectins in different systems of alcohol-water(阿维菌素在不同醇-水溶剂体系中溶解度的测定与关联)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2010, 24(5): 735-738. |
| [13] | XU Qing-qing(许青青), SU Bao-gen(苏宝根), CHEN Wei(陈蔚), et al. Determination, correlation and prediction of solubilities of desmosterol in five organic solvents(链甾醇在五种有机溶剂中溶解度的测定、关联及预测)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(3): 443-448. |
| [14] | Jaatiene S, Touronen J, Karinen R, et al. Hydrogen solubility in furfural and 2-propanol:experiments and modeling[J]. The Journal of Chemical Thermodynamics , 2017, 112: 1-6. DOI:10.1016/j.jct.2017.04.004. |
| [15] | SHEN Le(沈乐), LI Hui-ping(李惠萍), GAO Jiang-tao(高江涛), et al. Measurement and correlation of 1-benzyl-4-hydroxymethyl-1H-1, 2, 3-triazole solubility(1-苄基-4-羟甲基-1H-1, 2, 3-三氮唑溶解度的测定及关联)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(1): 1-6. |
| [16] | HAO Han(郝汉), FENG Jian-guo(冯建国), XU Yong(徐勇), et al. Measurement and correlation of solubility for azadirachtin-A in four kinds of organic solvents(印楝素A在4种有机溶剂中溶解度的测定与关联)[J]. Journal of China Agricultural University(中国农业大学学报) , 2016, 21(4): 59-64. |
| [17] | JI Wen-qin(季文琴), WANG Bao-hua(王宝华), MENG Qing-qing(孟庆卿), et al. Determination and correlation of the solubility of lauric acid in organic solvents(肉桂酸在有机溶剂中溶解度的测定与关联)[J]. Journal of Beijing University of Chemical Technology(Natural Science Edition)(北京化工大学学报.自然科学版) , 2016, 43(6): 29-35. |




