(E, E, E)-香叶基香叶醇(geranylgeraniol,GGOH)是一种直链二萜类化合物,具有抗肿瘤[1]、杀菌等生理活性,对维持脑胆固醇具有重要作用[2]。同时,香叶基香叶醇是合成辅酶Qn(I)、维生素A、维生素E和维生素K2的重要中间体[3],是生物体内合成萜类物质、紫杉醇、甾体等的重要前体物质。化学法生产香叶基香叶醇以乙酸香叶酯为原料,获得的香叶基香叶醇是顺反异构混合体。研究表明仅有生物法合成的(E, E, E)-香叶基香叶醇具有明显的生物活性[4]。
在酿酒酵母中,(E, E, E)-香叶基香叶醇主要通过内源磷酸酶的作用将香叶基香叶基焦磷酸(GGPP)去磷酸化形成。2008年,Muramatus[5]通过外源添加角鲨烯合酶(ERG9)抑制剂的方式,抑制竞争支路角鲨烯合成途径并成功在酿酒酵母中检测到了约2mg·L-1GGOH。随后,Ohto等[6]过表达了甲基戊酸(MVA)途径中的限速酶羟甲基戊二酰辅酶A(HMG-QA)还原酶,经过7天的分批发酵,检测到了145.7mg·L-1法尼醇(FOH)和2.46mg·L-1GGOH。这两个实验表明,在酿酒酵母中存在的内源磷酸酶能够催化脱磷酸反应,形成类异戊二烯基醇(prenyl alcohols)。为了进一步挖掘酿酒酵母在GGOH生物合成方面的潜力,Ohto[7]尝试将法尼基焦磷酸合酶(ERG20)和香叶基香叶基焦磷酸合酶(BTS1)进行融合表达(BTS1-ERG20),同时过表达了3-羟基-3-甲基-辅酶A还原酶1基因(HMG1),以获得更多的前体物质---GGPP。最终,他们大幅提高了酿酒酵母中GGOH的产量,分批发酵133 h后,产量达到138.8mg·L-1。此后,Tokuhiro[8]在Ohto的基础上,表达了BTS1和DDP1的融合蛋白(BTS1-DPP1),对关键基因HMG1、BTS1-ERG20和BTS1-DPP1进行多拷贝整合,构建二倍体菌株,进一步提高了GGOH产量。最终,在10L分批发酵罐中,GGOH的产量达到了3g·L-1。2017年,元英进课题组[9]提出了组合设计(combinatorial design)的策略来提高GGOH的产量,将11个不同强弱的启动子分成3组,分别用于表达关键基因GGPPSas(来源于嗜酸热硫化叶菌的香叶基焦磷酸合成酶)、BTS1-ERG20和tHMG1,然后将上述三个不同强弱启动子控制的表达盒子进行多拷贝整合构建菌种库,最终筛选获得一株高产菌株,结合发酵优化,使GGOH分批发酵产量达到1315.44 mg·L-1。
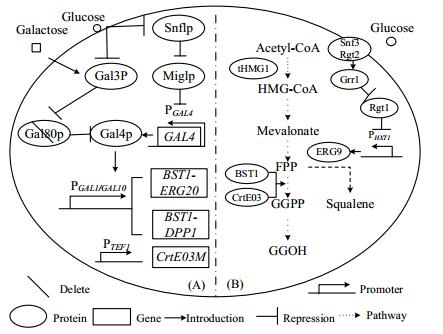
从这些研究中发现,中间产物GGPP的充足供应对GGOH的产量起着非常重要的作用,流向GGPP的代谢流越强,则GGOH的产量越高。但是,这些研究都采用组成型启动子进行基因的过表达。组成型的过表达常常能得到较高的蛋白表达产量,但同时也会造成细胞的代谢负担,而一个合适的调控体系往往能够缓解高蛋白表达和细胞代谢压力之间的矛盾。本课题组已经通过改造半乳糖诱导型调控体系,构建了葡萄糖调控体系[10],并基于此成功获得高产异戊二烯、β-胡萝卜素和虾青素的酿酒酵母菌株[10~17]。在半乳糖诱导型调控系统中,与半乳糖代谢相关的基因(统称为GAL基因)的表达受到外界碳源的紧密调控(如图 1(A))。在葡萄糖存在情况下,上述基因的表达都处于被抑制状态,而当细胞处于以半乳糖作为碳源的培养环境下时,上述基因的表达则可以被诱导上千倍[18~20]。但是,以半乳糖作为诱导剂的方法,存在价格昂贵以及需要适时补加等问题。敲除GAL80基因,可以使转录激活因子Gal4蛋白不再受半乳糖调控,仅受葡萄糖负反馈调控[10]。当培养基中存在大量葡萄糖时,Gal4蛋白受到抑制,GAL启动子控制下的外源基因不表达,碳源仅用于细胞生长,产物不合成。而当细胞生长到一定密度时,葡萄糖耗尽,GAL启动子控制下的外源途径正常表达,产物开始合成。因此,这个葡萄糖调控系统不仅可以有效缓解组成型启动子持续的高蛋白表达量所引起的细胞代谢压力,还能解决传统诱导型启动子需要外加诱导剂的问题。
|
图 1 代谢调控示意图(A)GAL系统调控改造原理图(B)酿酒酵母中GGOH合成途径基于葡萄糖调控以及顺序表达体系示意图 Fig.1 Schematic diagram of metabolic regulation (A) Modification of the GAL regulation system (B) Synthetic pathway of GGOH in Saccharomyces cerevisiae and the constructed sequential expression system based on glucose-responsive regulation. |
本研究拟构建葡萄糖调控的GGOH合成途径,对GGPP这个关键代谢节点进行代谢流重排。由于酿酒酵母内源的GGPP合酶(BTS1)相对活性较低,而红法夫酵母来源的GGPP合酶(CrtE)的活性较高[21],并且CrtE突变体CrtE03M(C81T)由于基因表达效率的提高效果更佳[16],因此,计划引入来自红法夫酵母的GGPP合酶突变体(CrtE03M)[16]促进GGPP的合成。同时,考虑到酿酒酵母细胞中法尼基焦磷酸(FPP)节点处的代谢流主要流向角鲨烯以及细胞生长所需的麦角固醇合成途径[22],计划以弱启动子替换角鲨烯合酶的天然启动子,对竞争性消耗FPP的角鲨烯合成支路进行下调。由于角鲨烯在细胞生长中具有不可或缺的生理作用,并且外源途径基因过早表达可能会造成代谢压力,作者考虑利用葡萄糖调控实现角鲨烯合成途径和GGOH合成途径的顺序表达。一方面,用葡萄糖诱导型弱启动子PHXT1来控制角鲨烯合酶基因,在生长后期葡萄糖浓度降低时下调角鲨烯合成途径,实现先扬后抑的表达模式;另一方面,通过GAL80敲除使GAL启动子调控下的GGOH合成途径受高葡萄糖浓度抑制,实现先抑后扬的表达模式[17]。以此实现GGOH合成所需前体物GGPP的充足供应,同时避免对细胞生长造成不良影响。
2 材料与方法 2.1 菌株和质粒大肠杆菌Top10购买于美国Novagen公司,用于基因克隆。酿酒酵母BY4741(MATa,his3Δ1,leu2Δ0,met15Δ0,ura3Δ0)由中国科学院上海生命科学研究院周金秋教授馈赠。表达载体pESC-URA和pESC-LEU由南洋理工大学汤晓玲博士馈赠。整合型载体PMRI系列[10]和PUMRI系列[16]分别为本课题组谢文平和吕小妹构建。本实验所用菌株见表 1。
|
|
表 1 本研究中用到的菌株 Table 1 Strains and plasmids used in this work |
高保真性DNA聚合酶Prime START HS DNApolymerase、SuperMIX、Easy Taq DNA聚合酶(北京全式金生物技术有限公司)、T4 DNA连接酶、DNA限制性内切酶,以及相关分子生物学试剂盒用于基因克隆等操作;香叶基香叶醇的标准品购自Sigma-Aldrich公司;蛋白胨、酵母粉购自安琪酵母有限公司。其它未做特殊说明的试剂和药品均为国产分析纯。PCR引物合成及测序服务由上海生物工程有限公司提供。
实验中所用主要仪器包括PCR仪(LongGene mgL96G,朗基,杭州)、荧光定量PCR仪(Mastercycler ep Realplex2,Eppendorf,德国)、高效液相色谱仪(SHIMADZU LC-20 AT,岛津,日本)、气相色谱(GC9790, 福立,台州)等。
2.3 质粒和菌株构建方法 2.3.1 基因克隆基因片段PCR扩增、基因组及质粒提取、酶切、连接等操作参照试剂盒说明书操作。Top10感受态细胞和转化等克隆实验参照《分子克隆实验指南》[24]。
2.3.2 整合型质粒和游离型质粒构建以及酿酒酵母菌株构建方法BTS1、ERG20和DPP1基因都从BY4741基因组PCR扩增获得。通过融合PCR的方式,用柔性linker将BTS1基因分别与ERG20和DPP1基因进行融合,获得5’-BamHI-BST1-ERG20-XhoI-3’和5’-NotI-BST1-DPP1-SpeI-3’,依次插入PUMRI-10质粒GAL1/10双向启动子两侧的多克隆位点[6]。获得PUMRI-10-BDE。5’-NotI-CrtE03M-SacI-3’基因从质粒PMRI-31-CrtE03M-CrtIPCR获得,并插入PUMRI-13的多克隆位点,获得PUMRI-13-CrtE03M。以PUMRI-12为骨架基础构建下调质粒PUMRI-12T,用PHXT1和PTEF1拼接得到的双向启动子替换原有启动子,PHXT1一端与ERG9同源臂相连。同时,将CrtE03M插入PUMRI-12T的TEF1下游的多克隆位点获得PUMRI-12T-CrtE03M。通过对YXWP113基因组PCR获得GAL80敲除盒(GAL80上游同源区段-HIS表达盒-GAL80下游同源区段)。质粒构建过程中所用引物见引物列表 2。
|
|
表 2 本实验所用引物 Table 2 Primers used in this work |
随后,采用LiAc/SS carrier/PEG法[25]转化酿酒酵母,并用菌液PCR的方式进行整合基因型验证。
2.4 培养基及培养条件Luria-Bertani(LB)培养基:NaCl 10 g·L-1,蛋白胨10 g·L-1,酵母提取物5 g·L-1,1 mol·L-1 NaOH调节至pH =7.0,121℃灭菌15min。Yeast Extract Peptone Dextrose(YPD)培养基:酵母粉10 g·L-1、蛋白胨20 g·L-1和葡萄糖20 g·L-1,115℃灭菌20 min。5-氟乳清酸(5-FOA)固体培养基(45 mL含有20 g·L-1葡萄糖的糖水+5mL YNB+500 μL相应缺陷性氨基酸+ 100 mg 5-FOA)用于PUMRI整合型菌株标签回收。挑取转化菌株,验证后接入5 mL YPD试管,30℃培养过夜。取100 μL菌液离心无菌水清洗后,将菌液全部涂布在5-FOA平板,30℃培养3d,即可挑取标签回收后的菌株[11]。以上固体LB培养基均添加2%的琼脂粉
取划线活化后的酿酒酵母菌株接在含5mL YPD培养基的试管中,30℃、220r·min-1下培养过夜。测量过夜培养的试管中菌株的浓度(OD600),取一定量菌液转接至50mL相应培养基,使得初始OD600值为0.05。再加入5%(V/V)的十二烷进行两相发酵,将250mL摇瓶放置于30℃摇床,220r·min-1下培养72h。
2.5 分析方法取一定量发酵液,离心后取上层有机相稀释一定倍数后直接进气相色谱进行检测。检测条件为:气相色谱柱采用HP-5 (30 m×0.25 mm i.d,0.25 mm,J & W Scientific,Folsom,CA),进样口温度为270℃,检测器温度为270℃。柱温箱采用程序升温的方式,起始温度为150℃,保留1 min;以10℃·min-1的升温速度升温至250℃,保留0 min;以6℃·min-1的速度升温至270℃,保留5 min。载气(N2)的压力为0.1 MPa,空气流量为300 mL·min-1(表压0.1MPa),氢气流量为30 mL·min-1(表压0.1MPa)。样品的进样量为1 μL,GGOH保留时间为12.697 min。
将50mL培养基静置1 min后,取1 mL下层发酵液进行酸抽提法提取角鲨烯[10]。角鲨烯采用HPLC检测,检测条件:岛津高效液相色谱仪LC-20 AT,色谱柱为Sepax Amethyst C18反相柱(5 μm×4.6 mm×150 mm)。流动相为100%乙腈,柱温40℃,流速为1mL·min-1,检测波长195 nm,样品的进样量为1μL。角鲨烯保留时间为23.432min。
荧光定量PCR使用SYBR PremixExTaqTM试剂盒,采用酿酒酵母中ACT1基因作为内参,基因相对转录水平按照2-ΔΔCT进行计算,取第二个小时的表达量作为实验对照组,设定表达量为1。PCR所用引物见表 1。
3 实验结果与讨论 3.1 葡萄糖调控系统构建为了构建葡萄糖调控的GGOH合成途径,本实验首先敲除了BY4741基因组上的GAL80基因得到YWWP1菌株。然后,采用GAL1/GAL10启动子过表达tHMG1基因,构建了PMRI-11-tHMG1,转化后获得YWWP11菌株。在此基础上,通过表达BTS1-DPP1和BTS1-ERG20融合蛋白,初步构建了GGOH合成途径。将PUMRI-10-BD-BE质粒用SfiI线性化后导入YWWP11,去Marker后,即在HO位点整合了TCYC1 -BTS1-ERG20-PGAL1/GAL10-BTS1-DPP1-TTADH1表达盒子,构建了整合型菌株YWWP11-DE,用于GGOH生产。经检测,YWWP11-DE在摇瓶中培养72 h后GGOH产量达到(34.85±3) mg·L-1。同时,本实验也对YWWP11-DE菌株中的角鲨烯含量进行了检测,发现在YWWP11-DE中角鲨烯含量高达(192.48±6.12) mg·L-1,是GGOH产量的5.5倍。该数据表明,在此菌株中FPP代谢节点处的代谢流分布主要流向了竞争途径角鲨烯-麦角固醇途径,而非目标途径GGOH合成途径。因此,对FPP代谢节点处代谢流的重新分配将是接下来工作的研究重点。
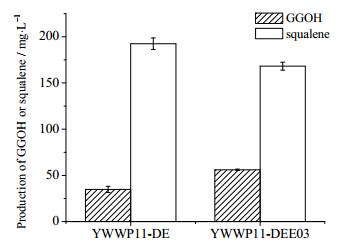
3.2 外源表达GGPP合酶突变体(CrtE03M)对GGOH产量的影响酿酒酵母内源的GGPP合酶相对活性较低[21],这直接影响了GGOH合成途径相对于角鲨烯合成途径的竞争力。为了提高目标途径对中间产物FPP的竞争力,本实验外源表达了来源于红法夫酵母中的GGPP合酶突变体CrtE03M,将PGAL10-CrtE03M-TTADH1表达盒子通过PUMRI-13质粒整合到YWWP11-DE的GAL1/7/10整合位点,获得菌株YWWP11-DEE03。摇瓶培养72 h后,YWWP11-DEE03的GGOH产量为(56.04±0.67) mg·L-1,角鲨烯含量为(168.19±4.28) mg·L-1。由图 2可以明显看出,相比初始菌株YWWP11-DE,GGOH产量仅提高了60.8%,角鲨烯含量下降幅度也较小。这表明相对于角鲨烯-麦角固醇途径,FPP节点处GGPP-GGOH方向的代谢流竞争力还是很弱。
|
图 2 外源表达CrtEO3M对GGOH产量和角鲨烯含量的影响 Fig.2 Effects of CrtE03M overexpression on GGOH yields and squalene accumulation |
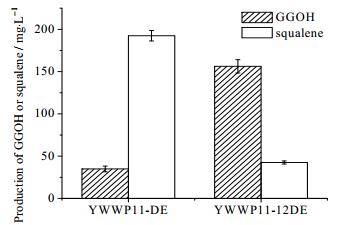
在FPP下游途径相关的研究中,FFP节点处的代谢流分布是一个研究热点。利用合适的弱启动子或者抑制性启动子替换天然ERG9启动子能有效改变FPP处的代谢流分布[5, 26~28]。根据文献报道,HXT1启动子在高浓度葡萄糖存在情况下能诱导表达,而在低葡萄糖浓度时则弱化表达[29],并且PHXT1启动子的强度弱于PERG9。考虑到角鲨烯在细胞生长中的作用,为了降低角鲨烯途径对GGOH合成前体物的竞争性消耗,同时不影响细胞的正常生长,作者在3.1节构建的GAL调控菌株YWWP11-DE基础上,用PHXT1启动子替换原有的PERG9启动子,构建葡萄糖调控的角鲨烯途径,从而构成一个顺序表达体系。当酿酒酵母生长环境中存在大量葡萄糖时,PHXT1诱导ERG9基因表达,保证足量的麦角固醇用于细胞生长,保证发酵液中能积累足够的生物量。当发酵液中葡萄糖消耗完毕,PHXT1控制下的基因停止表达,GAL系统启动,开始表达目标途径相关基因大量合成GGOH。对最终菌株YWWP11-12DE进行摇瓶培养72h后,检测到GGOH产量为(156.22±7.79) mg·L-1,与YWWP11-DE相比,提高了4.5倍(见图 3)。同时,YWWP11-12DE菌株中的角鲨烯含量(42.45±1.79) mg·L-1,仅为YWWP11-DE的约1/5。实验结果表明,经过PHXT1启动子对ERG9基因表达进行下调后,成功调整了FPP节点处的代谢流分布,使得更多的FPP流向GGPP-GGOH方向。同时,检测得到YWWP11-DE和YWWP11-12DE两个菌株最终OD600分别为25.032和24.633,表明此顺序调控策略不仅提高了目标产物GGOH的产物,并且没有对细胞生长造成不利影响,实现了细胞生长和产物合成的双赢。
|
图 3 下调角鲨烯旁路对GGOH产量和角鲨烯含量的影响 Fig.3 Effects of squalene pathway down-regulation on GGOH yields and squalene accumulation |
在上述实验中已经成功构建了角鲨烯竞争旁路和GGOH合成途径的顺序调控,成功地改变了FPP节点处的代谢流分布,并通过对来源于红法夫酵母的GGPP合酶突变体CrtE03M的外源表达增强了目标途径的代谢流,两种策略都有效地提高了酿酒酵母中GGOH的产量。在此基础上,作者整合上述代谢改造策略,进行了综合调控。文献表明[17]PHXT1启动子和PGAL启动子对葡萄糖的响应存在时间差。当PHXT1启动子停止表达后,PGAL启动子不能及时开启,在短时间内细胞中大量积累FPP,从而刺激别的内源竞争途径开启,再次导致FPP代谢流不平衡。为了解决这个问题,作者采用了组成型强启动子PTEF1来表达GGPP合酶突变体CrtE03M,使CrtE03M得到持续表达,从而保证在任何时期FPP都可以流向GGOH合成的目标途径。同时,在第一阶段合成角鲨烯-麦角固醇时,CrtE03M的组成型表达也能够进一步限制角鲨烯途径的强度。
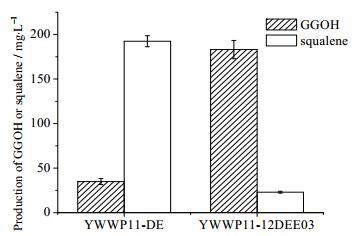
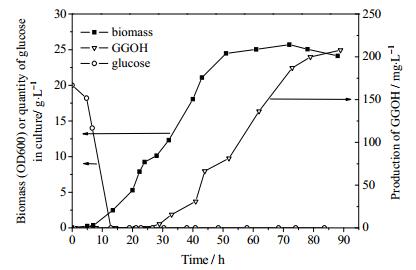
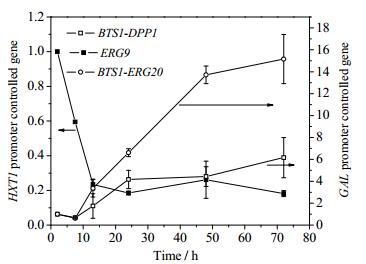
为此,本实验对下调质粒PUMRI-12进行改造,将PHXT1和PTEF1合成双向启动子,在PTEF1下游插入CrtE03M基因,构成质粒PUMRI-12-TE03M,并以YWWP11-DE为宿主构建综合调控菌株YWWP11-12DEE03,在50 mL YPD培养基中培养72 h后,检测到GGOH的量为(183.07±11.28) mg·L-1,与YWWP11-DE相比,提高了5倍。同时,YWWP11-12DEE03的角鲨烯含量为(22.87±1.03) mg·L-1,与菌株YWWP11-DE相比下降了7倍(见图 4),成功地将FPP处大部分代谢流拉向了目标代谢途径,大大提高了酿酒酵母中GGOH的产量。对YWWP11-12DEE03在摇瓶中的发酵曲线(图 5)进行分析发现,产物合成明显滞后于细胞生长,发酵13 h左右培养基中的葡萄糖完全耗尽,而一直到22 h左右才开始检测到产物GGOH。对转录水平变化进行分析发现GGOH合成途径及其竞争途径角鲨烯合成途径呈现明显的顺序表达模式(图 6)。在葡萄糖存在情况下,GAL系统下的基因BTS1-DPP1和BTS1-ERG20转录水平很低;而葡萄糖耗尽后转录水平明显上升,特别是BST1-DPP1提高了十余倍;另一方面,随着葡萄糖浓度的降低,HXT1启动子控制下的ERG9基因的转录水平明显降低。以上结果表明构建的葡萄糖调控体系确实对目标合成途径起到了响应于培养基中葡萄糖浓度的调控作用。发酵86 h后,最终GGOH产量达到了(207.5±6.14) mg·L-1 (见图 5)。这个产量数据与Tokuhiro等[8]和Song等[9]报道的摇瓶产量相当(分别为228 mg·L-1和161 mg·L-1)。这两篇文献均采用多拷贝整合的方式将关键基因进行随机多拷贝整合来筛选高产菌株,而本工作的菌株仅仅对FPP节点处代谢流分布相关基因进行了单拷贝整合。这进一步说明关键节点处代谢流的有效重排对于整个合成途径的代谢平衡具有重要的意义。
|
图 4 对酿酒酵母代谢途径综合调控后GGOH和角鲨烯的产量变化 Fig.4 Effects of comprehensive regulation for metabolic pathway on GGOH and squalene yields |
|
图 5 YWWP11-12DEE03在50 mL摇瓶的发酵曲线 Fig.5 Fermentation profiles of YWWP11-12EDE03 in 50mL YPD culture |
|
图 6 YWWP11-12DEE03M菌株在YPD中的基因转录变化 Fig.6 Analysis of gene transcriptional variation of YWWP11-12DEE03 in YPD |
本文围绕FPP处代谢流的分布和重排开展了一系列的代谢调控。首先,通过敲除GAL80构建葡萄糖调控的GGOH合成途径,初步缓解了过表达外源蛋白形成的代谢压力和细胞生长之间的矛盾。随后,利用葡萄糖诱导型弱启动子PHXT1下调ERG9基因的表达,减少FPP处的代谢流流向旁路合成途径---角鲨烯-麦角固醇合成途径,进一步建立基于葡萄糖调控的顺序表达体系,通过途径的分阶段表达兼顾了细胞生长和产物积累的需求。最后,引入组成型启动子表达来源于红发夫酵母的高活性GGPP合酶突变体CrtE03M,进一步增强了目标途径在FPP节点处的竞争力,同时解决了PHXT1启动子和PGAL启动子对葡萄糖响应的时间差问题。最终,通过综合调控构建的高产菌株的GGOH产量达到了初始菌株的5倍,而角鲨烯含量仅为原来的1/7。本文在FPP代谢节点处的代谢调控十分成功,对于其他FPP下游的目标途径的代谢调控均具有借鉴意义。同时,本文也表明关键节点的识别和调控在整条代谢途径的平衡调控中起着极其重要的作用。
| [1] | Benford H L, Frith J C, Auriola S, et al. Farnesol and geranylgeraniol prevent activation of caspases by aminobisphosphonates biochemical evidence for two distinct pharmacological classes of bisphosphonate drugs[J]. Molecular Pharmacology, 1999, 56(1): 131-140. DOI:10.1124/mol.56.1.131. |
| [2] | Kpttl T J, Ramirez D M, Pfeiffer B E, et al. Brain cholesterol turnover required for geranylgeraniol production and learning in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(10): 3869-3874. DOI:10.1073/pnas.0600316103. |
| [3] | John A, Hyatt G S K, Janet Effler. Development of synthetic routes to D, L-r-tocopherol (vitamin E) from biologically produced geranylgeraniol[J]. Organic Process Research & Development, 2002, 6(6): 782-787. |
| [4] | Koyama T, Tanetoshi K. Enzymatic aspects of isoprenoid chain elongation[J]. Chemical Reviews, 1998, 98(4): 1263-1276. DOI:10.1021/cr9600464. |
| [5] | Muramatus M, Ohto C, Obata S, et al. Accumulation of prenyl alcohols by terpenoid biosynthesis inhibitors in various microorganisms[J]. Applied Microbiology and Biotechnology, 2008, 80(4): 589-595. DOI:10.1007/s00253-008-1578-z. |
| [6] | Ohto C, Muramatsu M, Obata S, et al. Overexpression of the gene encoding HMG-CoA reductase in Saccharomyces cerevisiae for production of prenyl alcohols[J]. Applied Microbiology and Biotechnology, 2009, 82(5): 837-845. DOI:10.1007/s00253-008-1807-5. |
| [7] | Ohto C, Muramatsu , Obata S, et al. Production of geranylgeraniol on overexpression of a prenyl diphosphate synthase fusion gene in Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2010, 87(4): 1327-1334. DOI:10.1007/s00253-010-2571-x. |
| [8] | Tokuhiro K, Muramatsu M, Ohto C, et al. Overproduction of geranylgeraniol by metabolically engineered Saccharomyces cerevisiae[J]. Applied and Environmental Microbiology, 2009, 75(17): 5536-5543. DOI:10.1128/AEM.00277-09. |
| [9] | Song T Q, Ding M Z, Zhai F, et al. Engineering Saccharomyces cerevisiae for geranylgeraniol overproduction by combinatorial design[J]. Scientific Reports, 2017, 7(1): 14991-15002. DOI:10.1038/s41598-017-15005-4. |
| [10] | Xie W P, Liu M, Lv X M, et al. Construction of a controllable b-carotene biosynthetic pathway by decentralized assembly strategy in Saccharomyces cerevisiae[J]. Biotechnology and Bioengineering, 2014, 111(1): 125-133. DOI:10.1002/bit.25002. |
| [11] | Lv X M, Wang F, Zhou P P, et al. Dual regulation of cytoplasmic and mitochondrial acetyl-CoA utilization for improved isoprene production in Saccharomyces cerevisiae[J/OL]. Nature Communications, 2016[2018-01-26]. https://www.nature.com/articles/ncomms12851.pdf/10.1038/12851. |
| [12] | Wang F, Lv X M, Xie W P, et al. Combining Gal4p-mediated expression enhancement and directed evolution of isoprene synthase to improve isoprene production in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2017(39): 257-266. |
| [13] | Zhou P P, Xie W P, Li A P, et al. Alleviation of metabolic bottleneck by combinatorial engineering enhanced astaxanthin synthesis in Saccharomyces cerevisiae[J]. Enzyme and Microbial Technology, 2017, 100: 28-36. DOI:10.1016/j.enzmictec.2017.02.006. |
| [14] | Zhou P P, Xie W P, Yao Z, et al. Development of a temperature-responsive yeast cell factory using engineered Gal4 as a protein switch[J]. Biotechnology and Bioengineering, 2018, 115(5): 1321-1330. DOI:10.1002/bit.v115.5. |
| [15] | Zhou P, Ye L, Xie W P, et al. Highly efficient biosynthesis of astaxanthin in Saccharomyces cerevisiae by integration and tuning of algal crtZ and bkt[J]. Applied Microbiology and Biotechnology, 2015, 99(20): 8419-8428. DOI:10.1007/s00253-015-6791-y. |
| [16] | Xie W P, Lv X M, Ye L D, et al. Construction of lycopene-overproducing Saccharomyces cerevisiae by combining directed evolution and metabolic engineering[J]. Metabolic Engineering, 2015, 30: 69-78. DOI:10.1016/j.ymben.2015.04.009. |
| [17] | Xie W P, Ye L D, Lv X M, et al. Sequential control of biosynthetic pathways for balanced utilization of metabolic intermediates in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2015, 28: 8-18. DOI:10.1016/j.ymben.2014.11.007. |
| [18] | Giniger E. Cooperative DNA binding of the yeast transcriptional activator GAL4[J]. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(2): 382-386. DOI:10.1073/pnas.85.2.382. |
| [19] | Johnston M. Multiple mechanisms provide rapid and stringent glucose repression of GAL gene expression in Saccharomyces cerevisiae[J]. Molecular And Cellular Biology, 1994, 14(6): 3834-3841. DOI:10.1128/MCB.14.6.3834. |
| [20] | Lohr D, Venkov P, Zlatanova J. Transcriptional regulation in the yeast GAL gene family:a complex genetic network[J]. The FASEB Journal, 1995, 9(9): 777-787. DOI:10.1096/fasebj.9.9.7601342. |
| [21] | Verwaal R, Wang J, Meijnen J P, et al. High-level production of beta-carotene in Saccharomyces cerevisiae by successive transformation with carotenogenic genes from Xanthophyllomyces dendrorhous[J]. Applied and Environmental Microbiology, 2007, 73(13): 4342-4350. DOI:10.1128/AEM.02759-06. |
| [22] | Polakowski T, Stahl U, Lang C. Overexpression of a cytosolic hydroxymethylglutaryl-CoA reductase leads to squalene accumulation in yeast[J]. Applied Microbiology and Biotechnology, 1998, 49(6): 66-71. |
| [23] | Brachmann C B, Davles A, Cost G J. Designer deletion strains derived from Saccharomyces cerevisiae S288C:a useful set of strains and plasmids for PCR-mediated gene disruption and other applications[J]. Yeast, 1998, 14(2): 115-132. DOI:10.1002/(ISSN)1097-0061. |
| [24] | Sambrook J, Mamiatis T. Molecular cloning: a laboratory manual (分子克隆实验指南)[M]. Huang Pei-tang (黄培堂), trans. Beijing (北京): Science Press (科学出版社), 2001. |
| [25] | Gietz R D, Schiestl R H. High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method[J]. Nature Protocols, 2007, 2(1): 31-34. DOI:10.1038/nprot.2007.13. |
| [26] | Yuan J, Ching C B. Dynamic control of ERG9 expression for improved amorpha-4, 11-diene production in Saccharomyces cerevisiae[J]. Microbial Cell Factories, 2015, 14(38): 1-10. |
| [27] | Scalcinati G, Knuf C, Partow S, et al. Dynamic control of gene expression in Saccharomyces cerevisiae engineered for the production of plant sesquitepene alpha-santalene in a fed-batch mode[J]. Metabolic Engineering, 2012, 14(2): 91-103. DOI:10.1016/j.ymben.2012.01.007. |
| [28] | Asadollahi , Manury J, Mfller K, et al. Production of plant sesquiterpenes in Saccharomyces cerevisiae:Effect of ERG9 repression on sesquiterpene biosynthesis[J]. Biotechnology and Bioengineering, 2008, 99(3): 666-677. DOI:10.1002/(ISSN)1097-0290. |
| [29] | Mosley A L, Lakshmanab J, Aryal B K, et al. Glucose-mediated phosphorylation converts the transcription factor Rgt1 from a repressor to an activator[J]. The Journal of Biological Chemistry, 2003, 278(12): 10322-10327. DOI:10.1074/jbc.M212802200. |




