2. 河南省产品质量监督检验院,河南 郑州 450004
2. Henan Province Product Quality Supervision and Inspection Center, Zhengzhou 450004, China
化学反应热力学主要研究反应过程中各种形式能量之间的转化、化学反应方向和反应限度之间的关系,因此,测定“两步法”合成棕榈酸异丙酯反应体系中相关物质的热力学参数具有重要意义。该反应体系中,常见物质的热力学基础数据可由化工数据手册查取得到,但棕榈酸、棕榈酸异丙酯的热力学基础数据缺乏。白银鸽等[1, 2]采用了Joback与Yoneda基团贡献法对热力学参数进行了估算,但由于估算方法误差具有不确定性[3]。为保证热力学数据的可靠性,本文采用DSC-60差示扫描量热仪分别对棕榈酸、棕榈酸异丙酯的比热容进行测定,使用XRY-1C氧弹量热器对二者的标准摩尔燃烧焓进行测算;通过热力学关系式,计算出反应体系的焓变。本文得到的有关热力学数据,为该工艺的实施提供了热力学依据,也为热力学数据库增添了新内容。
2 实验部分 2.1 实验试剂与仪器实验试剂:棕榈酸异丙酯,标准品,阿达玛斯试剂;棕榈酸,分析纯,国药集团化学试剂有限公司;苯甲酸,分析纯,天津科密欧化学试剂有限公司;α-Al2O3,标准品,日本岛津公司;萘,分析纯,上海化学试剂采购供应站。
实验仪器:DTG-60差热-热重分析仪、DSC-60差示扫描量热仪,日本岛津公司;PB203-N分析天平,上海梅特勒托利多仪器有限公司;XRY-1C氧弹式量热计,上海昌吉地质仪器有限公司;SPB-3全自动空气源北京中惠普分析技术研究所;SPN-500氮气发生器,北京中惠普分析技术研究所。
2.2 棕榈酸异丙酯合成的化学反应以棕榈酸、氯化亚砜、异丙醇为原料,采用“两步法”[4]进行棕榈酸异丙酯合成所涉及的基本化学反应见反应式(a)与(b),整体反应式为式(c)。
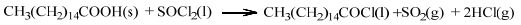
|
(a) |

|
(b) |
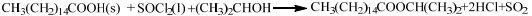
|
(c) |
采用差示扫描量热仪(简称DSC)测定物质比热容的原理为:试样处于线性升温程序控制下,流入试样的热流速率dH/dT即为样品吸收的热量可被连续测定。试样比热容与dH/dT满足式(1)[5~7],即:
| ${{C}_{\text{p}}}{=}\frac{\text{d}H}{\text{d}T}\times \frac{1}{m}$ | (1) |
将空钳锅放置于试样支持器和标准物质支持器,测量后得到一条基线,继而在相同条件下分别测定标准物质和待测试样的DSC曲线,通过式(2)[8]即可计算出任意测定温度下试样的定压比热容。
| ${C_{\rm{p}}}{\rm{ = }}\frac{{{m_{{\rm{std}}}}}}{{{m_{\rm{s}}}}} \times \frac{{DS{C_{\rm{S}}} - DS{C_{{\rm{bl}}}}}}{{DS{C_{{\rm{std}}}} - DS{C_{{\rm{bl}}}}}} \times {C_{{\rm{p}},{\rm{std}}}}$ | (2) |
当某物质完全燃烧时,若为等容条件,则物质燃烧热等同该物质热力学能变化值,QV = ∆U;若为定压条件,则满足QP= ∆H。燃烧焓∆H同QP与Qv关系[9]满足式(3):
| $\Delta H={{Q}_\rm{P}}={{Q}_\rm{v}}+\Delta nRT$ | (3) |
当样品在量热计氧弹中完全燃烧时,燃烧过程释放的热量可引起氧弹热量计自身及周围介质水的温度升高[8],如式(4) 所示。若已知仪器热容量C及介质水的温度变化值,可通过式(4) 计算出被测样品的QV,进一步由式(3) 计算得到该物质的∆H。
| $m{Q_{\rm{v}}} = \left( {3200{C_{{{\rm{H}}_2}{\rm{O}}}} + C} \right)\Delta T + {Q_{\rm{f}}}$ | (4) |
若反应物和生成物均进行完全氧化,由状态函数法可知化学反应标准摩尔焓变
| ${{\Delta }_{\text{r}}}H_{\text{m}}^{\theta }=-\sum{{{\nu }_{\text{i}}}}{{\Delta }_{\text{c}}}H_{\text{m}}^{\theta }(i)$ | (5) |
采用DSC-60测定棕榈酸和棕榈酸异丙酯的Cp,扫描范围37~297℃,以N2气氛作为保护气,液氮作为制冷剂。具体操作条件为:N2流量为30 mL·min-1,升温速率为5 K⋅min-1,取样量为3~5 mg。
利用金属铟对DSC-60进行校正,铟的熔点测定值为156.85℃,熔融焓测定值为-28.85 J·g-1,其对应文献值[10]分别为156.61℃和-28.45 J·g-1,测定结果与文献值偏差较小,表明DSC-60的温度示值正常;采用标准物质苯甲酸和α-Al2O3验证仪器比热容测定的可靠性,二者的测定值与文献值[5, 8]之间误差分别为0.38%和0.31%,即均在±1%内,表明使用DSC-60测定物质比热容的方法是可行的,测定结果是可靠的。
在此,通过DTG-60差热-热重分析仪测定棕榈酸和棕榈酸异丙酯的热解温度,测定棕榈酸液相比热容的温度范围为340~470 K,棕榈酸异丙酯的温度范围为310~430 K,得到采用DSC-60测定二者的定压比热容结果见表 1。
| 表 1 棕榈酸、棕榈酸异丙酯比热容的测量数据 Table 1 Specific heat capacities of palmitic acid and isopropyl palmitate |
采用最小二乘法对棕榈酸、棕榈酸异丙酯比热容的实验数据进行拟合,即可得到二者的液态比热容随温度变化的多项式方程分别为式(6)、式(7),各自的复相关系数R2分别为0.9981、0.9956。
| ${C_{\rm{p}}}/J\cdot {{(g\cdot K)}^{-1}}=3\times {{10}^{-6}}{{T}^{2}}+0.0025T-0.0678$ | (6) |
| ${C_{\rm{p}}}/\text{J}\cdot {{\text{(g}\cdot \text{K)}}^{-1}}=8\times {{10}^{-7}}{{T}^{2}}+0.0038T+0.1803$ | (7) |
因棕榈酸在较低温度下为固体,故采用DSC-60差示扫描量热仪测定其熔点和熔融焓,得到棕榈酸的熔融温度区间为64.12~74.15℃,熔融焓为-205.77 J·g-1,即-52.48 kJ·mol-1。
2.4.3 棕榈酸、棕榈酸异丙酯燃烧焓的测定文献[11]指出苯甲酸的恒容燃烧热为26460 J·g-1,在此选用苯甲酸来测定该量热计的C值,由式(4) 可得到氧弹量热计的热容量C为1940 J·K-1。选择萘作为参比物质进行仪器可靠性的验证,其标准燃烧焓的测定值为-5165.8 kJ·mol-1,同文献[5]报道值-5156.30 kJ·mol-1之间的误差仅0.18%。棕榈酸、棕榈酸异丙酯完全燃烧的化学反应方程式分别如下:
| ${{\text{C}}_{\text{16}}}{{\text{H}}_{\text{32}}}{{\text{O}}_{\text{2}}}\text{(s) + 23}{{\text{O}}_{\text{2}}}\text{(g) = 16C}{{\text{O}}_{\text{2}}}\text{(g) + 16}{{\text{H}}_{\text{2}}}\text{O(l)}$ | (d) |
| ${{\text{C}}_{\text{19}}}{{\text{H}}_{\text{38}}}{{\text{O}}_{\text{2}}}\text{(l) + }\frac{\text{55}}{2}{{\text{O}}_{\text{2}}}\text{(g) = 19C}{{\text{O}}_{\text{2}}}\text{(g) + 19}{{\text{H}}_{\text{2}}}\text{O(l)}$ | (e) |
由式(5) 可知,棕榈酸、棕榈酸异丙酯的燃烧焓的计算公式分别为式(8) 和(9),且根据盖斯定律,可由某物质在实验温度T下的燃烧焓计算出该物质在298.15 K下的标准摩尔燃烧焓,如式(10) 所示,且温度区间T至298.15 K时反应物、生成物对应焓变的表达式分别为式(11) 和(12)。
| ${\Delta _{\rm{C}}}H={{Q}_{v}}+\Delta nRT={{Q}_{v}}-7RT$ | (8) |
| ${\Delta _{\rm{C}}}H={{Q}_{v}}+\Delta nRT={{Q}_{v}}-8.5RT$ | (9) |
| ${\Delta _{\rm{C}}}{H_{\rm{m}}}\left( 298.15K \right)=\Delta {H_{\rm{rea}}}+{\Delta _{\rm{C}}}{H_{\rm{m}}}\left( T \right)+\Delta {H_{\rm{pro}}}$ | (10) |
| $\Delta {H_{{\rm{rea}}}} = \int\limits_{298.15}^T {\sum {({v_i}{C_{{\rm{P}},i}})} } {\rm{d}}T$ | (11) |
| $\Delta {H_{{\rm{pro}}}} = \int\limits_{298.15}^T {\sum {({v_j}{C_{{\rm{P}},j}})} } {\rm{d}}T$ | (12) |
由热力学手册可知O2,CO2,H2O及萘在实验温度下的恒压比热容,结合测试温度下棕榈酸及棕榈酸异丙酯的比热容值,以及XRY-1C型氧弹式量热计分别测得的棕榈酸、棕榈酸异丙酯的燃烧热,在上述计算公式的基础上,得到二者的标准燃烧焓,结果见表 2。
| 表 2 棕榈酸、棕榈酸异丙酯燃烧焓相关数据 Table 2 Standard mole combustion enthalpies of palmitic acid and isopropyl palmitate |
由表 2可知,棕榈酸的标准燃烧焓为:-38731.9 J·g-1,即-9931.64 kJ·mol-1;棕榈酸异丙酯的标准燃烧焓为:-40476.3 J·g-1,即-12082.33 kJ·mol-1。
2.4.4 棕榈酸、棕榈酸异丙酯标准摩尔生成焓的计算298.15 K的标准态下,棕榈酸(s)和棕榈酸异丙酯(l)的生成反应可表示为:
| ${{\text{O}}_{2}}\left( \text{g} \right)+16\text{C}\left( \text{石墨} \right)+16{{\text{H}}_{2}}\left( \text{g} \right)\to {{\text{C}}_{16}}{{\text{H}}_{32}}{{\text{O}}_{2}}\left( \text{s} \right)$ | (f) |
| ${{\text{O}}_{2}}\left( \text{g} \right)+19\text{C}\left( \text{石墨} \right)+19{{\text{H}}_{2}}\left( \text{g} \right)\to {{\text{C}}_{19}}{{\text{H}}_{38}}{{\text{O}}_{2}}\left( 1 \right)$ | (g) |
棕榈酸生成反应中反应物与产物完全燃烧得到16CO2(g)和16H2O(l),棕榈酸异丙酯成反应中反应物与产物完全燃烧得到19CO2(g)和19H2O(l),则棕榈酸、棕榈酸异丙酯的标准摩尔生成焓分别为式(13)、式(14):
| ${\Delta _{\text{f}}}H_{\text{m}}^\theta = - \left\{ {{\Delta _{\text{c}}}H_{\text{m}}^\theta \left( {{{\text{C}}_{{\text{16}}}}{{\text{H}}_{{\text{32}}}}{{\text{O}}_{\text{2}}}} \right) - 16{\Delta _{\text{c}}}H_{\text{m}}^\theta \left( {{\text{C}},\;\;{\text{石墨}}} \right) - 16{\Delta _{\text{c}}}H_{\text{m}}^\theta \left( {{{\text{H}}_2},\;\;{\text{g}}} \right)} \right\}$ | (13) |
| ${\Delta _{\text{f}}}H_{\text{m}}^\theta = - \left\{ {{\Delta _{\text{c}}}H_{\text{m}}^\theta \left( {{{\text{C}}_{{\text{19}}}}{{\text{H}}_{{\text{38}}}}{{\text{O}}_{\text{2}}}} \right) - 19{\Delta _{\text{c}}}H_{\text{m}}^\theta \left( {{\text{C}},\;\;{\text{石墨}}} \right) - 19{\Delta _{\text{c}}}H_{\text{m}}^\theta \left( {{{\text{H}}_2},\;\;{\text{g}}} \right)} \right\}$ | (14) |
由式(13)、式(14) 分别计算出棕榈酸和棕榈酸异丙酯的标准摩尔生成焓,结果见表 3。
| 表 3 棕榈酸和棕榈酸异丙酯的标准生成焓 Table 3 Standard formation enthalpies of palmitic acid and isopropyl palmitate |
合成棕榈酸异丙酯反应体系中各个反应物和生成物的标准摩尔生成焓汇总于表 4。
| 表 4 棕榈酸异丙酯合成反应体系中各物质的标准摩尔生成焓 Table 4 Standard formation enthalpies of every component in the reaction system |
化学反应的标准反应焓变△rHmθ的计算公式为式(15):
| ${\Delta _{\text{r}}}H_{\text{m}}^\theta =-\sum{{{\nu }_{i}}}{\Delta _{\text{r}}}H_{\text{m}}^\theta \left( i \right)$ | (15) |
因棕榈酸酰氯的不稳定性,无法测定其标准摩尔生成焓,结合表 4各组分的△fHmθ数据及反应式(a)~(c),依据式(15),可知棕榈酸异丙酯合成的整体反应的标准摩尔反应焓变为193.26 kJ·mol-1。
3 结论(1) 采用DSC-60差示扫描量热仪测定棕榈酸和棕榈酸异丙酯的定压比热容,二者的比热容表达式分别为:
(2) 采用XRY-1C型氧弹式量热计及热力学关系式测算出棕榈酸和棕榈酸异丙酯的定容标准摩尔燃烧焓分别为-9931.64和-12082.33 kJ·mol-1,298.15 K下二者的标准摩尔生成焓分别为-937.80和-825.25 kJ·mol-1;由相关组分的标准摩尔生成焓可得到棕榈酸异丙酯合成的整体反应标准摩尔反应焓变为193.26 kJ·mol-1。
(3) 实验测定并计算得到了合成榈酸异丙酯反应体系的有关热力学数据,为该合成工艺的开发、工程设计以及规模生产等提供了基础的热力学数据;此外,为减小外部条件对实验结果的影响,在后续研究工作中进一步考察密闭或相对密闭的条件下,采用DTG-60差热-热重分析仪对棕榈酸和棕榈酸异丙酯热分解过程的分析。
符号说明:
| CP | -物质的定压比热容,J·g-1·K-1 | i, j | -组分 |
| CP, std | -标准物质的定压比热容,J·g-1·K-1 | ms | -试样的质量,mg |
| Cp, exp | -物质定压比热容测定值,J·g-1·K-1 | mstd | -标准物质的质量,mg |
| DSCbl | -基线在温度T时DSC信号值,μV | Δn | -摩尔量变化值,mol-1 |
| DSCs | -试样在温度T时DSC信号值,μV | Qv | -物质的燃烧热 |
| DSCstd | -标准物质在温度T时DSC信号值,μV | T | -温度,K |
| ΔfH | -物质的生成焓,J·mol-1 | ΔT | -温度变化值,K |
| ΔrH | -反应焓变,J·mol-1 | v | -化学计量数 |
| ΔHpro | -生成物对应的焓变,J·mol-1 | 上标 | |
| ΔHrea | -反应物对应的焓变,J·mol-1 | θ | -表示标准状态 |
| [1] | 白银鸽. 两步法合成生物柴油连续化生产工[D]. 郑州: 郑州大学, 2014. BAI Yin-ge. Continuous process of two-Step biodiesel production [D]. Zhengzhou : Zhengzhou University, 2014. |
| [2] | FU Li-li(付丽丽), JIANG Deng-gao(蒋登高). Thermodynamic analysis of isopropyl palmitate synthesis(棕榈酸异丙酯合成反应的热力学分析)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2016, 30(2): 398-403. |
| [3] | Poling B E(PolingB E), Prausnitz J M(PrausnitzJ M), O'Connell J P(O'ConnellJ P), et al. The properties of gases and liquids(气液物性估算手册)[M].5th ed. Beijing(北京): Chemical Industry Press(化学工业出版社), 2006. |
| [4] | Fu L L, Bai Y G, Jiang D G. Reaction kinetics of isopropyl palmitate synthesis[J]. Chinese Journal of Chemical Engineering, 2015, 23(8): 1335-1339.DOI:10.1016/j.cjche.2015.05.004. |
| [5] | JIANG Deng-gao(蒋登高), ZHOU Cai-rong(周彩荣), WANG Fei(王斐), et al. Study on standard combustion enthalpy and heat capacity for cis-and trans-1, 2-cyclohexanediol(1, 2-环己二醇标准摩尔燃烧焓和定压热容测定)[J]. Chemical Engineering (China)(化学工程), 2005, 33(4): 63-67. |
| [6] | CHEN Ling-ling(陈玲玲), ZHOU Cai-rong(周彩荣), SHI Xiao-hua(石晓华). Standard combustion enthalp and thermal capacity of some organisms(几种含氮有机物标准摩尔燃烧焓和比热的测定)[J]. Journal Chemical Engineering of Chinese University(高校化学工程学报), 2009, 23(5): 729-735. |
| [7] | YANG Chang-sheng(杨长生), MA Pei-sheng(马沛生), XIA Shu-qian(夏淑倩). The specific heats of aqueous mixtures of acetic acid with water measured with DSC(DSC法测定醋酸-水溶液的比热)[J]. Journal of Chemical Engineering of Chinese University(高校化学工程学报), 2002, 6(5): 479-483. |
| [8] | Li W L, Zhou C R, Zhang L. Investigation on specific heat capacity, combustion enthalpy of ivermectin[J]. Journal of Thermal Analysis and Calorimetry, 2016, 124(1): 447-453.DOI:10.1007/s10973-015-5111-1. |
| [9] | LIU Jun-ji(刘俊吉), ZHOU Ya-ping(周亚平), LI Song-Lin(李松林). Physical chemistry(物理化学)[M].Beijing(北京): Higher Education Press(高等教育出版社), 2010. |
| [10] | XIA Wen(夏雯), LIU Shu-feng(刘淑凤), ZHANG Li-min(张丽民). Application of vacuum distillation technology to purification of low melting point metals(真空蒸馏技术在低熔点金属提纯中的应用)[J]. Nonferrous Metal Science and Engineering(有色金属科学与工程), 2013, 4(4): 36-40. |
| [11] | ZHOU Cai-rong(周彩荣), PENG Guo-sheng(彭国胜), ZHANG Ya-dong(章亚东). Study on thermodynamics properties of cis-and trans-1, 2-cyclohexanediol(顺式-, 反式-1, 2-环己二醇热力学性质的研究)[J]. Journal of Chemical Engineering of Chinese University(高校化学工程学报), 2002, 16(3): 237-241. |
| [12] | Barin Ihsan, CHENG Nai-liang (程乃良), NIU Si-tong (牛四通). Themochemical date of pure substances (纯物质热化学数据手册)[M] Beijing (北京): Science Press (科学出版社), 2003. |




