2. 西安交通大学 动力工程多相流国家重点实验室, 陕西 西安 710049
2. State Key Laboratory of Multiphase Flow in Power Engineering, Xi'an Jiaotong University, Xi'an 710049, China
生物质的组成单体中大多存在两个或多个相邻碳原子上含有羟基的结构,该结构可抽象为1, 2-二醇结构单元。生物质的转化,大多可从1, 2-二醇结构单元的变化入手。因此在温和条件下实现对1, 2-二醇的选择性氧化,断裂邻位二醇的C─C键生成对应的醛或酮,使生物质大分子转化成小分子的高附加值产物[1],可对生物质的化学转化利用产生深远的影响。对于邻位二醇选择性的氧化裂解,传统方法是使用高碘酸盐或四乙酸铅作为氧化剂[2],但这些氧化剂会产生有毒废弃物。近年来研究者对以O2为氧化剂的均相催化体系进行了大量探索[3]。然而这些均相催化剂不具备重复使用性,而且产物选择性较低。因此,构建具有较高反应活性和选择性,且可反复使用性能优良的新的催化体系则成为一个需要攻克的难点。分子筛作为非均相反应催化剂的载体多有报道[4]。其中,H-Beta沸石是一种具有三维十二元环孔结构,该结构使H-Beta沸石不仅拥有更大的比表面积和热稳定性,脱铝的H-Beta沸石将允许金属前驱物填充到蚀刻铝留下的空位中[5]。基于此,可以选择对邻位二醇催化活性更佳的金属组分与脱铝分子筛进行离子交换,并进入脱铝分子筛的骨架中充当Lewis酸和反应过程的吸附位点,进而利用金属离子的价态变化及其与H-Beta载体的协同作用[6]而调节其裂解活性与反应的选择性,构建出满足邻位二醇C─C键断裂的高效且可重复使用的催化剂。鉴此,本研究选用具有裂化活性的过渡金属Cu2+,通过浸渍法和离子交换法将其负载在脱铝的H-Beta沸石骨架中,开发了一种适用于邻位醇裂解的非均相催化剂。以期为具有1, 2-二醇结构的生物质的利用,探索一条经济、高效、环保的新途径。
2 实验 2.1 材料苯基乙二醇购自萨恩化学技术有限公司(中国上海)。三水合硝酸铜,九水合硝酸铁,六水合硝酸锌,四氯金酸,六水合氯化钴购自国药集团化学试剂有限公司(中国上海)。Off-Al H-Beta为商用的脱铝H-Beta(ID:45875),其硅铝比为360:1,购自阿法埃莎化学有限公司(中国上海)。甲醇,乙醇,正丙醇,异丙醇,正丁醇,四氢呋喃为分析纯,购自国药集团化学试剂有限公司(中国上海)。
2.2 催化剂的制备离子交换法:将脱铝的H-Beta沸石在0.1 mol·L−1的Cu(NO3)2溶液中在室温下搅拌12 h,进行离子交换。离心后,使用去离子水和乙醇洗涤处理固体。回收的固体在80 ℃下干燥12 h,并在研钵中进一步研磨。随后将固体在450 ℃下煅烧6 h得到Cu-ie/ Off-Al H-Beta。使用相似的方法,同时制备了Co-ie/ Off-Al H-Beta、Zn-ie/ Off-Al H-Beta、Au-ie/ Off-Al H-Beta、Fe-ie/ Off-Al H-Beta,并分别得到经过2次、3次离子交换的Cu-ie-2/ Off-Al H-Beta、Cu-ie-3/ Off-Al H-Beta等系列催化剂。
浸渍法:将脱铝的H-Beta沸石和Cu(NO3)2·3H2O在质量比为100:15的条件下,加入适量去离子水搅拌12 h。随后使用旋转蒸发仪RE-52A(上海亚荣生化仪器厂)在60 ℃下真空旋蒸。将得到的固体混合物在80 ℃下干燥12 h,随后将固体在450 ℃下煅烧6 h,得到负载量为15% 的Cu-15/ Off-Al H-Beta催化剂。作为比较,用类似的方法制备Cu负载量分别为1%、5%、10%、20%、25%、30%、50%、100%的催化剂。
2.3 催化剂的表征方法催化剂粉末的X射线衍射图(XRD)通过日本岛津仪器有限公司的XRD-6100获得。BET表面积是基于氮气吸附-脱附实验,通过美国ASAP 2460多站扩展式全自动比表面与孔隙度分析仪测得。催化剂样品中的铜含量通过岛津AA-6880F/AAC原子吸收光谱仪测定。此外,分别采用MAIA3LMH(美国),JEOL JEM-2100Plus(日本),进行了催化剂样品的扫描电子显微镜(SEM)、透射电子显微镜(TEM)、能谱分析(EDS)图像采集。催化剂的X射线光电子能谱(XPS)是在Thermo Fisher ESCALAB Xi+(美国)上,用双阳极Al/Mg靶和单色Al Kα X射线源(hv=1 486.6 eV)获得。NH3-程序升温脱附(NH3-TPD)通过美国自动化学吸附仪Quantachrome Instruments完成。
2.4 氧化裂解反应及产物分析反应在10 mL的不锈钢高压反应釜中进行。在典型操作中,将1 mmol苯基乙二醇溶解在2 mL甲醇中,然后将溶液和50 mg催化剂装入高压反应釜,反应器用氧气吹扫3次后,将氧气加压至3.0 MPa。此后将反应釜移至智能恒温磁力搅拌器中,待加热到所需的反应温度后,以800 r·min−1的转速进行搅拌。反应结束后,将反应釜浸入冷水中快速冷却,通过离心操作分离固体催化剂与液体产物。使用气相色谱-质谱联用法(岛津QP2010)对产物进行定性分析,使用福立GC-9790气相色谱对产物进行定量分析。
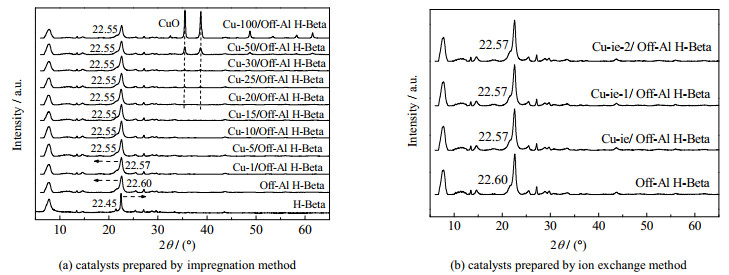
3 结果与讨论 3.1 催化剂的表征通过XRD分析得到了Cu/Off-Al H-Beta催化剂的晶相。对于浸渍法和离子交换法制备的Cu/Off-Al H-Beta催化剂,所有样品都出现了与Beta分子筛拓扑结构相对应的衍射峰(见图 1),表明脱铝和负载Cu后Beta沸石的骨架结构保持不变。图 1(a)中,随着Cu的负载量(质量分数)增大,XRD图谱中逐渐出现了CuO的衍射峰,该衍射峰对应了催化剂中CuO晶体的形成。
|
图 1 催化剂X射线衍射图谱 Fig.1 XRD patterns of catalysts |
沸石骨架结构的收缩/膨胀表现为衍射角2θ在22.45°附近的主衍射峰位置的变化[7]。如图 1所示,在沸石脱铝后,衍射峰从22.45°到22.60°发生了显著的位移,表明脱铝的H-Beta沸石晶格发生了收缩[8]。在负载Cu后,主衍射峰的2θ减小,表明Beta沸石结构产生扩张,Cu被成功引入H-Beta骨架因脱铝而产生的空位中。而当负载量大于5%,Cu/Off-Al H-Beta的主衍射峰的2θ值保持22.55°不变,Beta沸石的骨架结构不再发生改变,未能进入晶格的过量Cu则会负载在Beta沸石表面及孔道之中。
对于浸渍法制备的催化剂,Cu的质量分数由初始配比经计算得到;离子交换法制备的催化剂,Cu的质量分数由原子吸收光谱(AAS)测定。如表 1所示结果表明,离子交换法只能在Off-Al H-Beta沸石中引入相对少量的Cu,因此在XRD图谱中没有观察到氧化铜晶体的衍射峰。而浸渍法则引入了更多Cu到Off-Al H-Beta沸石中。H-Beta沸石样品的总比表面积为469 m2·g−1,孔体积为0.37 cm3·g−1,而Off-Al H-Beta沸石的比表面积SBET增大到500 m2·g−1,孔体积缩小到0.32 cm3·g−1,表明Beta沸石因脱铝而形成了空位,且在脱铝过程中Beta沸石结构发生了收缩。对于浸渍法制备的Cu/Off-Al H-Beta,在负载量小于20% 时,催化剂的孔体积变化不大。当负载量大于25% 时,其总比表面积和孔体积均有下降,这说明在高负载量下,Cu团聚形成的CuO晶体会堵塞孔道,从而造成比表面积的减小与孔体积的减小,这些结果与XRD分析的结论一致。
|
|
表 1 沸石催化剂的物理化学性质 Table 1 Physicochemical properties of zeolite catalysts |
用SEM和TEM对样品的形貌和结构进行了观察。图 2中SEM图像表明,Off-Al H-Beta为规则生长的球状结构,Cu负载后Beta沸石的形貌没有明显变化,表明载体材料具有良好的稳定性。图 3中的TEM图像和扫描透射电子显微镜(STEM)图像证实了Cu在分子筛中是均匀分散的。此外,在Cu-15/Off-Al H-Beta中观察到一些平均粒径约为2 nm的小颗粒。这些颗粒被认为是未进行离子交换的Cu在浸渍过程中聚集结晶形成的CuO颗粒[9]。

|
图 2 催化剂样品的SEM图片 Fig.2 SEM images of catalyst samples |

|
图 3 催化剂样品的TEM、STEM图片 Fig.3 TEM and STEM images of catalyst samples |
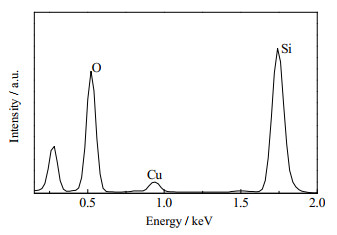
Cu-15/Off-Al H-Beta的能谱分析EDS结果表明(图 4、表 2),催化剂表面Cu的质量分数约为5.11%,高于表 1中Cu的质量分数的计算值(3.76%),表明更多的Cu负载到Off-Al H-Beta的表面。同时,在EDS检测中,未检测到Al元素,证明沸石中的铝完全被Cu替代。
|
图 4 Cu-15/Off-Al H-beta 的EDS图像 Fig.4 EDS spectrum of Cu-15/Off-Al H-beta |
|
|
表 2 Cu-15/Off-Al H-Beta的元素含量 Table 2 Element contents of Cu-15/Off-Al H-Beta |
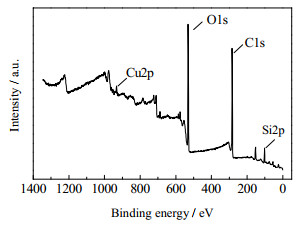
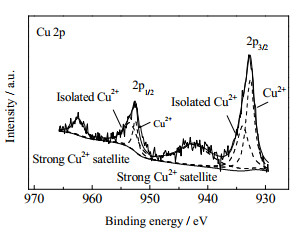
从Cu-15/Off-Al H-Beta的XPS表征全谱中(图 5),检测到Cu 2p的峰,表明Cu元素成功掺杂到Off-Al H-Beta中。Cu 2p光谱图 6中,在930~937和950~959 eV处观察到2个峰,分别对应于Cu 2p3/2和Cu 2p1/2[10]。此外,在938~950和962~966 eV出现了2个携振卫星峰。这表明Cu-15/Off-Al H-Beta中存在Cu(Ⅱ)[11]。这是因为Cu(0),Cu(Ⅰ)的3d均为闭壳层,只出现一个终态;Cu(Ⅱ)的3d为开壳层,3d电子可以与O 2p交叠耦合,产生终态分裂,使它出现2个终态,因此可以在主峰的高结合能处形成携振卫星峰。
|
图 5 Cu-15/Off-Al H-Beta的XPS全谱 Fig.5 XPS full spectrum of Cu-15/Off-Al H-Beta |
|
图 6 Cu-15/Off-Al H-Beta的XPS表征 Fig.6 XPS characterization of Cu-15/Off-Al H-Beta |
用高斯拟合的方法进行分峰处理,Cu 2p3/2和Cu 2p1/2均可解卷积为2个峰。952.5和932.7 eV处的峰表示催化剂中存在Cu─O─Cu键结构,对应的CuO纳米颗粒可以在Cu-15/Off-Al H-Beta的TEM图(图 3(a)、(b))中观察得到。而在结合能较高的953.4和934.0 eV处得到了与催化剂晶格氧原子配位的Cu2+峰,即Cu─O─Si键结构[12-13]。这是因为Si比Cu的电负性更强,Cu─O─Si中的Cu─O键比Cu─O─Cu中的Cu─O键具有更高的结合能。这些结果表明,Cu2+和CuO都存在于Cu/Off-Al H-Beta催化剂中,而且都可作为反应活性位点,从而可大幅增加催化剂C─C键的断裂能力。
用NH3-TPD测定了Cu-15/Off-Al H-Beta催化剂和参考样品表面的酸性中心[14],结果如图 7所示。脱附曲线中可观察到样品在温度为100~250、250~500和500~700 ℃出现了3个脱附带。这表明Cu-15/Off-Al H-Beta的表面有不同强度的酸性中心。根据文献[15-16],在100~250 ℃时的脱附带可归因于弱吸附氨的解吸(在弱路易斯酸位上的表面羟基Si-OH所吸收的NH3),这些位点据推测可以有效增加沸石中的质子迁移率[17],但却没有催化作用。在250~500 ℃时出现的脱附带可归因于吸附在强Lewis酸位点上的NH3[18]。而550 ℃以上的峰值可能归因于吸附在Brønsted酸酸位上的NH3[19]。
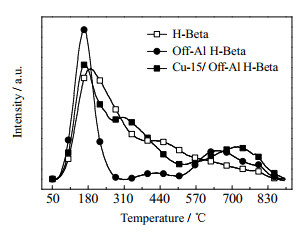
|
图 7 所选沸石催化剂的NH3-TPD测试 Fig.7 NH3-TPD results of selected zeolite catalysts |
通过对NH3-TPD曲线进行分峰拟合,可得不同催化剂样品总酸性位点的量以及不同强度酸位点的量,如表 3所示。由图 7和表 3可知,H-Beta沸石脱铝后100~250 ℃的峰强增加,说明脱Al产生的空位由表面羟基所取代,产生了大量弱吸附位点。而在250~500 ℃的峰强度的减弱和500~800 ℃的峰的强度的提高,说明由于Al的脱除使得沸石强Lewis酸的酸量大大减少,并产生了Brønsted酸酸位点。
|
|
表 3 NH3-TPD得到的样品酸度 Table 3 Acidity of the samples obtained from NH3-TPD |
在负载Cu后,Cu替代Al进入沸石的晶格中,取代弱Lewis酸位上表面羟基的质子氢,使得100~250 ℃的峰强减弱。同时,铜的引入使样品的强Lewis酸酸性位点数目增加到0.47 mmol·g−1,骨架脱铝造成的酸性中心的损失通过加入Cu得到了补充。由于Cu-15/Off-Al H-Beta中与晶格氧配位的Cu2+和CuO纳米颗粒都可以作为强Lewis酸酸性位点,因此其强Lewis酸性位数目甚至多于H-Beta沸石。由于Cu是+2价,而Al是+3价,使用Cu替代骨架中的Al必然会造成Lewis酸强度的减弱,这体现在了Cu-15/Off-Al H-Beta样品位于250~500 ℃的峰向低温位置偏移。负载Cu后,脱铝沸石表面的强酸性中心的位点数并没有降低,说明Cu离子难以取代强酸性中心的Brønsted酸位上的质子,这就使得Off-Al H-Beta在负载Cu后,可以在不影响Brønsted酸性位点的条件下增加强Lewis酸性位点数目。这有利于Lewis酸和Brønsted酸在反应过程中协同作用。
3.2 催化剂的有效性测试 3.2.1 不同的催化剂活性比较使用离子交换法制备的分别负载Cu2+、Co2+、Zn2+、Au3+、Fe3+ 5种不同金属的Off-Al H-Beta,在150 ℃下反应8 h,不同催化剂的各产物收率如图 8所示。其中Cu-ie/Off-Al H-Beta较其他几种金属改性的催化剂表现出更高催化活性,表明Cu可以作为反应的活性位点有效地参与反应。
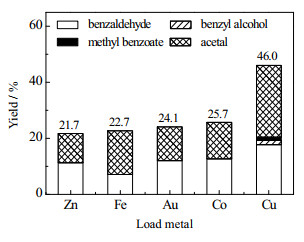
|
图 8 负载不同金属的催化剂活性测试 Fig.8 Activity of catalysts loaded with different metals |
以离子交换法制备的Cu-ie/Off-Al H-Beta、Cu-ie-2/Off-Al H-Beta、Cu-ie-3/Off-Al H-Beta作为催化剂,以未负载的Off-Al H-Beta作为对照,在150 ℃下反应8 h,得到了苯甲醛、苯甲醛二甲缩醛、苯甲醇、苯甲酸甲酯4种产物。不同催化剂的各产物收率如图 9所示。从图中可以看到,改性后的Off-Al H-Beta的催化性能明显提升,且随着离子交换次数的增加,各裂解产物的收率之和从46.0% 增加到53.6%。
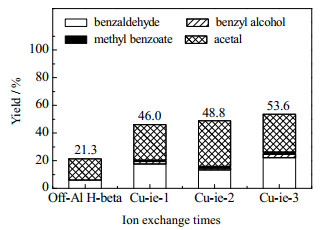
|
图 9 离子交换次数对产物收率的影响 Fig.9 Effects of ion exchange times on product yields |
对于浸渍法所得催化剂,相同反应条件下苯基乙二醇的转化率如图 10所示。从图中可以看到,随着负载量的增加,反应活性先增加后降低。当负载量为15% 时,苯基乙二醇氧化裂解的反应转化率最高(94.8%)。这是由于Cu作为活性组分,增加负载量虽可加速反应,但负载量过大时,CuO晶体会堵塞部分孔道,造成催化剂比表面积减小,使反应活性降低。
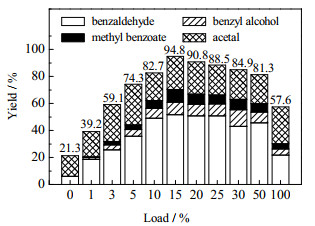
|
图 10 浸渍负载量对产物收率的影响 Fig.10 Effects of impregnation loading on product yields |
从上述结果可知,浸渍法可以在载体上负载更高质量分数的Cu,所得催化剂的活性高于离子交换法。因此,后续选择Cu-15/Off-Al H-Beta进一步研究。
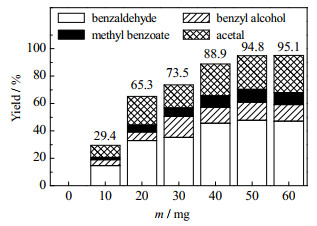
3.2.2 催化剂用量对氧化裂解反应的影响考察了Cu-15/Off-Al H-Beta催化剂用量m对苯基乙二醇氧化裂解的影响,如图 11所示。当催化剂用量从0.01~0.05 g递增时,反应的转化率逐渐增加。在实验范围内,苯基乙二醇的转化率由29.4% 逐渐增加到95.1%。而其后继续增加催化剂用量,反应转化率无明显提高。这是因为,随着催化剂用量增加,反应由动力学控制变为热力学控制,此时再增加催化剂用量,对产物收率提高不明显。
|
图 11 催化剂用量对产物收率的影响 Fig.11 Effects of catalyst dosage on product yields |
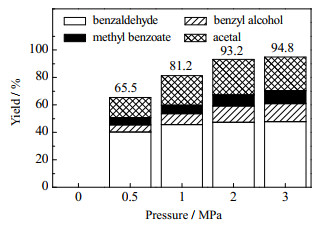
氧气压力对苯基乙二醇选择性裂解的影响如图 12所示。当使用3 MPa N2替代O2时,无任何反应发生。这证实了苯基乙二醇的氧化裂解需要氧气的参与。当O2压力由0.5 MPa上升至2 MPa,反应的转化率及4种产物的收率均提高。当氧气分压大于2 MPa时,再增加氧气压力已不影响产物收率。这是因为,在反应过程中,氧气需要吸附在固体催化剂的酸性位点上。当氧气压力增加,吸附在固体催化剂的酸性位点上的氧增加,反应速率加快。而固体催化剂的酸性位点数量有限,当氧气分压持续增加时,催化剂酸性位点吸附饱和,再增加氧气压力已不影响反应速率。
|
图 12 氧气分压对产物收率的影响 Fig.12 Effects of oxygen pressure on product yields |
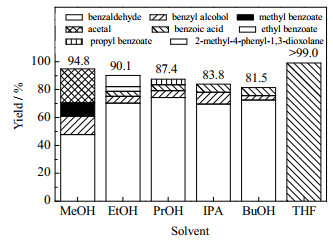
选用甲醇(MeOH)、乙醇(EtOH)、正丙醇(PrOH)、异丙醇(IPA)、正丁醇(BuOH)以及四氢呋喃(THF)探究溶剂对氧化裂解反应的影响。其中乙醇、正丙醇、异丙醇、正丁醇和甲醇均为有机质子溶剂,对苯基乙二醇都有良好的溶解性,为反应提供质子H、增加反应体系中的H转移速率。但几种溶剂,由于烷基的含C量不同,其给出质子能力有差异,同时其在反应过程中的溶剂化效应也存在差异。而四氢呋喃属于醚类,由于它的液程宽,常被用作中等极性的非质子性溶剂。
不同溶剂发生的反应如图 13所示。使用乙醇为溶剂时,可以得到苯甲醛、苯甲醇、苯甲酸、苯甲酸乙酯、2-甲基-4-苯基-1, 3-二氧戊环;使用正丙醇为溶剂时,可以得到苯甲醛、苯甲醇、苯甲酸、苯甲酸丙酯;使用异丙醇和正丁醇为溶剂时,可以得到苯甲醛、苯甲醇、苯甲酸;使用四氢呋喃为溶剂时,可以得到苯甲酸。

|
图 13 不同溶剂的氧化裂解反应 Fig.13 Oxidative cleavage with different solvents |
对于醇类来说,由于氧的电负性大于氢的电负性,因此氧和氢的共用电子对偏向于氧,使醇可以给出质子。这种给出质子的能力与烃基的吸电子能力相关,烃基的吸电子能力越强,羟基O的电子云密度越大,O和H的共用电子对会更加偏向于O,醇给出质子的能力则越强。而烷基是吸电子基,因此根据诱导效应,上述溶剂的给质子的能力排序为:异丙醇 > 正丁醇≈正丙醇≈乙醇 > 甲醇。而溶剂给质子的能力越强,苯基乙二醇氧化裂解反应就越容易发生。
此外,溶剂分子的空间位阻效应也会对氧化裂解反应产生重要影响。醇含C的数量越大,其空间位阻效应就会使反应越难发生。还有诱导效应以及溶剂化效应也将对反应产生影响。当使用质子溶剂时(如图 14所示),苯基乙二醇的转化率大小为:甲醇 > 乙醇 > 正丙醇 > 异丙醇 > 正丁醇。需要指出的是,乙醇作为溶剂时,并没有发生C─C键的断裂,而是仅发生了脱水反应,且其产物的收率低于甲醇、正丙醇、异丙醇等。
|
图 14 不同溶剂对产物收率的影响 Fig.14 Effects of solvents on product yields |
当非质子溶剂四氢呋喃作为溶剂时,氧化裂解反应有着极高的转化率。150 ℃时,只需要2 h反应物就能完全转化。进一步分析可知,当四氢呋喃作为溶剂时,反应器内的氧气分压会迅速下降。而反应的产物中,也检测出γ-丁内酯、γ-羟基丁酸及其衍生物等多种四氢呋喃的氧化产物。因此可以认为,四氢呋喃作为溶剂时的高活性和选择性是由于在反应过程中,四氢呋喃的氧化产物会与苯基乙二醇反应,且表现出更好的活性。因此四氢呋喃为生物质大分子选择性氧化裂解的研究,提供了一种自身先被氧化,进而再使苯基乙二醇氧化的新的反应路径。
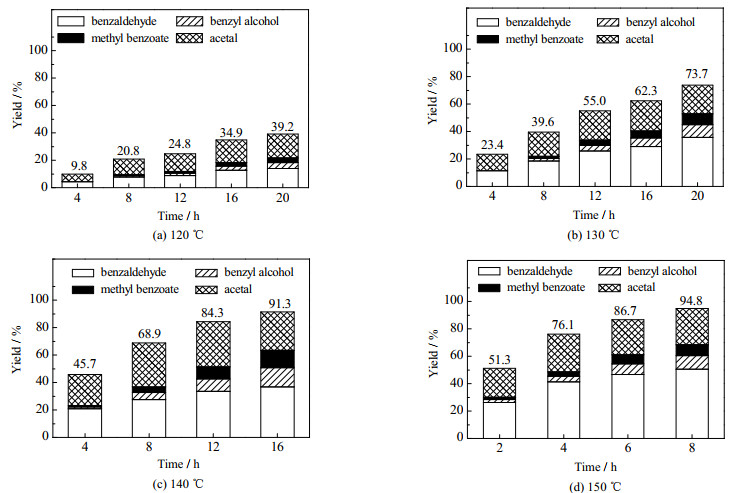
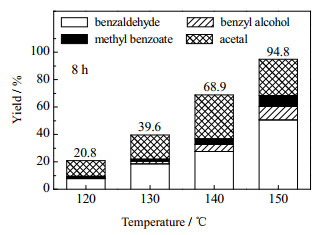
3.2.5 反应温度和反应时长对氧化裂解反应的影响研究了不同温度不同时长下反应产物收率的变化。分别在120、130、140、150 ℃下,进行不同时长的反应得到各产物的收率如图 15、16所示。从图中可以看到,在相同反应温度下,反应的转化率随反应时间的延长而增加。同时随反应温度的增加,反应转化率也大幅增加。升高温度,反应活化分子数增多,有效碰撞增加,反应速率加快。
|
图 15 不同温度下反应的经时变化 Fig.15 Effects of reaction time on product yields at different temperatures |
|
图 16 不同温度反应8 h的各产物收率 Fig.16 Product yields at different temperatures after 8 h reaction |
使用扫描电子显微镜图像(SEM) 对反应后的Cu-15/Off-Al H-Beta催化剂进行了形貌观察(图 17)。对比反应前Cu-15/Off-Al H-Beta催化剂的SEM图(图 2)可知,催化剂在反应前后均为球状颗粒,且粒径为500 nm左右,其结构在反应前后基本保持稳定。

|
图 17 反应后的Cu-15/Off-Al H-Beta的SEM图像 Fig.17 SEM images of Cu-15/Off-Al H-Beta after reaction |
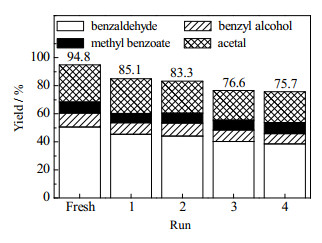
改性催化剂的可重复使用性能,通过回收焙烧(450 ℃,6 h)后再反应而得以证实。如图 18所示,各裂解产物的总收率在5次回收反应后虽然从94.8% 降至75.7%,但该活性值仍然远高于未改性的Off-Al H-Beta催化剂的收率21.3%。
|
图 18 回收试验中各产物的收率 Fig.18 Product yields in recycling tests |
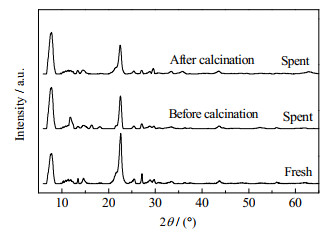
对反应前后的Cu-15/Off-Al H-Beta催化剂的XRD谱图(图 19)可知,反应前后的催化剂样品都出现了与BEA拓扑结构相对应的衍射峰,这说明催化剂的结构在反应前后基本保持稳定。在反应后,未经过焙烧的催化剂的峰高降低,表示对应衍射角的晶面数量减少,说明催化剂结构不如新鲜催化剂规则[20]。同时,未经过焙烧的Cu-15/Off-Al H-Beta还出现了一些新鲜催化剂所没有的有机物的峰,这说明在反应结束以后,会有有机物残留在催化剂的表面和孔道中。在经过焙烧后,这些残留有机物的峰消失,催化剂又恢复到了初始的状态。总体而言,这些结果表明Cu-15/Off-Al H-Beta具有很好的再利用特性。
|
图 19 反应后Cu-15/Off-Al H-beta的XRD图谱 Fig.19 XRD patterns of Cu-15/Off-Al H-beta after reaction |
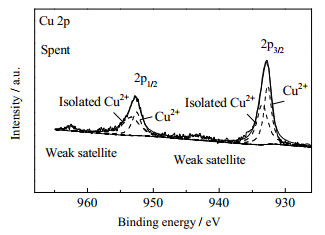
对于使用后的催化剂,用XPS测定了催化剂中Cu组分的氧化状态,并与新鲜催化剂的氧化态进行了比较。使用后的Cu-15 /Off-Al H-Beta的Cu 2p光谱如图 20所示。在930~937 eV和950~959 eV处观察到2个峰,分别对应于Cu 2p3/2和Cu 2p1/2。但使用后的Cu-15 /Off-Al H-Beta在主峰的高结合能处仅得到了2个较弱的携振卫星峰,这说明在反应过程中,部分Cu2+变为Cu+。这个结果证实了在反应过程中吸附在Cu上的具有亲核性的O2−可以插入1, 2-二醇中缺电子的位置,在反应物C─C键断裂的同时,Cu─O键发生断裂,Cu2+得到电子被还原为Cu+。
|
图 20 使用后的Cu-15/Off-Al H-Beta的XPS表征 Fig.20 XPS characterization of the used Cu-15/Off-Al H-beta |
由NH3-TPD测试可知,Cu-15/Off-Al H-Beta具有0.47 mmol·g−1的强Lewis酸酸性位点和0.24 mmol·g−1的Brønsted酸位点。在反应过程中,一方面作为Brønsted酸的质子H可以进攻1, 2-二醇上的醇羟基,脱水后可以得到易被亲核性的基团进攻的碳正离子。另一方面作为强Lewis酸性位点的Cu,可以有效吸附氧,被吸附的氧气可以获得电子,达到各种氧的平衡[21](图 21)。而其中具有亲核性的O22−和O2−可以进攻缺电子的碳正离子,使得二醇间的C─C键断裂并形成碳氧双键。此外,Cu位点在吸附氧气分子后,其与晶格氧之间的Cu─O键断裂。此后,随着亲核性的O2−插入1, 2-二醇缺电子的位置,Cu2+变为Cu+,被还原为较低价态。随后Cu+可以给出电子,被氧气氧化为初始的高价态,实现自身的循环。
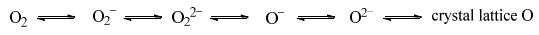
|
图 21 催化剂表面的氧平衡图 Fig.21 Equilibrium of oxygen species on catalyst surface |
Cu/Off-Al H-Beta是苯基乙二醇氧化裂解的高效催化剂,在负载Cu后Beta沸石的骨架结构保持不变,且强Lewis酸位的数量增加,强度减小,Cu以CuO颗粒和配位晶格氧的形式存在于载体中。
活性测试表明:Cu-15/Off-Al H-Beta的反应活性最高,在实验条件下苯基乙二醇的转化率可达94.8%,但裂解反应需要催化剂和氧气共同存在。当使用高级醇作为溶剂时,反应不仅有较高的转化率,同时也可以提高苯甲醛的选择性。此外,Cu/Off-Al H-Beta的结构在反应前后基本不发生改变,残留在催化剂中的有机物可以通过焙烧去除。
催化机理和反应路径的研究表明:1, 2-二醇的氧化裂解是Brønsted酸和Lewis酸协同作用的结果,Cu对分子筛晶格中Al的取代,以及Cu2+变为Cu+的自身的循环,可使催化剂的酸性和酸量得以调节,并有效提高催化剂C─C键的断裂能力。
| [1] |
YI Y, JIANG Z, YANG S, et al. Formaldehyde formation during the preparation of dialdehyde carboxymethyl cellulose tanning agent[J]. Carbohydrate Polymers, 2020, 239(13): 116217. |
| [2] |
FENG Y, ZHANG J, WEN C, et al. Recent advances in agaricus bisporus polysaccharides: Extraction, purification, physicochemical characterization and bioactivities[J]. Process Biochemistry, 2020, 94(7): 39-50. |
| [3] |
AMADIO E, FABRA J, CARRARO D, et al. Efficient vanadium-catalyzed serobic C-C bond oxidative cleavage of vicinal diols[J]. Advanced Synthesis & Catalysis, 2018, 360(17): 3286-3296. |
| [4] |
张燕婷, 潘华. 高空速条件Zn改性Co/H-beta催化剂上C3H8催化还原NOx[J]. 高校化学工程学报, 2009, 23(2): 236-239. ZHANG Y T, PAN H. SCR of NOx with C3H8 over Co/H-beta modified by Zn at high GHSV[J]. Journal of Chemical Engineering of Chinese Universities, 2009, 23(2): 236-239. |
| [5] |
MÜLLER M, HARVEY G, PRINS R. Comparison of the dealumination of zeolites beta, mordenite, ZSM-5 and ferrierite by thermal treatment, leaching with oxalic acid and treatment with SiCl4 by 1H, 29Si and 27Al MAS NMR[J]. Microporous and Mesoporous Materials, 2000, 34(2): 135-147. DOI:10.1016/S1387-1811(99)00167-5 |
| [6] |
席振峰. 协同效应双金属有机化合物及Lewis酸促进的金属有机化学反应[J]. 中国科学(B辑: 化学), 2009, 39(10): 1115-1124. XI Z F. Synergistic bimetallic organic compounds and metal-organic chemical reactions promoted by Lewis acids[J]. Chinese Science (Part B: Chemistry), 2009, 39(10): 1115-1124. |
| [7] |
ŚRĘBOWATA A, BARAN R, ŁOMOT D, et al. Remarkable effect of postsynthesis preparation procedures on catalytic properties of Ni-loaded BEA zeolites in hydrodechlorination of 1, 2-dichloroethane[J]. Applied Catalysis B: Environmental, 2014, 147(4): 208-220. |
| [8] |
陆栋, 蒋平, 徐至中. 固体物理学[M]. 上海: 上海科学技术出版社, 2010. LU D, JIANG P, XU Z Z. Solid state physics[M]. Shanghai: Shanghai Scientific and Technical Press, 2010. |
| [9] |
WANG D, JANGJOU Y, LIU Y, et al. A comparison of hydrothermal aging effects on NH3-SCR of NOx over Cu-SSZ-13 and Cu-SAPO-34 catalysts[J]. Applied Catalysis B: Environmental, 2015, 165(4): 438-445. |
| [10] |
ZHU P, CHENG Z, DU L, et al. Synthesis of the Cu-doped dual-emission fluorescent carbon dots and its analytical application[J]. Langmuir, 2018, 34(34): 9982-9989. DOI:10.1021/acs.langmuir.8b01230 |
| [11] |
AMRI A, DUAN X, YIN C, et al. Solar absorptance of copper-cobalt oxide thin film coatings with nano-size, grain-like morphology: Optimization and synchrotron radiation XPS studies[J]. Applied Surface Science, 2013, 275(12): 127-135. |
| [12] |
WAN J, CHEN J, ZHAO R, et al. One-pot synthesis of Fe/Cu-SSZ-13 catalyst and its highly efficient performance for the selective catalytic reduction of nitrogen oxide with ammonia[J]. Journal of Environmental Sciences, 2021, 100(2): 306-316. |
| [13] |
XING X, LI N, SUN Y, et al. Selective catalytic oxidation of n-butylamine over Cu-zeolite catalysts[J]. Catalysis Today, 2020, 339(1): 192-199. |
| [14] |
KATADA N, IGI H, KIM J H, et al. Determination of the acidic properties of zeolite by theoretical analysis of temperature programmed desorption of ammonia based on adsorption equilibrium[J]. Journal of Physical Chemistry B, 1997, 101(31): 5969-5977. DOI:10.1021/jp9639152 |
| [15] |
WANG D, ZHANG L, LI J, et al. NH3-SCR over Cu/SAPO-34-zeolite acidity and Cu structure changes as a function of Cu loading[J]. Catalysis Today, 2014, 231(10): 64-74. |
| [16] |
WANG J, YU T, WANG X, et al. The influence of silicon on the catalytic properties of Cu/SAPO-34 for NOx reduction by ammonia-SCR[J]. Applied Catalysis B: Environmental, 2012, 127(10): 137-147. |
| [17] |
FRANKE M E, SIMON U. Solvate-supported proton transport in zeolites[J]. Chemphyschem, 2004, 5(4): 465-472. DOI:10.1002/cphc.200301011 |
| [18] |
HAN S, CHENG J, ZHENG C, et al. Effect of Si/Al ratio on catalytic performance of hydrothermally aged Cu-SSZ-13 for the NH3-SCR of NO in simulated diesel exhaust[J]. Applied Surface Science, 2017, 419(31): 382-392. |
| [19] |
MARTINS G V A, BERLIER G, BISIO C, et al. Quantification of brønsted acid sites in microporous catalysts by a combined FTIR and NH3-TPD study[J]. The Journal of Physical Chemistry C, 2008, 112(18): 7193-7200. DOI:10.1021/jp710613q |
| [20] |
SCHMIEG S J, OH S H, KIM C H, et al. Thermal durability of Cu-CHA NH3-SCR catalysts for diesel NOx reduction[J]. Catalysis Today, 2012, 184(1): 252-261. DOI:10.1016/j.cattod.2011.10.034 |
| [21] |
BRADY C, MURPHY B, XU B. Enhanced methane dehydroaromatization via coupling with chemical looping[J]. ACS Catalysis, 2017, 7(6): 3924-3928. DOI:10.1021/acscatal.7b00879 |




