薰衣草富含黄酮、挥发油、香豆素和单宁等成分,其黄酮类化合物具有较强的抗氧化和清除自由基的功效,能够抗肿瘤,调节心血管,提高身体免疫力,可用于烹调、药用和美容等各方面。目前,薰衣草采收后仅少量用于直接加工提取,约90%需经干燥后储存或深加工。薰衣草产地主要采用晒干、烘干方式干燥处理,然而,晒干受天气影响较大,易褐变;烘干需要在一定温度下进行,较高温度会导致薰衣草中黄酮类化合物被氧化,影响其药用价值。因此,开发薰衣草干燥新工艺,降低薰衣草有效成分流失,对于薰衣草加工利用具有重要意义。
近年来,关于薰衣草精油提取及成分分析研究[1~4]较多,有关薰衣草干燥工艺及条件对其黄酮类成分影响方面研究未见报道。吴霞等[5]从薰衣草花的乙醇提取物中分离出木犀草素、芹菜素和野黄芩素等7种黄酮类化合物。Zhao等[6]研究了薰衣草中7种黄酮类化合物的抗氧化性,结果表明,犀草素和芹菜素清除自由基能力较强。白永亮等[7]研究了干燥方式对桑树叶中黄酮类化合物含量的影响,干燥桑树叶中黄酮类化合物含量由高到低依次为:冷冻干燥>热风干燥>微波干燥>红外干燥;烘干温度明显影响桑树叶中黄酮类化合物含量。Rabeta等[8]研究了三叶乌蔹莓叶片中黄酮类化合物的过氧化活性和自由基清除能力,结果表明,新鲜乌蔹莓叶片中较高水含量对黄酮类化合物的抗氧化活性有稀释作用;新鲜乌蔹莓叶片含有活性生物酶,酶降解过程会降低黄酮类化合物的抗氧化性,脱除叶片水分有利于保留其抗氧化剂活性。
吸附干燥是一种新型干燥技术,能较好地保存被干燥物料的有效成分和理化特性,特别适合热、湿敏性生物材料的干燥,过程能效优于冷冻干燥[9],受到国内外干燥行业的广泛关注。我国有关学者报道了胡萝卜[10]、紫薯浆液[11]、白芷[12]等吸附干燥过程研究成果。Alikhan[13]将转轮式干燥机用于玉米干燥过程;Seyhan[14]研制出可用于蘑菇、菠菜等蔬菜类低温吸附干燥系统;Djaeni[15]研制了多级低温(10~50℃)吸附干燥机。目前,尚未见有关薰衣草的吸附干燥过程研究报道。
本文提出将吸附干燥技术用于薰衣草干燥过程,研究吸附干燥条件对薰衣草中具有药用价值的黄酮类化合物(芹菜素、木犀草素)含量的影响,优化薰衣草吸附干燥工艺及条件;建立薰衣草吸附干燥过程动力学方程,关联吸附干燥过程中薰衣草含水率随着时间的变化关系;为开发薰衣草干燥新工艺提供基础研究。
2 实验方法 2.1 主要原料及试剂原料:新鲜薰衣草(唇形科植物狭叶薰衣草),采自江苏省南京市。
试剂:甲醇,色谱纯,山东禹王实业有限公司;甲苯,分析纯,上海凌峰化学试剂有限公司;芹菜素、木犀草素,标准品,上海阿拉丁生化科技股份有限公司。
2.2 吸附干燥薰衣草实验薰衣草试样:将新鲜薰衣草洗净,去除表面水分,取花、茎、叶部分,备用。
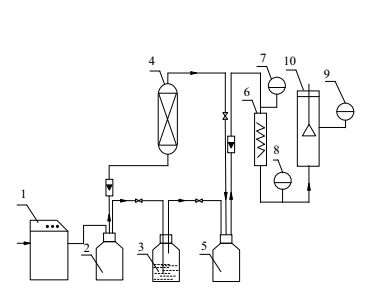
薰衣草吸附干燥实验在如图 1所示的实验装置上进行。取适量新鲜薰衣草试样装入干燥器,干燥介质(空气)通过压缩机1增压后,经缓冲罐2进入吸附器,通过吸附剂床层4脱除空气中水分后,干燥气流垂直穿过干燥器10中的薰衣草试样,对薰衣草样品进行干燥。进入干燥器的空气湿度和温度分别通过饱和瓶3、加热器6调节。吸附器床层和干燥介质温度、湿度由温湿传感器7、8、9实时分别测量、显示和记录。在不同干燥介质温度、湿度、流速下,分别进行薰衣草吸附干燥实验;分析干燥薰衣草试样中有效成分及水含量。
|
图 1 吸附干燥实验装置流程图 Fig.1 Scheme of the adsorption drying experimental setup 1. gas compressor 2. buffer tank 3. saturation bottle 4. adsorber 5. mixer 6.heater 7, 8, 9. temperature and humidity detector 10. dryer |
参照中国药典(附录48页附录IX-H)有关含水量分析[16]方法,采用甲苯蒸馏法测定薰衣草试样含水量[17],分别按照式(1)、式(2) 计算干基含水率(Wd)和相对含水率(WR)
| ${W_{\rm{d}}} = \frac{{{m_{\rm{w}}}}}{{{m_{}} - {m_{\rm{w}}}}} \times 100\% $ | (1) |
| $WR{\rm{ = }}\frac{{{W_{{\rm{dt}}}} - {W_{{\rm{de}}}}}}{{{W_{{\rm{do}}}} - {W_{{\rm{de}}}}}}$ | (2) |
根据中国药典有关总黄酮含量分析[18]方法,采用U-3310紫外可见分光光度仪(日本株式会社日立高新技术)测定薰衣草干燥试样中总黄酮含量[17],检测波长为350 nm。
2.3.3 薰衣草中芹菜素和木犀草素含量分析干燥后薰衣草中芹菜素和木犀草素含量测定[17]在1100HPLC液相色谱仪(美国安捷伦公司)上进行。采用HangbanC18色谱柱(5 μm,4.6 mm×250 mm),DAD检测器,检测波长为350 nm。
3 结果与讨论在吸附干燥实验装置上测定薰衣草干燥特性曲线;考察干燥介质温度、相对湿度和空速对干燥后薰衣草(简称“干燥薰衣草”)主要药效成分(总黄酮、芹菜素和木犀草素)的影响;采用正交试验优化吸附干燥薰衣草的工艺条件;对薰衣草干燥特性曲线进行回归分析,研究薰衣草吸附干燥过程动力学特性。
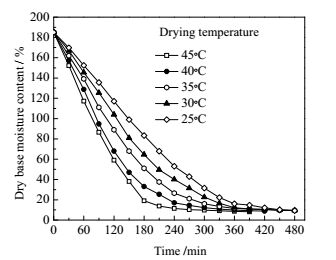
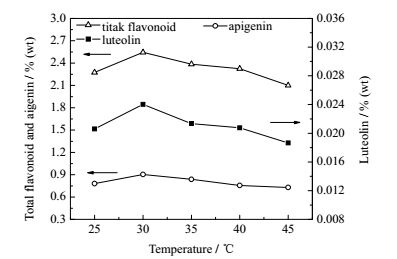
3.1 干燥介质温度在干燥介质相对湿度为16%、空速为905 h-1的条件下,控制干燥后薰衣草含水量≤10%(干基,质量百分数,用“wt”表示),测定不同干燥温度下薰衣草干燥特性曲线(图 2),以及薰衣草中总黄酮、芹菜素和木犀草素含量(质量百分数,%(wt))随着干燥温度的变化关系(图 3)。
|
图 2 不同温度下薰衣草吸附干燥特性曲线 Fig.2 Adsorption drying curves of lavender at different temperatures |
|
图 3 干燥介质温度对薰衣草有效成分含量的影响 Fig.3 Effects of drying temperature on the contents of effective compositions in lavender |
由图 2可知,新鲜薰衣草初始含水率(干基)在180%左右,在相同条件下,干燥温度越高,恒速阶段干燥速率越快,薰衣草干燥时间越短。在45℃下,恒速干燥速率为0.72 g·(g-1·min-1),干燥时间为300 min;当温度降至25℃时,恒速干燥速率下降为0.42 g·(g-1·min-1),干燥时间延长至460 min,比45℃下增加了53.33%。这是因为随着干燥介质的温度升高,干燥介质传递给物料的热量增加,水分由物料内部向表面迁移的扩散速率加快,达到平衡含水率的时间缩短。
由图 3可知,当温度为30℃,干燥薰衣草中总黄酮、芹菜素和木犀草素含量均为最高值,分别为2.544%、0.904%、0.0240%。吸附干燥温度由30℃升高至45℃,薰衣草中总黄酮、芹菜素、木犀草素含量分别减少17.43%、19.41%、22.35%,木犀草素减少量最大,超过20%。
由此可见,干燥温度对干燥薰衣草中总黄酮、芹菜素和木犀草素含量均有明显影响,木犀草素对干燥温度尤为敏感。黄酮类化合物的抗氧化性强弱与芳环上的酚羟基取代数目有关[19],木犀草素中含有更多酚羟基,干燥温度低于30℃时,干燥时间相对较长,长时间暴露在干燥介质中,酚羟基部分易被氧化,木犀草素含量减少,降低了总黄酮含量;干燥温度高于30℃时,干燥时间明显缩短,酚羟基被氧化为醌类衍生物[20],黄酮类化合物上部分配糖体发生水解[21],导致黄酮类化合物含量减少;因此,总黄酮含量在30℃时达到最高点。
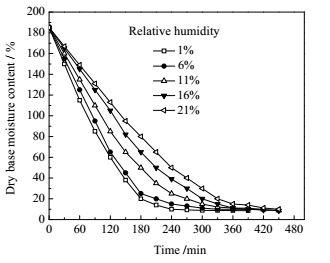
3.2 干燥介质相对湿度在干燥温度为30℃、空速为905 h-1的条件下,考察干燥介质相对湿度对薰衣草干燥特性的影响(图 4),测定薰衣草中总黄酮、芹菜素、木犀草素含量随着相对湿度的变化关系(图 5)。
|
图 4 不同相对湿度下薰衣草吸附干燥特性曲线 Fig.4 Adsorption drying curves of lavender at different relative humidities |
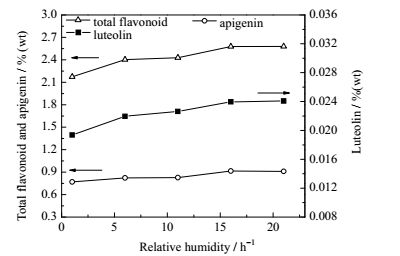
|
图 5 干燥介质相对湿度对薰衣草有效成分的影响 Fig.5 Effects of relative humidity on the contents of effective compositions in lavender |
由图 4可知,在相同条件下,干燥介质相对湿度降低,薰衣草的干燥时间缩短。在相对湿度为1%时,恒速干燥速率为0.79 g·(g-1·min-1),干燥时间为240 min;当相对湿度增加到21%时,恒速干燥速率降低至0.50 g·(g-1·min-1),干燥时间延长至450 min,增加了87.50%。这是因为随着干燥介质的相对湿度降低,与物料表面的传质推动力增大,薰衣草内部水分向水汽压低的表面迁移,增大了传质速率,加快了物料表面的水分蒸发,减少了干燥时间。
由图 5可知,随着干燥介质相对湿度的升高,干燥薰衣草中的总黄酮、芹菜素和木犀草素含量逐渐上升,之后趋于平稳。当相对湿度为16%,干燥薰衣草中总黄酮、芹菜素和木犀草素含量均达到最大值,分别为2.577%、0.915%、0.0239%,比干燥介质相对湿度为1%条件下的总黄酮、芹菜素和木犀草素含量分别增加了15.65%、16.05%、19.21%,木犀草素增加量最大。
新鲜薰衣草含水量较高,黄酮类化合物木犀草素和芹菜素微溶于水且相对含量较低,当干燥介质相对湿度为1%时,干燥过程传质推动力较大,扩散速度较快,薰衣草植物细胞过度收缩,较快的水汽迁移加剧黄酮类化合物的流失。随着干燥介质相对湿度的提高,水汽迁移减缓,黄酮类化合物含量开始提高,在相对湿度达到16%时趋于稳定。相对湿度对干燥薰衣草中总黄酮、芹菜素和木犀草素含量有明显影响,其中对木犀草素影响最大。
3.3 干燥介质空速在干燥介质相对湿度为16%、干燥温度30℃条件下,考察干燥介质空速对薰衣草干燥特性的影响(图 6),测定薰衣草中总黄酮、芹菜素、木犀草素含量(%(wt))随着空速的变化关系(图 7)。
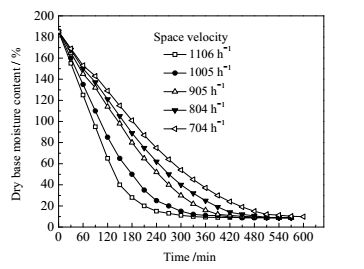
|
图 6 不同空速下薰衣草吸附干燥特性曲线 Fig.6 Adsorption drying curves of lavender under different space velocities |
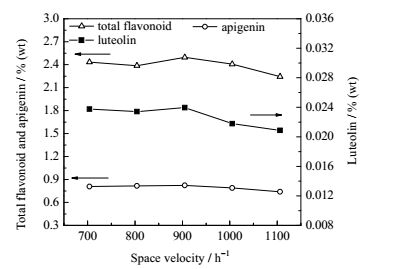
|
图 7 不同干燥介质空速下薰衣草有效成分含量 Fig.7 Effects of different space velocities on the contents of effective compositions in lavender |
由图 6可知,在相同条件下,干燥介质空速越大,干燥时间越短。当空速为1106 h-1时,恒速干燥速率为0.85 g·(g-1·min-1),干燥时间为360 min;当空速降至704 h-1时,恒速干燥速率降低为0.47g·(g-1·min-1),干燥时间延长至600 min。这是因为物料内部水分在浓度梯度作用下向外扩散,提高空速,物料表面气膜阻力越小,加快内部水分向表面迁移,从而提高了干燥速率,缩短了干燥时间。
由图 7可知,在干燥介质空速较低时,空速对干燥薰衣草中总黄酮、芹菜素和木犀草素含量影响不明显;干燥介质空速为905 h-1时,干燥薰衣草中总黄酮、芹菜素和木犀草素含量分别为2.496%、0.824%和0.0239%;干燥介质空速由905 h-1增至1106 h-1时,薰衣草中总黄酮、芹菜素、木犀草素含量分别减少10.05%、10.21%、12.87%;表明随着干燥空速继续增大,干燥时间缩短,干燥速率明显提高,薰衣草内部的水分和挥发性成分快速逸出,导致有效成分损失量增加。
3.4 薰衣草吸附干燥工艺条件优化在上述薰衣草吸附干燥单因素实验基础上,采用正交设计实验进一步优化薰衣草吸附干燥工艺条件。选取干燥介质温度(A)、相对湿度(B)和空速(C)三个因素,每个因素考察3个水平;因素与水平对照见表 1。按照L9(34)正交表安排9组实验,空白列(D)用于实验误差分析,实验条件和结果见表 2。采用直观分析法,分别对薰衣草中总黄酮、芹菜素和木犀草素含量三个指标进行优化分析,结果列于表 2。
| 表 1 薰衣草吸附干燥正交实验的因素和水平 Table 1 Factors and levels of the orthogonal experimental design for lavender adsorption drying study |
| 表 2 L9(34)薰衣草吸附干燥实验及结果分析 Table 2 Orthogonal experimental results of lavender adsorption drying processes L9(34) |
由表 2中极差(R)分析结果可知,对干燥薰衣草中总黄酮和芹菜素含量影响大小的干燥条件顺序为:空速>相对湿度>温度,空速和相对湿度是总黄酮含量主要影响因素,空速对芹菜素含量影响最为显著。对木犀草素含量影响大小的干燥条件顺序为:温度>空速>相对湿度,干燥温度是影响木犀草素含量的主要因素。实验误差(D)对干燥薰衣草中有效成分含量的影响低于各个因素。
由表 2中各因素水平和均值(K)可见,分别以干燥后薰衣草中总黄酮、芹菜素和木犀草素含量为指标,优选吸附干燥工艺条件均为A2B2C2。对照表 2中实验条件可见,A2B2C2不在9组正交实验之列。为此,本研究进行了薰衣草吸附干燥验证实验,结果表明,在干燥温度30℃、相对湿度16%和空速905 h-1条件下,干燥薰衣草中总黄酮含量为2.673%、芹菜素含量为0.976%、木犀草素含量为0.0245%,均大于表 2中9组实验各指标的最大值,说明上述正交试验优化获得的薰衣草干燥最适宜工艺条件是合理的。
3.5 薰衣草吸附干燥特性曲线数学模拟在上述薰衣草吸附干燥工艺条件优化基础上,对其干燥特性曲线进行数学模拟,分析干燥过程中含水率随干燥时间变化关系,获得薰衣草干燥过程动力学方程,以用于薰衣草干燥装置设计和干燥过程含水率在线检测过程。
选取7种用于多孔介质物料干燥的数学模型[22~26]对在最优干燥工艺条件(干燥温度30℃,相对湿度16%,空速905 h-1)下测得的薰衣草吸附干燥特性数据进行拟合,结果见表 3。
| 表 3 薰衣草干燥特性曲线数学模拟 Table 3 Mathematical simulation results of lavender drying curves |
由表 3可知,除了“Newton”、“Henderson and Pabis”模型外其他模型都能较好拟合实验结果,原因是模型的适用性与物质组织结构、成分和形状等有关。其中,M & K模型拟合薰衣草吸附干燥特性曲线有着较高的相关系数R2(0.9983)、较小的方差x2(2.0401×10-4)和均方差RMSE(2.6521×10-3)。
为了进一步考察M & K模型对薰衣草吸附干燥特性曲线模拟的适应性,本文选取7组薰衣草干燥特性数据,采用M & K模型分别对其进行模拟,模拟结果见表 4。
| 表 4 M & K模型拟合薰衣草干燥特性曲线 Table 4 Results of lavender drying curves fitted with M & K model |
由见表 4可见,M & K模型对7组干燥特性曲线拟合的相关系数R2均大于0.998,方差χ2和均方差RMSE分别小于0.0002、0.0029。这与对最优条件下薰衣草吸附干燥特性曲线拟合结果一致。
为了进一步验证M & K模拟薰衣草干燥特性的准确性,本文将表 4中7组干燥实验测得的(在不同干燥时间)薰衣草相对含水率(WRexp.)与M & K模型计算值(WRcalc.)进行了对比分析,结果见图 8。
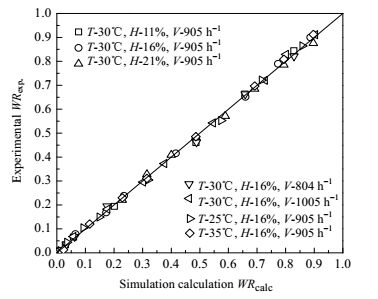
|
图 8 M & K模型计算值和实验值的比较 Fig.8 Comparison of WRcal results between M & K model and experiments (T-temperature, H-relative humidity, V-space velocity) |
由图 8可见,所有数据点均分布在对角线附近,其相关系数为0.9985。这表明实验值与M & K模型计算值相近,或者说,用M & K模型可较为准确模拟薰衣草吸附干燥过程中含水率与干燥时间的变化关系。
综上所述,M & K模型较适用于薰衣草吸附干燥特性曲线的模拟;在最优的吸附干燥实验条件下,薰衣草干燥过程动力学方程为:
| $WR = 0.9834\exp \left( { - 5.484 \times {{10}^{ - 4}} \times {t^{1.46}}} \right) - 6.2934t$ |
(1) 降低干燥介质相对湿度、提高干燥温度和干燥介质空速度,可提高薰衣草吸附干燥速率。干燥温度、干燥介质相对湿度及空速对薰衣草中总黄酮、芹菜素和木犀草素含量都有明显影响,相对湿度影响最大;木犀草素对干燥条件变化最为敏感。
(2) 空速和相对湿度是总黄酮含量的主要影响因素,空速对芹菜素含量影响最为显著,干燥温度是影响木犀草素含量的主要因素。薰衣草吸附干燥较适宜的工艺条件为:干燥温度30℃,相对湿度16%,空速905 h-1,在此条件下干燥薰衣草中总黄酮、芹菜素、木犀草素含量较高,分别为2.673%,0.976%,0.0245%。
(3) Midilli-kucuk模型较适用于薰衣草吸附干燥特性模拟。在较适宜干燥条件下,薰衣草吸附干燥过程动力学为:WR=0.9834exp(-5.484×10-4×t1.46) -6.2934t。
符号说明:
| a、b | —常数,无因次 | Wd | —干基含水率,g·g-1 |
| k、k1 | —模型干燥参数 | Wd0 | —试样初始含水率,g·g-1 |
| m | —试样质量,g | Wde | —试样最终含水率,g·g-1 |
| mw | —试样含水量,g | Wdt | —干燥一定时间(t,min)试样含水率,g·g-1 |
| n | —实验数据点个数 | WR | —相对含水率,g·g-1 |
| p | —模型中常数个数 | WRcalc | —相对含水率模型计算值,g·g-1 |
| R2 | —模型相关系数 | WRexp | —相对含水率实验值,g·g-1 |
| RSEM | —均方差 | χ2 | —方差 |
| t | —时间,min |
| [1] | SHAO Ting-ting(邵婷婷), WANG Hui-li(王会利), YAN Yu-xin(闫玉鑫), et al. Study of extraction and chemical components of volatile oil from lavandula dentate(齿叶薰衣草挥发油提取及化学成分研究)[J]. Yunnan Chemical Technology(云南化工) , 2015, 42(3): 14-16. |
| [2] | TONG Hong(童红), TANG Jun(唐军), ZHANG Zheng-fang(张正方). Optimization of microwave extraction process conditions of lavender essential oil by tesponse durface methodology(响应面法优化微波辅助水蒸气提取薰衣草挥发油的工艺研究)[J]. China Condiment(中国调味品) , 2013, 38(10): 61-65. DOI:10.3969/j.issn.1000-9973.2013.10.015. |
| [3] | Carrasco A, Ortiz-Ruiz V, Martinez-Gutierrez R, et al. Lavandula stoechas essential oil from Spain:aromatic profile determined by gas chromatography-mass spectrometry, antioxidant and lipoxygenase inhibitory bioactivities[J]. Industrial Crops and Products , 2015, 73: 16-27. DOI:10.1016/j.indcrop.2015.03.088. |
| [4] | Bajalan I, Pirbalouti A G. Variation in chemical composition of essential oil of populations of lavandula intermedia collected from Western Iran[J]. Industrial Crops and Products , 2015, 69: 344-347. DOI:10.1016/j.indcrop.2015.02.049. |
| [5] | WU Xia(吴霞), LIU Jing(刘净), YU Zhi-bin(于志斌), et al. Studies on flavones in of lavandula augusifolia(薰衣草中黄酮类化学成分的研究)[J]. China Journal of Chinese Materia Medica(中国中药杂志) , 2007, 32(9): 821-823. |
| [6] | Zhao J, Xu F, Huang H, et al. Evaluation on bioactivities of total flavonoids from lavandula angustifolia[J]. Pakistan Journal of Pharmaceutical Sciences , 2015, 28(4): 1245-1251. |
| [7] | Bai Y L, Duan J A, Su S L, et al. Analysis of dynamic changes of flavonoids and alkaloids during different drying process of lavender leaves[J]. Journal of Chinese Medicinal Materials , 2014, 37(7): 1158-1163. |
| [8] | Rabeta M S, Lin S P. Effects of different drying methods on the antioxidant activities of lavender leaves and berries of cayratia trifolia[J]. Sains Malaysiana , 2015, 44(2): 275-280. DOI:10.17576/jsm. |
| [9] | LIU Zhi-wei(刘志伟), ZHANG Chen(张晨), YU Ruo-qian(余若黔), et al. New low-temperature drying technology for food(食品低温干燥新技术)[J]. Modern Chemical Industry(现代化工) , 2000, 20(8): 62-63. |
| [10] | SUN Qing-mei(孙庆梅), ZHU Yue-zhao(朱跃钊), CHEN Hai-jun(陈海军), et al. Research of drying characteristics on the low-temperature adsorption drying of carrot(胡萝卜吸附式低温干燥特性的研究)[J]. Chinese Journal of Bioprocess Engineering(生物加工过程) , 2004, 2(3): 63-67. |
| [11] | LU Xiao-jiang(卢晓江), ZHU Ming-tian(朱明甜), ZHAO Xiao-jie(赵晓杰), et al. Adsorption drying mashed purple potatoes with zeolite under the vacuum condition(真空状态下沸石分子筛吸附干燥紫薯浆液的实验研究)[J]. Journal of Tianjin University of Science & Technology(天津科技大学学报) , 2015, 30(3): 67-71. |
| [12] | XU Jian(徐健), LI Ping-bo(李平波), ZHU Ya-mei(朱鸭梅), et al. Study on technical conditions of adsorption drying of angelica dahurica and their effects on microscopic feature of the angelica dahurica(吸附干燥工艺条件对川白芷有效成分及形貌影响的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2012, 26(3): 443-448. |
| [13] | Alikhan Z, Raghavan G SV, Mujumdar A S. Adsorption drying of corn iin zeolite granules using a rotary drum[J]. Drying Technology , 1992, 10(3): 783-797. DOI:10.1080/07373939208916475. |
| [14] | Seyhan F G, Evranuz Ö. Low temperature mushroom(A. bisporus) drying with desiccant dehumidifiers[J]. Drying Technology , 2010, 18(1 & 2): 433-445. |
| [15] | Djaeni M, G van Straten P, Bartels V, et al. Energy efficiency of multi-stage adsorption drying for low-temperature drying[J]. Drying Technology , 2009, 27(4): 555-564. DOI:10.1080/07373930802715682. |
| [16] | State Pharmacopoeia Commission of the People's Republic of China (中华人民共和国国家药典委员会). China pharmacopoeia(1st edition) (中国药典(一部))[S]. Beijing (北京): Chem Eng Press (化学工业出版社), 2005: 69. |
| [17] | DAI Xin-ye (戴欣烨). Study on lavender adsorption drying and system conceptual design (薰衣草吸附干燥过程研究及系统概念设计)[D]. Nanjing (南京): Nanjing Tech University (南京工业大学), 2015. |
| [18] | MENG Fan-mei(孟繁妹), LIU Quan-you(刘权友), GAO Dong-li(高东立), et al. Determination of quercetin, apigenin and luteolin in violayedoensis makino by RP -HPLC(HPLC法测定紫花地丁中槲皮素、芹菜素、木犀草素含量)[J]. Drug Standards of China(中国药品标准) , 2011, 12(1): 48-49. |
| [19] | LIU Shuai-tao(刘帅涛), TAO Hui-lin(陶慧林), LI Jin-yan(李锦艳). Structure-activity relationship of four flavonoids on scavenging activities to DPPH free radical(4种黄酮小分子对DPPH自由基的清除作用及构效关系研究)[J]. Journal of Instrumental Analysis(分析测试学报) , 2012, 31(1): 71-75. |
| [20] | CHEN Jian-zhong(陈建中), GE Shui-lian(葛水莲), ZAN Li-feng(昝立峰), et al. The antioxidant activity and its stability of total flavonoids from chrysanthemum coronarium L(茼蒿总黄酮抗氧化活性及稳定性研究)[J]. Food Science and Technology(食品科技) , 2015(8): 217-222. |
| [21] | WANG Wei-qian(王维茜), DENG Jie-hong(邓洁红), WEI-Yi-zhi (魏一枝), et al. Research progress on synthesis and stability of grape anthocyanins(葡萄花色苷的合成及稳定性研究进展)[J]. China Brewing(中国酿造) , 2014, 33(5): 10-14. |
| [22] | XIAO Hong-wei(肖红伟), ZHANG Shi-xiang(张世湘), BAI Jun-wen(白竣文), et al. Air impingement drying characteristics of apricot(杏子的气体射流冲击干燥特性)[J]. Transactions of the CSAE(农业工程学报) , 2010(7): 318-323. |
| [23] | HUANG Yan(黄艳), HUANG Jian-li(黄建立), ZHENG Bao-dong(郑宝东). Microwave vacuum drying properties and kinetics model of white fungus(银耳微波真空干燥特性及动力学模型)[J]. Transactions of the CSAE(农业工程学报) , 2010(4): 362-367. |
| [24] | YU Wen-sheng(余文胜), WANG Jun(王俊). Studies on the microwave drying characteristics and mathematical model of water-oat(茭白微波干燥特性及数学模型的研究)[J]. Bulletin of Science and Technology(科技通报) , 2009, 25(5): 654-658. |
| [25] | Nawirska A, Figiel A, Kucharska A Z, et al. Drying kinetics and quality parameters of pumpkin slices dehydrated using different methods[J]. Journal of Food Engineering , 2009, 94(1): 14-20. DOI:10.1016/j.jfoodeng.2009.02.025. |
| [26] | Zhu J F, Liu J Z, Wu J H, et al. Thin-layer drying characteristics and modeling of Ximeng lignite under microwave irradiation[J]. Fuel Processing Technology , 2015, 130: 62-70. DOI:10.1016/j.fuproc.2014.09.033. |




