2. 安徽大学 文典学院, 安徽 合肥 230601
2. School of Wendian, Anhui University, Hefei 230601, China
偶氮染料如甲基橙(methyl orange, MO)广泛用于印刷、纺织、造纸等工业[1],在生产过程中产生大量含染料废水。染料废水处理不当将对人类健康和生态环境造成严重影响。如染料分子进入人体后将被转化为芳香烃,具有导致肠道癌症的可能性[2]。而染料甲基橙溶于水体导致水体颜色改变,减少光线进入水体量,降低水中生物的光呼吸能力,最终导致生物的生长受到影响,生态环境被破坏[3]。目前开发的降解甲基橙技术包括光催化反应、超声波技术、微波技术、电化学法以及微生物降解法[4-6],这些技术各有优点,微生物降解法具有工艺简单、处理成本低和易规模化的优点,是处理染料废水常用技术之一。
希瓦氏菌属的菌株是一类兼性厌氧菌,广泛存在于海洋与淡水。目前已发现40余种菌株,其中具有胞外电子传递能力的菌株常用来还原多种电子受体,如偶氮染料,卤化有机物,NO3-、NO2-、S2O32-、SO32-等无机化合物,Mn(Ⅳ)、Fe(Ⅲ)、Cr(Ⅵ)等重金属离子,以及Tc、U、Pu等放射性核素[7-8]。同时由于希瓦氏菌属菌株具有细胞外电子传递[9-10]和形成生物膜的能力,因此希瓦氏菌属菌株也被用于微生物燃料电池(MFC)中,完成废水处理的同时实现能源回收[11-12]。Shewanella oneidensis MR-1是希瓦氏菌属中研究最多的菌株,研究表明:S. oneidensis MR-1在乳酸盐作为电子供体的条件下具有良好的降解甲基橙的能力[13]。而其他希瓦氏菌属菌株在环境和能源领域的应用有待开发。
分离自海洋的Shewanella algae CCU101隶属希瓦氏菌属,具有区别于S. oneidensis MR-1菌株的一些特性。如,S. algae CCU101有更高的盐离子耐受能力[14],能够产生H2S[15],能够以乙酸作为电子供体支持Mn(Ⅲ)还原[16]。S. algae CCU101在微生物燃料电池中以有机酸作为电子供体实现高效的电流输出,表明S. algae CCU101具有较强的胞外电子传递能力[17]。此外,S. algae CCU101有较强的形成生物膜的能力[18],有利于实现工程应用中菌体的自絮凝。
目前,对S. algae CCU101还原染料的性能尚未见报道。因此,本研究对S. algae CCU101还原偶氮染料甲基橙的性能及影响因素进行了研究,并与S. oneidensis MR-1的还原能力进行对比。
2 实验(材料与方法) 2.1 材料Shewanella algae CCU101:购自海洋微生物菌种管理保藏中心MCCC。
主要试剂:甲基橙、磷酸氢二钾、磷酸二氢钾、氯化钠、硫酸铵、七水合硫酸钾、磷酸氢二钠、磷酸二氢钠均购自天津市永大化学试剂有限公司。酵母提取物、胰蛋白胨和乳酸(Lactic acid)购自西陇化工有限公司。所有化学试剂均为分析纯。
2.2 培养基的配制矿物盐培养基:质量浓度为0.225 g·L-1磷酸氢二钾、0.225 g·L-1磷酸二氢钾、0.46 g·L-1氯化钠、0.255 g·L-1硫酸铵、0.024 g·L-1七水合硫酸钾、3.46 g·L-1磷酸氢二钠、1.87 g·L-1磷酸二氢钠和5 mL·L-1微量元素。
LB培养基:质量浓度为10 g·L-1胰蛋白胨、5 g·L-1酵母提取物和10 g·L-1氯化钠。
2.3 菌液的制备S. algae CCU101和S. oneidensis MR-1菌液均按以下方法制备:将保藏菌种转接入50 mL液体LB培养基中,在温度为30 ℃和转速为150 r·min-1的摇床中培养16~18 h。通过离心和用矿物盐培养基洗菌3次去除LB培养基成分。最后用矿物盐培养基稀释获得所需浓度的菌液。
2.4 甲基橙降解实验将30 mL矿物盐培养基加入50 mL厌氧瓶中,使用丁基胶塞和铝盖封口,通氮气10 min以去除溶液中的氧气。在121 ℃下高温高压灭菌20 min。厌氧瓶冷却至室温后,使用一次性无菌注射器分别注入无菌甲基橙溶液、无菌乳酸钠溶液和菌液。将装有甲基橙、乳酸钠、菌液和培养基的厌氧瓶放入30 ℃和150 r·min-1的摇床中进行甲基橙降解实验。每隔0.5 h从厌氧瓶中取样分析甲基橙质量浓度。每类实验设置3个平行组。
固定反应体系的菌液吸光度OD600=0.5和乳酸钠浓度为0.05 mol·L-1,改变甲基橙质量初始浓度为100、150、200、250、300 mg·L-1,研究甲基橙初始质量浓度对S. algae CCU101降解甲基橙的影响。
固定甲基橙初始质量浓度为100 mg·L-1和乳酸钠浓度为0.05 mol·L-1,改变OD600为0.1、0.2、0.3、0.4、0.5,研究OD600对S. algae CCU101降解甲基橙的影响。
固定甲基橙初始质量浓度为100 mg·L-1和OD600=0.5,改变电子供体乳酸钠浓度为0.012 5、0.025 0、0.050 0、0.075 0、0.100 0 mol·L-1,研究电子供体乳酸钠浓度对S. algae CCU101降解甲基橙的影响。
固定甲基橙初始质量浓度为100 mg·L-1、乳酸钠浓度为0.05 mol·L-1和OD600=0.5,向厌氧瓶中分别加入1.0和0.1 mmol·L-1这2种浓度的Cu2+、Mg2+、Fe3+,研究金属离子浓度对S. algae CCU101还原甲基橙的影响。
2.5 分析与测试方法菌体浓度测定:将菌液接种至灭菌液体LB培养基,置于30 ℃和150 r·min-1摇床中,每间隔1 h取样测量溶液的OD600。
甲基橙质量浓度测定:从厌氧瓶中取出1 mL溶液放入离心管中,以10 000 r·min-1离心1 min,离心后取上清液并稀释至适当浓度。采用分光光度计(UV-2600,日本岛津)测定溶液在465 nm波长处的吸光度,对照标准曲线计算得到甲基橙质量浓度。
菌液生长曲线的测定:向含有LB培养基的厌氧瓶中接入少量菌液,测定接入菌液后LB培养基在600 nm波长处吸光度。然后将厌氧瓶放置在30 ℃和150 r·min-1的摇床中培养4 h,每隔1 h取样一次,测定溶液样在600 nm波长处吸光度。在本实验中,均采用LB液体培养基在600 nm波长处吸光度为校零值。
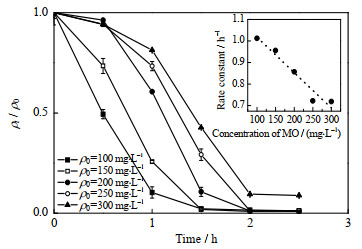
3 结果与分析 3.1 甲基橙初始质量浓度对S. algae CCU101降解甲基橙的影响S. algae CCU101降解不同初始质量浓度甲基橙的降解曲线如图 1所示,图中,ρt为t时间时培养基中甲基橙的质量浓度,ρ0为甲基橙初始质量浓度,ρt / ρ0为在t时间时,培养基中甲基橙质量浓度与甲基橙初始质量浓度的比值。从图中可以看出,当甲基橙初始质量浓度为100~250 mg·L-1时,甲基橙的降解率(1-ρt / ρ0)×100%均达到91%~98%,表明S. algae CCU101能有效降解甲基橙。气相色谱质谱联用仪(GC-MS)分析结果表明,甲基橙的降解产物主要为对氨基二甲基苯胺。此外,甲基橙的降解均呈现一段线性降解区间,表明甲基橙的降解主要为一级反应。当甲基橙初始质量浓度为100 mg·L-1时,甲基橙的降解从开始试验就呈现一级反应,其反应速率常数为1.012 2 h-1。当甲基橙初始质量浓度增加时,甲基橙的降解开始呈现一段缓慢降解时间,而后才呈现一级反应,且随着甲基橙初始质量浓度从150增加到300 mg·L-1,甲基橙降解的初期非一级反应的降解时间延长,其一级反应的速率常数也逐渐从1.012 2降低到0.719 4 h-1。以上结果表明:甲基橙初始质量浓度虽然不影响S. algae CCU101降解甲基橙的机理,但影响甲基橙的降解动力学。高初始质量浓度甲基橙抑制S. algae CCU101细胞内生理生化反应,导致细胞外电子传递速率和繁殖速率下降。
|
图 1 甲基橙初始质量浓度对S. algae CCU101降解甲基橙的影响 Fig.1 Effects of initial concentration of MO on the degradation of MO by S.algae CCU101 |
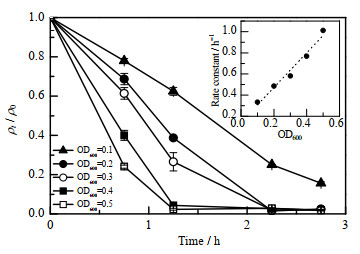
如图 2所示为菌液吸光度对甲基橙降解率的影响。从图中可以看出,在所分析的菌液吸光度范围内,S. algae CCU101降解甲基橙呈一级反应,反应速率常数随菌液吸光度的增加而增加。当OD600=0.1时,甲基橙降解速率常数为0.333 6 h-1,当OD600=0.5时,甲基橙降解速率常数为1.012 2 h-1,相对于OD600=0.1,甲基橙降解速率常数增加了203%。当OD600=0.1时,甲基橙的降解率仅为84%,而当OD600=0.2~0.5时,2 h内甲基橙的降解率达到98%。
|
图 2 OD600对S.algae CCU101降解甲基橙的影响 Fig.2 Effects of OD600 on the degradation of MO by S.algae CCU101 |
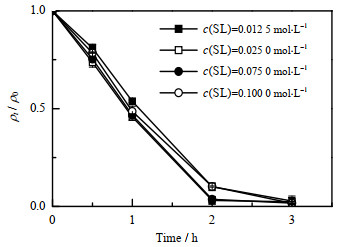
如图 3所示为电子供体乳酸钠浓度c(SL)对甲基橙降解的影响。从图中可以看出,乳酸钠浓度对甲基橙降解影响不大。根据计算拟合曲线,当乳酸钠浓度为0.012 5 mol·L-1时,甲基橙降解速率常数为0.456 4 h-1。当乳酸钠浓度增加到0.025 0和0.075 0 mol·L-1时,甲基橙降解速率常数接近,降解速率常数为0.485 3±0.001 5 h-1。当乳酸钠浓度进一步增加到0.100 0 mol·L-1时,甲基橙降解速率常数稍有减少,降解速率常数为0.454 4 h-1。结果表明:适当的电子供体浓度对甲基橙降解有利。
|
图 3 电子供体浓度对S.algae CCU101降解甲基橙的影响 Fig.3 Effects of electron donor on MO degradation by S.algae CCU101 |
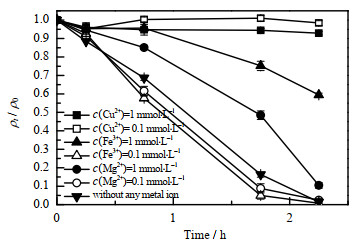
如图 4所示为金属离子浓度c(Cu2+)、c(Fe2+)、c(Mg2+)对S. algae CCU101降解甲基橙产生显著影响图,添加浓度为0.1 mmol·L-1 Fe3+或Mg2+,会促进甲基橙降解,根据计算拟合曲线,其甲基橙降解速率常数从0.452 8增加到0.576 2或0.545 8 h-1。当Fe3+或Mg2+浓度增加到1 mmol·L-1时,Fe3+或Mg2+会抑制甲基橙的降解,其甲基橙降解速率常数下降至0.204 7或0.315 8 h-1。低浓度的Fe3+促进甲基橙降解可能与Fe3+改善S. algae CCU101的胞外电子传递能力有关,而高浓度的Fe3+抑制甲基橙降解是由于Fe3+作为电子受体与甲基橙竞争呼吸作用产生的电子。已有研究表明,S. oneidensis MR-1能利用铁硫化合物的纳米结构增加电子传递能力。同时,S. oneidensis MR-1具有铁还原呼吸链,可通过PsrA、PsrB、PsrC蛋白将电子传递到细胞外表面,但过高浓度Fe3+会成为电子受体,导致Fe3+被还原成为Fe2+,由于Fe3+离子和降解反应中甲基橙竞争获取电子,最终使S. oneidensis MR-1还原甲基橙效率下降[19]。Mg2+浓度对甲基橙降解的影响可能与Mg2+能改变细胞内蛋白而影响细菌生长速度有关。研究发现[20]:与希瓦氏菌同属于变形菌门的沙门氏菌有mgtB、mgtCB等蛋白,此类蛋白的活性与Mg2+浓度有关,在不同Mg2+浓度的环境中,沙门氏菌生长速度不同,10 mmol·L-1 Mg2+环境中菌株生长速度快于10 μmol·L-1 Mg2+。由此推测:低浓度Mg2+可能促进S. algae CCU101的蛋白活性,而高浓度Mg2+可能抑制S. algae CCU101的蛋白活性,从而影响甲基橙的降解速度。
|
图 4 金属离子浓度对S.algae CCU101降解甲基橙的影响 Fig.4 Effects of metal ions on MO degradation by S.algae CCU101 |
Cu2+显著抑制甲基橙的降解,无论是添加低浓度或者高浓度Cu2+时,甲基橙几乎不被降解。Cu2+抑制S. algae CCU101降解甲基橙可能与Cu2+能结合电子呼吸链中Fe-S蛋白,对细胞产生毒性有关。此外,Cu2+对氢酶也有毒害作用,而希瓦氏菌的氢酶在多种金属离子的还原中发挥作用。这种Cu2+毒性作用在其他具有胞外电子传递能力的细菌如硫酸盐还原细菌已被证[21]。研究发现:在浓度为6 mol·L-1 Cu2+的培养基中,硫酸盐还原细菌的生长速率降低了25%,与之对应细胞蛋白也降低了18% 到35%。因此,Cu2+对甲基橙降解的抑制作用暗示S. algae CCU101中的Fe-S蛋白或氢酶参与甲基橙降解。
3.5 与S. oneidensis MR-1的比较如图 5所示为S. algae CCU101与S. oneidensis MR-1降解甲基橙性能和生长曲线。在图 5(a)中,当甲基橙初始质量浓度为100 mg·L-1时,S. algae CCU101在1.5 h内的降解率为98%,而S. oneidensis MR-1在1.5 h的降解率为82.41%。S. oneidensis MR-1降解甲基橙的速率常数为0.646 8 h-1,比S. algae CCU101低36%。当甲基橙初始质量浓度增加到200 mg·L-1时,在降解初期,S. algae CCU101降解甲基橙的速率常数低于S. oneidensis MR-1,而在0.5 h后,S. algae CCU101降解甲基橙的速率常数显著增加。虽然S. oneidensis MR-1在1 h后降解甲基橙的速度也明显增加,但其降解速率常数仍比S. algae CCU101低24% (0.652 0 h-1对0.857 1 h-1)。当甲基橙初始质量浓度为300 mg·L-1时,在1 h内,S. algae CCU101降解速度低于S. oneidensis MR-1,但在1 h后,S. algae CCU101降解甲基橙速度开始显著增加,在2 h时内甲基橙降解率达到91%。而S. oneidensis MR-1在0~2.5 h内降解甲基橙呈线性增加,2.5 h内甲基橙的降解率仅70%,其降解速率常数也仅为0.264 6 h-1,比S. algae CCU101降解甲基橙速率常数低63%。
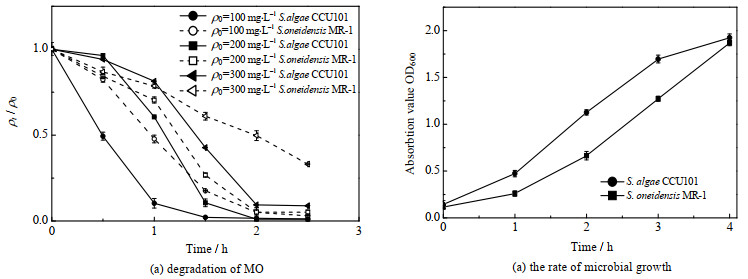
|
图 5 希瓦氏菌S. algae CCU101与S. oneidensis MR-1的比较 Fig.5 Performance comparison of S. algae CCU101 and S. oneidensis MR-1 |
在相同条件下,无论是对高质量浓度还是对低质量浓度甲基橙,S. algae CCU101降解甲基橙速率常数均比S. oneidensis MR-1大。图 5(b)为2种菌的生长曲线。从图中可以看出,S. algae CCU101的生长速度明显快于S. oneidensis MR-1。且在生长过程中,观察到S. algae CCU101的菌液呈絮状和在厌氧瓶壁上有挂膜现象,说明S. algae CCU101具有强的繁殖、易团聚和成膜能力。
4 结论S. algae CCU101能有效降解初始质量浓度为100~300 mg·L-1的甲基橙,其甲基橙降解率达到91%~98%。高于模式菌株S. oneidensis MR-1。
S. algae CCU101对甲基橙的降解符合一级反应动力学,降解速率常数受甲基橙初始质量浓度、菌液吸光度、电子受体和重金属离子浓度的影响。甲基橙初始质量浓度越低或菌液吸光度越高,降解速率越快;在测试浓度范围内,电子供体乳酸钠浓度对甲基橙降解速率影响不大。重金属离子浓度对S. algae CCU101降解甲基橙产生显著影响。低浓度Fe3+或Mg2+(0.1 mmol·L-1)促进甲基橙降解,而Cu2+或高浓度Fe3+或Mg2+(1 mmol·L-1)显著抑制S. algae CCU101降解。
S. algae CCU101具有快的生长速度、易于聚集和在器壁挂膜生长特性,有望在处理染料废水和生物电化学等方面得到应用。
| [1] |
NEETHU N, CHOUDHURY T. Treatment of methylene blue and methyl orange dyes in wastewater by grafted titania pillared clay membranes[J]. Recent Patents on Nanotechnology, 2018, 12(3): 200-207. DOI:10.2174/1872210512666181029155352 |
| [2] |
NI Z M, XIA S J, WANG L G, et al. Treatment of methyl orange by calcined layered double hydroxides in aqueous solution: Adsorption property and kinetic studies[J]. Journal of Colloid and Interface Science, 2007, 316(2): 284-291. DOI:10.1016/j.jcis.2007.07.045 |
| [3] |
HUANG J H, HUANG K L, LIU S Q, et al. Adsorption of Rhodamine B and methyl orange on a hypercrosslinked polymeric adsorbent in aqueous solution[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2008, 330(1): 55-61. |
| [4] |
王保伟, 彭叶平, 姚淑美. 降膜介质阻挡放电等离子体降解甲基橙研究[J]. 高校化学工程学报, 2018, 32(5): 1203-1209. WANG B W, PENG Y P, YAO S M. Degradation of methyl orange using falling film dielectric barrier discharge plasma[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(5): 1203-1209. DOI:10.3969/j.issn.1003-9015.2018.05.028 |
| [5] |
陈思, 胡腾飞, 于永波, 等. 硫掺杂石墨烯电催化降解有机染料甲基橙[J]. 化工进展, 2021, 40(1): 550-558. CHEN S, HU T F, YU Y B, et al. Electrocatalytic degradation of organic dye methyl orange by sulfur-doped graphene[J]. Chemical Industry and Engineering Progress, 2021, 40(1): 550-558. |
| [6] |
张静玉, 苑蕾. 偶氮染料甲基橙的降解研究综述[J]. 山东化工, 2017, 46(6): 157-158. ZHANG J Y, YUAN L. Research on the degradation of azo dye methyl orange[J]. Shandong Chemical Industry, 2017, 46(6): 157-158. DOI:10.3969/j.issn.1008-021X.2017.06.062 |
| [7] |
肖翔, 吴勇民, 徐灿灿, 等. 金属还原菌希瓦氏菌厌氧呼吸能力及其在环境修复中的研究进展[J]. 微生物学通报, 2012, 39(11): 1677-1686. XIAO X, WU Y M, XU C C, et al. Anaerobic respiratory capabilities of a metal-reducing microorganism Shewanella and its application in environmental remediation[J]. Microbiology, 2012, 39(11): 1677-1686. |
| [8] |
WATTS M P, COKER V S, PARRY S A, et al. Effective treatment of alkaline Cr(Ⅵ) contaminated leachate using a novel Pd-bionanocatalyst: Impact of electron donor and aqueous geochemistry[J]. Applied Catalysis B: Environmental, 2015(170/171): 162-172. |
| [9] |
沈楠. 厌氧微生物体系中还原力的产生及其应用[D]. 合肥: 中国科学技术大学, 2014. SHEN N. The production and application of reducing power in the anaerobic microorganism systems[D]. Hefei: University of Science and Technology of China, 2014. |
| [10] |
吴勇民. 产电细菌Shewanella oneidensis MR-1对磺化三苯甲烷染料苯胺蓝的脱色降解及其机制研究[D]. 镇江: 江苏大学, 2013. WU Y M. Decolorization of sulfonated triphenylmethane dye aniline blue by exoelectrogenic bacterium Shewanella oneidensis MR-1 and its mechanism[D]. Zhenjinag: Jiangsu University, 2013. |
| [11] |
LANTHIER M, GREGORY K B, LOVLEY D R. Growth with high planktonic biomass in Shewanella oneidensis fuel cells[J]. FEMS Microbiology Letters, 2008, 278(1): 29-35. DOI:10.1111/j.1574-6968.2007.00964.x |
| [12] |
黄亦馨, 李晓, 赵津莹, 等. 一株耐盐产电菌Shewanella algae E-1的分离及其产电特性分析[J]. 微生物学通报, 2020, 47(2): 351-361. HUANG Y X, LI X, ZHAO J Y, et al. Isolation and characterization of a salt-tolerant exoelectrogenic strain Shewanella algae E-1[J]. Microbiology, 2020, 47(2): 351-361. |
| [13] |
CAI P J, XIAO X, HE Y R, et al. Anaerobic biodecolorization mechanism of methyl orange by Shewanella oneidensis MR-1[J]. Applied Microbiology and Biotechnology, 2012, 93(4): 1769-1776. DOI:10.1007/s00253-011-3508-8 |
| [14] |
FU X, WANG D, YIN X, et al. Time course transcriptome changes in Shewanella algae in response to salt stress[J]. PLoS One, 2014, 9(5): e96001. DOI:10.1371/journal.pone.0096001 |
| [15] |
HOLT H M, GAHRN-HANSEN B, BRUUN B. Shewanella algae and Shewanella putrefaciens: clinical and microbiological characteristics[J]. Clinical Microbiol and Infection, 2005, 11(5): 347-352. DOI:10.1111/j.1469-0691.2005.01108.x |
| [16] |
SZEINBAUM N, LIN H, BRANDES J A, et al. Microbial manganese(Ⅲ) reduction fuelled by anaerobic acetate oxidation[J]. Environmental Microbiology, 2017, 19(9): 3475-3486. DOI:10.1111/1462-2920.13829 |
| [17] |
INOHANA Y, KATSUYA S, KOGA R, et al. Shewanella algae relatives capable of generating electricity from acetate contribute to coastal-sediment microbial fuel cells treating complex organic matter[J]. Microbes and Environments, 2020, 35(2): 1-7. |
| [18] |
MARTIN-RODRIGUEZ A J, REYES-DARIAS J A, MARTIN-MORA D, et al. Reduction of alternative electron acceptors drives biofilm formation in Shewanella algae[J]. NPJ and Biofilms Microbiomes, 2021, 7(1): 9. DOI:10.1038/s41522-020-00177-1 |
| [19] |
黄建福. 希瓦氏菌铁还原和胞外电子传递的转录组研究[D]. 南京: 东南大学, 2018. HUANG J F. Transcriptome analysis on iron reduction and extracellular electron transfer of S. oneidensis MR-1[D]. Nanijian: Southeast University, 2018. |
| [20] |
MONCRIEF M, MAGUIRE M E J I, IMMUNIT Y. Magnesium and the role of mgtC in growth of Salmonella typhimurium[J]. Infection and Immunity, 1998, 66(8): 3802-3809. DOI:10.1128/IAI.66.8.3802-3809.1998 |
| [21] |
SANI R K, PEYTON B M, BROWN L T, et al. Copper-induced inhibition of growth of desulfovibrio desulfuricans G20:Assessment[J]. Applied and Environmental Microbiology, 2001, 67(10): 4765-4765. DOI:10.1128/AEM.67.10.4765-4772.2001 |




