2. 安徽六国化工股份有限公司,安徽 铜陵 244000
2. Anhui Liuguo Chemical Co., Ltd., Tongling 244000, China
半水硫酸钙晶须 (CaSO4·0.5H2O) 是潜在的强化材料,可作为阻燃材料[1], 纳米纤维[2~4],晶须[5]和微型管[6]等,在医学方面有优越的生物相容性和骨传导性[7]。研究表明[8, 9],高长径比的晶须有助于提高机械性能。
在制备硫酸钙晶须的过程中,金属离子对于结晶有很大的影响。K+和Na+[10]等金属离子在低浓度范围内随浓度增大,得到的晶须长径比增大;当浓度增大到一定值时会抑制晶须长径比。在二价离子中Mg2+[11]会优先吸附在半水硫酸钙晶须的 (200), (400) 和 (020) 晶面,而且Mg2+的吸附和掺杂会提高α-CaSO4·0.5H2O晶须的一维生长,最终生成高长径比的晶须;同时Mg2+[12]的吸附和取代对α-CaSO4·0.5H2O晶须生长影响的研究,结果显示由于静电作用Mg2+会优先吸附在 (200) 晶面,且Mg2+的取代能量最低,最终α-CaSO4·0.5H2O晶须会沿着c轴生长,沿直径方向的生长会受到抑制。低浓度的Cu2+[10]存在会显著增加结晶产物的长度。Al3+[13]增加到2%时会减少诱导时间,增加晶粒的平均直径。在盐酸水溶液体系中低浓度Fe3+[10]会降低晶须长径比,较高浓度Fe3+会诱导从半水向二水硫酸钙晶型的转变。金属离子添加剂,可作为晶型控制剂提高长径比或减小长径比。
本文主要研究水热法制备α-CaSO4·0.5H2O晶须过程中Al3+的掺杂和吸附影响,并探讨相关机理。鉴于Al3+是磷石膏重要组成成分,利用CaSO4·2H2O制备α-CaSO4·0.5H2O,通过往体系添加Al3+可以研究其对制备晶须的影响,为磷石膏水热法制备晶须提供参考。
2 实验 (材料和方法) 2.1 实验试剂及设备主要试剂:CaSO4·2H2O,AR;Al2(SO4)3∙18H2O,AR;国药集团药业股份有限公司。
主要设备:WHF-0.5型反应釜,威海自控反应釜有限公司,釜体体积0.5 L,直径65 mm, 内置温度传感器、螺旋式三叶搅拌桨,桨片直径50 mm,螺旋冷凝管,外置取样口和泄压阀。
2.2 实验方法300 mL去离子水先预热至55℃与一定量CaSO4·2H2O混合均匀后加入反应釜,加入称量的Al2(SO4)3∙18H2O溶于混合浆液,分别配制溶液中Al3+浓度为4.50×10-3和9.03×10-3mol∙L-1,以60 r∙ min-1搅拌速率,以升温速率2.5℃∙min-1升温至130℃,保持恒温1.5 h, 取样趁热过滤。过滤得固相用乙醇洗涤,在45℃干燥8 h用于表征和分析。
2.3 测试和表征方法微观形貌采用场发射扫描电子显微镜观测,晶须表面元素分布通过EDS分析,SU8020型,日本株式会社日立制作所;
场发射透射电子显微镜用于辅助观测晶须微观形貌和晶体结构,JEM-2100F,日本电子株式会社;
物相组成采用X射线衍射仪表征,X'Pert PRO MPD, 荷兰帕纳科公司;
元素结合能采用X射线光电子能谱测定,ESCALAB250Xi, 美国赛默飞世尔科技公司。
3 结果与讨论 3.1 水热条件参数优化以α-CaSO4·0.5H2O的平均长径比为目标参数,选取水热温度、搅拌速率、反应时间和料浆浓度4个主要参数设计正交试验,见表 1。
| 表 1 正交试验 Table 1 Design of the orthogonal experimental study |
由表 1可得出优化参数为水热温度130℃、搅拌速率60 r∙min-1、反应时间90 min和料浆浓度2%。
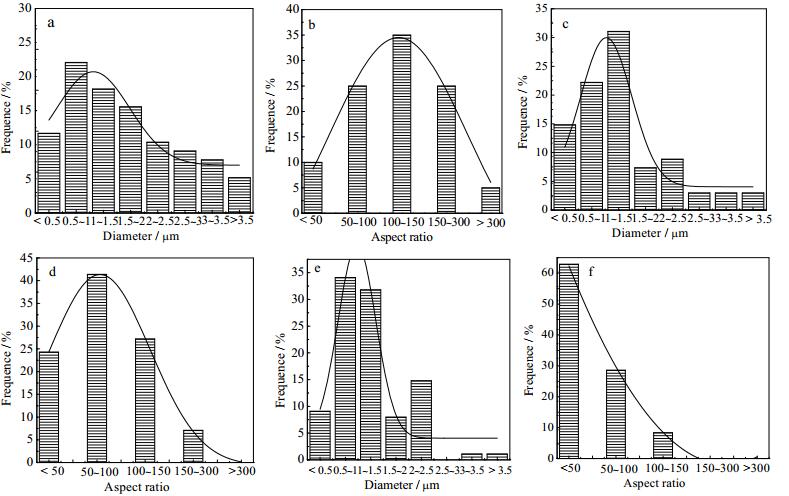
3.2 Al3+对晶须形貌和长径比的影响在表 1的优化参数下 (水热温度130℃、搅拌速率60 r∙min-1、反应时间90 min和料浆浓度2%) 添加不同浓度Al3+对α-CaSO4·0.5H2O晶须形貌的影响如图 1所示。晶须的直径和长径比分布区间如图 2所示。

|
图 1 α-CaSO4·0.5H2O晶须SEM图 Fig.1 SEM micrographs of α-CaSO4·0.5H2O whiskers a, d. [Al3+] = 0 b, e, g. [Al3+] = 4.50×10-3 mol·L-1 c, f. [Al3+] = 9.03×10-3 mol·L-1 |
|
图 2 α-CaSO4·0.5H2O晶须直径和长径比区间分布图 Fig.2 Diameter and aspect ratio distributions of α-CaSO4·0.5H2O whiskers a. [Al3+] = 0 b. [Al3+] = 4.50×10-3 mol·L-1 c. [Al3+] = 9.03×10-3 mol·L-1 |
从图 1可见,在溶液Al3+浓度逐渐增大的过程中,晶须表面由光滑无附着物变成表面吸附很多小颗粒, 且晶须长度缩短 (图 1a,1b,1c),直径变小 (图 1d,1e,1f),与图 2a,2c,2e直径分布趋势对应。此外,图 2b,2d,2f所示晶须长径比随溶液Al3+浓度增大而减小,表明晶须在长度方向的生长抑制程度大于直径方向,而Rashad[13]实验结果表明,体系中Al3+增加到2%时,晶体的平均直径增大,并非是晶体在长度方向的生长抑制程度大于直径方向。虽然最终Al3+的引入均使晶体长径比减小,但有本质差异。
TEM和SAED用来更加细致的观察晶体形貌和晶须结构。图 1g所示为一根晶须的局部形貌和电子衍射花样图,结果显示平行于生长方向的晶格条纹的间距为3.4232Å ,与α-CaSO4·0.5H2O晶须 (020) 晶面 (d (020) = 3.4674 Å ) 间距大小相近,说明晶格条纹对应于晶须 (020) 晶面,生成的晶须为单晶。
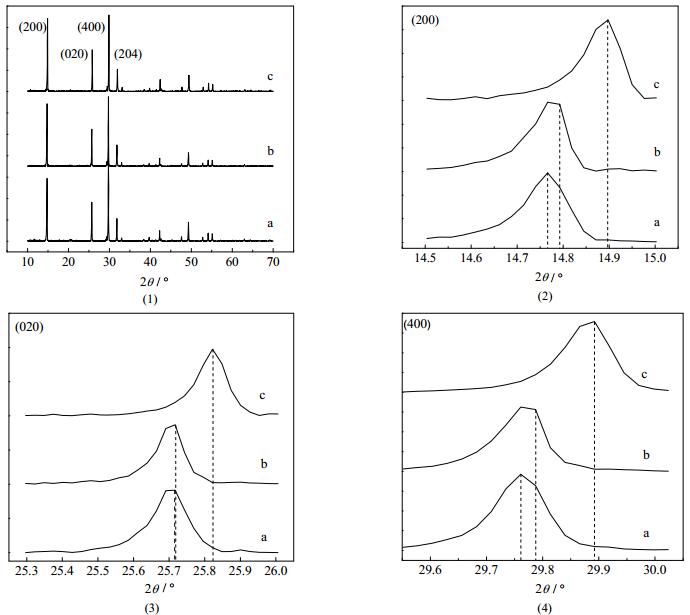
3.3 Al3+对晶须晶面间距的影响不同Al3+浓度条件下制备的晶须XRD图谱见图 3。其中图 3(1)为晶须XRD全谱图,图 3(2),3(3),3(4) 分别表示 (200),(020) 和 (400) 晶面XRD图。
|
图 3 α-CaSO4·0.5H2O晶须XRD图谱 Fig.3 XRD patterns of α-CaSO4·0.5H2O whiskers a. [Al3+] = 0 b. [Al3+] = 4.50×10-3 mol·L-1 c. [Al3+] = 9.03×10-3 mol·L-1 |
图 3(1)中XRD特征衍射峰与α-CaSO4·0.5H2O相对应,可以得知Al3+的存在不会诱导生成除α-CaSO4·0.5H2O外的其他晶型。Al3+浓度分别为0、4.50×10-3和9.03×10-3mol∙L-1时,图 3(2)显示 (200) 晶面特征峰2θ从14.766˚增加到14.793˚再增加至14.897˚,图 3(3)说明 (020) 晶面特征峰2θ从25.716˚增加到25.719˚再增加至25.822˚,图 3(4)显示 (400) 晶面特征峰2θ从29.760˚增加到29.788˚再增加至29.893˚。相关晶面间距大小见表 2。
| 表 2 不同晶面的晶面间距 Table 2 Interplanar spacing on different planes |
表 2表明晶面间距减小导致特征峰位置偏移。主要是由于Al3+半径 (0.535Å ) 小于Ca2+半径 (1.00Å ),很容易进入α-CaSO4·0.5H2O晶格的间隙位置,而不是取代Ca2+。相关研究表明[10],在硫酸钙晶体中微量的Na+能取代Ca2+,并随溶液中Na+浓度的增加取代量略有增大,可能是由于它们的离子半径接近,即使它们电荷量不同[14, 15]。而Al3+和Ca2+离子半径相差大,难以发生取代。离子带电荷量和半径是决定离子发生取代或掺入晶格间隙的两个重要的影响因素[16]。为进一步证实Al3+没有取代Ca2+,采用XPS图谱进一步分析。
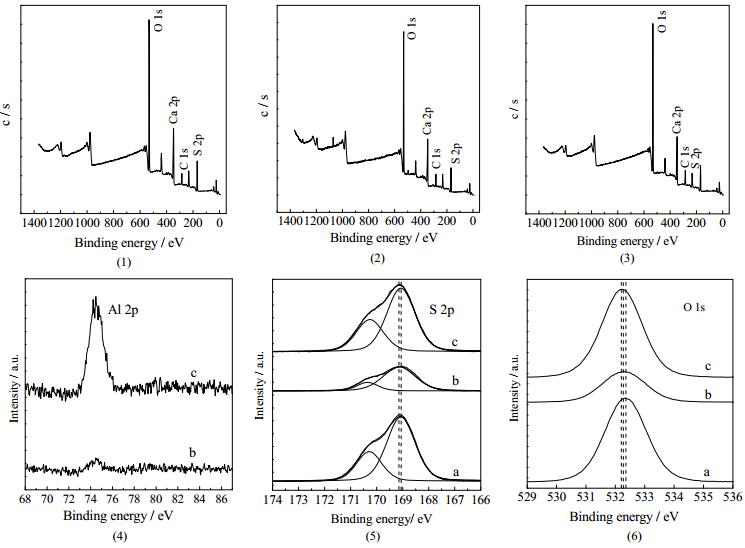
图 4(1)表示溶液中没有添加Al3+,4(2) 和4(3) 分别表示溶液Al3+浓度为4.50×10-3和9.03×10-3mol∙L-1下的α-CaSO4·0.5H2O晶须的XPS全谱图。从全谱图看没有明显区别,故分析Al、S和O的单元素谱图。
|
图 4 α-CaSO4·0.5H2O晶须的XPS谱图 Fig.4 Effects of Al3+ on XPS spectra of α-CaSO4·0.5H2O whiskers a. [Al3+] = 0 b. [Al3+] = 4.50×10-3 mol·L-1 c. [Al3+] = 9.03×10-3 mol·L-1 |
图 4(4)显示Al的2p峰强度随Al3+浓度增大而增大,表明可能存在Al3+的掺杂或晶须表层吸附。图 4(5)为S 2p谱峰所对应的结合能,S 2p1/2谱峰的结合能为170.3 eV,S 2p3/2谱峰的结合能为169.05~169.16 eV,对应Ca2+和SO42-的结合能数值[11]。图 4(6)所示为O 1s谱峰所在结合能范围,从曲线a至c,结合能从532.36降至532.20 eV,对应α-CaSO4·0.5H2O晶须晶格中S-O结合能数值[17]。基于XPS谱图结果,S 2p和O 1s局部谱图所对应结合能只有微弱变化,并没有检测到Al3+和SO42-的结合能168.45 eV。
故可得出以下结论:Al3+存在时,所制备的α-CaSO4·0.5H2O晶须晶格间隙可能掺入了微量的Al3+,Al3+没有取代Ca2+。
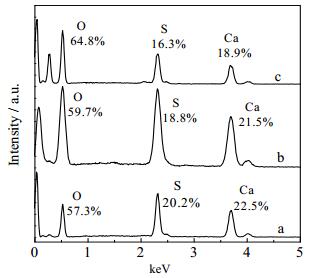
3.4 Al3+对晶须表面元素分布的影响能谱 (EDS) 分析被用来测定溶液不同浓度Al3+下晶须表面光滑部分和晶须表面小颗粒元素组成 (图 1a,1b,1c)。EDS结果 (图 5和6) 显示的各个原子比列于表 3和4。
|
图 5 不同浓度Al3+下晶须表面光滑部分的EDS图 Fig.5 Effects of Al3+ on EDS spectra of α-CaSO4·0.5H2O a. [Al3+] = 0 b. [Al3+] = 4.50×10-3 mol·L-1 c. [Al3+] = 9.03×10-3 mol·L-1 |
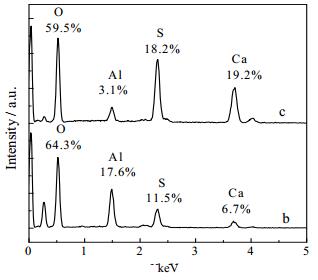
|
图 6 不同浓度Al3+下α-CaSO4·0.5H2O晶须表面小颗粒EDS图 Fig.6 Effects of Al3+ on EDS spectra of α-CaSO4·0.5H2O whiskers (spot on surface) b. [Al3+] = 4.50×10-3 mol·L-1, c.[Al3+] = 9.03×10-3 mol·L-1 |
| 表 3 晶须光滑表面Ca/S原子比 Table 3 Atomic ratios of Ca/S at smooth surfaces / %(wt) |
| 表 4 小颗粒表面Ca/S原子比 Table 4 Atomic ratios of Ca/S at spot surface / %(wt) |
图 5b和5c上无Al元素的存在,图 6b和6c上Al元素相对含量分别为17.6%和3.1%。表明Al3+在α-CaSO4·0.5H2O晶须表面的吸附具有选择性,主要以小颗粒形式吸附在晶须表面。
从表 3和4也能间接证明这一点,光滑表面的Ca/S原子比小颗粒上Ca/S原子比别要大,说明Al3+占据了部分Ca2+在晶须表面的活性生长位点[18],从而使Ca/S原子比在溶液中Al3+存在时变小。
研究发现溶液中加入Al3+,对α-CaSO4·0.5H2O晶须沿c轴方向的生长的抑制效果比沿直径方向生长的抑制效果要显著,且随Al3+浓度增大抑制效果越明显 (图 2b,2d,2f)。
表 5展示了α-CaSO4·0.5H2O的晶胞 (a = 12.0275 Å ,b = 6.9312 Å ,c = 12.6919 Å )。主要晶面元素分布密度 (晶胞及各晶面图省略)。
| 表 5 α-CaSO4·0.5H2O晶胞各晶面的Ca、S、O和H的原子数及原子密度分布 Table 5 Distribution of Ca, S, O and H on different facets of α-CaSO4·0.5H2O whiskers |
从表 5可以看出O原子的分布密度在 (001) 和 (002) 晶面较其他晶面高,说明 (001) 和 (002) 晶面对溶液中Al3+和Ca2+吸附能力更强,当Al3+吸附于晶面时会取代部分Ca2+的活性生长位点[18],
从而抑制该晶面的生长速率。所以溶液中Al3+浓度越大,对于α-CaSO4·0.5H2O而言,(001) 和 (002) 晶面的抑制生长作用越强,即沿c轴的生长抑制速率大于直径方向。
4 结论作为一种晶型抑制剂,Al3+的存在可有效抑制晶须沿c轴方向的生长,达到调控长径比的目的。而且添加Al3+会使晶须表面吸附很多小颗粒。
XRD和XPS表征说明Al3+较容易掺入晶体晶格间隙位置,而非发生取代。Al3+的掺入使特征晶面的晶面间距减小。
Al3+和α-CaSO4·0.5H2O晶须表面的相互作用主要是静电吸附,O原子在各个晶面的分布密度主要影响其对溶液中阳离子的吸附能力大小。在 (001) 和 (002) 晶面的O原子分布密度高于其它晶面,晶须沿c轴方向生长抑制效果较直径方向更大。在本文中Al3+可作为水热法制备α-CaSO4·0.5H2O晶须的晶型抑制剂。
| [1] | Lv J P, Qiu L Z, Qu B J. Controlled synthesis of magnesium hydroxide nanoparticles with different morphological structures and related properties in flame retardant ethylene-vinyl acetate blends[J]. Nanotechnology , 2004, 15(11): 1576-1581. DOI:10.1088/0957-4484/15/11/035. |
| [2] | Nath M, Parkinson B A. A simple sol-gel synthesis of superconducting MgB2 nanowires[J]. Advanced Materials , 2006, 18(14): 1865-1868. DOI:10.1002/(ISSN)1521-4095. |
| [3] | Li S Y, Lee C Y, Lin P, et al. Low temperature synthesized Sn doped indium oxide nanowires[J]. Nanotechnology , 2005, 16(4): 451-457. DOI:10.1088/0957-4484/16/4/021. |
| [4] | Kim H W, Shim S H. Growth of MgO nanowires assisted by the annealing treatment of Au-coated substrates[J]. Chemical Physics Letters , 2006, 422(422): 165-169. |
| [5] | Chen Y J, Li J B, Han Y S, et al. The effect of Mg vapor source on the formation of MgO whiskers and sheets[J]. Journal of Crystal Growth , 2002, 245(1-2): 163-170. DOI:10.1016/S0022-0248(02)01690-1. |
| [6] | MituhashiI K, Tagami N, Tanabe K, et al. Synthesis of microtubes with a surface of ""house of cards"" structure via needlelike particles and control of their pore size[J]. Langmuir , 2005, 21(8): 3659-3663. DOI:10.1021/la047580o. |
| [7] | Sidqui M, Collin P, Vitte C, et al. Osteoblast adherence and resorption activity of isolated osteoclasts on calcium sulphate hemihydrate[J]. Biomaterials , 1995, 16(17): 1327-1332. DOI:10.1016/0142-9612(95)91048-4. |
| [8] | Gurtin M E, Murdoch A L. A continuum theory of elastic material surfaces[J]. Archive for Rational Mechanics and Analysis , 1975, 57(4): 389-390. |
| [9] | Eshelby J D. The continuum theory of lattice defects:vol.14[M].Amsterdam: Elsevier Besloten Vennootschap, 1956. |
| [10] | Mao X L, Song X F, Lu G M, et al. Effects of metal ions on crystal morphology and size of calcium sulfate whiskers in aqueous HCl solutions[J]. Industrial & Engineering Chemistry Research , 2014, 53(45): 17625-17635. |
| [11] | Hou S C, Wang J, Wang X X, et al. Effect of Mg2+ on hydrothermal formation of α-CaSO4·0.5H2O Whiskers with high aspect ratios[J]. Langmuir , 2014, 30(32): 9804-9810. DOI:10.1021/la502451f. |
| [12] | Xin Y, Hou S C, Xiang L, et al. Adsorption and substitution effects of Mg on the growth of calcium sulfate hemihydrate:an abinitio DFT study[J]. Applied Surface Science , 2015, 357(2015): 1552-1557. |
| [13] | Rashad M M, Mahmoud M H H, Ibrahim I A, et al. Crystallization of calcium sulfate dihydrate under simulated conditions of phosphoric acid production in the presence of aluminum and magnesium ions[J]. Journal of Crystal Growth , 2004, 267(1): 372-379. |
| [14] | Feldmann T, Demopoulos G P. Influence of impurities on crystallization kinetics of calcium sulfate dihydrate and hemihydrate in strong HCl-CaCl2 solutions[J]. Industrial & Engineering Chemistry Research , 2013, 52(19): 6540-6549. |
| [15] | Tansel B, Sager J, Rector T, et al. Significance of hydrated radius and hydration shells on ionic permeability during nanofiltration in dead end and cross flow modes[J]. Separation & Purification Technology , 2006, 51(1): 40-47. |
| [16] | Martynowicz, E T M J. Impurity uptake in calcium sulfate during phosphoric acid processing[D]. Delft:Delft University of Technology, 1994. |
| [17] | Yang L C, Guan B H, Wu Z B. Characterization and precipitation mechanism of α-calcium sulfate hemihydrate growing out of FGD gypsum in salt solution[J]. Science in China Series E:Technological Sciences , 2009, 52(9): 2688-2694. DOI:10.1007/s11431-009-0254-6. |
| [18] | Robert B, Christiane S, Joachim U. Fe3+ as an example of the effect of trivalent additives on the crystallization of inorganic compounds, here ammonium sulfate[J]. CrystEngComm , 2011, 13(4): 1118-1122. DOI:10.1039/C0CE00107D. |




